A Algemene informatie
A.1 Inleiding
Aanleiding voor herziening van de richtlijn
Sinds de publicatie van de KNGF-richtlijn Chronisch obstructieve longzieken (COPD) in 2008 en de VvOCM-richtlijn COPD in 2004 zijn nieuwe inzichten verkregen met betrekking tot de diagnostiek en behandeling van patiënten met COPD. Zo is bijvoorbeeld duidelijk aangetoond dat de mate van luchtwegobstructie onvoldoende inzicht geeft in de fysieke capaciteit, fysieke activiteit, ervaren symptoomlast en kwaliteit van leven. Daarnaast is duidelijker geworden dat fysiotherapie en oefentherapie Cesar en Mensendieck (C/M) ook tijdens en direct na een longaanval van grote waarde zijn.
Om patiënten met COPD de juiste therapeutische interventie(s) voor de juiste doelen te kunnen bieden – op de juiste plek binnen de gezondheidszorg – en om praktijkvariatie te verminderen, was herziening nodig van de bestaande richtlijnen voor fysiotherapie en oefentherapie C/M bij patiënten met COPD. Deze herziening maakte tevens onderdeel uit van de afspraken uit het Systeemadvies, waardoor onder andere fysiotherapie en oefentherapie C/M bij COPD terug konden keren naar de basisverzekering. De nauwe samenhang tussen fysiotherapie en oefentherapie C/M waren aanleiding voor het KNGF en de VvOCM om de KNGF-richtlijn uit 2008 en de VvOCM-richtlijn uit 2004 te herzien tot één gezamenlijke richtlijn.
Doel van de richtlijn
Deze richtlijn beoogt een leidraad te geven voor de dagelijkse praktijk van fysiotherapeutische en oefentherapeutische diagnostiek en behandeling van patiënten met COPD. Met een systematische evaluatie van wetenschappelijk onderzoek en weging van patiëntvoorkeuren en professionele expertise, ondersteunt de KNGF-richtlijn COPD therapeuten en patiënten in de klinische besluitvorming en biedt de richtlijn tevens transparantie naar andere zorgverleners en betrokken partijen. Door het formuleren van patiëntenprofielen (en het daaruit volgend diagnose- en behandelalgoritme) beoogt deze evidencebased richtlijn zorg op maat mogelijk te maken.
Aanbevelingen in een richtlijn zijn geen wetten of dwingende voorschriften. In principe wordt een therapeut geacht zich hieraan te houden, maar beargumenteerd afwijken is legitiem of zelfs noodzakelijk indien dit past bij de situatie en wensen van een individuele patiënt.
Doelgroep
Patiëntengroep Deze richtlijn is bedoeld voor de behandeling van patiënten bij wie een arts de diagnose COPD heeft gesteld. Behandeling van patiënten met andere longaandoeningen, zoals astma, interstitiële of restrictieve longaandoeningen, vormt geen onderdeel van deze richtlijn. De richtlijn betreft vrijwel alle categorieën patiënten: patiënten met stabiel COPD, patiënten die een longaanval doormaken of hiervan herstellend zijn, en patiënten met een lichte, matige of ernstige symptoomlast. De richtlijn is gericht op patiënten met alle maten van luchtwegobstructie (GOLD I-IV) en tevens op patiënten met comorbiditeit of in de palliatieve fase.
Beoogde gebruikers van de richtlijn Deze richtlijn is primair gericht op fysiotherapeuten en oefentherapeuten C/M die patiënten met gezondheidsproblemen als gevolg van COPD behandelen, ongeacht de setting (eerstelijns praktijk, een ziekenhuis of een revalidatie-instelling; mono- of multidisciplinaire setting).
In deze richtlijn zijn aanbevelingen geformuleerd waarvoor specifieke kennis en vaardigheden nodig zijn, bijvoorbeeld:
- interpretatie van medische onderzoeksgegevens, zoals van de maximale inspanningstest en spirometrie;
- inspanningstraining bij diverse typen patiënten (met bijv. zuurstofsuppletie, (non-)invasieve beademing of lage zuurstofsaturatie);
- diverse interventies voor het adembewegingsapparaat, zoals ademspiertraining en interventies voor mucusklaring;
- behandeling van patiënten met complexe comorbiditeit, zoals cardiovasculaire problematiek;
- behandeling van patiënten tijdens of direct na een longaanval;
- behandeling van patiënten in de palliatieve fase.
Kennis en vaardigheden kunnen opgedaan en bijgehouden worden door het volgen van na- en bijscholing, opdoen van praktijkervaring, lezen van vakliteratuur en/of bijwonen van lezingen. Hierbij geldt de stelling: ‘bekwaam is bevoegd’.
De richtlijn is ook relevant voor andere zorgverleners die betrokken zijn bij de begeleiding en behandeling van patiënten met COPD, zoals huisartsen, longartsen, (long)verpleegkundigen, longverpleegkundig specialisten, psychologen, ergotherapeuten, diëtisten, alsmede voor patiënten, beleidsmakers en andere organisaties die betrokken zijn in de zorg voor patiënten met COPD. Uit de richtlijn ontstaat een duidelijk beeld van wat men kan verwachten van therapeuten en welke informatie therapeuten nodig hebben voor de samenwerking met andere betrokken zorgverleners.
Leeswijzer
De informatie in de richtlijn is inhoudelijk verdeeld over drie delen (Deel A ‘Algemeen’, Deel B ‘Diagnostisch proces’ en Deel C ‘Therapeutisch proces’). De algemene informatie in deel A omvat de algemene inleiding, achtergrondinformatie over de aandoening COPD en informatie over de wijze waarop de zorg wordt georganiseerd. In het Diagnostisch proces en het Therapeutisch proces staat het methodisch handelen beschreven.
De verschillende onderwerpen binnen een deel vormen afzonderlijke op zichzelf staande modules. In elke module is de informatie vervolgens verdeeld over drie verdiepende lagen (de Praktijkrichtlijn, de Toelichting en de Verantwoording). Met elke laag is het desbetreffende onderwerp verder uitgediept. De praktische handvatten zijn opgenomen in de Praktijkrichtlijn (de eerste laag). De informatie over het onderwerp dat aan de orde is, en de afweging van de belangrijkste argumenten die leiden tot de aanbeveling dan wel omschrijving staan in de noten, die zijn opgenomen in de Toelichting (de tweede laag). De Verantwoording (de derde laag) beschrijft de details over de wijze waarop deze informatie is vergaard (o.a. zoekstrategie, samenvatting van resultaten, beoordeling van bewijskracht en beschrijving van overwegingen), het proces waarmee deze afweging tot stand is gekomen en de referenties van de gebruikte (wetenschappelijke) literatuur.
Daar waar ‘hij’ geschreven staat, kan ook ‘zij’ gelezen worden. Waar ‘therapeut’ geschreven staat, kan ‘fysiotherapeut’ of ‘oefentherapeut C/M’ worden gelezen. Waar ‘therapie’ geschreven staat, kan ‘fysiotherapie’ of ‘oefentherapie C/M’ worden gelezen.
Methodiek
De ontwikkeling van deze richtlijn heeft plaatsgevonden conform de ‘KNGF Richtlijnenmethodiek 2019’. De wijze waarop deze methodiek toegepast is en de wijze waarop belanghebbenden betrokken zijn bij de ontwikkeling, zijn beschreven in de verantwoording van deze module.
Definities en begrippen
Zie de toelichting voor de belangrijkste definities en begrippen.
Onderbouwing
In de Praktijkrichtlijn staat de aanleiding en het doel van deze richtlijnherziening omschreven. In dit onderdeel van de richtlijn staat een toelichting op het systeemadvies en de belangrijkste begrippen in deze richtlijn. De ‘KNGF-Richtlijn COPD’ is ontwikkeld volgens de ‘KNGF Richtlijnenmethodiek 2019’. In de Verantwoording staat beschreven op welke wijze deze methodiek is toegepast voor deze specifieke richtlijn.
Systeemadvies
Zorginstituut Nederland (ZiN) heeft in 2016 advies uitgebracht aan de minister van VWS om de aanspraken fysiotherapie en oefentherapie met betrekking tot de vergoedingenstructuur anders te gaan vastleggen. Belangrijkste reden daarvoor was dat de huidige aanspraken ertoe leiden dat patiënten/verzekerden bijvoorbeeld uitwijken naar duurdere vormen van zorg die wel volledig worden vergoed.
De minister heeft dat advies deels overgenomen en benadrukt dat met name moet worden geëxperimenteerd met aandoeningen waarbij de fysiotherapie en oefentherapie een grote kans op substitutie opleveren (dure zorg vervangen door goedkope zorg met vergelijkbare effectiviteit). In het kader van de uitvoering van het advies heeft ZiN prioriteiten bepaald. Onderdeel van het advies van ZiN is ook dat er voor de betreffende aandoeningen richtlijnen moeten zijn die voldoen aan het Toetsingskader (ZiN 2018). In het kader van het Systeemadvies is de ontwikkeling van deze richtlijn – naast financiering van het KNGF en de VvOCM – mede gefinancierd door het ministerie van VWS.
Status van een richtlijn
Aanbevelingen in een richtlijn zijn geen wetten of dwingende voorschriften. In principe wordt een therapeut geacht zich hieraan te houden, maar beargumenteerd afwijken is legitiem of zelfs noodzakelijk indien dit past bij de situatie en wensen van een individuele patiënt (AQUA 2014).
Belangrijkste definities en begrippen
- COPD Chronisch obstructieve longziekte (‘chronic obstructive pulmonary disease’), een aandoening die wordt gekarakteriseerd door persistente respiratoire symptomen en luchtstroombeperking als gevolg van luchtweg- en/of alveolaire abnormaliteiten, meestal veroorzaakt door significante blootstelling aan giftige deeltjes en gassen (GOLD 2020).
- Kenmerken van de individuele patiënt Ziektegerelateerde kenmerken, omgevingsfactoren en demografische factoren, die beïnvloedbaar zijn door therapie of die de therapie kunnen beïnvloeden.
- Symptoomlast De fysieke, emotionele en psychologische en/of sociale ongemakken van een patiënt met COPD (Slok 2014).
- Integrale gezondheidstoestand (Engels: ‘health status’) Een totaalconcept dat de volgende vier hoofddomeinen omvat: 1) fysiologisch functioneren, 2) klachten, 3) beperkingen en 4) kwaliteit van leven (Wilson 1995; Vercoulen 2008).
Elk van deze vier domeinen representeert een uniek aspect van iemands integrale gezondheidstoestand. Fysiologisch functioneren omvat bij COPD de primaire longfunctiestoornis(sen), eventuele systemische consequenties en mogelijke comorbiditeit. Of en in welke mate fysiologisch functioneren leidt tot symptoomlast wordt gemodereerd door adaptatie (Peters 2017). Adaptatie aan fysiologische disfunctie wordt bepaald door psychologische en culturele kenmerken. Zie de schematische
voorstelling van de integrale gezondheidstoestand en haar subcomponenten.
- Longaanvallen (exacerbaties) Een acute verergering van respiratoire symptomen, die resulteert in additionele behandeling (Burge 2003; Hurst 2007; Seemungal 1998; Wedzicha 2007) met of zonder ziekenhuisopname (GOLD 2020).
- Comorbiditeit Een of meerdere aandoeningen die bij dezelfde patiënt voorkomen naast de primaire aandoening COPD waarvoor de patiënt in behandeling is (indexziekte). Deze nevenaandoening is: 1) een medische conditie die tegelijkertijd voorkomt, maar onafhankelijk is van de andere medische aandoening of 2) een medische conditie die de andere medische conditie veroorzaakt, erdoor veroorzaakt wordt of op een andere manier samenhangt met de andere medische conditie bij dezelfde patiënt (Valderas 2009).
- Fysieke capaciteit Het vermogen om activiteiten uit te voeren die fysieke acties vereisen (Puente Maestu 2016), uitgedrukt in de volgende grootheden die door therapie te beïnvloeden zijn: spierkracht, spieruithoudingsvermogen, cardiovasculair inspanningsvermogen (maximaal en submaximaal) (De Morree 2011) en balans. Voor meer informatie zie A.3.3 ‘Aangrijpingspunten fysio- en oefentherapie C/M’.
- Fysieke activiteit Een parameter voor beweeggedrag, die bestaat uit elke lichaamsbeweging die wordt teweeggebracht door skeletspieren en energiegebruik vereist (Caspersen 1985; WHO 2018). In de richtlijn wordt lichamelijke activiteit uitgedrukt in de verhouding tussen sedentair gedrag en actief gedrag die door therapie te beïnvloeden zijn, zoals liggen, zitten, staan en bewegen. Voor meer informatie zie A.3.3 ‘Aangrijpingspunten voor fysio- en oefentherapie C/M’.
- Adembewegingsapparaat. e vitale pomp voor de ventilatie bestaande uit de borstwand (thorax en abdomen) en ademspieren (Gosselink 2016). Het adembewegingsapparaat wordt gekarakteriseerd door de volgende functies die door therapie te beïnvloeden zijn: ademspierfunctie, ademhalingstechniek, lichaamshouding en mucusevacuatie. Voor meer informatie zie A3.3 ‘Aangrijpingspunten voor fysio- en oefentherapie C/M’.
Toepassing KNGF-Richtlijnenmethodiek
De ontwikkeling van deze richtlijn heeft plaatsgevonden conform de ‘KNGF Richtlijnenmethodiek 2019’ (KNGF 2019). Deze methodiek is opgesteld conform de AQUA-leidraad, GRADE, het AGREE II-instrument en het Toetsingskader voor Kwaliteitsstandaarden (AGREE Next Steps Consortium 2010; AQUA 2014; GRADE Working Group 2008; ZiN 2018). Jaarlijks beoordelen de betrokken experts (dr. Emmylou Beekman, prof. dr. Martijn Spruit en het KNGF) of inhoudelijke en/of beleidsmatige ontwikkelingen (modulaire) herziening van de richtlijn noodzakelijk maakt.
Voorbereidingsfase
Er werd een werkgroep en een klankbordgroep samengesteld met daarin een vertegenwoordiging van de volgende relevante partijen:
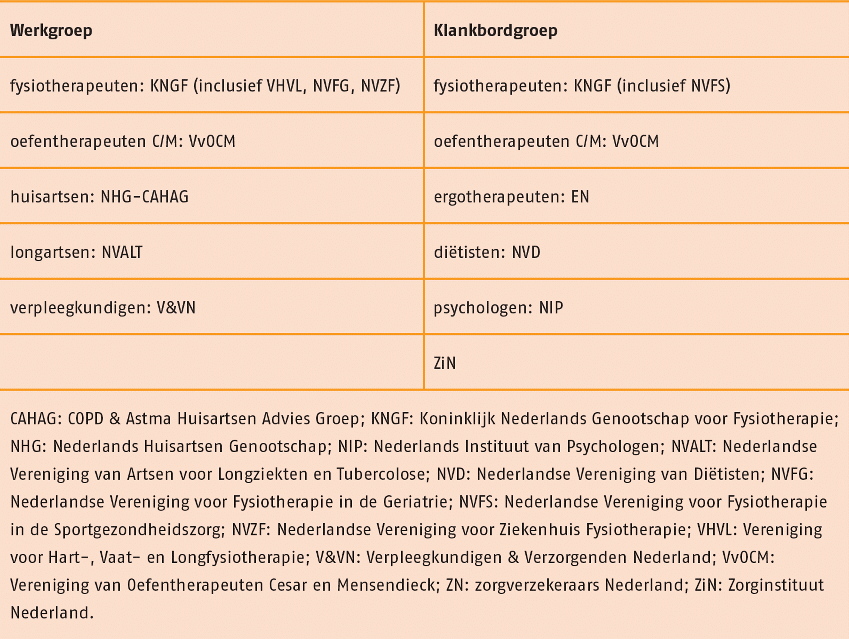
Alle betrokken werkgroep- en klankbordgroepleden hebben bij aanvang van het project een belangenverklaring getekend. In de voorbereidingsfase vonden vier focusgroepen plaats (2 met therapeuten en 2 met patiënten), waarin de knelpunten zijn geïnventariseerd. Aan deze focusgroepen is deelgenomen door in totaal 22 therapeuten en 12 patiënten (en 1 mantelzorger). Deze knelpunten zijn vervolgens voorgelegd aan de leden van de werkgroep en de klankbordgroep tijdens de eerste werkgroep- respectievelijk klankbordgroepbijeenkomst. Daaruit kwamen nog diverse knelpunten naar voren. Alle op deze wijze verzamelde knelpunten zijn vervolgens omgezet in uitgangsvragen.
Ontwikkelfase
Van iedere uitgangsvraag is vervolgens vastgesteld op welke wijze deze het beste beantwoord zou kunnen worden: door middel van systematisch literatuuronderzoek of middels een narratieve uitwerking. Indien systematisch literatuuronderzoek niet aangewezen was, omdat met een dergelijke aanpak de vraag niet zou kunnen worden beantwoord, is door inhoudsdeskundig wetenschappers op narratieve wijze naar literatuur gezocht. Voor de uitgangsvragen waarvoor systematisch literatuuronderzoek wel aangewezen was, zijn PICO’s opgesteld en zijn – met behulp van een bibliothecaris van het Leids Universitair medisch Centrum (LUMC) – ‘search-strings’ opgesteld, waarna is gezocht in de volgende databases: ‘PubMed’, ‘EMBASE’, ‘Web of Science’, ‘Cochrane Library’, ‘CENTRAL’, ‘EmCare’ en ‘CINAHL’. Waar mogelijk zijn de searchstrings voor verschillende uitgangsvragen samengevoegd. Door middel van vooraf opgestelde in- en exclusiecriteria zijn de vindresultaten geselecteerd op basis van – achtereenvolgens – titel en abstract en vervolgens op de volledige tekst.
Een KNGF-richtlijnexpert heeft vervolgens op basis van de geïncludeerde studies literatuurconclusies opgesteld (grootte van het effect en betrouwbaarheid van het bewijs) zoals beschreven in de ‘KNGF-Richtlijnenmethodiek 2019’ (KNGF 2019). Als een bestaande systematische review is gebruikt, en dat is waar mogelijk gedaan, dan is de beoordeling van de betreffende review overgenomen, waarbij recente studies die na de systematische review waren verschenen, aan de review zijn toegevoegd. Nadat de sterkte van het bewijs en de grootte van het effect waren bepaald, formuleerden subgroepjes van werkgroep- en klankbordgroepleden de overige overwegingen, die vervolgens in zeven bijeenkomsten met de werkgroep en vijf bijeenkomsten met de klankbordgroep zijn besproken aan de hand van het (in het Nederlands vertaalde) ‘evidence-to-decision’formulier totdat consensus over het formulier was bereikt. Op basis van het wetenschappelijk bewijs en de overige overwegingen is tot slot de formulering (richting en sterkte) van de aanbeveling bepaald. Zie de tabel.

Formulering van aanbevelingen
De volledige zoekstrategie, de resultaten van het systematisch literatuuronderzoek en – indien van toepassing – het volledig ingevulde evidence-to-decisionformulier is opgenomen bij de betreffende uitgangsvraag. Alle aanbevelingen, inclusief de toelichting en verantwoording, vormen samen de conceptrichtlijn.
Commentaar- en autorisatiefase
De conceptrichtlijn is vervolgens uitgestuurd naar alle organisaties die vertegenwoordigd werden in de werkgroep en/of klankbordgroep. Daarnaast hebben ook enkele tientallen fysio- en oefentherapeuten de conceptrichtlijn ontvangen ter commentaar. Waar mogelijk zijn alle commentaren verwerkt door de auteursgroep en schriftelijk voorgelegd aan de werkgroep en de klankbordgroep, waarna er nog een bijeenkomst van zowel de werkgroep als de klankbordgroep plaatsvond waarin de laatste discussiepunten zijn besproken. Na vaststelling door de werkgroep en de klankbordgroep is de richtlijn ter autorisatie voorgelegd aan alle betrokken partijen.
Disseminatie- en implementatiefase
Ter bevordering van de implementatie van de richtlijn zijn/worden de volgende activiteiten ondernomen:
- fysieke scholing verspreid door het land
- ontwikkeling van een e-learningmodule
- publicatie van artikelen in tijdschriften (zowel binnen als buiten de fysio-/oefentherapie en zowel nationaal als internationaal)
- lezingen op congressen en symposia
- ontwikkeling van patiënteninformatie
Implementatieactiviteiten richten zich in het bijzonder op de volgende vijf onderwerpen, die ook wel aangemerkt worden als kernaanbevelingen:
- onderscheid tussen de aangrijpingspunten fysieke activiteit, fysieke capaciteit en adembewegingsapparaat
- patiëntenprofielen
- verwijzing voor maximale inspanningstest
- frequentie, intensiteit, type en tijdsduur van fysieke training (FITT-factoren)
- behandeling van specifieke subgroepen (comorbiditeit, longaanval en palliatieve fase)
Betrokkenheid belanghebbenden
Therapeuten
De primaire gebruikers van de richtlijn zijn fysiotherapeuten en oefentherapeuten C/M. Zij hebben in alle fasen van de richtlijn een belangrijke bijdrage geleverd aan de ontwikkeling van de richtlijn. Zo hebben therapeuten in de voorbereidingsfase knelpunten aangeleverd, in de ontwikkelfase zitting genomen in de werkgroep en klankbordgroep, in de commentaarfase commentaar gegeven op de conceptrichtlijn en in de implementatiefase feedback gegeven op de implementatieproducten, zoals de e-learning.
Patiënten
Om het patiëntenperspectief maximaal te borgen, zijn patiënten al in de voorbereidingsfase bij de ontwikkeling van de richtlijn betrokken. In totaal 12 patiënten en één mantelzorger brachten, verdeeld over twee focusgroepen – door middel van een semigestructureerde methode – knelpunten in. Deze knelpunten hebben, in combinatie met de knelpunten vanuit de therapeuten en vanuit de werkgroep- en klankbordgroep, als basis gediend voor de uitgangsvragen. Ook hebben afgevaardigden van het Longfonds deelgenomen aan het ontwikkelproces als onderdeel van de werkgroep en aan de commentaarfase. Daarnaast heeft deze patiëntenvereniging ook een bijdrage geleverd aan de ontwikkeling van de patiënteninformatie.
Overige belanghebbenden
Overige belanghebbenden namen zitting in de werkgroep of klankbordgroep en/of waren bij de richtlijn betrokken in de commentaarfase, en droegen op deze manier bij aan de totstandkoming van de richtlijn.
- AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42.
- AQUA. Leidraad voor kwaliteitsstandaarden. Advies- en expertgroep Kwaliteitsstandaarden (AQUA); 2014.
- Beschikbaar via https://www.zorginstituutnederland.nl/ Geraadpleegd op 28 november 2019.
- Burge S, Wedzicha JA. COPD exacerbations: definitions and classifications. Eur Resp J Suppl. 2003;41:46s-53s. Caspersen CJ, Powell KE, Christenson GM. Physical activity, exercise, and physical fitness: definitions and dis-
- tinctions for health-related research. Public Health Rep. 1985;100:126-31. de Morree JJ, Jongert MWA, van der Poel G. Inspanningsfysiologie, oefentherapie en training. Houten: Bohn Stafleu van Loghum; 2011.
- GOLD. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. Fontana, CA, VS: Global Initiative for Chronic Obstructive Lung Disease (GOLD); 2020.
- Gosselink R, Decramer M. Revalidatie bij chronisch obstructieve longziekten, hoofdstuk 7: Kinesiologie en pathokinesiologie van het adembewegingsapparaat. Houten: Bohn Stafleu van Loghum; 2016.
- GRADE Working Group. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 2008;336(7650):924-6.
- Hurst JR, Wedzicha JA. What is (and what is not) a COPD exacerbation: thoughts from the new GOLD guidelines.
- Thorax. 2007;62(3):198-9.
- KNGF-richtlijnenmethodiek: ontwikkeling en implementatie van KNGF-richtlijnen, versie 2. Amersfoort: Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF); 2019.
- Peters JB, Boer LM, Molema J, Heijdra YF, Prins JB, Vercoulen JH. Integral health status-based cluster analysis in moderate-severe COPD patients identifies three clinical phenotypes: relevant for treatment as usual and pulmonary rehabilitation. Int J Behav Med. 2017;24(4):571-83.
- Puente-Maestu L, Palange P, Casaburi R, Laveneziana P, Maltais F, Neder JA, et al. Use of exercise testing in the evaluation of interventional efficacy: an official ERS statement. Eur Respir J. 2016;47:429-60.
- Seemungal TA, Donaldson GC, Paul EA, Bestall JC, Jeffries DJ, Wedzicha JA. Effect of exacerbation on quality of life in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 1998;157(5 Pt 1):1418-22.
- Slok AH, in ’t Veen JC, Chavannes NH, Rutten-van Mölken MP, Kerstjens HA, Salomé PL, et al. Development of the assessment of burden of COPD tool: an integrated tool to measure the burden of COPD. NPJ Prim Care Respir Med. 2014;10;24:14021.
- Valderas JM, Starfield B, Sibbald B, Salisbury C, Roland M. Defining comorbidity: implications for understanding health and health services. Ann Fam Med. 2009;7(4):357-63.
- Vercoulen JH, Daudey L, Molema J, Vos PJ, Peters JB, Top M, Folgering H. An Integral assessment framework of health status in chronic obstructive pulmonary disease (COPD). Int J Behav Med. 2008;15(4):263-79.
- Wedzicha JA, Seemungal TA. COPD exacerbations: defining their cause and prevention. Lancet (London, England). 2007;370(9589):786-96.
- Wilson IB, Cleary PD. Linking clinical variables with health-related quality of life. A conceptual model of patient outcomes. JAMA. 1995;273(1):59-65.
- WHO. Global Strategy on diet, physical activity and health.
- World Health Organization. Beschikbaar via http://www.who.int. Geraadpleegd op 14 september 2018.
ZiN. Toetsingskader kwaliteitsstandaarden, informatiestandaarden en meetinstrumenten 2015. Versie 2.1 – 18 juni 2018. Den Haag: Zorginstituut Nederland (ZiN). Beschikbaar via https://www.zorginstituutnederland. nl/ Geraadpleegd op 28 november 2019.
A.2 Achtergrond COPD
Deze module betreft:
- Pathofysiologie (module A.2.1)
- Klinisch beeld (module A.2.2)
- Etiologische en prognostische factoren (module A.2.3)
- Epidemiologie en maatschappelijke impact (module A.2.4)
A.2.1 Pathofysiologie
COPD is een veelvoorkomende, vaak te voorkómen en behandelbare (ongeneesbare) aandoening die wordt gekarakteriseerd door persisterende luchtwegklachten (symptomen) en chronische luchtstroombeperking als gevolg van luchtweg en/of alveolaire abnormaliteiten, meestal veroorzaakt door significante blootstelling aan schadelijke deeltjes en gassen.
Onderbouwing
Uitgangsvraag
Wat is de pathofysiologie van COPD?
In deze richtlijn wordt de definitie van de ‘Global Initiative for Chronic Obstructive Lung Disease’ (GOLD) anno 2020 gehanteerd.
De definitie COPD conform de GOLD-richtlijn 2020
De pathologie COPD bestaat uit emfyseem en chronische bronchitis. De relatieve bijdrage van emfyseem en chronische bronchitis aan de ziekte COPD varieert van persoon tot persoon. Voor meer achtergrondinformatie over de pathofysiologie, zie www.goldcopd.org.
In overleg met de werkgroep en de klankbordgroep is besloten om geen systematische zoekactie uit te voeren voor deze uitgangsvraag, maar de informatie op niet-systematische wijze te vergaren.
GOLD. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. Fontana, CA, VS: Global Initiative for Chronic Obstructive Lung Disease (GOLD); 2020.
A.2.2 Klinisch beeld
Het klinisch beeld kenmerkt zich door de blijvende luchtstroombeperking en respiratoire symptomen, zoals kortademigheid bij inspanning (en mogelijk later ook in rust) en eventueel chronische hoest met of zonder sputumproductie. Naast fysieke aspecten zijn emotionele, psychologische en/of sociale aspecten van belang bij het in kaart brengen van de symptoomlast en het bepalen van de therapie.
Onderbouwing
Uitgangsvraag
Wat is het klinisch beeld van COPD?
Het klinisch beeld kenmerkt zich door de blijvende luchtstroombeperking en respiratoire symptomen, zoals kortademigheid bij inspanning (en mogelijk later ook in rust) en eventueel chronische hoest met of zonder sputumproductie (Gibson 2013). Bij verergering van de luchtwegobstructie door een longaanval nemen deze klachten toe. Daarnaast komt comorbiditeit bij COPD veel voor (GOLD 2020).
De maat FEV1 is de traditionele fysiologische indicator om de ernst van de luchtstroombeperking bij patiënten met COPD te bepalen. Deze maat zegt echter onvoldoende over de symptoomlast en het beloop van de aandoening. Het functioneel inspanningsvermogen, gemeten met de Zes Minuten wandeltest (6MWT), is slechts in beperkte mate gerelateerd aan de FEV1 (Agusti 2012; Spruit 2010). Kortademigheid tijdens fysieke activiteit komt voor bij patiënten met licht tot zeer ernstig COPD en heeft dus een beperkte relatie met de mate van luchtstroombeperking (O’Donnell 2016).
Naast fysieke aspecten zijn emotionele, psychologische en/of sociale aspecten van belang bij het in kaart brengen van de symptoomlast en het bepalen van de therapie. Naarmate de kwetsbaarheid van een patiënt toeneemt, worden deze aspecten belangrijker voor een therapeut in het zorgproces. Voor meer achtergrondinformatie over het klinisch beeld, zie www.goldcopd.org.
In overleg met de werkgroep en de klankbordgroep is besloten om geen systematische zoekactie uit te voeren voor deze uitgangsvraag, maar de informatie op niet-systematische wijze te vergaren.
- Agusti A, Calverley PM, Celli B, Coxson HO, Edwards LD, Lomas DA, et al. Characterisation of COPD heterogeneity in the ECLIPSE cohort. Respir Res. 2010;11:122.
- Gibson GJ, Loddenkemper R, Lundback B, Sibille Y. Respiratory health and disease in Europe: the new European lung white book. Eur Respir J. 2013;42(3):559-63.
- GOLD. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. Fontana, CA, VS: Global Initiative for Chronic Obstructive Lung Disease (GOLD); 2020.
- O’Donnell DE, Elbehairy AF, Faisal A, Webb KA, Neder JA, Mahler DA. Exertional dyspnoea in COPD: the clinical utility of cardiopulmonary exercise testing. Eur Respir Rev. 2016;25(141):333-47.
- Spruit MA, Watkins ML, Edwards LD, Vestbo J, Calverley PM, Pinto-Plata V, et al. Evaluation of COPD Longitudinally to Identify Predictive Surrogate Endpoints (ECLIPSE) study investigators. Determinants of poor 6-min walking distance in patients with COPD: the ECLIPSE cohort. Respir Med. 2010;104(6):849-57.
A.2.3 Etiologische en prognostische factoren
Roken is de belangrijkste etiologische factor voor het ontwikkelen van COPD. Andere etiologische factoren zijn luchtvervuiling, sociaal-economische status, omgevingsfactoren in de vroege levensfase en genetische factoren. Het beloop van COPD kan negatief beïnvloed worden door de volgende prognostische factoren: blijven roken, longaanvallen, respiratoire insufficiëntie, een slechte voedingsstatus en comorbiditeit. Om het beloop van COPD positief te beïnvloeden, is stoppen met roken de belangrijkste prognostische factor.
Onderbouwing
Uitgangsvraag
Wat zijn de etiologische en prognostische factoren van COPD?
Etiologische factoren
Het chronisch ontstekingsproces in de kleine luchtwegen en het longparenchym wordt veroorzaakt door factoren die een ontsteking kunnen veroorzaken en in stand houden. Roken is hierbij de belangrijkste en tevens beïnvloedbare etiologische factor voor COPD. Ongeveer 40-50% van de mensen die levenslang roken, ontwikkelt COPD, ten opzichte van 10% van de mensen die nooit gerookt hebben (Gibson 2013). Rokers hebben een hogere prevalentie van respiratoire symptomen en afwijkende longfunctie, een grotere jaarlijkse afname van de FEV1 en bovendien overlijden meer rokers aan COPD dan niet-rokers. Toch ontwikkelen niet alle rokers klinisch-relevant COPD. Deze bevinding suggereert dat ook genetische factoren invloed hebben op het risico van een persoon om COPD te ontwikkelen.
Er spelen bij de ontwikkeling van COPD ook andere factoren een rol, zoals blootstelling aan luchtvervuiling (binnenshuis en buiten), sociaal-economische status, omgevingsfactoren in de vroege levensfase en genetische factoren (Gibson 2013). In Europa wordt 30-40% van de algemene bevolking blootgesteld aan luchtvervuiling op het werk. Wanneer de blootstelling intensief of langdurig is, kunnen stof, chemicaliën en gassen COPD veroorzaken, onafhankelijk van het roken van sigaretten. Voor meer achtergrondinformatie over etiologische factoren, zie www.goldcopd.org.
Prognostische factoren
Er bestaat veel variatie in de natuurlijke ontwikkeling van COPD. Factoren die bijdragen aan een slechte prognose van COPD zijn: blijven roken, longaanvallen, respiratoire insufficiëntie, slechte voedingsstatus en comorbiditeit (Gibson 2013; GOLD 2020). Voor meer achtergrondinformatie over prognostische factoren, zie www.goldcopd.org.
In overleg met de werkgroep en de klankbordgroep is besloten om geen systematische zoekactie uit te voeren voor deze uitgangsvraag, maar de informatie op niet-systematische wijze te vergaren.
- Gibson GJ, Loddenkemper R, Lundback B, Sibille Y. Respiratory health and disease in Europe: the new European lung white book. Eur Respir J. 2013;42(3):559-63.
- GOLD. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. Fontana, CA, VS: Global Initiative for Chronic Obstructive Lung Disease (GOLD); 2020.
A.2.4 Epidemiologie en maatschappelijke impact
In Nederland hebben ongeveer 600.000 mensen COPD en jaarlijks komen er in Nederland ongeveer 10.000 mensen met chronische bronchitis en 27.000 mensen met emfyseem bij. Op basis van demografische ontwikkelingen zal het absolute aantal patiënten met COPD in de periode 2015-2040 met 36% stijgen. Momenteel is COPD de vijfde meest voorkomende doodsoorzaak in Nederland. De zorgkosten van COPD bedragen in Nederland circa 1 miljard euro per jaar (in 2015).
Onderbouwing
Uitgangsvraag
- Wat is de prevalentie en incidentie van COPD (epidemiologie)?
- Wat is de maatschappelijke impact van COPD?
Epidemiologie
In 2018 waren er in Nederland 613.800 patiënten met CODP: 304.800 mannen en 309.000 vrouwen. In dat jaar kwamen er in Nederland 27.100 patiënten met emfyseem bij (13.400 mannen en 13.700 vrouwen) en 10.200 patiënten met chronische bronchitis (4300 mannen en 5900 vrouwen). Gebaseerd op demografische ontwikkelingen zal naar verwachting het absolute aantal patiënten met COPD in de periode 2015-2040 met 36% stijgen. De verwachte stijging bedraagt 44% voor mannen en 28% voor vrouwen (RIVM 2019).
In 2017 overleden in Nederland ruim 6820 patiënten aan COPD. Het betrof 3457 mannen (40,1 per 100.000 mannen) en 3363 vrouwen (36,6 per 100.000 vrouwen). De WHO (2017) voorspelt dat COPD in 2030 wereldwijd de derde meest voorkomende doodsoorzaak is.
De gepresenteerde cijfers zijn landelijke schattingen die zijn gebaseerd op de NIVEL Zorgregistratie Eerste Lijn. Deze cijfers zijn mogelijk een onderschatting, omdat niet alle patiënten met klachten van chronisch hoesten, slijm opgeven en kortademigheid bij de huisarts komen. Patiënten met een luchtwegobstructie kunnen langzaamaan gewend zijn geraakt aan de kortademigheid en/of hun leven hierop hebben aangepast en dit symptoom niet meer als klacht ervaren. Ook worden niet alle patiënten altijd direct door de huisarts onderkend (RIVM 2019).
Maatschappelijke impact
Ruim een derde van de patiënten met COPD ervaart dat hun longziekte emotioneel een weerslag heeft op hun leven (Waverijn 2017). Ruim een derde (37%) van de patiënten met COPD < 65 jaar is arbeidsongeschikt, van wie een ruime meerderheid (69%) volledig (Waverijn 2017). Maatschappelijk gezien is COPD een ernstige longziekte met onomkeerbare gevolgen (WHO 2017). Patiënten met COPD hebben niet alleen een verhoogd risico op vroegtijdig overlijden (Wedzicha 2003), maar hebben ook een verhoogd risico op ziekenhuisopnamen, vooral ten gevolge van longaanvallen (Gibson 2013). Meer dan 50% van de patiënten met COPD die na een longaanval ontslagen worden uit het ziekenhuis wordt binnen een jaar weer opgenomen, waarvan een groot deel binnen enkele weken na ontslag (Gibson 2013; LAN 2019).
De zorg van COPD in Nederland bedragen in totaal 912 miljoen euro per jaar (in 2017) (RIVM 2019). Dit komt neer op 1% van de totale kosten voor de gezondheidszorg en 31% van de kosten voor alle luchtwegaandoeningen. Van de totale zorgkosten wordt 32% uitgegeven aan ouderenzorg, 24% aan ziekenhuiszorg en 21% aan genees- en hulpmiddelen.
De zorgkosten voor patiënten met COPD zullen naar verwachting verder toenemen door ‘dubbele vergrijzing’ (toename van het aantal ouderen en de stijgende leeftijd onder ouderen) en de daarmee gepaard gaande toename van het aantal chronische aandoeningen (RIVM 2019).
In overleg met de werkgroep en de klankbordgroep is besloten om geen systematische zoekactie uit te voeren voor deze uitgangsvraag, maar de informatie op niet-systematische wijze te vergaren.
- LAN. Landelijk Zorgpad COPD longaanval met ziekenhuisopname – Betere zorg voor de patiënt met COPD. Amersfoort: Longalliantie Nederland (LAN); 2019.
- Gibson GJ, Loddenkemper R, Lundback B, Sibille Y. Respiratory health and disease in Europe: the new European lung white book. Eur Respir J. 2013;42(3):559-63.
- RIVM. COPD – Cijfers en context. 4 september 2019. Bilthoven: Rijksinstituut voor Volksgezondheid en Milieu. Beschikbaar via https://www.volksgezondheidenzorg.info/onderwerp/copd. Geraadpleegd op 4 maart 2020.
- Waverijn G, Spreeuwenberg P, Heijmans M. Leven met een longziekte in Nederland. Cijfers en trends over de zorg- en leefsituatie van mensen met een longziekte – 2016. Utrecht: Nivel; 2017.
- Wedzicha JA, Donaldson GC. Exacerbations of chronic obstructive pulmonary disease. Respir Care. 2003;48(12):1204-13; discussion 13-5.
- WHO. Chronic obstructive pulmonary disease (COPD). 1 december 2017. Beschikbaar via http://www.who.int. Geraadpleegd op 12 juli 2018.
A.3 Organisatie van zorg
Deze module betreft:
Rol van de therapeut (module A.3.1)
Organisatie van multidisciplinaire samenwerking (module A.3.2)
Aangrijpingspunten voor fysio- en oefentherapie C/M (module A.3.3)
Informatie-uitwisseling met verwijzer (module A.3.4)
A.3.1 Rol van de therapeut
De rol van de therapeut bestaat uit:
- inventariseren en analyseren van de aan COPD gerelateerde gezondheidsproblemen op het domein van het fysiek functioneren;
- opstellen van het behandelplan en de behandeldoelen, gerelateerd aan de therapeutische aangrijpingspunten (zie A.3.3 ‘Aangrijpingspunten voor fysio- en oefentherapie C/M’);
- begeleiden en monitoren van de therapie;
- doorverwijzen van de patiënt indien er gezondheidsgerelateerde problematiek gesignaleerd wordt waarbij behandelen niet tot de rol van de therapeut behoort;
- de patiënt actief stimuleren om zelf regie te nemen en de patiënt stimuleren om tijdens en na afsluiting van de therapie voldoende fysiek actief te worden/blijven.
Onderbouwing
Uitgangsvraag
Wat is de rol van de therapeut in het zorgproces van patiënten met COPD?
De rol van de therapeut staat beschreven in het ‘Beroepsprofiel Fysiotherapeut’ en het ‘Beroepsprofiel Oefentherapeut’ (KNGF 2014; VvOCM 2015). De module in deze richtlijn betreft specifiek de rol die de therapeut heeft bij de behandeling van bij patiënten met COPD.
De therapeut heeft bij de behandeling van patiënten met COPD meerdere rollen. Zo bestaat de rol van de therapeut uit het inventariseren en analyseren van de aan COPD gerelateerde gezondheidsproblemen op het domein van fysiek functioneren, het opstellen van het behandelplan en de behandeldoelen, gerelateerd aan de therapeutische aangrijpingspunten, en het begeleiden en monitoren van de therapie. Deze begeleiding is effectief ten aanzien van afname van symptomen, verbetering van inspanningsvermogen, verbetering van kwaliteit van leven en afname van angst en depressie (ATS/ERS 2013; McCarthy 2015; Puhan 2016).
Daarnaast is het de rol van de therapeut om de fysieke activiteit buiten de therapeutische setting te stimuleren door de patiënt actief in contact brengen met regulier sport- en beweegaanbod. Een verminderde fysieke activiteit geeft namelijk een verhoogd risico op het ontwikkelen van comorbiditeit en een snellere achteruitgang van de gezondheid (Troosters 2019).
Het is ook belangrijk dat de therapeut de eigen regie van de patiënten met COPD bevordert. Het uitgangspunt is dat patiënten een actief aandeel hebben in hun eigen behandeling en omgang met de aandoening. Naarmate patiënten meer regie over hun eigen leven ervaren, hoe beter de ervaren kwaliteit van leven (Longfonds 2018). De patiënt en de therapeut werken tijdens het zorgproces actief samen.
Ten slotte heeft de therapeut een signalerende functie op het gebied van fysiek functioneren, psychosociaal functioneren en participatie. Indien een probleem op een van deze gebieden buiten de expertise van de therapeut valt, is het belangrijk dat dit probleem integraal wordt aangepakt om verergering van de gezondheidsproblematiek te voorkomen. De therapeut heeft gedurende het behandeltraject intensief contact met de patiënt en kan de patiënt goed monitoren, en contact opnemen met de behandelend arts bij de inschatting dat er expertise van een andere zorgverlener nodig is.
In de huidige dagelijkse praktijk zijn de huisarts en/of longarts en de therapeut vaak de eerste zorgverleners met wie de patiënt met COPD in contact komt. Een goede afstemming en samenwerking tussen huisarts en/ of longarts en therapeut is daarom van groot belang voor een optimale zorgverlening. De wijze waarop deze afstemming en samenwerking plaatsvindt, is persoonlijk en afhankelijk van de hulpvraag en gezondheidsproblematiek van de patiënt.
In overleg met de werkgroep en de klankbordgroep is besloten om geen systematische zoekactie uit te voeren voor deze uitgangsvraag, maar de informatie op niet-systematische wijze te vergaren.
- ATS/ERS. An official American Thoracic Society/European Respiratory Society statement: key concepts and advances in pulmonary rehabilitation. Am J Respir Crit Care Med. 2013;188(8):e13-64.
- GOLD. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. Fontana, CA, VS: Global Initiative for Chronic Obstructive Lung Disease (GOLD); 2020.
- KNGF. Beroepsprofiel Fysiotherapeut. Amersfoort: Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF); 2014.
- Longfonds. Zelf regie nemen. Beschikbaar via https://www.longfonds.nl. Geraadpleegd op 17 september 2019.
- McCarthy B, Casey D, Devane D, Murphy K, Murphy E, Lacasse Y. Pulmonary rehabilitation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2015;(2):CD003793.
- Puhan MA, Gimeno-Santos E, Cates CJ, Troosters T. Pulmonary rehabilitation following exacerbati ons of chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2016; 12:CD005305.
- Troosters T, Blondeel A, Rodrigues FM, Janssens W, Demeyer H. Strategies to increase physical activity in chronic respiratory diseases. Clin Chest Med. 2019;40(2):397-404.
- VvOCM. Beroepsprofiel Oefentherapeut. Utrecht: Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM); 2015.
A.3.2 Organisatie van multidisciplinaire samenwerking
Multidisciplinaire samenwerking tussen verschillende beroepsbeoefenaren in de gezondheidszorg draagt bij aan een mogelijk succes van het behandelplan bij COPD. Een van de manieren waarop multidisciplinaire samenwerking plaatsvindt, is de samenwerking binnen een COPD-netwerk of ketenzorg. Behandeling van patiënten met COPD kan plaatsvinden in de eerste, tweede of derde lijn.
Behandeling in de eerste lijn vindt plaats in de nabije omgeving van de patiënt. Tweede- en derdelijnszorg vinden plaats in het ziekenhuis of een longrevalidatiecentrum.
Onderbouwing
Uitgangsvraag
Hoe wordt multidisciplinaire samenwerking rond patiënten met COPD georganiseerd?
Multidisciplinaire samenwerking tussen verschillende beroepsbeoefenaren in de gezondheidszorg draagt bij aan een mogelijk succes van het behandelplan bij mensen met COPD.
COPD-netwerken en ketenzorg
Een van de manieren waarop multidisciplinaire samenwerking plaatsvindt, is de samenwerking binnen een COPD-netwerk of ketenzorg. In veel regio’s zijn netwerken voor therapeuten met aandachtsgebied COPD. Deze netwerken zijn onder meer gericht op kennisverbreding en casuïstiekbespreking. Daarnaast kan door middel van de netwerken laagdrempelig multidisciplinaire samenwerking aangegaan worden, eventueel ook met de tweede en derde lijn. Deze multidisciplinaire samenwerking heeft als doel de kwaliteit van zorg te verbeteren en voorziet in korte lijnen, die van pas komen indien de gezondheidstoestand van de patiënt met COPD verandert en er behoefte is aan aanvullende zorg.
Ketenzorg wordt gedefinieerd als ‘een vorm van zorg die, toegesneden op de behoefte van de patiënt, wordt verleend op basis van afspraken over samenwerking, afstemming en regie tussen alle zorgverleners, gedurende het hele traject van preventie, diagnose, behandeling en (na)zorg. Er is sprake van een gemeenschappelijk gedragen verantwoordelijkheid met expliciete deelverantwoordelijkheden’ (Zorgstandaard 2016). Door de dynamiek binnen een ketenzorgmodel worden veranderingen in de integrale gezondheidstoestand van de patiënt vroegtijdig gesignaleerd en kunnen deze richting geven aan de behandelvormen die de patiënt op dat moment nodig heeft. Het tijdig signaleren van veranderingen in de integrale gezondheidstoestand (bij voorkeur al door de patiënt zelf) en daarop volgende zorg op maat voorkomen escalatie van gezondheidsproblemen.
Eerstelijnszorg
Behandeling in de eerste lijn vindt plaats in de nabije omgeving van de patiënt en richt zich op verbetering of instandhouding van de lichamelijke conditie en kwaliteit van leven (LAN 2016). Bij de patiënt die enkel eerstelijnszorg ontvangt, is de huisarts de medisch eindverantwoordelijke (hoofdbehandelaar). Hij is eindverantwoordelijk voor de diagnostiek en behandeling c.q. begeleiding van de patiënt en draagt zorg voor de continuïteit van de zorg. Daarnaast worden lokaal afspraken gemaakt over wie de functie van zorgcoördinator vervult.
De zorgcoördinator zorgt ervoor dat binnen een multidisciplinair samenwerkingsverband afspraken, taken en acties goed op elkaar worden afgestemd (LAN 2016). De hoofdbehandelaar en zorgcoördinator maken deel uit van een multidisciplinair team, dat kan bestaan uit: een praktijkverpleegkundige / ondersteuner, een longverpleegkundige, een apotheker, een apothekersassistent, een psycholoog, een fysiotherapeut/oefentherapeut C/M, een diëtist, een ergotherapeut, een logopedist en de verantwoordelijke van een thuiszorgorganisatie.
Eerstelijns fysiotherapeutische behandeling is over het algemeen monodisciplinair, maar samenwerking met andere disciplines is mogelijk, indien nodig. Indien er behoefte is aan multidisciplinaire samenwerking met andere zorgverleners in de eerste lijn (behalve de verwijzer), overlegt de therapeut met de huisarts over een eventuele verwijzing naar een andere discipline, zodat deze samenwerking georganiseerd kan worden. Zie B.4.2 ‘Doorverwijzing naar andere zorgverleners’.
Tweede- en derdelijnszorg
Bij patiënten met een hoge symptoomlast die een meer gespecialiseerde behandeling in de tweede of derde lijn krijgen, is de longarts in principe hoofdbehandelaar. In onderling overleg tussen longarts en huisarts kan hiervan worden afgeweken. Voor de patiënt moet echter duidelijk zijn wie de hoofdbehandelaar is. Dergelijke transmurale afspraken tussen huisarts en longarts zijn vastgelegd in de ‘NHG Standaard COPD’ (NHG 2015). Het zorgcoördinatorschap kan bij complexe COPD-patiënten vervuld worden door de longarts of de intramurale longverpleegkundige van het multidisciplinaire team (LAN 2016).
Jaarlijks worden 30.000 mensen in Nederland opgenomen in het ziekenhuis voor een COPD-longaanval. Het landelijk transmuraal Zorgpad ‘COPD longaanval met ziekenhuisopname’ heeft als doel betere zorg te leveren aan patiënten met COPD tijdens en na een ziekenhuisopname door goede zorg, in een goede afstemming met de keten. In het zorgpad wordt gesteld dat door toepassing hiervan het aantal opnamedagen substantieel verlaagd kan worden met minstens gelijke kwaliteit van leven en patiënttevredenheid (LAN 2019).
Tweede- of derdelijnslongrevalidatie richt zich specifiek op de patiënt met een ernstige symptoomlast. Bij patiënten die in de tweede- of derdelijnszorg behandeld worden of vanuit de tweedelijnszorg verwezen zijn, is de longarts hoofdbehandelaar (LAN 2016). De revalidatieprogramma’s binnen de tweede- en derdelijnszorg richten zich behalve op de lichamelijke conditie en het omgaan met medicatie en longaanvallen, ook op andere aspecten van het fysiologisch functioneren en de adaptatie aan de ziekte. Deze zorg is gericht op het optimaliseren van de gehele gezondheidstoestand, participatie en autonomie van de patiënt. De intensiteit van longrevalidatie varieert en kan zowel in dagbehandeling als klinisch vormgegeven zijn. Basisuitgangspunt is dat longrevalidatie een multidisciplinair programma is waarin meerdere disciplines nauw met elkaar samenwerken (LAN 2016).
Na afronding van de longrevalidatie kan de patiënt terugverwezen worden naar de eerstelijnszorg, zodat dichtbij huis het fysiek functioneren en de kwaliteit van leven in stand gehouden of verder verbeterd kunnen worden.
In overleg met de werkgroep en de klankbordgroep is besloten om geen systematische zoekactie uit te voeren voor deze uitgangsvraag, maar de informatie op niet-systematische wijze te vergaren.
- LAN. Zorgstandaard COPD. Amersfoort: Longalliantie Nederland (LAN); 2016.
- LAN. Landelijk Zorgpad COPD longaanval met ziekenhuisopname – Betere zorg voor de patiënt met COPD. Amersfoort: Longalliantie Nederland (LAN); 2019.
- NHG. NHG-Standaard COPD. Utrecht: Nederlands Huisartsen Genootschap (NHG); 2015.
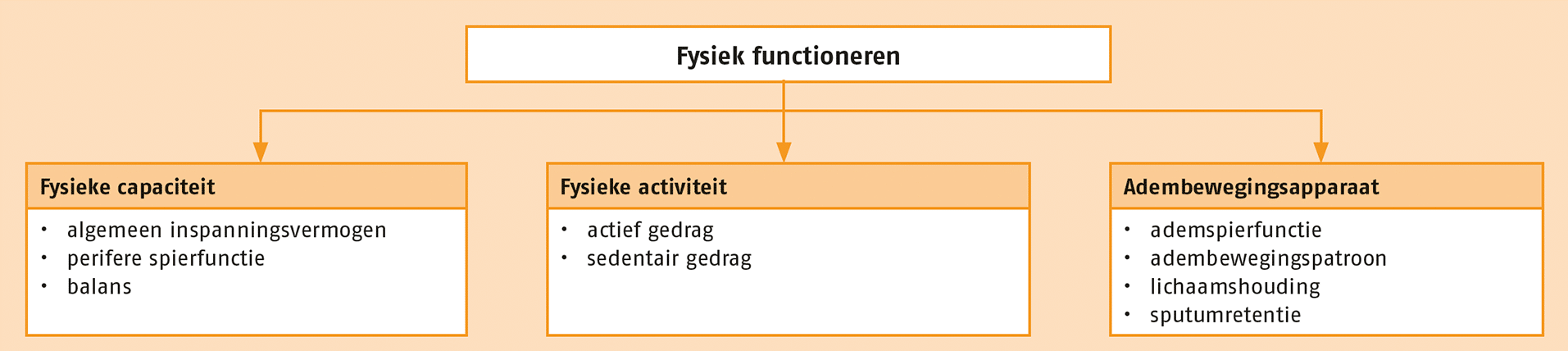
A.3.3 Aangrijpingspunten voor fysio- en oefentherapie C/M
Fysiotherapie en oefentherapie C/M bij patiënten met COPD is, afhankelijk van de gediagnosticeerde beperkingen, gericht op een of meer van de volgende drie aangrijpingspunten:
- de fysieke capaciteit
- de fysieke activiteit
- het adembewegingsapparaat
Onderbouwing
Uitgangsvraag
Wat zijn de belangrijkste aangrijpingspunten voor fysio- en oefentherapie C/M bij patiënten met COPD?
Ondanks een optimale medische behandeling door huisarts en/of longarts ervaren veel patiënten met COPD dagelijks een milde tot hoge symptoomlast. Kortademigheid en vermoeidheid zijn hierbij de meest voorkomende symptomen (Goertz 2019; Janssen 2011). De dagelijkse symptomen kunnen leiden tot een afname in de dagelijkse fysieke activiteit en een verlies van fysieke capaciteit. Hierdoor komen patiënten met COPD in een vicieuze cirkel terecht van fysieke deconditionering, wat uiteindelijk kan leiden tot psychische problemen, een slechtere kwaliteit van leven en een verminderde autonomie en participatie (Gimeno-Santos 2014). Dit proces kan worden versneld door ernstige longaanvallen, die resulteren in een ziekenhuisopname (Pitta 2006; Ramon 2018; Spruit 2003).

Om de vicieuze cirkel van fysieke deconditionering te doorbreken of te vertragen, richten het diagnostisch en therapeutisch proces van de therapeut zich op de aangrijpingspunten ‘fysieke capaciteit’, ‘fysieke activiteit’ en ‘adembewegingsapparaat’. De relevante aangrijpingspunten voor fysio- en oefentherapie C/M bij COPD zijn opgenomen in de volgende figuur.De fysieke capaciteit betreft het vermogen om activiteiten uit te voeren die fysieke acties vereisen (Puente Maestu 2016). Fysieke capaciteit wordt uitgedrukt in een aantal door therapie te beïnvloeden grootheden, namelijk: algemeen inspanningsvermogen (maximaal en submaximaal), perifere spierfunctie (spierkracht en -uithoudingsvermogen) en balans (statische en dynamisch) (De Morree 2011; ERS 2019; ERS/ATS 2014a,b; Hernandes, 2011; Mesquita, 2013; Robles, 2011).
De fysieke activiteit is een parameter voor beweeggedrag en betreft elke lichaamsbeweging die teweeggebracht wordt door skeletspieren en die energiegebruik vereist (Caspersen 1985; WHO 2018). Deze parameter wordt uitgedrukt als verhouding tussen sedentair gedrag en actief gedrag die door therapie te beïnvloeden is, zoals liggen, zitten, staan en bewegen (bijv. aantal stappen per dag).
Het adembewegingsapparaat is de vitale pomp voor de ventilatie en bestaat uit de borstwand (thorax en abdomen) en ademspieren (Gosselink 2016). Het adembewegingsapparaat wordt gekarakteriseerd door een aantal door therapie te beïnvloeden functies, namelijk: ademspierfunctie, adembewegingspatroon (in rust en tijdens inspanning), lichaamshouding en sputumretentie (Charususin 2016; Langer 2018; Priori 2013; Singer 2011).
De fysieke activiteit en de fysieke capaciteit, beide maten voor het fysiek functioneren, hangen redelijk nauw samen, maar zijn niet een-op-een inwisselbaar (Koolen 2019; Lummel 2015). Zodoende worden zij apart gemeten. Fysiek functioneren wordt beïnvloed door fysieke, sociale en omgevingsfactoren. Behandeling is voornamelijk gericht op verbeteren van het (beperkt) fysiek functioneren en de daarmee samenhangende ervaren symptoomlast, en het verbeteren van de mate van participatie en de kwaliteit van leven van de patiënt.
Tijdens het veelvuldig contact met de patiënten kan de therapeut aandacht schenken aan leefstijlverandering en op die manier een coachende functie hebben. Aangrijpingspunten voor leefstijlverandering, zoals gezonde voeding en begeleiding bij het stoppen met roken behoren echter niet tot het primaire domein van de fysiotherapeut en de oefentherapeut C/M; voor deze aangrijpingspunten is de therapeut niet de hoofdbehandelaar. In het geval van een doorverwijzing kan een multidisciplinair overleg met de betreffende zorgverlener overwogen worden voor het afstemmen van de behandeling.
In overleg met de werkgroep en de klankbordgroep is besloten om geen systematische zoekactie uit te voeren voor deze uitgangsvraag, maar de informatie op niet-systematische wijze te vergaren.
- Charususin N, Gosselink R, McConnell A, Demeyer H, Topalovic M, Decramer M, Langer D. Inspiratory muscle training improves breathing pattern during exercise in COPD patients. Eur Respir J. 2016;47(4):1261-4.
- ERS. ERS statement on standardisation of cardiopulmonary exercise testing in chronic lung diseases. Eur Respir Rev. 2019 Dec;28(154).
- ERS/ATS. An official European Respiratory Society/American Thoracic Society technical standard: field walking tests in chronic respiratory disease. Eur Respir J. 2014a;44(6):1428-46.
- ERS/ATS. An official systematic review of the European Respiratory Society/American Thoracic Society: measurement properties of field walking tests in chronic respiratory disease. Eur Respir J. 2014b;44(6):1447-78.
- Gimeno-Santos E, Frei A, Steurer-Stey C, de Batlle J, Rabinovich RA, Raste Y, et al. Determinants and outcomes of physical activity in patients with COPD: a systematic review. Thorax. 2014;69(8):731-9.
- Goërtz YMJ, Spruit MA, Van ‘t Hul AJ, Peters JB, Van Herck M, Nakken N, et al. Fatigue is highly prevalent in patients with COPD and correlates poorly with the degree of airflow limitation. Ther Adv Respir Dis. 2019;13:1753466619878128.
- Hernandes NA, Wouters EF, Meijer K, Annegarn J, Pitta F, Spruit MA. Reproducibility of 6-minute walking test in patients with COPD. Eur Respir J. 2011;38(2):261-7.
- Janssen DJ, Spruit MA, Uszko-Lencer NH, Schols JM, Wouters EF. Symptoms, comorbidities, and health care in advanced chronic obstructive pulmonary disease or chronic heart failure. J Palliat Med. 2011;14(6):735-43.
- Koolen EH, van Hees HW, van Lummel RC, Dekhuijzen R, Djamin RS, Spruit MA, et al. ‘Can do’ versus ‘do do’: A Novel concept to better understand physical functioning in patients with chronic obstructive pulmonary disease. J Clin Med. 2019;8(3).
- Langer D, Ciavaglia C, Faisal A, Webb KA, Neder JA, Gosselink R, et al. Inspiratory muscle training reduces diaphragm activation and dyspnea during exercise in COPD. J Appl Physiol (1985). 2018;125(2):381-92.
- Lummel RC, Walgaard S, Pijnappels M, Elders PJ, Garcia-Aymerich J, van Dieën JH, et al. Physical performance and physical activity in older adults: associated but separate domains of physical function in old age.
- PloS one 2015;10(12):e0144048.
- Mesquita R, Janssen DJ, Wouters EF, Schols JM, Pitta F, Spruit MA. Within-day test-retest reliability of the Timed Up & Go test in patients with advanced chronic organ failure. Arch Phys Med Rehabil. 2013;94(11):2131-8.
- Pitta F, Troosters T, Probst VS, Spruit MA, Decramer M, Gosselink R. Physical activity and hospitalization for exacerbation of COPD. Chest. 2006;129(3):536-44.
- Priori R, Aliverti A, Albuquerque AL, Quaranta M, Albert P, Calverley PM. The effect of posture on asynchronous chest wall movement in COPD. J Appl Physiol (1985). 2013;114(8):1066-75.
- Puente-Maestu L, Palange P, Casaburi R, Laveneziana P, Maltais F, Neder JA, et al. Use of exercise testing in the evaluation of interventional efficacy: an official ERS statement. Eur Respir J. 2016;47:429-60.
- Ramon MA, ter Riet G, Carsin AE, Gimeno-Santos E, Agustí A, Antó JM, et al. The dyspnoeain activity vicious circle in COPD: development and external validation of a conceptual model. Eur Respir J. 2018;52(3).
- Robles PG, Mathur S, Janaudis-Fereira T, Dolmage TE, Goldstein RS, Brooks D. Measurement of peripheral muscle strength in individuals with chronic obstructive pulmonary disease: a systematic review. J Cardiopulm Rehabil Prev. 2011;31(1):11-24.
- Singer J, Yelin EH, Katz PP, Sanchez G, Iribarren C, Eisner MD, Blanc PD. Respiratory and skeletal muscle strength in chronic obstructive pulmonary disease: impact on exercise capacity and lower extremity function. J Cardiopulm Rehabil Prev. 2011;31(2):111-9.
- Spruit MA, Gosselink R, Troosters T, Kasran A, Gayan-Ramirez G, Bogaerts P, Bouillon R, et al. Muscle force during an acute exacerbation in hospitalised patients with COPD and its relationship with CXCL8 and IGF-I. Thorax. 2003;58(9):752-6.
- Vanfleteren LE, Spruit MA, Groenen M, Gaffron S, van Empel VP, Bruijnzeel PL, et al. Clusters of comorbidities based on validated objective measurements and systemic inflammation in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2013;187(7):728-35.
A.3.4 Informatie-uitwisseling met verwijzer
Op de verwijzing moeten de volgende (recentelijk gemeten) gegevens vermeld staan:
- luchtstroombeperking (FEV1)
- mate van kortademigheid (Medical Research Council (MRC) of modified Medical Research Council (mMRC))
- symptoomlast (score op de ‘Clinical COPD Questionnaire’ (CCQ) of de ‘COPD Assessment Test’ (CAT))
- aantal doorgemaakte longaanvallen in de afgelopen 12 maanden
- aantal longgerelateerde ziekenhuisopnamen in de afgelopen 12 maanden
- vraagstelling/reden van verwijzing
- relevante comorbiditeit
- actueel medicatieoverzicht
- uitslagen van relevant medisch diagnostisch onderzoek
Bij gebruik van medische zuurstof dient de verwijzing informatie te bevatten over de dosering (continu en/of inspanningsafhankelijk plus de instellingen ten aanzien van de stroomsnelheid in l/min).
Aanbevelingen
Neem contact op met de verwijzer indien de noodzakelijke informatie niet op de verwijzing vermeld staat.
Stuur een rapportage naar de verwijzer en de zorgcoördinator (indien aangesteld) bij het niet starten van therapie, bij relevante tussentijdse veranderingen, bij tussentijdse evaluaties, bij afsluiting van de behandeling en bij iedere periodieke terugkomsessie.
Stel verslagen en eindrapportages op conform de vigerende ‘NHG-KNGF-richtlijn Gestructureerde informatie-uitwisseling tussen huisarts en fysiotherapeut’, de ‘KNGF-richtlijn Fysiotherapeutische dossiervoering’ en de ‘VvOCM-richtlijn Verslaglegging’.
Rapporteer na toestemming van de patiënt aan zowel de verwijzer als de zorgcoördinator (indien deze is aangesteld). Optioneel kan een kopie van de rapportage verstuurd worden aan andere zorgverleners die betrokken zijn bij de multidisciplinaire behandeling.
Onderbouwing
Uitgangsvragen
- Welke informatie heeft de therapeut nodig van de verwijzer (huisarts of longarts)?
- Welke informatie rapporteert de therapeut aan de verwijzer?
Informatie-uitwisseling van verwijzer naar therapeut
Een patiënt met COPD kan verwezen zijn door de huisarts of de longarts. Een verwijzing bestaat uit:
- administratieve en logistieke gegevens
- de kern, die alle relevante informatie over de patiënt bevat
- een bijlage waarin de overige medisch-inhoudelijke rubrieken zijn opgenomen
De verwijzing dient de volgende (recentelijk gemeten) gegevens te bevatten: FEV1, de score op de mMRC (of MRC) schaal, de score op de ‘Clinical COPD Questionnaire’ (CCQ) of de ‘COPD Assessment Test’ (CAT), het aantal doorgemaakte longaanvallen en het aantal longgerelateerde ziekenhuisopnamen in de afgelopen 12 maanden. De volgende noodzakelijke gegevens dienen te zijn bijgevoegd: vraagstelling/reden van verwijzing, relevante comorbiditeit, actueel medicatieoverzicht en uitslagen van relevant medisch-diagnostisch onderzoek (waaronder de maximale inspanningstest (CPET) indien van toepassing). Optioneel zijn: familieanamnese, psychosociale anamnese en, indien van toepassing, informatie over voorzieningen die nodig zijn bij een consult (NHG/ KNGF 2012). Als de patiënt zuurstof gebruikt, is het noodzakelijk om hoeveel l/min zuurstof de patiënt nodig heeft en of de zuurstof continu of alleen bij inspanning is geïndiceerd.
Om een patiënt met COPD te kunnen classificeren volgens de vereisten van de vergoedingsaanspraak dient de verwijzing de volgende gegevens te bevatten:
- FEV1
- de score op de (m)MRC-schaal en/of de CAT-score en/of de CCQ-score
- het aantal longaanvallen in de afgelopen twaalf maanden
- het aantal aan een longaanval gerelateerde ziekenhuisopnamen in de afgelopen twaalf maanden
Informatie-uitwisseling van therapeut naar verwijzer
De therapeut brengt zowel tussentijds als bij afsluiting van de behandeling in ieder geval verslag uit aan de verwijzer en de zorgcoördinator (indien aangesteld). Bij multidisciplinaire samenwerking kan – indien wenselijk – een kopie van de rapportage verstuurd worden aan andere zorgverleners die betrokken zijn bij de betreffende patiënt met COPD. Ook indien de patiënt niet start met het programma, ongeacht de reden (financieel, compliance, logistiek, enz.) brengt de therapeut verslag uit aan de verwijzer.
Bij tussentijdse rapportages vermeldt de therapeut ten minste de volgende gegevens: vraagstelling/reden van verwijzing, conclusie/therapeutische diagnose, behandelplan en behandelverloop/resultaat. Optioneel kan ook vermeld worden: anamnese, lichamelijk onderzoek, toegepaste interventies en het resultaat van het overleg met de patiënt (adviezen en afspraken) (NHG/KNGF 2012).
Het eindverslag bevat ten minste de volgende gegevens: vraagstelling/reden van verwijzing, conclusie, de fysiotherapeutische/oefentherapeutische diagnose, het behandelplan, het behandelverloop/resultaat van de behandeling en het resultaat van het overleg met de patiënt (adviezen en afspraken). Optioneel kunnen gegevens van het tussentijds verslag opgenomen worden. In het eindverslag staat ook de reden van de afsluiting vermeld, en of er terugkomsessies zijn gepland om de gezondheidssituatie van de patiënt te monitoren.In geval van terugkomsessies wordt van iedere sessie een tussentijds evaluatieverslag opgesteld en verstuurd, waarin is opgenomen of er sprake is van consolidatie of achteruitgang van de gezondheidssituatie en het behandelverloop.
Bij een langdurig behandelproces brengt de therapeut minimaal één keer per jaar verslag uit aan de verwijzer en de zorgcoördinator (indien aangesteld).
Zie voor verdere informatie over informatie-uitwisseling de ‘NHG-KNGF-richtlijn Gestructureerde informatie- uitwisseling tussen huisarts en fysiotherapeut’ en voor meer informatie over dossiervoering de vigerende KNGF-richtlijn ‘Fysiotherapeutische Dossiervoering’ en de VvOCM-richtlijn ‘Verslaglegging’ (NHG/KNGF 2012, KNGF 2019, VvOCM 2018).
In overleg met de werkgroep en de klankbordgroep is besloten om geen systematische zoekactie uit te voeren voor deze uitgangsvraag, maar de informatie op niet-systematische wijze te vergaren.
- KNGF. Richtlijn Fysiotherapeutische dossiervoering 2019. Amersfoort: Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF); 2019.
- NHG/KNGF. Richtlijn gestructureerde informatie-uitwisseling tussen huisarts en fysiotherapeut. Nederlands Utrecht/Amersfoort: Huisartsen Genootschap (NHG)/Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF); 2012.
- VvOCM. Richtlijn verslaglegging. Utrecht: Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM); 2018.

