Hoofdstuk C en D
Diagnostisch proces
Het diagnostisch proces start met een verwijzing door een arts en aanmelding van de patiënt, gevolgd door het afnemen van een anamnese en het uitvoeren van een lichamelijk onderzoek, waarna het proces wordt afgesloten met een analyse van de bevindingen. Voor het objectiveren van onder andere de neurologische symptomen en functionele gevolgen van het CVA is een aantal meetinstrumenten geselecteerd met bijbehorende scoreformulieren. Ten behoeve van de diagnostiek is een intakeformulier (opent in nieuw tabblad) ontwikkeld.
Dit formulier en de geselecteerde meetinstrumenten kunnen door fysiotherapeuten in de eerste, tweede en de derde lijn worden gebruikt. Bij elke fysiotherapeutische overdracht dient een kopie van de gegevens uit het diagnostisch proces te worden bijgesloten. Op deze wijze is binnen een regionale stroke service continuïteit in registratie van fysiotherapeutische gegevens gewaarborgd.
Het klinisch redeneren, dat wil zeggen het kunnen interpreteren van meetuitslagen van gevalideerde meetinstrumenten en het kunnen beargumenteren en nemen van klinische beslissingen, is geen vanzelfsprekendheid; het vergt ervaring en deskundigheid.
Het fysiotherapeutisch diagnostisch proces is opgebouwd uit een viertal stappen, te weten:
- de verwijzing en aanmelding,
- de anamnese,
- het onderzoek, inclusief gebruik van meetinstrumenten op vaste meetmomenten en
- de analyse.
Het doel van dit proces is te komen tot een uniforme fysiotherapeutische beoordeling van patiënten met een CVA.
Voor stap 1 en 2 is een intakeformulier (opent in nieuw tabblad) ontwikkeld. Voor het objectiveren van onder andere de neurologische symptomen en functionele gevolgen van het CVA in stap 3 heeft de werkgroep meetinstrumenten geselecteerd. Zowel de ontwikkeling van het intakeformulier als het selecteren van de meetinstrumenten met bijbehorende test- en scoreformulieren heeft plaatsgevonden in een aantal consensusbijeenkomsten met de leden van de eerste kring die op dat moment als fysiotherapeut werkzaam waren in een stroke service in de eerste, tweede of derde lijn. De keuze van de meetinstrumenten is in eerste instantie gebaseerd op klinimetrische eigenschappen. In tweede instantie is door middel van consensus met de leden van de eerste kring de definitieve set meetinstrumenten met bijbehorende scoreformulieren vastgesteld. De meetinstrumenten en scoreformulieren zijn op draagkracht getoetst in de conceptversie van de richtlijn door ze voor te leggen aan 169 fysiotherapeuten in het werkveld. Bij de herziening van de richtlijn zijn de meetinstrumenten en formulieren nogmaals kritisch beschouwd. Voor enkele domeinen zijn meetinstrumenten toegevoegd nadat zij op bruikbaarheid werden getoetst in 11 instellingen en praktijken met daaraan gelieerde ketenpartners in de stroke service.
Systematisch meten wordt in deze richtlijn niet beschouwd als een doel op zich, maar als een integraal onderdeel van evidence-based practice. Het aantal in de richtlijn aanbevolen meetinstrumenten is daarom beperkt gehouden; het zijn wél de meetinstrumenten die als basis dienen voor het objectiveren van stoornissen in functies en beperkingen in activiteiten en participatie van de patiënt. Klinisch kunnen redeneren (het kunnen interpreteren van meetuitslagen van gevalideerde meetinstrumenten en het kunnen maken en beargumenteren van klinische beslissingen) is geen vanzelfsprekendheid; het vergt ervaring en deskundigheid.
Het bij het diagnostisch proces behorende intakeformulier en de geselecteerde meetinstrumenten kunnen zowel in de eerste, tweede als derde lijn worden gebruikt. Geadviseerd wordt een kopie van deze gegevens bij elke fysiotherapeutische overdracht bij te sluiten, waardoor binnen een regionale stroke service continuïteit in registratie van fysiotherapeutische gegevens is gewaarborgd.
C.1 Verwijzing, aanmelding en anamnese
Bij de verwijzing en aanmelding en op grond van de daarop volgende anamnese dienen in het fysiotherapeutisch dossier de volgende gegevens te worden opgenomen: patiëntgegevens, zoals naam, geboortedatum, geslacht, burgerservicenummer (BSN), adres en medische diagnose; ontstaansdatum CVA; type CVA; lokalisatie CVA; locatie van opname; opnamedatum; opleidingsniveau; beroep; gegevens over de woonsituatie; vrijetijds- of dagbesteding; voorkeurshand; comorbiditeit; motorisch en cognitief pre-existent functioneren; relevante medische en/of psychiatrische voorgeschiedenis; relevante medicatie en eventuele gegevens van partner en kinderen. Voor een overzicht van vast te leggen gegevens wordt verwezen naar de ‘KNGF-richtlijn Fysiotherapeutische dossiervoering (opent in nieuw tabblad)‘.
De fysiotherapeut dient bij aanvang van de behandeling op de hoogte te zijn van het premorbide en actuele functioneren, de aanwezige stoornissen en beperkingen, de sociale ondersteuning en de hulpvraag en verwachtingen van de patiënt. Indien mogelijk kunnen deze gegevens worden overgenomen uit de medische status, de verpleegkundige status en/of het elektronisch patiëntendossier (EPD). Zijn er geen gegevens beschikbaar of is de status of het EPD niet toegankelijk, dan is het wenselijk de mate van stoornissen in functies nader uit te vragen en te beoordelen, zoals parese, bewegingsuitslag, coördinatie, somatosensibiliteit, evenals beperkingen in activiteiten als transfers, loop- en arm-handvaardigheid en ADL-vaardigheden. Kan de patiënt de gewenste gegevens niet zelf verstrekken, dan is een hetero-anamnese bij de partner/mantelzorger(s) een optie.
Tijdens deze drie stappen van het methodisch handelen registreert de fysiotherapeut algemene gegevens van de patiënt, demografische gegevens, de medische voorgeschiedenis, de diagnose, de gegevens van de partner en de sociale ondersteuning. Indien mogelijk kunnen deze gegevens worden overgenomen uit de medische status, de verpleegkundige status en/of het elektronisch patiëntendossier (EPD) en worden genoteerd op het intakeformulier (opent in nieuw tabblad). Voor een overzicht van vast te leggen gegevens wordt verwezen naar de vigerende ‘KNGF-richtlijn Fysiotherapeutische dossiervoering (opent in nieuw tabblad)‘.(voorheen 319) Daarnaast dient de fysiotherapeut bij aanvang van de behandeling op de hoogte te zijn van het premorbide en actuele functioneren, de aanwezige stoornissen en beperkingen, en de hulpvraag en verwachtingen van de patiënt.
C.2 Diagnostische verrichtingen met meetinstrumenten
Na de anamnese worden voorlopige conclusies getrokken en hypotheses opgesteld naar aanleiding waarvan de fysiotherapeut diagnostische verrichtingen uitvoert. De werkgroep adviseert hierbij gebruik te maken van een aantal geselecteerde meetinstrumenten, om op objectieve wijze stoornissen in functie, beperkingen in activiteiten en participatie, en bevorderende en belemmerende contextuele factoren in kaart te brengen. Met behulp van deze meetinstrumenten kunnen voor de patiënt belangrijke (behandel)domeinen in kaart worden gebracht op activiteiten- en participatieniveau, zoals arm-handvaardigheid, loopvaardigheid en daaraan gerelateerde vaardigheden, basale en instrumentele activiteiten van het dagelijks leven (ADL-vaardigheden) en ervaren kwaliteit van leven. Op het niveau van lichaamsfuncties kan worden gedacht aan neurologische functies, lichamelijke conditie, neuropsychologische en psychische functies, en vermoeidheid.
Meetinstrumenten kunnen onderscheiden worden op basis van de functie die zij vervullen. Zo zijn er instrumenten die met name diagnosticeren, classificeren, screenen, en/of evalueren. De meetinstrumen ten die van toepassing kunnen zijn bij patiënten met een beroerte zijn op systematische wijze gekoppeld aan de gezondheidsdomeinen van de ICF. In de volgende figuur staat een overzicht van de aanbevolen meetinstrumenten. Deze instrumenten kunnen worden toegepast wanneer daar in de praktijk aanleiding toe is. De optionele meetinstrumenten staan in de Verantwoording.
Overzicht van de aanbevolen meetinstrumenten.
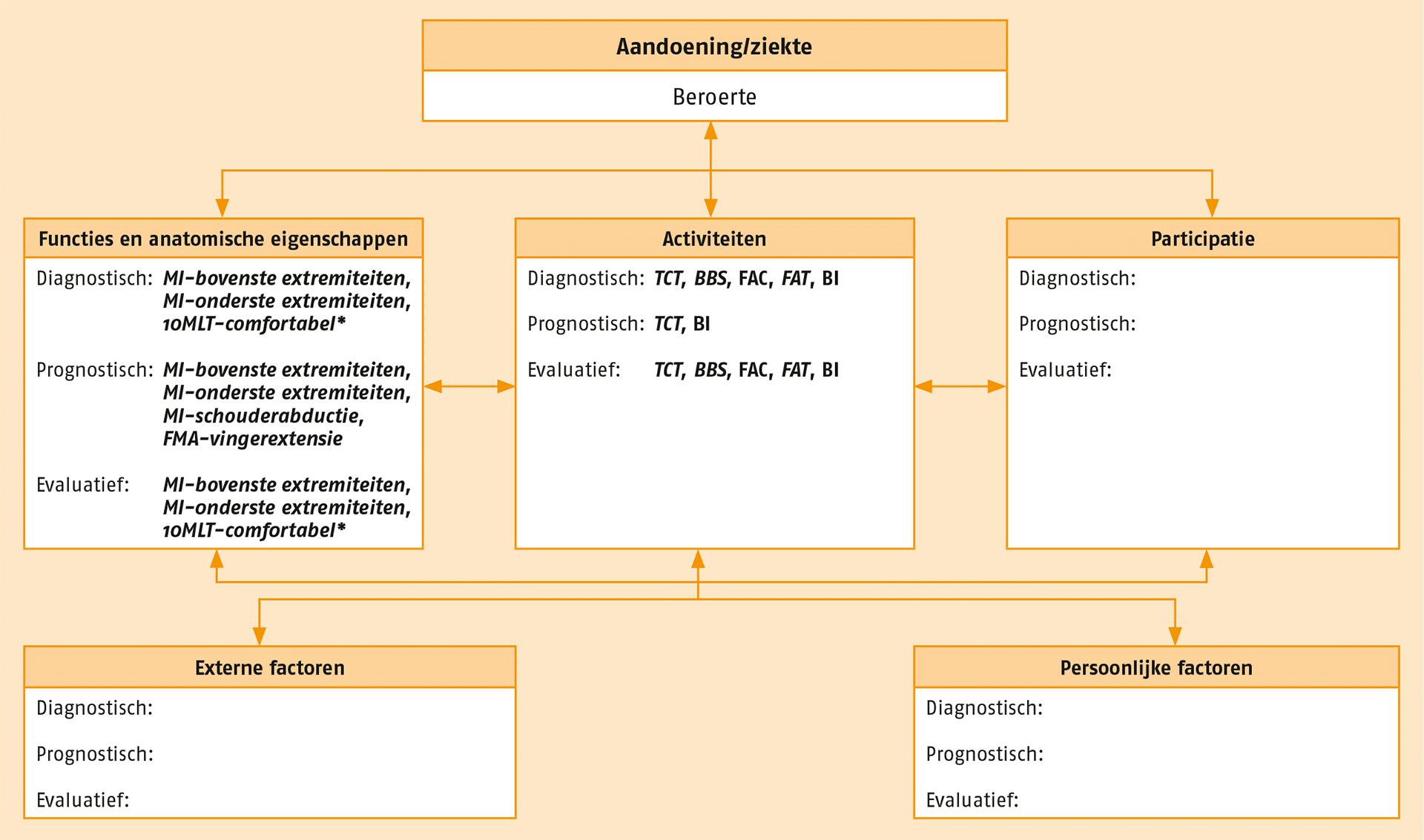
10MLT = Tien-meter looptest; BBS = Berg Balance Scale; BI = Barthel Index; FAC = Functional Ambulation Categories; FAT = Frenchay Arm Test; FMA = Fugl-Meyer Assessment; MI = Motricity Index; TCT = Trunk Control Test.
Cursief = performancetest/functietest; niet cursief = vragenlijst/observatielijst. * indien FAC ≥ 3.
NB Voor het in kaart brengen van participatie, externe en persoonlijke factoren zijn in deze richtlijn geen aanbevolen meetinstrumenten beschreven.
De aanbevolen meetinstrumenten zijn een voorkeursset van meetinstrumenten die belangrijke stoornissen in functie en beperkingen in activiteiten vastleggen. Sommige optionele meetinstrumenten zijn bedoeld voor het verzamelen van gegevens binnen een domein dat reeds is geobjectiveerd met een van de aanbevolen meetinstrumenten en zijn in die zin een aanvulling daarop. Het merendeel van de optionele meetinstrumenten beslaat echter andere (relevante) domeinen dan de domeinen die de aanbevolen meetinstrumenten beslaan.
De fysiotherapeut hoeft niet altijd alle gewenste metingen zélf te verrichten. Door afspraken te maken met andere betrokken disciplines van het behandelteam kan in de meeste gevallen een evenwichtige verdeling worden gemaakt van de tijdsinvestering die het meten met zich meebrengt. Een van de voorwaarden voor vrijwel alle meetinstrumenten is dat de patiënt over voldoende begripsvermogen beschikt en instrueerbaar is. Indien dit niet het geval is, zal uitsluitend klinische observatie (d.w.z. descriptie) gebruikt worden voor het vastleggen van stoornissen in functies en beperkingen in activiteiten en participatie.
In de volgende tabel is een overzicht opgenomen van alle relevante domeinen en bijbehorende meetinstrumenten. Alle meetinstrumenten die in deze Praktijkrichtlijn en in de Verantwoording en toelichting zijn beschreven, en de formulieren met de klinimetrische eigenschappen van de instrumenten ten aanzien van patiënten met een CVA, zijn beschikbaar via www.meetinstrumentenzorg.nl.
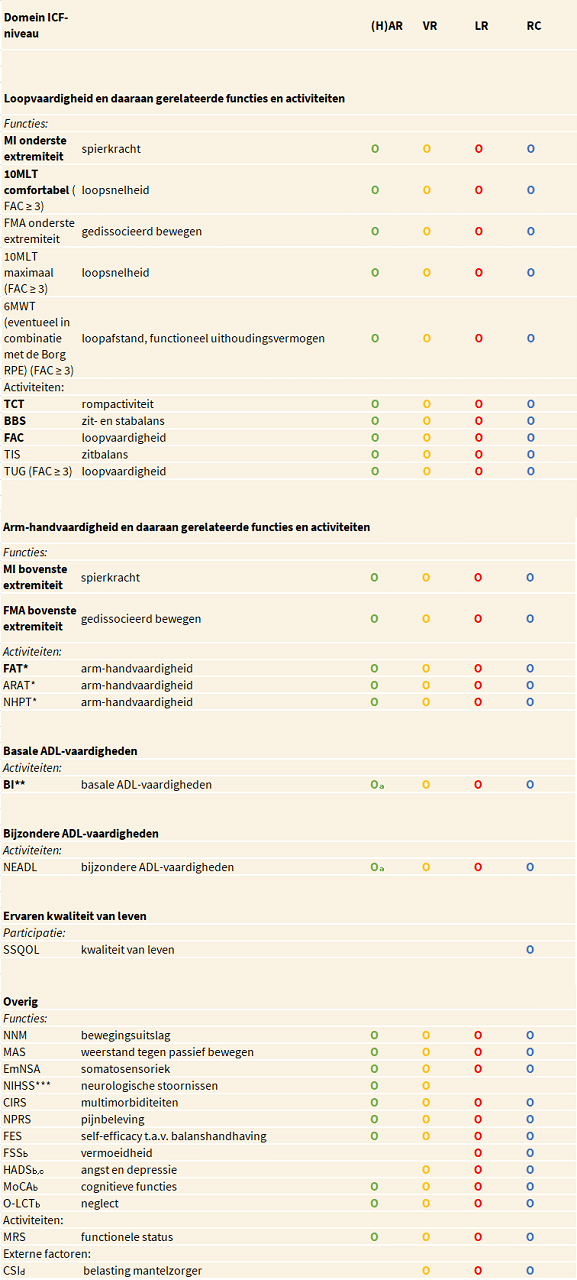
Voor de fysiotherapie relevante domeinen en meetinstrumenten, onderscheiden naar aanbevolen en optionele meetinstrumenten.
(H)AR = (hyper)acute (revalidatie)fase; VR = vroege revalidatiefase; LR = late revalidatiefase; RC = revalidatie in de chronische fase. O De fase waarin het aanbevolen/optionele meetinstrument wordt afgenomen.
10MLT = Tien-meter looptest; 6MWT = Zes-minuten wandeltest; ARAT = Action Research Arm Test; BI = Barthel Index; BBS = Berg Balance Scale; Borg RPE = Borg Rating of Perceived Exertion; CIRS = Cumulative Illness Rating Scale; CSI = Caregiver Strain Index; EmNSA = Erasmus MC modificatie van het (revised) Nottingham Sensory Assessment; FAC = Functional Ambulation Categories; FAT = Frenchay Arm Test; FES = Falls-Efficacy Scale; FMA = Fugl-Meyer Assessment; FSS = Fatigue Severity Scale; HADS = Hospital Anxiety and Depression Scale; MAS = Modified Ashworth Scale; MI = Motricity Index; MoCA = Montreal Cognitive Assessment; mRS = Modified Rankin Scale; NEADL = Nottingham Extended ADL index; NIHSS = National Institutes of Health Stroke Scale; NHPT = Nine Hole Peg Test; NNM = Goniometer volgens de Neutrale-0-Methode; NPRS = Numeric Pain Rating Scale; O-LCT = O-Letter Cancellation Test; SSQoL = Stroke-Specific Quality Of Life scale; TCT = Trunk Control Test; TIS = Trunk Impairment Scale; TUG = Timed Up and Go test.
a Om de premorbide situatie vast te stellen. b Bedoeld als signalering; behandeling hiervan ligt niet primair binnen het domein van de Fysiotherapie. c Af te nemen vanaf 7 dagen na het CVA. d Na ontslag naar huis of na proefverlof, én er een mantelzorger aanwezig is. * indien mogelijk ook over te nemen uit ergotherapeutisch dossier. ** Indien mogelijk ook over te nemen uit verpleegkundig dossier. *** Indien mogelijk ook over te nemen uit medisch dossier.
Na de anamnese worden voorlopige conclusies getrokken en hypotheses opgesteld naar aanleiding waarvan de fysiotherapeut een aantal diagnostische verrichtingen uitvoert. Hierbij valt te denken aan: bewustzijn, algemene indruk, communicatie en neuropsychologische functiestoornissen, hersenzenuwen, complicaties, spierkracht, gedissocieerd bewegen, gewrichtsmobiliteit, somatosensoriek, stijfheid bij passief bewegen, coördinatie, pijn, houding handhaven, houding veranderen, dragen, verplaatsen en manipuleren, gebruik van hulpmiddelen en ADL (zie ook de Samenvatting). Er wordt geadviseerd om gebruik te maken van de meetinstrumenten die de werkgroep heeft geselecteerd, omdat deze instrumenten op objectieve wijze de stoornissen in functie, beperkingen in activiteiten en participatie, en bevorderende en belemmerende contextuele factoren in kaart brengen, en daarmee de voor de patiënt belangrijke (behandel)domeinen op activiteiten- en participatieniveau, zoals arm-handvaardigheid, loopvaardigheid en daaraan gerelateerde vaardigheden, basale en instrumentele ADL-vaardigheden en ervaren kwaliteit van leven. Dat geldt ook voor de domeinen op het niveau van lichaamsfuncties, zoals neurologische functies, lichamelijke conditie en vermoeidheid.
Meetinstrumenten kunnen onderscheiden worden op basis van de functie die zij vervullen. Zo zijn er instrumenten die met name diagnosticeren, classificeren, screenen, en/of evalueren. De set meetinstrumenten in deze richtlijn is geclassificeerd volgens de International Classification of Functioning, disability and health (ICF).15 (Voor een beschrijving van het ICF wordt verwezen naar paragraaf A.5.1 ‘WHO ICF’.) De testbatterij beslaat zo veel mogelijk voor de patiënt relevante domeinen. Daarnaast zijn de klinimetrische eigenschappen van de diverse meetinstrumenten richtinggevend geweest, zoals betrouwbaarheid, validiteit en responsiviteit. Tevens speelden gebruiksvriendelijkheid en jarenlange klinische ervaring met het meten van patiënten met een CVA van de leden van de eerste kring een rol bij de selectie. Waar mogelijk is gebruikgemaakt van in het Nederlands gevalideerde meetinstrumenten. Wanneer deze niet voorhanden waren, koos de werkgroep reeds vertaalde, niet gevalideerde versies. Nog niet vertaalde versies zijn door de projectgroep vertaald. Voor deze vertaalde versies en andere niet-gevalideerde testen zal in de toekomst echter validiteitsonderzoek moeten plaatsvinden.
De meetinstrumenten die van toepassing kunnen zijn bij patiënten met een beroerte zijn op systematische wijze gekoppeld aan de gezondheidsdomeinen van de ICF. Zie paragraaf C.2.1 voor de aanbevolen meetinstrumenten en paragraaf C.2.2 voor de optionele meetinstrumenten.
Het gebruik van de aanbevolen meetinstrumenten op vaste meetmomenten wordt noodzakelijk geacht voor adequate zorgverlening. De optionele meetinstrumenten kunnen worden gebruikt wanneer daar aanleiding voor is. Dit betekent echter niet dat de fysiotherapeut altijd zélf de metingen moet verrichten. Door afspraken te maken met andere betrokken disciplines van het behandelteam kan in de meeste gevallen een evenwichtige verdeling worden gemaakt van de tijdsinvestering die het meten met zich meebrengt.
Een van de voorwaarden voor het afnemen van vrijwel alle meetinstrumenten is dat de patiënt voldoende begrip heeft en instrueerbaar is. Indien dit niet het geval is zal uitsluitend klinische observatie (d.w.z. descriptie) gebruikt worden voor het vastleggen van stoornissen in functies en/of beperkingen in activiteiten en participatie.
C.2.1 Aanbevolen meetinstrumenten
De acht aanbevolen meetinstrumenten die door de werkgroep zijn geselecteerd, dienen voor het kwantificeren van: de spierkracht aan de hemiplegische zijde, de rompactiviteit, de balans, de loopvaardigheid, de arm-handvaardigheid en de uitvoering van basale ADL-activiteiten, namelijk:
- de Motricity Index (MI),
- de Trunk Control Test (TCT),
- de Berg Balance Scale (BBS),
- de Functional Ambulation Categories (FAC),
- de Tien-meter looptest (10MLT) met comfortabele loopsnelheid,
- de Frenchay Arm Test (FAT),
- de Barthel Index (BI) en
- de Fugl-Meyer Assessment (FMA-vingerextensie).
Deze meetinstrumenten kunnen zowel diagnostisch als evaluatief worden ingezet. Ze zijn geselecteerd op grond van hun betrouwbaarheid, responsiviteit, predictieve en constructvaliditeit en tot slot, hun praktische toepasbaarheid. Niet alle metingen hoeven in een keer afgenomen te worden; afname kan ook gefaseerd, afhankelijk van de belastbaarheid van de patiënt en de ernst van het CVA.
In deze richtlijn zijn acht aanbevolen meetinstrumenten opgenomen. Deze kwantificeren: de mate van spierkracht aan de hemiplegische zijde, de rompactiviteit, de balans, de loopvaardigheid, de arm-handvaardigheid en de vaardigheden in de basale ADL te kwantificeren. De geselecteerde aanbevolen meetinstrumenten zijn:
- de Motricity Index (MI),
- de Trunk Control Test (TCT),
- de Berg Balance Scale (BBS),
- de Functional Ambulation Categories (FAC),
- de Tien-meter looptest (10MLT) met comfortabele loopsnelheid,
- de Frenchay Arm Test (FAT),
- de Barthel Index (BI) en
- de Fugl-Meyer Assessment (FMA-vingerextensie).
De meetinstrumenten kunnen zowel diagnostisch als evaluatief worden gebruikt. Gekozen is voor deze set aan meetinstrumenten op basis van betrouwbaarheid, responsiviteit, predictieve en constructvaliditeit en praktische toepasbaarheid. Niet alle metingen hoeven in een keer afgenomen worden; dit kan ook gefaseerd, afhankelijk van de belastbaarheid van de patiënt en de ernst van het CVA.
In de volgende figuur staan de aanbevolen meetinstrumenten. Deze meetinstrumenten vormen een voorkeursset van meetinstrumenten die, indien relevant, bij alle patiënten met een CVA kunnen worden gebruikt om belangrijke stoornissen in functie en beperkingen in activiteiten en participatie vast te leggen. Al deze meetinstrumenten zijn beschikbaar via www.meetinstrumentenzorg.nl.
Overzicht van de aanbevolen meetinstrumenten.
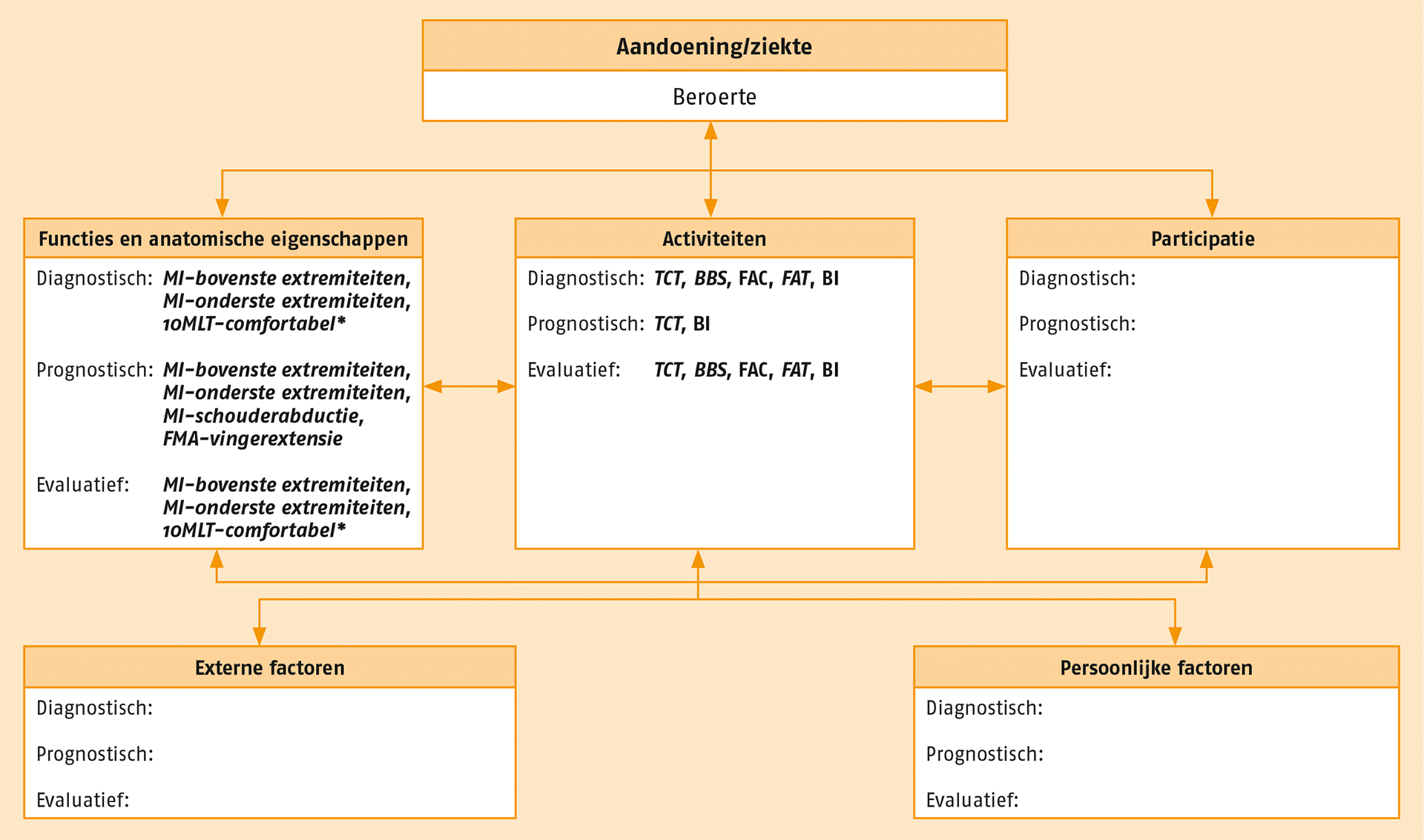
10MLT = Tien-meter looptest; BBS = Berg Balance Scale; BI = Barthel Index; FAC = Functional Ambulation Categories; FAT = Frenchay Arm Test; FMA = Fugl-Meyer Assessment; MI = Motricity Index; TCT = Trunk Control Test.
Cursief = performancetest/functietest; niet cursief = vragenlijst/observatielijst. * indien FAC ≥ 3.
NB Voor het in kaart brengen van participatie, externe en persoonlijke factoren zijn in deze richtlijn geen aanbevolen meetinstrumenten beschreven.
Bron: Swinkels RAHM, Meerhoff GA, Beekman E, Beurskens AJHM. Raamwerk Klinimetrie voor evidence based products. Amersfoort: KNGF; 2016.
C.2.2 Optionele meetinstrumenten
Naast de aanbevolen zijn in de richtlijn 23 optionele meetinstrumenten opgenomen, die gebruikt kunnen worden wanneer daarvoor aanleiding is. De fysiotherapeut selecteert deze meetinstrumenten op basis van de hulpvraag van de patiënt met de aan de hulpvraag gerelateerde behandeldoelen en/of handelt naar eigen inzicht. Elk meetinstrument heeft zijn eigen (beperkte) toepasbaarheid en zal, afhankelijk van de ernst van bepaalde symptomen, het moment na het CVA en waar de patiënt wordt verpleegd, kunnen worden gebruikt voor diagnostiek, screening en/of evaluatie.
De optionele meetinstrumenten zijn:
- het Fugl-Meyer Assessment (FMA),
- de Tien-meter looptest (10MLT) met maximale loopsnelheid,
- de Zes-minuten wandeltest (6MWT), eventueel gecombineerd met de ‘Borg Rating of Perceived Exertion’ (Borg RPE),
- de Trunk Impairment Scale (TIS),
- de Timed Up and Go test (TUG),
- de Action Research Arm Test (ARAT),
- de Nine Hole Peg Test (NHPT),
- de Nottingham Extended ADL-index (NEADL),
- de Stroke-Specific Quality of Life scale (SSQOL),
- de Neutrale-0-Methode (NNM) (goniometer),
- de Modified Ashworth Scale (MAS),
- de Erasmus MC modificatie van het (revised) ‘Nottingham Sensory Assessment (EmNSA),
- de National Institutes of Health Stroke Scale (NIHSS),
- de Numeric Pain Rating Scale (NPRS),
- de Falls-Efficacy Scale (FES),
- de Fatigue Severity Scale (FSS),
- de Nottingham Extended ADL-index (NEADL) en
- de Modified Rankin Scale (MRS).
De richtlijn bevat ook vijf optionele meetinstrumenten die met name een signalerende functie hebben voor stoornissen in functies of contextuele factoren die niet direct (primair) tot het behandeldomein van de fysiotherapeut behoren, maar wel invloed kunnen hebben op de behandeling, namelijk:
- de ‘Hospital Anxiety and Depression Scale’ (HADS),
- het ‘Montreal Cognitive Assessment’ (MoCA),
- de ‘O-Letter Cancellation Test’ (O-LCT) en
- de ‘Caregiver Strain Index’ (CSI).
Deze screeningsinstrumenten zijn met name zinvol als er verdenking bestaat op een stoornis of beperking binnen een van bedoelde domeinen, terwijl er op dat moment bij de behandeling geen zorgverlener betrokken is met relevante beroepsspecifieke expertise op desbetreffend(e) domein(en). De uitkomsten van deze metingen kunnen, mits interdisciplinair geïmplementeerd, worden gebruikt voor een duidelijke en transparante communicatie tussen de teamleden, maar ook ter signalering van nog niet ontdekte problemen die niet primair binnen het domein van de fysiotherapeut vallen.
Tot slot is er
- de ‘Cumulative Illness Rating Scale’ (CIRS) die de mate en ernst van multimorbiditeiten classificeert.
In de richtlijn zijn 23 optionele meetinstrumenten opgenomen die gebruikt kunnen worden wanneer daarvoor aanleiding is. Deze meetinstrumenten worden geselecteerd op basis van de hulpvraag van de patiënt met de daaraan gerelateerde behandeldoelen en/of naar eigen inzicht van de fysiotherapeut. De optionele meetinstrumenten staan in de volgende figuur. Een aantal optionele meetinstrumenten is een aanvulling op domeinen die reeds met de aanbevolen meetinstrumenten zijn geobjectiveerd. Het merendeel van deze opetionele meetinstrumenten beslaat echter andere, eveneens relevante, domeinen. Alle meetinstrumenten en de formulieren met de klinimetrische eigenschappen van de instrumenten ten aanzien van patiënten met een CVA zijn beschikbaar via www.meetinstrumentenzorg.nl.
Overzicht van de optionele meetinstrumenten.
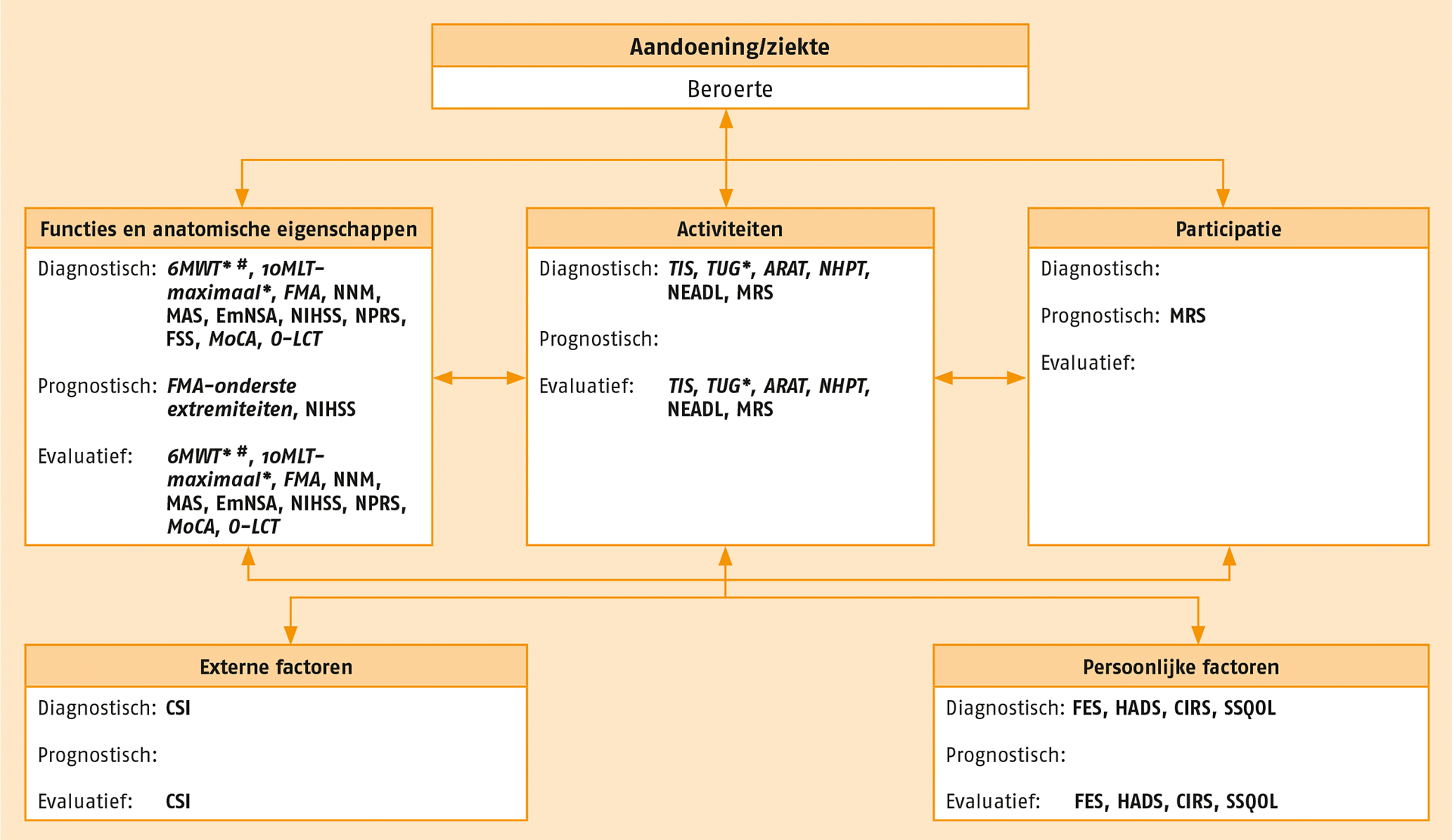
10MLT = Tien-meter looptest; 6MWT = Zes-minuten wandeltest; CIRS = Cumulative Illness Rating Scale; CSI = Caregiver Strain Index; EmNSA = Erasmus MC modificatie van het (revised) Nottingham Sensory Assessment; FES = Falls-Efficacy Scale; FMA = Fugl-Meyer Assessment; FSS = Fatigue Severity Scale; HADS = Hospital Anxiety and Depression Scale; MAS = Modified Ashworth Scale; MoCA = Montreal Cognitive Assessment; MRS = Modified Rankin Scale; NEADL = Nottingham Extended ADL-index; NHPT = Nine Hole Peg Test; NIHSS = National Institutes of Health Stroke Scale; NNM = Goniometer volgens de Neutrale-O-Methode; NPRS = Numeric Pain Rating Scale; O-LCT = O-Letter Cancellation Test; SSQOL = Stroke-Specific Quality of Life scale; TIS = Trunk Impairment Scale; TUG = Timed Up and Go test.
Cursief = performancetest/functietest; niet cursief = vragenlijst/observatielijst.
* Indien FAC ≥ 3. # Eventueel in combinatie met de Borg Rating of Perceived Exertion Scale (Borg RPE).
Bron: Swinkels RAHM, Meerhoff GA, Beekman E, Beurskens AJHM. Raamwerk Klinimetrie voor evidence based products. Amersfoort: KNGF; 2016.
Elk meetinstrument heeft haar eigen (beperkte) toepasbaarheid en zal, afhankelijk van de ernst van bepaalde symptomen, het moment na het CVA en waar de patiënt wordt verpleegd, kunnen worden gebruikt voor diagnostiek, screening en/of evaluatie. Tot de optionele meetinstrumenten behoren:
- het Fugl-Meyer Assessment,
- de Tien-meter looptest met maximale loopsnelheid,
- de Zes-minuten wandeltest, eventueel gecombineerd met de Borg Rating of Perceived Exertion,
- de Trunk Impairment Scale,
- de Timed Up and Go test,
- de Action Research Arm Test,
- de Nine Hole Peg Test,
- de Nottingham Extended ADL-index,
- de Stroke-Specific Quality of Life scale,
- de Neutrale-0-Methode (goniometer),
- de Modified Ashworth Scale,
- de Erasmus MC modificatie van het (revised) Nottingham Sensory Assessment,
- de National Institutes of Health Stroke Scale,
- de Numeric Pain Rating Scale,
- de Falls-Efficacy Scale en
- de Fatigue Severity Scale.
De richtlijn bevat ook vijf optionele meetinstrumenten die met name een signalerende functie hebben voor stoornissen in functies of contextuele factoren die niet direct (primair) tot het behandeldomein van de fysiotherapeut behoren, maar wel invloed kunnen hebben op de behandeling.
Het gaat hierbij om:
- de Hospital Anxiety and Depression Scale,
- het Montreal Cognitive Assessment,
- de O-Letter Cancellation Test en
- de Caregiver Strain Index.
Deze screeningsinstrumenten zijn met name zinvol als er verdenking bestaat op een stoornis of beperking binnen één van deze domeinen, terwijl er op dat moment bij de behandeling geen zorgverlener betrokken is met verdere expertise op desbetreffend(e) domein(en). De uitkomsten van deze metingen kunnen, mits interdisciplinair geïmplementeerd, worden gebruikt voor een duidelijke en transparante communicatie tussen de teamleden, maar ook ter signalering van nog niet ontdekte problemen die niet primair op het domein van de fysiotherapeut liggen.
Tot slot is er
- de Cumulative Illness Rating Scale die de mate en ernst van multimorbiditeiten classificeert.
C.2.3 Systematisch meten
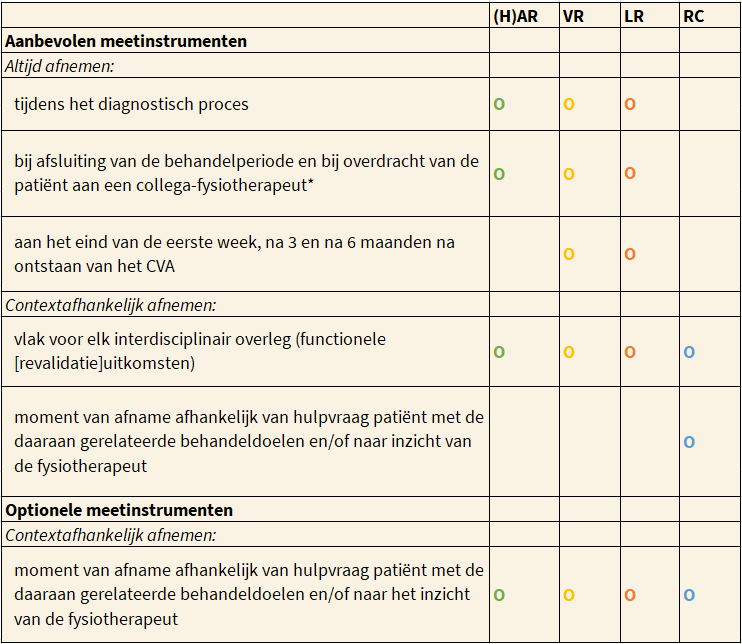
Systematisch meten’ wordt in de KNGF-richtlijnen beschouwd als een integraal onderdeel van evidence-based practice. Vaste meetmomenten, startend bij het eerste behandelcontact, maken het ziekte- en revalidatiebeloop inzichtelijk. In de volgende tabel staan de geadviseerde meetmomenten beschreven. Voor meetmomenten ten behoeve van het stellen van een functionele prognose wordt verwezen naar Prognosticeren van het functioneren.
Overzicht meetmomenten voor de aanbevolen en optionele meetinstrumenten.
(H)AR = (hyper)acute (revalidatie)fase; VR = vroege revalidatiefase; LR = late revalidatiefase; RC = revalidatie in de chronische fase.
O De fase waarin het aanbevolen/optionele meetinstrument wordt afgenomen. * Dit geldt ook wanneer de patiënt wordt overgedragen aan een collega-fysiotherapeut.
Naast het objectiveren van de status praesens van de patiënt bij het eerste behandelcontact, is het afnemen van meetinstrumenten binnen het klinisch redeneren ook van belang voor het adequaat inschatten en het bijsturen van de gestelde (functionele) doelen (‘goal setting’). Dit is slechts mogelijk bij regelmatig gebruik van betrouwbare en valide meetinstrumenten, die voldoende gevoelig zijn voor het objectiveren van verandering. Dit betekent dat de meetmomenten zich niet beperken tot het diagnostisch proces, maar zich uitstrekken tot in het therapeutisch proces.
In de eerste zes maanden na het CVA: (hyper)acute, vroege en late revalidatiefase
In de eerste zes maanden worden de aanbevolen meetinstrumenten afgenomen tijdens:
- het diagnostisch proces,
- aan het eind van de eerste week,
- na drie maanden en
- na zes maanden.
Ook dienen zij te worden afgenomen bij het
- beëindiging van de behandelperiode (hieronder valt ook het overdragen van de patiënt aan een collega).
Geadviseerd wordt om deze aanbevolen meetinstrumenten tevens te gebruiken vlak voor elk interdisciplinair overleg, op momenten die samenhangen met de hulpvraag van de patiënt met de daaraan gerelateerde behandeldoelen en/of naar het inzicht van de fysiotherapeut. Welke optionele meetinstrumenten relevant zijn, wordt vastgesteld op basis van de hulpvraag van de patiënt en de daaraan gerelateerde behandeldoelen en/of naar het inzicht van de fysiotherapeut.
Zes maanden na het CVA: revalidatie in de chronische fase
Wanneer en hoe vaak metingen in de chronische fase dienen plaats te vinden, wordt sterk bepaald door de veranderingen die tijdens de behandeling worden verwacht of geobserveerd. Zowel de aanbevolen als de optionele meetinstrumenten kunnen worden afgenomen bij aanvang van het fysiotherapeutisch proces en vervolgens op momenten die gerelateerd zijn aan de gestelde behandeldoelen. Het uitgangspunt is dat functionele veranderingen (voor- of achteruitgang) in de chronische fase reden kunnen zijn om de behandeling te continueren, aan te passen, te hervatten of te staken. Voor het monitoren van het functioneren in de chronische fase wordt verwezen naar hoofdstuk D.
De werkgroep formuleerde de volgende aanbeveling:
(15) Systematisch meten (monitoren)
Er zijn aanwijzingen dat het systematisch meten (monitoren) met behulp van betrouwbare en valide meetinstrumenten leidt tot verbetering van het klinisch redeneerproces en de continuïteit van zorg voor patiënten met een CVA.
Context en interpretatie
Elke patiënt met een CVA dient voorafgaand aan het therapeutisch proces systematisch in kaart te worden gebracht in termen van functies, activiteiten en participatie, bij voorkeur met gebruikmaking van betrouwbare, valide en responsieve meetinstrumenten.
Het afnemen van deze meetinstrumenten wordt op vaste momenten herhaald tijdens het therapeutisch proces, om zo het klinisch beloop te objectiveren.
Systematisch meten wordt in de richtlijnen gezien als een integraal onderdeel van evidence-based practice. Door het gestandaardiseerd meten op vaste meetmomenten wordt het ziekte- en revalidatiebeloop inzichtelijk gemaakt. In de volgende tabel staan de geadviseerde meetmomenten beschreven. Voor meetmomenten ten behoeve van het stellen van een functionele prognose wordt verwezen naar .
Overzicht meetmomenten voor voor het stellen van een functionele prognose

Naast het objectiveren van de status praesens van de patiënt bij het eerste behandelcontact, is het afnemen van meetinstrumenten binnen het klinisch redeneren ook van belang voor het adequaat inschatten en het bijsturen van de gestelde (functionele) doelen (‘goal setting’). Dit is slechts mogelijk bij regelmatig gebruik van betrouwbare en valide meetinstrumenten, die voldoende gevoelig zijn voor het objectiveren van verandering. Dit betekent dat de meetmomenten zich niet alleen beperken tot het diagnostisch proces, maar ook doorlopen in het therapeutisch proces.
In de eerste zes maanden na het CVA: de (hyper)acute, vroege en late revalidatiefase
In de eerste zes maanden worden de aanbevolen meetinstrumenten afgenomen tijdens:
- het diagnostisch proces,
- aan het eind van de eerste week,
- na drie maanden en
- na zes maanden. Ook dienen zij te worden afgenomen bij
- beëindiging van de behandelperiode (hieronder valt ook het overdragen van de patiënt aan een collega).
Geadviseerd wordt om deze aanbevolen meetinstrumenten tevens te gebruiken vlak voor elk interdisciplinair overleg, op momenten die samenhangen met de hulpvraag van de patiënt met de daaraan gerelateerde behandeldoelen en/of naar inzicht van de fysiotherapeut.
De meetmomenten van de optionele meetinstrumenten worden bepaald naar inzicht van de fysiotherapeut en zullen vaak gerelateerd zijn aan de termijn die gesteld is om bepaalde behandeldoelen te behalen.
Welke aanbevolen meetinstrumenten relevant zijn wordt vastgesteld op basis van de hulpvraag van de patiënt en de daaraan gerelateerde behandeldoelen en/of naar het inzicht van de fysiotherapeut.
Zes maanden na het CVA: revalidatie in de chronische fase
Wanneer en hoe vaak metingen in de chronische fase dienen plaats te vinden, wordt sterk bepaald door de veranderingen die tijdens de behandeling worden verwacht of geobserveerd. Zowel de basismeetinstrumenten als de aanbevolen meetinstrumenten kunnen worden afgenomen bij aanvang van het fysiotherapeutisch proces en vervolgens op momenten die gerelateerd zijn aan de gestelde behandeldoelen. Het uitgangspunt is dat functionele veranderingen (voor- of achteruitgang) in de chronische fase reden kunnen zijn om de behandeling te continueren, aan te passen, te hervatten of te staken. Voor het monitoren van functioneren in de chronische fase wordt verwezen naar hoofdstuk D en tabel 2 en 3 van de Praktijkrichtlijn.
Op basis van bovenstaande formuleerde de werkgroep de volgende aanbeveling:
(15) Systematisch meten (monitoren)
Er zijn aanwijzingen dat het systematisch meten (monitoren) met behulp van betrouwbare en valide meetinstrumenten leidt tot verbetering van het klinisch redeneerproces en de continuïteit van zorg voor patiënten met een CVA. (niveau 3)
Context en interpretatie
Elke patiënt met een CVA dient voorafgaand aan het therapeutisch proces systematisch in kaart te worden gebracht in termen van functies, activiteiten en participatie, bij voorkeur met gebruikmaking van betrouwbare, valide en responsieve meetinstrumenten.
Het afnemen van deze meetinstrumenten wordt op vaste momenten herhaald tijdens het therapeutisch proces, om zo het klinisch beloop te objectiveren.
D Prognosticeren van het functioneren
In deze richtlijn heeft prognostiek betrekking op het voorspellen van het toekomstig functioneren van patiënten met een CVA. Deze voorspellingen zijn gebaseerd op een combinatie van, bij voorkeur klinische factoren (ook wel voorspellers of determinanten genoemd) en kunnen worden gebruikt om onder andere patiënten en hun naasten te informeren, maar ook ter ondersteuning van klinische besluitvorming. Daarnaast kan kennis van determinanten worden gebruikt bij het selecteren van patiënten voor zorginnovatieprojecten en wetenschappelijk onderzoek.
Het functioneel herstel na een CVA verloopt in een kromme, waarbij 80% van het herstel reeds in de eerste drie maanden plaatsvindt. In het kader van prognostiek zijn grofweg twee fasen in het beloop te onderscheiden: de eerste fase beslaat de eerste zes maanden na het CVA en de tweede fase is de periode die daarop volgt.
De eerste zes maanden worden over het algemeen gekenmerkt door functioneel herstel, waarbij initiële stoornissen in functies en beperkingen in activiteiten verminderen of zelfs volledig verdwijnen. In deze fase is met name het potentieel van het herstel belangrijk. Hierbij moet worden opgemerkt dat niet elke patiënt in gelijke mate herstelt op alle uitkomstmaten (loopvaardigheid, arm-handvaardigheid en de uitvoering van de basale ADL-vaardigheden). In de chronische fase (na zes maanden) blijft bij een grote groep patiënten het functioneren stabiel. Er zijn echter ook patiënten bij wie in deze periode verdere verbetering of juist verslechtering optreedt. De nadruk ligt in de chronische fase dan ook op het identificeren van patiënten die een grote kans hebben op verder functioneel herstel, en het signaleren van de patiënten die ‘at risk’ zijn voor verslechtering. Het grootste herstel vindt plaats in de eerste paar weken/maanden na het CVA. Daarom zullen de voorspellers van de functionele prognose van loopvaardigheid, arm-handvaardigheid en basale ADL-vaardigheden van het dagelijks leven als de eerste zes maanden na het CVA zijn verstreken, afwijken van die in de eerste periode na het CVA.
In de volgende tabel staan de momenten waarop een functionele prognose kan worden geformuleerd met behulp van betrouwbare en valide meetinstrumenten.
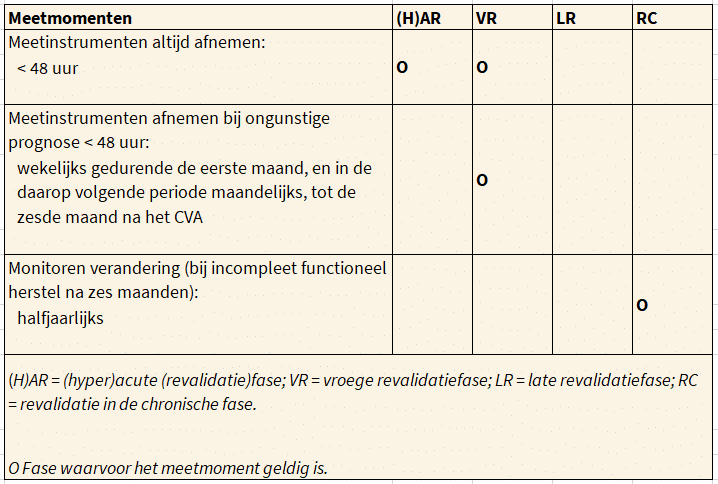
Overzicht meetmomenten voor het stellen van een functionele prognose.
Een eerste functionele prognose voor loopvaardigheid en arm-handvaardigheid dient zo snel mogelijk, maar bij voorkeur op dag twee na het CVA te worden geformuleerd aan de hand van determinanten. Basale ADL-vaardigheden dienen op dag vijf te worden geprognosticeerd. Wanneer deze initiële prognose ongunstig is, dienen de determinanten wekelijks opnieuw te worden geobjectiveerd gedurende de eerste maand en in de daarop volgende periode maandelijks, tot de zesde maand na het CVA, zolang de prognose ongunstig blijft.
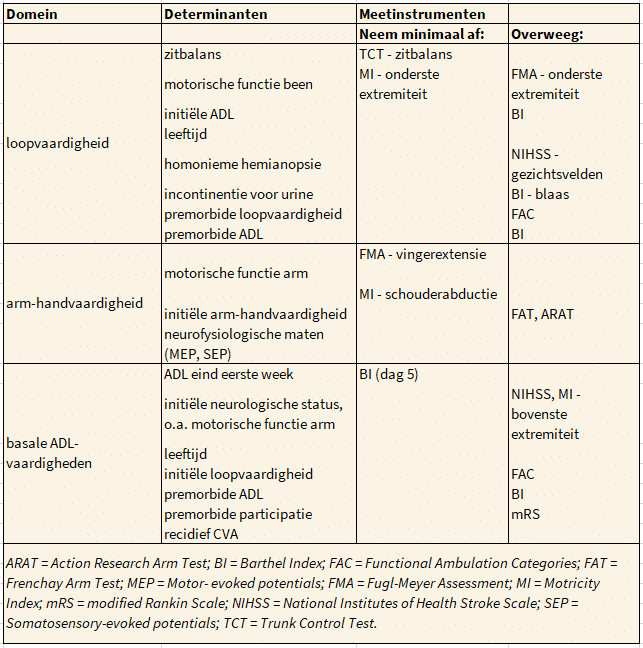
Determinanten voor functionele veranderingen na zes maanden zijn slechts op zeer kleine schaal onderzocht. Voor loopvaardigheid en basale ADL-vaardigheden komen de voorspellers vrijwel overeen. Er zijn aanwijzingen dat een hogere leeftijd, hogere corticale functiestoornissen, depressie, vermoeidheid en/of fysieke inactiviteit functionele achteruitgang van loopvaardigheid en basale ADL-vaardigheden voorspellen. Verslechtering van arm-handvaardigheid is veelal zichtbaar bij patiënten met een incompleet herstel van arm-handvaardigheid, somatosensorische functiestoornissen en/of neglect. Het is niet duidelijk op grond waarvan verdere verbetering in de chronische fase kan worden geprognosticeerd. De determinanten en bijbehorende meetinstrumenten die voorspellend zijn voor het functioneren zes maanden na het CVA zijn weergegeven in de volgende tabel.
Determinanten en meetinstrumenten ter ondersteuning van het bepalen van de prognose voor het functioneren 6 maanden na het CVA.
In deze richtlijn heeft prognostiek betrekking op het voorspellen van het toekomstig functioneren van patiënten met een CVA. Deze voorspellingen zijn gebaseerd op een combinatie van demografische, klinische, neuroradiologische en neurofysiologische factoren320 (ook wel voorspellers of determinanten genoemd) die eerder in de tijd zijn gemeten dan het moment waarop de functionele uitkomst is vastgelegd.321 Kennis van prognostische factoren kan als hulpmiddel worden gebruikt om onder andere patiënten te informeren, maar ook ter ondersteuning bij het nemen van klinische beslissingen.321 Daarnaast kan deze kennis worden gebruikt bij het selecteren van patiënten voor zorginnovatieprojecten en wetenschappelijk onderzoek.321
D.1 Prognostische determinanten voor functioneel herstel in de eerste zes maanden
Gezien de steeds korter wordende opnameduur op ziekenhuis stroke units is het belangrijk om zo vroeg mogelijk een accurate voorspelling te kunnen geven van het functioneren van de patiënt, met als doel adequaat advies te geven over de triage. Daarnaast is het belangrijk om al in de eerste dagen na het CVA een adequate inschatting te maken van de functionele uitkomsten en daarover zowel de patiënt als de familie te informeren om zo nodig tijdig woningaanpassingen te kunnen realiseren.
Longitudinaal onderzoek laat zien dat 80% van het herstel van functionaliteit plaatsvindt in de eerste drie maanden na het ontstaan van het CVA. Gemiddeld genomen vinden bij slechts 10 tot 15% van de patiënten na zes maanden nog klinisch relevante verbeteringen plaats op activiteitenniveau.
Indien een patiënt in de eerste zes maanden na het CVA functioneel verslechtert buiten de 95%-grenzen van de meetfout zal moeten worden nagegaan welke oorzaken hier mogelijk aan ten grondslag liggen, denk aan de ontwikkeling van secundaire complicaties of comorbiditeiten.
Het functionele beloop na een CVA verloopt kromlijnig waarbij 80% van het herstel reeds in de eerste drie maanden wordt bereikt. Grofweg zijn er twee fasen te onderscheiden: de eerste zes maanden, en de tijd die daarop volgt. De eerste zes maanden worden over het algemeen gekenmerkt door functioneel herstel, waarbij initiële beperkingen in activiteiten verminderen of zelfs volledig verdwijnen. In de chronische fase (> zes maanden) is er een grote groep patiënten die stabiel blijft wat betreft het functioneren, terwijl de resterende patiënten verslechtering of verbetering vertoont. Vanwege dit kromlijnige beloop verschillen de determinanten voor het functioneren tussen de eerste zes maanden en de chronische fase.
In de eerste zes maanden is het vaststellen van het potentieel van het herstel belangrijk. Dit dient zo vroeg mogelijk na het ontstaan van het CVA te gebeuren, omdat een adequate inschatting van de functionele uitkomsten van een patiënt belangrijk is voor onder andere het plannen van de revalidatie (triage), maar ook voor het informeren van patiënt en familie en zo nodig het tijdig regelen van aanpassingen in huis.
Longitudinaal onderzoek laat zien dat verreweg het meeste herstel van functionaliteit plaatsvindt in de eerste drie maanden na het ontstaan van het CVA en dat het merendeel van de patiënten zes maanden na het CVA niet verder herstelt.322 Omdat het meeste herstel in de eerste paar weken/maanden plaatsvindt, zal de functionele prognose voor loopvaardigheid, arm-handvaardigheid en basale ADL-vaardigheden voor de periode vanaf zes maanden andere voorspellers kennen.
Indien een patiënt in de eerste zes maanden na het CVA functioneel verslechtert buiten de 95%-grenzen van de meetfout, zal moeten worden nagegaan welke oorzaken hier mogelijk aan ten grondslag liggen, zoals het ontwikkelen van secundaire complicaties of comorbiditeiten.
In de chronische fase zal de nadruk liggen op het identificeren van patiënten die een grote kans hebben op verder functioneel herstel en het aanwijzen van patiënten die ‘at risk’ zijn voor verslechtering. Het blijkt namelijk dat een aantal patiënten ook nog na zes maanden, buiten de aanwezige 95%-grenzen van de meetfout, verandert.323-325 Deze significante verandering in het functioneren legitimeert mede het geven van fysiotherapie wanneer patiënten zich in de chronische fase bevinden.
D.1.1 Loopvaardigheid: functioneel herstel in de eerste zes maanden
Ongeveer 70 tot 80% van de patiënten met een CVA kan na verloop van tijd weer zelfstandig lopen. Dit betekent dat de prognose voor terugkeer van loopvaardigheid in principe gunstig is. Verreweg het meeste herstel in loopvaardigheid vindt plaats binnen drie maanden na ontstaan van het CVA. Er zijn aanwijzingen dat het herstel van loopvaardigheid grotendeels kan worden voorspeld in de eerste één à twee weken na het ontstaan van het CVA. Voor patiënten die initieel niet zelfstandig kunnen lopen, kan een gunstig herstel van zelfstandige loopvaardigheid zelfs al accuraat worden voorspeld in de eerste paar dagen na het CVA op grond van de zitbalans (Trunk Control Test, item zitbalans = 25 punten) en slechts een milde parese van het been (Motricity Index ≥ 25 punten of een score op het motorische deel van het Fugl-Meyer Assessment – onderste extremiteit ≥ 19).
Voor patiënten die hier niet aan voldoen, zullen deze klinische determinanten opnieuw moeten worden vastgelegd in de loop van de tweede week, omdat bij deze groep patiënten blijkt dat een voorspelling in de eerste paar dagen na het CVA vaak een te pessimistisch beeld geeft. De kans om weer tot zelfstandig lopen te komen, wordt tevens bepaald door: initiële redelijk goede ADL-vaardigheden, jonge leeftijd, afwezigheid van homonieme hemianopsie, continentie voor urine en afwezigheid van premorbide beperkingen in loopvaardigheid en ADL.
Systematisch literatuuronderzoek laat zien dat de genoemde determinanten van loopvaardigheid in belangrijke mate overeenkomen met die van ADL-zelfstandigheid na een CVA.
De werkgroep formuleerde de volgende aanbevelingen:
(16, 17) Prognose loopvaardigheid zes maanden na het CVA
Het is aangetoond dat voor het inschatten van de prognose voor loopvaardigheid zes maanden na het CVA de zitbalans (gemeten met de Trunk Control Test item zitbalans) en de motorische functie van het been (gemeten met de Motricity Index) zo snel mogelijk, maar bij voorkeur op dag twee na het CVA dienen te worden vastgelegd.
De werkgroep is van mening dat patiënten die aanvankelijk een ongunstige prognose hebben voor loopvaardigheid, wekelijks gedurende de eerste vier weken en vervolgens maandelijks tot zes maanden na het CVA, dienen te worden gemonitord op eventuele terugkeer van genoemde determinanten, met behulp van betrouwbare en valide meetinstrumenten. Dit geldt zolang patiënten geen zelfstandige loopvaardigheid hebben.
Prognose en natuurlijk beloop
Epidemiologisch onderzoek toont aan dat ongeveer 70 tot 80% van de patiënten met een CVA na verloop van tijd weer zelfstandig kan lopen.322,326 Dit betekent dat de prognose voor terugkeer van loopvaardigheid bij CVA-patiënten in principe gunstig is. Verreweg het meeste herstel in loopvaardigheid vindt plaats in de eerste drie maanden na het ontstaan van het CVA.322 Binnen het herstel van loopvaardigheid is een aantal functionele mijlpalen te onderscheiden (‘mobility milestones’).327 Wanneer patiënten herstellen, blijkt het zitten het eerst terug te keren, vervolgens het opstaan en gaan zitten, daarna het veilig leren staan en tot slot het lopen. Deze functionele mijlpalen in het herstel zijn betrouwbaar vast te leggen.328Bovendien blijkt de snelheid waarmee patiënten genoemde ‘mobility milestones’ bereiken sterk te worden bepaald door het type CVA (geclassificeerd op basis van het Oxford Community Stroke Project), waarbij patiënten met een totale anterieure CVA (total anterior circulation syndrome [TACS]) er langer over doen dan patiënten met de andere types CVA (lacunar syndrome (LACS), partial anterior circulation syndrome (PACS), posterior circulation syndrome [POCS]). Kennis van deze natuurlijke sequentie in het beloop van loopvaardigheid heeft een belangrijke betekenis voor het definiëren van therapeutisch haalbare functionele doelen in de tijd en het inschatten van de functionele prognose op korte en lange termijn.327,328
Hoewel het herstel van loopvaardigheid een relatief gunstige prognose heeft, kan uiteindelijk slechts 30% van de patiënten die loopvaardig is een voor de desbetreffende leeftijd normale loopafstand en loopsnelheid bereiken. Dit betekent dat in de meeste gevallen de kwaliteit van het gangbeeld na een CVA afwijkend blijft.329 Het is hierbij van belang om bij het inschatten van de toekomstige loopvaardigheid het premorbide functioneren van de patiënt als uitgangspunt te nemen. Prospectief onderzoek laat zien dat herhaalde metingen in de tijd (monitoren) de accuratesse van voorspelling sterk doet verbeteren.261,326 In de eerste paar dagen na het CVA kan al een gunstig herstel van zelfstandige loopvaardigheid accuraat worden voorspeld wanneer er sprake is van een aanwezige zitbalans (gemeten met het item zitbalans van de Trunk Control Test 25 punten) en slechts een milde parese van het been (gemeten met de Motricity Index ≥ 25 punten of Fugl-Meyer Assessment ≥ 19 punten). Voor patiënten die hier niet aan voldoen, zullen deze determinanten opnieuw moeten worden vastgelegd in de loop van de tweede, derde en vierde week na het CVA, omdat bij deze groep patiënten een voorspelling in de eerste paar dagen na het CVA vaak een te pessimistisch beeld geeft.259,261 Dit betekent dat huidige op herstel van loopvaardigheid gerichte modellen goed kunnen voorspellen wie wel weer uiteindelijk aan het lopen komt, maar relatief slecht kunnen voorspellen wie na zes maanden niet loopvaardig is.
Ook initiële beperkingen in ADL-vaardigheden, hoge leeftijd, homonieme hemianopsie, incontinentie voor urine en premorbide problemen in loopvaardigheid en ADL-vaardigheden, dragen bij aan het verminderen van de kans om tot zelfstandig lopen te komen.43,259,261,326,330-336 De determinanten van loopvaardigheid komen in belangrijke mate overeen met die van ADL-zelfstandigheid na een CVA.43 Hiermee wordt de visie ondersteund dat loopvaardigheid sterk samenhangt met ADL-zelfstandigheid.43 Tegelijk moet worden opgemerkt dat de onderzoeksresultaten moeilijk met elkaar te vergelijken zijn door het verschil in tijdstip en duur van observatie, de methode van statistische analyse en de meetinstrumenten waarmee afhankelijke variabelen worden beoordeeld.
Context en interpretatie
Prognostisch onderzoek naar herstel van loopvaardigheid bij patiënten met een CVA is complex. De vertaling van bovengenoemde determinanten naar de individuele prognose van een patiënt met een CVA is lastig, en ook hebben de meeste studies de gebruikte modellen niet gevalideerd bij een onafhankelijke groep patiënten. Dit laatste neemt niet weg dat het behandelteam bij het uitvoeren van triage of het opstellen van realistische, haalbare behandeldoelen eerst de individuele prognose dient te bepalen. Valide gemeten determinanten zijn hierbij onontbeerlijk. Alleen op deze wijze kan vervolgens tot een adequate (dat wil zeggen therapeutisch haalbare) behandelstrategie worden gekomen.
Op basis van het tot nu toe bekende longitudinale onderzoek kan worden gesteld dat verreweg het meeste herstel van functionaliteit plaatsvindt in de eerste drie maanden na het CVA en dat dit al gedetermineerd is binnen de eerste maand, met name in de eerste twee weken. Voor loopvaardigheid zijn vooral de zitbalans en de motorische functie van het paretische been belangrijke voorspellers. Bij de patiënt die initieel niet zelfstandig loopt, bij wie de op dag twee na het CVA gemaakte prognose ongunstig is, wordt geadviseerd om metingen van onder andere de zitbalans en de motorische functie van paretische been wekelijks te herhalen gedurende de eerste vier weken en vervolgens maandelijks tot zes maanden na het CVA, zolang de patiënt niet zelfstandig kan lopen.
Op basis van bovenstaande formuleerde de werkgroep de volgende aanbevelingen:
(16, 17) Prognose loopvaardigheid zes maanden na het CVA
Het is aangetoond dat voor het inschatten van de prognose voor loopvaardigheid zes maanden na het CVA de zitbalans (gemeten met de Trunk Control Test item zitbalans) en de motorische functie van het been (gemeten met de Motricity Index) zo snel mogelijk, maar bij voorkeur op dag twee na het CVA dienen te worden vastgelegd. (niveau 1)
De werkgroep is van mening dat patiënten die aanvankelijk een ongunstige prognose hebben voor loopvaardigheid, wekelijks gedurende de eerste vier weken en vervolgens maandelijks tot zes maanden na het CVA, dienen te worden gemonitord op eventuele terugkeer van genoemde determinanten, met behulp van betrouwbare en valide meetinstrumenten. Dit geldt zolang de patiënten geen zelfstandige loopvaardigheid hebben. (niveau 4)
Meetinstrumenten
De volgende meetinstrumenten worden geadviseerd ter ondersteuning van het bepalen van prognose voor herstel van loopvaardigheid zes maanden na het CVA.
Neem minimaal af
- Trunk Control Test (TCT) – item zitbalans (25 punten)
- Motricity Index (MI) – onderste extremiteit (≥ 25 punten)
Overweeg
- Fugl-Meyer Assessment (FMA) – onderste extremiteit (≥ 19 punten)
- Barthel Index (BI) (premorbide en eind eerste week)
- Barthel Index (BI) – item blaas
- National Institutes of Health Stroke Scale (NIHSS) – item gezichtsvelden
- Functional Ambulation Categories (FAC) (premorbide)
Wetenschappelijke verantwoording
Er is een zestal systematische reviews gepubliceerd over determinanten voor herstel van loopvaardigheid.43,44,334,337-339 Zie voor een toelichting op het beoordelen van de methodologische kwaliteit van prognostische studies paragraaf A.9 ‘Methodologieontwikkeling’.
D.1.2 Arm-handvaardigheid: functioneel herstel in de eerste zes maanden
Bij circa 40% van de patiënten met een CVA die initieel een parese van de arm hebben, is zes maanden na het CVA enig herstel van de arm-handvaardigheid opgetreden, en van deze groep is 11 tot 34% na die zes maanden volledig hersteld. Het herstel van de paretische arm volgt een min of meer vast patroon. Herstel van motorische controle blijkt bij de meeste patiënten met een hemisferische CVA in het voorste stroomgebied in een proximaal-distale richting te ontwikkelen. Er zijn echter uitzonderingen, zoals bij patiënten met een CVA in de thalamus of in de a. cerebri anterior en bij een lacunaire CVA. Het vroegtijdig inzetten van de romp tijdens het grijpen en pakken van voorwerpen, alsmede een proximale sturing vanuit de schouder, zijn kenmerkend binnen dit natuurlijke herstel. Patiënten maken gebruik van bewegingssynergieën die hen in staat stellen functionele handelingen uit te voeren. Dit betekent dat ontwikkeling van bewegingssynergieën als een gunstig adaptief proces gezien moet worden; zij dienen niet a priori als pathologisch beschouwd te worden. Het steeds minder afhankelijk worden van bewegingssynergieën en de mogelijkheden om geïsoleerd/gedissocieerd te bewegen, zijn een reflectie van het spontaan neurologisch herstel.
Bij de paretische hand blijkt, indien herstel plaatsvindt, eerst de (massale) grijpfunctie terug te keren, gevolgd door de extensiegreep en grove pincetgreep. Pas in laatste instantie vindt herstel plaats van de fijne pincetgreep. Verreweg het meeste herstel van functionaliteit blijkt in de eerste paar maanden na het ontstaan van het CVA plaats te vinden. Arm-handvaardigheid verbetert doorgaans minder uitgesproken dan loopvaardigheid. Bovendien verloopt de snelheid van herstel van de arm trager dan die van het been. Dat neemt echter niet weg dat er aanwijzingen zijn dat de uitkomst van arm- en handvaardigheid van de paretische arm op de lange termijn grotendeels reeds is gedetermineerd in de eerste twee weken na het ontstaan van het CVA.
Herstel van functionaliteit blijkt in hoge mate gerelateerd te zijn aan:
- de ernst van de parese van met name de extensoren van de vingers (gemeten met het Fugl-Meyer Assessment ≥ één punt) en abductoren van de schouder (gemeten met de Motricity Index ≥ negen punten), ook wel het ‘SAFE’-model genoemd (Shoulder Abduction – Finger Extension);
- initiële arm-handvaardigheid;
- neurofysiologische maten als ‘motor-evoked potentials’ (MEP) en ‘somatosensory-evoked potentials’ (SEP).
Het blijkt dat meer dan 90% van de patiënten bij wie na een kritische periode van twee weken nog geen willekeurige grijpfunctie, dan wel extensiefunctie van de pols en vingers bestaat, ook zes maanden en één jaar na het CVA geen herstel van arm-handvaardigheid vertoont. Een ongunstige prognose kan echter minder accuraat worden geformuleerd dan een gunstige prognose.
De werkgroep formuleerde de volgende aanbevelingen:
(18, 19) Prognose arm-handvaardigheid zes maanden na het CVA
Het is aangetoond dat voor het inschatten van de prognose voor arm-handvaardigheid zes maanden na het CVA extensie van de vingers (gemeten met het Fugl-Meyer Assessment) en abductie van de schouder (gemeten met de Motricity Index) zo snel mogelijk, maar bij voorkeur op dag twee na het CVA dienen te worden vastgelegd.
De werkgroep is van mening dat patiënten die aanvankelijk een ongunstige prognose hebben voor armhandvaardigheid, wekelijks gedurende de eerste vier weken en vervolgens maandelijks tot zes maanden na het CVA, dienen te worden gemonitord op eventuele terugkeer van genoemde determinanten met behulp van betrouwbare en valide meetinstrumenten. Dit geldt zolang patiënten geen arm-handvaardigheid hebben.
Prognose en natuurlijk beloop
Longitudinaal onderzoek laat zien dat het herstel van de paretische bovenste extremiteit volgens min of meer vaste patronen verloopt.332,339,340 Het herstel van motorische controle lijkt hierbij in een proximaal-distale ontwikkeling te verlopen. Vroegtijdig inzetten van de romp tijdens het grijpen en pakken van voorwerpen, alsmede een proximale sturing vanuit de schouder zijn kenmerkend binnen dit natuurlijke herstel (d.w.z. gebruikmakend van bewegingssynergieën).332 Bij de paretische hand blijkt, indien herstel plaatsvindt, eerst de (massale) grijpfunctie terug te keren, gevolgd door de extensiegreep en grove pincetgreep. Als laatste vindt herstel plaats van de fijne pincetgreep.332,339
Epidemiologische onderzoeken naar prognose van herstel van functionaliteit van de bovenste extremiteit ontbreken. Verschillende longitudinale onderzoeken bij patiënten met een CVA schatten dat gemiddeld 5 tot ruim 30% van de patiënten weer een normale functionaliteit van de paretische arm terugkrijgt.81,341-346 Bij circa 25 tot 45% van de patiënten is het herstel van arm-handvaardigheid incompleet81,343,346-348 en bij ongeveer 30346,349 tot 65%342,350 van de patiënten heeft zes maanden na het CVA in het geheel geen functioneel herstel van de arm en hand plaatsgevonden.81,341,345
Uit deze bevindingen blijkt dat de prognose voor herstel van functionaliteit van de paretische arm over het algemeen ongunstig is en dat deze voornamelijk door herstel van de hand wordt bepaald. Voor een belangrijk deel is de ongunstige prognose van de bovenste extremiteit te verklaren vanuit het gegeven dat de meeste CVA’s in het stroomgebied van de a. cerebri media gelokaliseerd zijn, waar de arm en hand het sterkst zijn vertegenwoordigd. Met name initiële stoornissen in de motorische functie en initiële beperkingen in arm-handvaardigheid zijn, samen met neurofysiologische factoren (als ‘motor-evoked potentials’ en ‘somatosensory-evoked potentials’), voorspellend voor het al dan niet herwinnen van een functionele arm en hand.351-353 Leeftijd, geslacht en lateralisatie spelen hierbij geen rol.352 Prospectief cohortonderzoek laat zien dat het vroegtijdig aanwezig zijn van vingerextensie346,354,355 en elevatie en abductie van de schouder346,356 een belangrijke rol spelen bij het voorspellen van de aanwezigheid van arm-handvaardigheid zes maanden na het CVA. Eén studie laat zelfs zien dat wanneer patiënten binnen drie dagen na het CVA:
- enige willekeurige vingerextensie van de paretische hand en
- minimaal een zichtbare of voelbare contractie van de paretische schouderabductoren hebben, zij 98% kans hebben op enige arm-handvaardigheid zes maanden na het CVA.346 Van deze groep herstelt 34% zelfs volledig.346
Het blijkt echter moeilijker te zijn het herstel accuraat te voorspellen bij patiënten die bij aanvang niet aan beide criteria voldoen. Van degenen die binnen drie dagen niet in staat zijn een of meerdere vingers willekeurig te extenderen en de schouder te abduceren, herwint toch nog 25% enige arm-handvaardigheid. Herhaaldelijk meten van deze twee determinanten (het ‘SAFE’-model: Shoulder Abduction – Finger Extension) in de loop van de tijd leidt echter tot een steeds accurater voorspelling. Wanneer vingerextensie en schouderabductie ook negen dagen na het CVA nog ontbreken, is de kans op enige arm-handvaardigheid slechts 14%. Ander prospectief cohortonderzoek toont aan dat patiënten die in eerste instantie een flaccide arm (= paralyse van de arm) hebben en binnen vier weken geen enkele willekeurige activiteit van de hand (= twee punten Fugl-Meyer Assessment (FMA) handscore) en arm terugkrijgen (= 19 punten FMA – bovenste-extremiteitscore) de kans op herstel van arm-handvaardigheid tot minder dan 10% nivelleert.332
Dat het uitblijven van functieherstel langer dan drie à vier weken na het ontstaan van het CVA als ongunstig wordt gezien voor herstel van arm-handvaardigheid wordt ook door vele andere prospectieve onderzoeken gesteund.342,343,347,357-359 Hieruit blijkt dat vooral het tijdsinterval tussen het ontstaan van het CVA en het moment van het eerste functieherstel,344 alsmede de hoeveelheid verandering die in de eerste maand is gevonden,332 bepalend zijn voor het uiteindelijk te verwachten herstel na zes maanden.346,347,357,358,360,361
Men moet zich realiseren dat de Barthel Index niet geschikt is om het eventuele herstel van de paretische arm op activiteitenniveau te objectiveren.82,86 Patiënten zijn in staat om, ondanks het uitblijven van herstel van arm-handvaardigheid, de persoonlijke verzorging zoals wassen en aankleden geheel te compenseren met de gezonde extremiteit.
Context en interpretatie
Prognostisch onderzoek naar herstel van arm-handvaardigheid bij patiënten met een CVA is complex. De vertaling van bovengenoemde determinanten naar de individuele prognose van een patiënt met een CVA is lastig, terwijl de meeste studies de gebruikte modellen niet hebben gevalideerd bij een onafhankelijke groep patiënten. Dit laatste neemt niet weg dat het behandelteam bij het uitvoeren van triage of het opstellen van realistische, haalbare behandeldoelen eerst de individuele prognose dient te bepalen. Valide gemeten determinanten zijn hierbij onontbeerlijk. Alleen op deze wijze kan vervolgens tot een adequate (dat wil zeggen therapeutisch haalbare) behandelstrategie worden gekomen.
Aan de hand van het tot nu toe bekende longitudinale onderzoek kan gesteld worden dat verreweg het meeste herstel van functionaliteit in de eerste paar maanden na het CVA plaatsvindt. Arm-handvaardigheid blijkt echter minder sterk te verbeteren dan loopvaardigheid. Bovendien verloopt het herstelproces van de arm over het algemeen trager dan dat van het been. Dit laatste neemt niet weg dat accuraat voorspellen van terugkeer van arm-handvaardigheid reeds in de eerste maand, en vooral in de eerste twee weken na een CVA mogelijk is. Met name het vroegtijdig aanwezig zijn van motorische functies als willekeurige vingerextensie en schouderabductie zijn tekenen van een gunstig beloop voor herstel van arm-handvaardigheid. Bij patiënten bij wie de binnen 48 uur na het CVA gemaakte prognose ongunstig is, wordt geadviseerd het meten van deze twee voorspellers wekelijks te herhalen gedurende de eerste vier weken en vervolgens maandelijks tot zes maanden na het CVA zolang de patiënt niet over enige arm-handvaardigheid beschikt.
Op basis van bovenstaande formuleerde de werkgroep de volgende aanbevelingen:
(18, 19) Prognose arm-handvaardigheid zes maanden na het CVA
Het is aangetoond dat voor het inschatten van de prognose voor arm-handvaardigheid zes maanden na het CVA extensie van de vingers (gemeten met het Fugl-Meyer Assessment) en abductie van de schouder (gemeten met de Motricity Index) zo snel mogelijk, maar bij voorkeur op dag twee na het CVA dienen te worden vastgelegd. (niveau 1)
De werkgroep is van mening dat patiënten die aanvankelijk een ongunstige prognose hebben voor armhandvaardigheid, wekelijks gedurende de eerste vier weken en vervolgens maandelijks tot zes maanden na het CVA, dienen te worden gemonitord op eventuele terugkeer van genoemde determinanten met behulp van betrouwbare en valide meetinstrumenten. Dit geldt zolang patiënten geen arm-handvaardigheid hebben. (niveau 4)
Meetinstrumenten
De volgende meetinstrumenten worden geadviseerd ter ondersteuning van het bepalen van de prognose voor herstel van arm-handvaardigheid zes maanden na het CVA.
Neem minimaal af
- Fugl-Meyer Assessment (FMA) – item vingerextensie (≥ één punt)
- Motricity Index (MI) – item schouderabductie (≥ negen punten)
Overweeg
- Frenchay Arm Test (FAT)
- Action Research Arm Test (ARAT).
Wetenschappelijke verantwoording
In tegenstelling tot ADL- en loopvaardigheid zijn slechts twee systematische reviews gepubliceerd met betrekking tot determinanten van arm-handvaardigheid.351,352 Zie ‘Methodologieontwikkeling’ voor een toelichting op het beoordelen van de methodologische kwaliteit van prognostische studies.
D.1.3 Basale ADL-vaardigheden: functioneel herstel in de eerste zes maanden
Afhankelijk van de gebruikte definitie van zelfstandigheid bij activiteiten van het dagelijks leven heeft naar schatting 25 tot 74% van de patiënten met een CVA op de lange termijn al dan niet in grote mate ondersteuning nodig bij het uitvoeren van ADL-vaardigheden. Na analyse van prognostische onderzoeken kan een trend worden geconstateerd die het functionele herstel van ADL-zelfstandigheid na een CVA voorspelt. Verreweg de belangrijkste voorspellende factor is:
- de mate van zelfstandigheid bij de activiteiten van het dagelijks leven aan het eind van de eerste week (gemeten met bijvoorbeeld de Barthel Index op dag 5).
Andere belangrijke vroegtijdig gemeten onafhankelijke determinanten zijn:
- initiële neurologische status (gemeten met de National Institutes of Health Stroke Scale; NIHSS), waaronder de parese van de arm;
- leeftijd;
- initiële loopvaardigheid;
- premorbide zelfstandigheid in activiteiten;
- een CVA-recidief.
Zowel het geslacht van de patiënt als de aanwezigheid van risicofactoren, zoals atriumfibrilleren, blijken niet voorspellend te zijn. Dit geldt ook voor het type CVA (ischemisch dan wel hemorragisch), de topografische subtypes (de Oxford Community Stroke Project Classification: lacunar syndrome [LACS], partial anterior circulation syndrome [PACS], total anterior circulation syndrome [TACS], posterior circulation syndrome [POCS]) radiologische variabelen, bewustzijn, dysartrie en premorbide niveau van participatie. Het is onduidelijk of er een (onafhankelijke) relatie bestaat tussen stoornissen zoals homonieme hemianopsie, visuospatiële (hemi)inattentie en dwangstand van de ogen (‘déviation conjuguée’) en het herstel.
De werkgroep formuleerde de volgende aanbevelingen:
(20, 21) Prognose basale ADL-vaardigheden zes maanden na het CVA
Het is aangetoond dat het meest optimale moment om een inschatting te maken van de mogelijkheid tot het uitvoeren van basale ADL-vaardigheden zes maanden na het CVA, de Barthel Index is, afgenomen aan het eind van de eerste week na het CVA, maar bij voorkeur op dag vijf. Met de Barthel Index wordt vastgelegd wat de patiënt op het moment van meting doet, niet wat de patiënt zou kunnen.
De werkgroep is van mening dat patiënten die aanvankelijk een ongunstige prognose hebben voor het uitvoeren van basale ADL-vaardigheden, de eerste maand wekelijks (vier keer) en daarna maandelijks tot zes maanden na het CVA, dienen te worden gemonitord op eventuele terugkeer van genoemde determinanten met behulp van betrouwbare en valide meetinstrumenten. Dit geldt zolang patiënten niet zelfstandig zijn in de basale ADL-vaardigheden.
Afhankelijk van de gebruikte definitie van ADL-zelfstandigheid, heeft naar schatting 25 tot 74% van de patiënten met een CVA al dan niet in grote mate ondersteuning nodig bij het uitvoeren van ADL-vaardigheden op lange termijn.24 Het functionele herstel na een CVA kent een min of meer vaste hiërarchische sequentie ten aanzien van het herstel van persoonlijke verzorging. Zo blijkt volgens de Katz-Index bij 80% van de onderzochte patiënten met een CVA het eten en drinken het eerst te herstellen, gevolgd door respectievelijk transfers, toiletgang, uitkleden en aankleden. Als laatste herstelt het in en uit bad stappen.360,363-365 Ook in het herstel gemeten met de Barthel Index is deze sequentie terug te vinden. Onderzoek naar de hiërarchische schaalconstructie van de items bij 102 CVA-patiënten laat zien dat de items ‘continentie voor feces’, ‘uiterlijke verzorging’ en ‘continentie voor urine’ het eerst terugkomen, gevolgd door ‘eten’, ‘transfers’, ‘toiletgebruik’, ‘mobiliteit’, ‘uitkleden’, ‘aankleden’ en ‘baden (of douchen)’. Veilig traplopen blijkt in de meeste gevallen het laatst terug te komen.81 Deze hiërarchie op basis van een Guttman-schalingsprocedure komt in grote lijnen overeen met die in een andere studie, die op basis van een Rasch-analyse van de Barthel Index bij 192 patiënten vond dat ‘continentie voor feces’, ‘uiterlijke verzorging’ en ‘continentie voor urine’ het eerst terugkwamen, gevolgd door ‘transfers’, ‘toilet’, ‘uitkleden en aankleden’, ‘mobiliteit’, ‘traplopen’ en ‘baden (of douchen)’.366 Kennis van deze min of meer vaste sequentie in herstel biedt de fysiotherapeut de mogelijkheid beter in te spelen op het te verwachten herstel. Hiermee kan een meer realistische inschatting worden gemaakt van de haalbaarheid van geformuleerde behandeldoelen op korte termijn.
Gezien het belang van prognostisch onderzoek voor een effectief en efficiënt revalidatiebeleid zijn sinds de vijftiger jaren meer dan honderd onderzoeken gepubliceerd.43-45,334,337,338,367-369 In elk onderzoek is getracht op basis van factoren het functionele herstel na een CVA te voorspellen. Een belangrijke uitkomst is ADL-zelfstandigheid, gemeten met bijvoorbeeld de Barthel Index.45 Momenteel noemt de literatuur meer dan 66 verschillende determinanten die geassocieerd zouden zijn met herstel van ADL.45 Deze zijn van demografische, radiologische, neurologische, neurofysiologische of functionele aard. De determinanten zijn afzonderlijk of in combinatie in staat een belangrijk deel van het uiteindelijk te verwachten herstel van ADL-vaardigheid bij patiënten met een CVA te voorspellen. De accuratesse van de geformuleerde predictiemodellen loopt uiteen van ongeveer 30329,370-373 tot 80%374-378 van de verklaarde variantie.
Een belangrijke voorspellende factor voor ADL-zelfstandigheid is de mate van ADL-zelfstandigheid gemeten met Barthel Index aan het eind van de eerste week of de modified Rankin Scale.379 Andere belangrijke vroegtijdig gemeten onafhankelijke determinanten zijn:
- initiële neurologische status (gemeten met de National Institutes of Health Stroke Scale,380 waaronder parese van de arm,
- leeftijd,
- initiële loopvaardigheid,
- premorbide zelfstandigheid in ADL-vaardigheden en
- een CVA in de voorgeschiedenis.
Zowel geslacht als de aanwezigheid van risicofactoren zoals atriumfibrilleren, blijken niet voorspellend te zijn. Dit geldt ook voor type CVA (ischemisch dan wel hemorragisch), de topografische subtypes (Oxford Community Stroke Project) lacunar syndrome (LACS), partial anterior circulation syndrome (PACS), total anterior circulation syndrome (TACS) en posterior circulation syndrome (POCS), diverse radiologische variabelen, bewustzijn, dysartrie en premorbide niveau van participatie. Van een groot aantal stoornissen zoals hemianopsie, visuospatiële (hemi)inattentie en dwangstand van de ogen (déviation conjuguée) is de (onafhankelijke) relatie met herstel nog onduidelijk.
Context en interpretatie
Prognostisch onderzoek naar herstel van ADL bij patiënten met een CVA is complex. De vertaling van bovengenoemde determinanten naar de individuele prognose van een patiënt met een CVA is lastig, terwijl de meeste studies de gebruikte modellen niet hebben gevalideerd bij een onafhankelijke groep patiënten. Dit laatste neemt niet weg dat het behandelteam bij het uitvoeren van triage of het opstellen van een realistische, haalbare behandeldoelen eerst de individuele prognose dient te bepalen. Valide gemeten determinanten zijn hierbij onontbeerlijk. Alleen op deze wijze kan vervolgens tot een adequate (dat wil zeggen therapeutisch haalbare) behandelstrategie worden gekomen.
Uit het tot nu toe bekende longitudinale onderzoek kan opgemaakt worden dat verreweg het meeste herstel van functionaliteit plaatsvindt in de eerste drie maanden na het CVA. De accuratesse van predictie van ADL-vaardigheid wordt in de eerste zes maanden sterk bepaald door het moment waaróp men tracht te voorspellen. Dit impliceert dat het prognosticeren op een later tijdstip door de meting in de tijd te herhalen de accuratesse van de voorspelling verbetert.379 Het vroegste moment waarop een accurate voorspelling kan worden gedaan is aan het eind van de eerste week na het CVA. Als vuistregel kan worden gesteld dat een goede, gemiddelde schatting kan worden gegeven van het uiteindelijk herstel na zes maanden door acht (van de maximaal te behalen 20) punten op te tellen bij de Barthel Index-score, gemeten aan het eind van de eerste week.260,379,381,382 Bij patiënten bij wie aan het eind van de eerste week na het CVA de prognose ongunstig is, wordt geadviseerd de meting wekelijks te herhalen gedurende de eerste vier weken en vervolgens maandelijks tot zes maanden na het CVA zolang de patiënt niet ADL-zelfstandig is.
Op basis van bovenstaande formuleerde de werkgroep de volgende aanbevelingen:
(20, 21) Prognose basale ADL-vaardigheden zes maanden na het CVA
Het is aangetoond dat het meest optimale moment om een inschatting te maken van de mogelijkheid tot het uitvoeren van basale ADL-vaardigheden zes maanden na het CVA, de Barthel Index is, afgenomen aan het eind van de eerste week na het CVA, maar bij voorkeur op dag vijf. Bij de Barthel Index wordt vastgelegd wat de patiënt op het moment van meting doet, niet wat de patiënt zou kunnen. (niveau 1)
De werkgroep is van mening dat patiënten die aanvankelijk een ongunstige prognose hebben voor het uitvoeren van basale ADL-vaardigheden, de eerste maand wekelijks (vier keer) en daarna maandelijks tot zes maanden na het CVA, dienen te worden gemonitord op eventuele terugkeer van genoemde determinanten met behulp van betrouwbare en valide meetinstrumenten. Dit geldt zolang patiënten niet zelfstandig zijn in de basale ADL-vaardigheden. (niveau 4)
Meetinstrumenten
De volgende meetinstrumenten worden geadviseerd ter ondersteuning van het bepalen van de prognose voor herstel van basale ADL-vaardigheden zes maanden na het CVA.
Neem minimaal af
- Barthel Index (BI) (premorbide en aan het eind van de eerste week)
Overweeg
- modified Rankin Scale (premorbide) (mRS)
- National Institutes of Health Stroke Scale (NIHSS)
- Motricity Index (MI) – bovenste extremiteit
- Functional Ambulation Categories (FAC)
Wetenschappelijke verantwoording
Een aantal systematische reviews is verricht naar determinanten voor herstel van loopvaardigheid en ADL.43-45,334,337,338 Prognostisch onderzoek naar herstel van functionaliteit bij patiënten met een CVA is complex en stelt, evenals effectonderzoek, specifieke methodologische eisen aan het onderzoeksdesign omdat er een (intern) valide relatie moet zijn tussen determinant en testcriterium. Geen van de onderzoeken blijkt volledig aan de belangrijkste methodologische eisen van een observatieonderzoek te voldoen vanwege:
- het gebrek aan betrouwbare en valide meetinstrumenten waarmee afhankelijke en onafhankelijke variabelen zijn gemeten,
- het ontbreken van een rationale voor de gehanteerde codeerschema’s en afkappunten,
- het ontbreken van een beschrijving van de belangrijkste patiëntkarakteristieken bij inclusie,
- het ontbreken van informatie over (para)medische behandeling,
- ongecontroleerde uitval van patiënten met een CVA tijdens de periode van observatie en de manier waarop hiermee statistisch is omgegaan,
- het ontbreken van een correcte (beschrijving van) de gehanteerde statistische methodiek en de uitkomsten en
- het gebrek aan klinische performance en validatie.45
In een meta-analyse bleken slechts zes van de 48 onderzochte studies een laag risico op vertekening te hebben.383-388
Zie ‘Methodologieontwikkeling’ voor een toelichting op de beoordeling van de methodologische kwaliteit van prognostische studies.
D.2 Prognostische determinanten voor verandering in de chronische fase
Op de lange termijn blijkt een groot percentage van de patiënten nog beperkingen te hebben bij het uitvoeren van activiteiten. Hoewel het merendeel van de patiënten in de periode die volgt op de eerste zes maanden na het CVA niet verder herstelt, blijkt, afhankelijk van de uitkomstmaat, 10 tot 40% van de patiënten ook daarna nog verder te verbeteren of juist geleidelijk aan te verslechteren buiten de 95%-grenzen van de meetfout. Significante verslechtering of zich voortzettende verbetering legitimeert het continueren of opnieuw starten van fysiotherapie in de chronische fase.
D.2.1 Loopvaardigheid: verandering in de chronische fase
In de chronische fase na het CVA verbetert de loopvaardigheid bij 20 tot 30% van de patiënten voorbij de 95%-grenzen van de meetfout, terwijl er bij 10 tot 20% van de patiënten sprake is van achteruitgang. In tegenstelling tot vroegtijdig gemeten determinanten voor herstel van loopvaardigheid in de eerste zes maanden na een CVA, zijn naar voorspellers voor verandering in loopvaardigheid in de chronische fase slechts enkele cohortstudies verricht. Patiënten zijn na een CVA altijd ‘at risk’ voor achteruitgang in loopvaardigheid, zowel na de eerste maanden actieve intramurale revalidatie, als wanneer zij zich al lange tijd in de chronische fase bevinden. Een hogere leeftijd, hoger gelegen corticale functiestoornissen, depressie, vermoeidheid en/of fysieke inactiviteit lijken functionele achteruitgang van loopvaardigheid te voorspellen. De cohortstudies waaruit deze resultaten afkomstig zijn, hebben echter een matige methodologische kwaliteit, waardoor de resultaten met voorzichtigheid moeten worden geïnterpreteerd.
Voorspellers van verbetering in de periode die volgt op de eerste zes maanden na het CVA zijn vooralsnog onbekend.
De werkgroep formuleerde de volgende aanbevelingen:
(22 t/m 24) Prognose functionele verandering loopvaardigheid in de periode die volgt op de eerste zes maanden na het CVA
De werkgroep is van mening dat, om een indicatie te krijgen van eventuele verandering in loopvaardigheid van patiënten in de chronische fase die zes maanden na het CVA een Functional Ambulation Categories (FAC) van drie of meer hebben, elke zes maanden de Tien-meter looptest met comfortabele loopsnelheid moet worden afgenomen. Er is sprake van een daadwerkelijke verandering wanneer de loopsnelheid met minimaal 0,16 m/s is veranderd ten opzichte van de snelheid die zes maanden na het CVA werd behaald.
De werkgroep is van mening dat patiënten in de chronische fase die ook in de periode die volgt op de eerste zes maanden na het CVA nog beperkt zijn in loopvaardigheid regelmatig (elk halfjaar) dienen te worden gemonitord op hun functioneren.
De werkgroep is van mening dat bij patiënten in de chronische fase significante verandering in het functioneren op activiteitenniveau het continueren of herstarten van fysiotherapie legitimeert.
Prognose en natuurlijk beloop
Na zes maanden verbetert de loopvaardigheid bij 20 tot 30% van de patiënten voorbij de meetfout. Het blijkt echter dat in deze fase de loopvaardigheid in zo’n tien323 tot 40%389 van de gevallen achteruitgaat.
In tegenstelling tot vroegtijdig gemeten determinanten voor herstel van loopvaardigheid in de eerste zes maanden na een CVA, zijn naar voorspellers van achteruitgang in loopvaardigheid op lange termijn slechts enkele studies verricht. Longitudinaal onderzoek laat zien dat patiënten zowel na de eerste maanden actieve intramurale revalidatie, als ook wanneer zij zich al geruime tijd in de chronische fase bevinden, ‘at risk’ zijn voor achteruitgang wat betreft loopvaardigheid.389 In één van de studies wordt aangegeven dat achteruitgang in loopvaardigheid in het eerste jaar kan worden voorspeld door de aanwezigheid van een globale afasie, neglect, hoge leeftijd (≥ 75 jaar) en de achteruitgang wanneer er geen paramedicus bij de behandeling is betrokken. Uit een andere studie blijkt dat aanwezigheid van cognitieve stoornissen, depressie, vermoeidheid en inactiviteit één jaar na het CVA voorspellend lijken te zijn voor achteruitgang in loopvaardigheid in de daaropvolgende twee jaar.390 Eén longitudinale cohortstudie rapporteerde dat het krijgen van oefentherapie na ontslag een voorspeller is van verbetering in loopvaardigheid en dat bij patiënten die geen zelfstandige loopvaardigheid hadden in de maanden na ontslag het lopen toch nog verder verbeterde.389
Context en interpretatie
Prognostisch onderzoek naar herstel van functionaliteit bij patiënten met een CVA is heterogeen en complex. In de periode die volgt op de eerste zes maanden na het CVA blijkt een aanzienlijk percentage van de patiënten verder te verbeteren of te verslechteren. Prognostisch onderzoek naar determinanten van functionele verandering in de chronische fase is schaars. De studies die loopvaardigheid hebben onderzocht, laten zien dat onder andere de aanwezigheid van cognitieve stoornissen, depressie en vermoeidheid voorspellend zijn voor achteruitgang in loopvaardigheid. Omdat deze studies een methodologisch matige kwaliteit hebben, moeten de resultaten met voorzichtigheid worden geïnterpreteerd. Omdat verandering in loopvaardigheid zich mede wegens gebrek aan goede studies moeilijk laat voorspellen, moet de loopvaardigheid van patiënten in de chronische fase regelmatig (elke halfjaar) worden geëvalueerd.
Op basis van bovenstaande formuleerde de werkgroep de volgende aanbevelingen:
(22 t/m 24) Prognose functionele verandering loopvaardigheid in de periode die volgt op de eerste zes maanden na het CVA
De werkgroep is van mening dat, om een indicatie te krijgen van eventuele verandering in loopvaardigheid van patiënten in de chronische fase die zes maanden na het CVA een Functional Ambulation Categories (FAC) van drie of meer hebben, elke zes maanden de Tien-meter looptest met comfortabele loopsnelheid moet worden afgenomen. Er is sprake van een daadwerkelijke verandering wanneer de loopsnelheid met minimaal 0,16 m/s is veranderd ten opzichte van de snelheid die zes maanden na het CVA werd behaald. (niveau 4)
De werkgroep is van mening dat patiënten in de chronische fase die ook in de periode die volgt op de eerste zes maanden na het CVA nog beperkt zijn in loopvaardigheid regelmatig (elk halfjaar) dienen te worden gemonitord op hun functioneren. (niveau 4)
De werkgroep is van mening dat bij patiënten in de chronische fase significante verandering in het functioneren op activiteitenniveau het continueren of herstarten van fysiotherapie legitimeert. (niveau 4)
Meetinstrumenten
De volgende meetinstrumenten worden geadviseerd ter ondersteuning van het bepalen van de prognose voor verandering van loopvaardigheid in de chronische fase.
Neem minimaal af
- Tien-meter looptest comfortabel (10MLT)
- Functional Ambulation Categories (FZC)
Overweeg
- Hospital Anxiety and Depression Scale (HADS)
- Montreal Cognitive Assessment (MCA)
- Fatigue Severity Scale (FSS)
- National Institutes of Health Stroke Scale (NIHSS) – item taal
- National Institutes of Health Stroke Scale – item extinctie en inattentie
- O-Letter Cancellation Test (O-LCT)
Wetenschappelijke verantwoording
Er zijn twee longitudinale cohortstudies bekend die determinanten van verandering in loopvaardigheid in de chronische fase onderzochten; beide van matige methodologische kwaliteit.389,390 Zie ‘Methodologieontwikkeling’ voor een toelichting op de beoordeling van de methodologische kwaliteit van prognostische studies.
D.2.2 Arm-handvaardigheid: verandering in de chronische fase
In de chronische fase is er sprake van een verbetering van de arm- handvaardigheid voorbij de 95%-grenzen van de meetfout bij circa 10 tot 15% van de patiënten. Patiënten die zes maanden na het CVA wel enige arm-handvaardigheid hebben, maar niet volledig zijn hersteld (d.w.z. een incompleet herstel hebben van de bovenste extremiteit), en patiënten die stoornissen hebben in gevoel (somatosensoriek) en herkenning (visuospatieel neglect) van de verlamde lichaamszijde, blijken ‘at risk’ te zijn voor ‘learned non-use’. Zij gebruiken de paretische arm en hand bij het uitvoeren van dagelijkse handelingen minder dan dat op basis van de motorische functie zou worden verwacht. Op langere termijn blijkt dan ook dat 10% van deze groep achteruitgaat in arm-handvaardigheid.
De werkgroep formuleerde de volgende aanbevelingen:
(25 t/m 27) Prognose functionele verandering arm-handvaardigheid in de periode die volgt op de eerste zes maanden na het CVA
De werkgroep is van mening dat om een indicatie te krijgen van eventuele verandering in arm-handvaardigheid in de chronische fase, bij patiënten met een score op de Frenchay Arm Test van één tot vier punten zes maanden na het CVA, somatosensorische functiestoornissen en/of hemineglect, de arm-handvaardigheid elke zes maanden dient te worden geëvalueerd (bij voorkeur met de Action Research Arm Test [ARAT]), omdat deze patiënten ‘at risk’ zijn voor ‘learned non-use’. Er is sprake van een daadwerkelijke verandering wanneer de ARAT-score met minimaal zes punten is veranderd ten opzichte van de ARAT-score die zes maanden na het CVA werd behaald.
De werkgroep is van mening dat patiënten in de chronische fase die zes maanden na het CVA nog beperkt zijn in arm-handvaardigheid geregeld (elk halfjaar) dienen te worden gemonitord op hun functioneren.
De werkgroep is van mening dat bij patiënten in de chronische fase significante verandering in het functioneren op activiteitenniveau het continueren of herstarten van fysiotherapie legitimeert.
Prognose en natuurlijk beloop
Van de patiënten met een CVA die initieel een parese van de arm hebben, heeft zo’n 40%333,347 enig herstel van de arm-handvaardigheid na zes maanden, van wie 11333 tot 34%347 op dat tijdstip volledig is hersteld. Desalniettemin meldt een klein aantal studies ook na zes maanden bij 10 tot 15% van de patiënten nog een opmerkelijke functieverandering (verslechtering, dan wel verdere verbetering). Vooral patiënten die wel enige arm-handvaardigheid hebben (d.w.z. met een incompleet herstel van de bovenste extremiteit), maar niet volledig zijn hersteld, blijken ‘at risk’ te zijn voor ‘learned non-use’.323 Geleidelijk aan gebruiken zij de paretische arm en hand bij het uitvoeren van dagelijkse handelingen minder dan dat op basis van de functie zou worden verwacht.333,391 Deze ‘learned non-use’ is gerelateerd aan afferente stoornissen, als somatosensorische functiestoornissen en neglect.392
Er is geen longitudinale cohortstudie bekend die determinanten voor verdere verbetering van arm-handvaardigheid na zes maanden heeft onderzocht.
Context en interpretatie
Na het eerste halfjaar blijkt een aanzienlijk percentage van de patiënten met een incompleet functioneel herstel van arm en hand verder te verbeteren of te verslechteren. Prognostisch onderzoek naar determinanten voor functionele verandering in de chronische fase is echter schaars. Tot op heden laat de verandering van arm-handvaardigheid zich moeilijk voorspellen bij gebrek aan studies. Dit impliceert dat de groep CVA-patiënten met een onvolledig herstel van arm-handvaardigheid zes maanden na het CVA regelmatig (halfjaarlijks) op behoud van functionaliteit moeten worden gecontroleerd.
Op basis van bovenstaande formuleerde de werkgroep de volgende aanbevelingen:
(25 t/m 27) Prognose functionele verandering arm-handvaardigheid in de periode die volgt op de eerste zes maanden na het CVA
De werkgroep is van mening dat om een indicatie te krijgen van eventuele verandering in arm-handvaardigheid in de chronische fase, bij patiënten met een score op de Frenchay Arm Test van één tot vier punten zes maanden na het CVA, somatosensorische functiestoornissen en/of hemineglect, de arm-handvaardigheid elke zes maanden dient te worden geëvalueerd (bij voorkeur met de Action Research Arm Test [ARAT]), omdat deze patiënten ‘at risk’ zijn voor ‘learned non-use’. Er is sprake van een daadwerkelijke verandering wanneer de ARAT-score met minimaal zes punten is veranderd ten opzichte van de ARAT-score die zes maanden na het CVA werd behaald. (niveau 4)
De werkgroep is van mening dat patiënten in de chronische fase die zes maanden na het CVA nog beperkt zijn in arm-handvaardigheid geregeld (elk halfjaar) dienen te worden gemonitord op hun functioneren. (niveau 4)
De werkgroep is van mening dat bij patiënten in de chronische fase significante verandering in het functioneren op activiteitenniveau het continueren of herstarten van fysiotherapie legitimeert. (niveau 4)
Meetinstrumenten
De volgende meetinstrumenten worden geadviseerd ter ondersteuning van het bepalen van de prognose voor verandering van arm-handvaardigheid in de chronische fase.
Neem minimaal af
- Frenchay Arm Test (FAT) (zes maanden)
- Action Research Arm Test (ARAT) (zes maanden bij een FAT-score van één tot vier punten; elke zes maanden)
Overweeg
- Erasmus MC modificatie van het Nottingham Sensory Assessment (EmNSA)
- National Institutes of Health Stroke Scale (NIHSS) – item extinctie en inattentie
- O-Letter Cancellation Test (O-LCT)
Wetenschappelijke verantwoording
Er zijn geen longitudinale cohortstudies bekend die verandering onderzochten van arm-handvaardigheid in de chronische fase en daaraan gerelateerde factoren.
Basale ADL-vaardigheden: verandering in de chronische fase
In de chronische fase verbetert de uitvoering van de basale ADL-vaardigheden significant bij circa 10 tot 15% van de patiënten, terwijl bij circa 5 tot 40% van de patiënten juist verslechtering optreedt.
Uit twee grote prospectieve cohortstudies blijkt dat de ADL-zelfstandigheid in de chronische fase afneemt, met de grootste achteruitgang circa twee tot drie jaar na het CVA. Dit is ook het geval bij patiënten die zes maanden na het CVA wél zelfstandig basale ADL-vaardigheden konden uitvoeren. Er zijn echter weinig studies gepubliceerd die determinanten voor achteruitgang in deze ADL-vaardigheden op lange termijn hebben onderzocht. Er zijn aanwijzingen dat hogere leeftijd, hoger gelegen corticale functiestoornissen, depressie, vermoeidheid, visuele stoornissen en/of fysieke inactiviteit functionele voorspellers zijn van achteruitgang in basale ADL-vaardigheden. De cohortstudies waaruit deze determinanten afkomstig zijn, hebben echter een matige methodologische kwaliteit, waardoor de resultaten met enige terughoudendheid moeten worden geïnterpreteerd.
De werkgroep formuleerde de volgende aanbevelingen:
(28 t/m 30) Prognose functionele verandering in de uitvoering van ADL-vaardigheden in de periode die volgt op de eerste zes maanden na het CVA
De werkgroep is van mening dat, om een indicatie te krijgen van eventuele veranderingen in de uitvoering van de ADL-vaardigheden in de chronische fase, de Barthel Index (BI) elke zes maanden dient te worden afgenomen. Er is sprake van een daadwerkelijke verandering wanneer de BI-score met minimaal twee punten is veranderd ten opzichte van de score die zes maanden na het CVA werd behaald.
De werkgroep is van mening dat patiënten in de chronische fase, die zes maanden na het CVA beperkt zijn in ADL-vaardigheden, regelmatig (elk halfjaar) dienen te worden gemonitord op hun functioneren.
De werkgroep is van mening dat bij patiënten in de chronische fase significante verandering in het functioneren op activiteitenniveau het continueren of herstarten van fysiotherapie legitimeert.
Prognose en natuurlijk beloop
Uit twee grote prospectieve cohortstudies blijkt dat het aantal patiënten dat zelfstandig is in ADL-vaardigheden afneemt in de loop van de chronische fase.393,394 Dit is ook het geval bij patiënten die zes maanden na het CVA wel zelfstandig waren in basale ADL-vaardigheden.393De grootste achteruitgang is zichtbaar rond twee tot drie jaar na het ontstaan van het CVA.393-396 Er zijn echter weinig studies gepubliceerd over factoren die voor- of achteruitgang in ADL-vaardigheden op lange termijn voorspellen.397,398 Neglect, cognitieve stoornissen, hoge leeftijd (≥ 65 jaar), gehoorsproblemen, delier, urine-incontinentie en decubitus lijken een voorspellende waarde te hebben voor functionele verslechtering van basale ADL-vaardigheden in de chronische fase.397,398 Voorspellers voor verbetering in ADL-vaardigheden op lange termijn zijn onduidelijk.
Context en interpretatie
In de chronische fase blijkt een aanzienlijk percentage van de patiënten verder te verbeteren of te verslechteren. Prognostisch onderzoek naar determinanten voor functionele verandering in de chronische fase is schaars. De studies die ADL-vaardigheden hebben onderzocht laten zien dat neglect, cognitieve stoornissen, hoge leeftijd (≥ 65 jaar), gehoorsproblemen, delier, urine incontinentie en decubitus voorspellend zijn voor het verslechteren van de uitvoering van ADL-vaardigheden. Patiënten die oefentherapie ontvangen na ontslag verbeteren hun zelfstandigheid in ADL-vaardigheden in de periode die volgt op de eerste zes maanden na het CVA.
Omdat deze studies een methodologische matige kwaliteit hebben, moeten de resultaten met voorzichtigheid worden geïnterpreteerd. Omdat verandering in ADL-vaardigheden zich mede wegens gebrek aan studies met goede kwaliteit moeilijk laat voorspellen, zullen patiënten in de chronische fase regelmatig (halfjaarlijks) wat betreft hun ADL-vaardigheden moeten worden geëvalueerd.
Op basis van bovenstaande formuleerde de werkgroep de volgende aanbevelingen:
(28 t/m 30) Prognose functionele verandering in de uitvoering van ADL-vaardigheden in de periode die volgt op de eerste zes maanden na het CVA
De werkgroep is van mening dat, om een indicatie te krijgen van eventuele veranderingen in de uitvoering van de ADL-vaardigheden in de chronische fase, de Barthel Index (BI) elke zes maanden dient te worden afgenomen. Er is sprake van een daadwerkelijke verandering wanneer de BI-score met minimaal twee punten is veranderd ten opzichte van de score die zes maanden na het CVA werd behaald. (niveau 4)
De werkgroep is van mening dat patiënten in de chronische fase, die zes maanden na het CVA beperkt zijn in ADL-vaardigheden, regelmatig (elk halfjaar) dienen te worden gemonitord op hun functioneren. (niveau 4)
De werkgroep is van mening dat bij patiënten in de chronische fase significante verandering in het functioneren op activiteitenniveau het continueren of herstarten van fysiotherapie legitimeert. (niveau 4)
Meetinstrumenten
De volgende meetinstrumenten worden geadviseerd ter ondersteuning van het bepalen van de prognose voor verandering van ADL-vaardigheid in de chronische fase.
Neem minimaal af
- Barthel Index (BI)
Overweeg
- Barthel Index (BI) – item blaas
- National Institutes of Health Stroke Scale (NIHSS) – item visus
- O-Letter Cancellation Test (O-LCT)
- Montreal Cognitive Assessment (MCA)
Wetenschappelijke verantwoording
Er zijn twee longitudinale cohortstudies bekend die determinanten voor verandering van ADL-vaardigheden in de chronische fase onderzoeken. Deze studies zijn echter van een matige methodologische kwaliteit, waardoor de resultaten met grote voorzichtigheid moeten worden geïnterpreteerd. Zie ‘Methodologieontwikkeling’ voor een toelichting op het beoordelen van de methodologische kwaliteit van prognostische studies.

