C Therapeutisch proces
C.1 Voorlichting en educatie
Integreer het geven van voorlichting en educatie aan patiënten en eventuele mantelzorgers in de
therapie.
Houd bij het geven van voorlichting en educatie rekening met de mogelijke aanwezigheid van
beperkte gezondheidsvaardigheden, een cognitieve beperking en/of eventuele andere psychsociale
factoren.
Richt de voorlichting en educatie op:
- Ziektespecifieke informatie: Geef voorlichting over wat COPD is, de gevolgen op het fysiek functioneren in het dagelijks leven en mogelijke aangrijpingspunten van de therapie. Geef advies over de rol van fysieke activiteit als onderdeel van een gezonde leefstijl.
- Zelfmanagement en eigen regie: Bespreek de impact van COPD en longaanvallen op fysiek functioneren en hoe daarmee om te gaan. Geef educatie over de eigen rol van de patiënt in de behandeling en het leren omgaan met de aandoening.
- Energiemanagement en aanpassingen van dagelijkse activiteiten: Adviseer ten aanzien van de dag-/weekindeling en de (fysieke) activiteiten van de patiënt. Houd hierbij rekening met de balans tussen belasting en belastbaarheid en de impact van fysieke activiteiten, therapie en sportsessies.
- Gebruik van (loop)hulpmiddelen: Adviseer, indien nodig, gebruik te maken van een (loop) hulpmiddel en hoe dit hulpmiddel te gebruiken is.
- Gebruik van sociale voorzieningen en lotgenotencontact: Adviseer, indien nodig, gebruik te maken van lotgenotencontact en sociale voorzieningen.
Toelichting
Uitgangsvraag
Welke voorlichting en educatie wordt door de therapeut gegeven aan patiënten met COPD?
Aanleiding
Patiënten met COPD en hun naasten hebben over het algemeen een beperkte kennis van gezondheidsgerelateerde onderwerpen (Nakken 2017). Een gebrek aan kennis kan de eigen regie in de weg staan (Stoilkova- Hartmann 2018). Therapeuten dienen zich bewust te zijn van het feit dat ongeveer 40% van de patiënten met COPD cognitieve stoornissen ervaart (Cleutjens 2016, 2018). Daarnaast laat onderzoek zien dat 46% van de patiënten met COPD onvoldoende of beperkt gezondheidsvaardig is (Nivel 2018). Dit kan eventueel het begrijpen, herinneren en/of toepassen van de aangeboden kennis bemoeilijken. Afstemming van hoe de educatie wordt overgebracht (via folder, verbaal of video) en herhaling van de adviezen/educatie is daarom wenselijk bij deze doelgroep.
Educatie wordt gezien als een integraal onderdeel van de therapie en het bewerkstelligen van gedragsverandering. Het aanbieden van enkel groepseducatie resulteert niet in een significante toename van de fysieke capaciteit bij patiënten met COPD (Ries 1995). Ook heeft het enkel verstrekken van schriftelijk informatie (bijv. aangaande het belang van fysieke activiteit) geen positief effect op het beweeggedrag van patiënten met COPD (Arbillaga-Etxarri 2018). Educatie kan daarom niet worden gezien als een losstaande therapie, maar moet deel uitmaken van de gehele behandeling.
Voorlichting en educatie hebben als doel patiënten en hun naasten aan te leren om fysiek actief te zijn en patiënten te ondersteunen om fysiek actief te blijven en hun fysieke capaciteit zelf op peil te houden (zelfmanagement en adequate coping) (LAN 2016). Educatie draagt daarnaast bij aan de eigen regie van patiënten door de kennisvermeerdering bij patiënten en hun naasten (Marques 2015; Nakken 2017).
Voor therapeuten zal de nadruk altijd liggen op de onderwerpen die nauw verband houden met de behandelbare grootheden: fysieke capaciteit, fysieke activiteit en adembewegingsapparaat (ATS/ERS 2013; Stoilkova 2013). Bij educatie wordt samen met de patiënt met COPD en eventuele mantelzorgers gekeken naar de mogelijkheden en vaardigheden van de patiënt en diens mogelijke barrières. Alleen dan neemt de kans toe dat de beoogde gedragsverandering tot stand komt én wordt volgehouden door de patiënt (LAN 2016). Educatie kan plaatsvinden in een groep of individueel, eventueel in aanwezigheid van naasten. Het is aan de therapeut om te beoordelen of een patiënt beter in een groep of beter individueel voorlichting en educatie kan krijgen. Educatie kan eventueel ondersteund worden met eHealth-toepassingen.
Diagnostiek en interventies kunnen gericht zijn op het bevorderen van de dagelijkse activiteiten en participatie. Educatie gericht op zelfmanagement, energiemanagement en advisering bij de selectie en het gebruik van loophulpmiddelen spelen een belangrijke rol (LESA 2007; LAN 2016). Voor het geven van voorlichting en educatie kan Motiverende gespreksvoering gebruikt worden (Naderloo 2018).
Zelfmanagement
Zelfmanagement is gericht op het aanleren en bestendigen van nieuw gedrag op grond waarvan patiënten met COPD zelf bewust beslissingen nemen op alle gebieden van hun dagelijks leven. Daarbij gaat het binnen fysio- en oefentherapie C/M over acceptatie van het hebben van COPD en de gevolgen daarvan en over het vergroten van de zelfeffectiviteit (‘self-efficacy’) door onder andere het stimuleren van fysieke activiteit, aansturen op het mobiliseren en behoud van sociale contacten, en het bespreken van een fysieke en emotionele balans. Dit kan ertoe leiden dat patiënten meer verantwoordelijkheid nemen voor hun eigen behandeling (LAN 2016).
Voor het vergroten van zelfmanagement zijn handvatten voor de therapeut genoemd in de literatuur:
- Wat? Wat de patiënt (weer) graag wil kunnen en wat de patiënt nodig heeft van de therapeut om dat te bereiken. De patiënt verantwoordelijkheid geven bij zijn behandeling. Denk bijvoorbeeld aan het zelf meer gaan/blijven bewegen c.q. het vragen naar begeleiding hierbij (LAN 2016).
- Waarom? Uit de literatuur is bekend dat een actieve rol bij het eigen zorgproces c.q. vragen naar begeleiding leidt tot krachtige effecten op de klachtbeleving en op de kwaliteit van leven. De patiënt is daarom medebehandelaar van zijn ziekte en dient zich bewust te worden van zijn eigen rol in de behandeling (Houben-Wilke 2017; LAN 2016; Wang 2017).
- Hoe? Om die rol waar te maken, is het belangrijk dat de patiënt ook ‘gereedschappen’ (kennis, vertrouwen en vaardigheden) aangereikt krijgt en begeleid wordt bij het verwerven van kennis van COPD en de behandeling van COPD. Het is wenselijk dat de patiënt in ieder geval ten aanzien van de volgende punten geïnformeerd/getraind wordt: de aard van de aandoening en de gevolgen daarvan op het fysiek functioneren in het dagelijks leven, en het opstellen en monitoren van persoonlijke doelen (LAN 2016). Verder is het cruciaal dat de therapeut beseft dat bij adaptatie (de mate waarin de patiënt erin slaagt zich aan de stoornis aan te passen) het gedrag van de patiënt zelf centraal staat (LAN 2016).
- Voor wie? Dit is belangrijk voor alle patiënten met COPD (LAN 2016; LESA 2007).
Zelfmanagementinterventies (gericht op het nemen van eigen regie) worden geassocieerd met een toegenomen kwaliteit van leven en een afname in ziekenhuisopnamen bij patiënten met COPD (Cannon 2016; Jonkman 2016; Lenferink 2017; Wang 2017; Zwerink 2014). Er is een diversiteit aan zelfmanagementinterventies. Belangrijke inhoudelijke aspecten die in ieder programma lijken terug te komen, zijn: ziektespecifieke educatie, het bespreken van de energieverdeling gericht op het uitvoeren van activiteiten (over de dag en over een week), advies over bewegen in de thuissituatie, omgaan met benauwdheid en het bespreken van een gezonde leefstijl. Een belangrijk aspect van de effectiviteit van zelfmanagementinterventies is het door de behandelend arts bespreekbaar maken van wat er gebeurt bij een longaanval en hier samen met de patiënt een plan voor maken (longaanval-actieplan). Het inzetten van informatiemateriaal (bijvoorbeeld filmpjes van het Longfonds) kan hierbij ondersteunen.
Energiemanagement
Educatie die is gericht op energiemanagement is een belangrijk en integraal onderdeel van de therapie. Een patiënt met COPD die bijvoorbeeld moeite heeft om zijn energie goed over de dag te verdelen, kan bijvoorbeeld geleerd worden om ergonomische principes te gaan gebruiken (zoals temporiseren en handelen of kracht leveren bij uitademen) (Lakerveld-Heyl 2005; Prieur 2020). Daarnaast kan de therapeut de patiënt adviezen geven over een goede verdeling van (fysieke) activiteiten over de dag/week.
De therapeut geeft de patiënt inzicht in zijn huidige dagindeling/fysieke activiteiten en wat voor effect dit heeft op de ervaren belasting of symptomen. Vervolgens gaat de therapeut met de patiënt in gesprek over hoe hij zijn dagindeling kan aanpassen om verbetering te bewerkstelligen in de ervaren belasting of symptomen. De therapeut geeft hierbij adviezen over op welke wijze en op welke momenten in de week de patiënt het beste kan sporten/ bewegen en hoe dit zich verhoudt tot de dagen waarop therapie wordt aangeboden. De therapeut houdt hierbij rekening met de individuele belastbaarheid van de patiënt enerzijds en de belasting van de fysieke activiteiten anderzijds.
Gedurende het behandeltraject kunnen patiënten ook gewezen worden op reguliere beweeg- of sportactiviteiten, zoals wandelen met de hond, tuinieren, fietsen (e-bike) of yoga. Ook kan de patiënt aansluiting zoeken bij regionale of landelijke initiatieven, zoals beweegprogramma’s in de reguliere sportsector, plaatselijk georganiseerde wandelgroepen en de Nationale COPD Challenge. Medebegeleiding door een ergotherapeut kan overwogen worden.
Adviseren over het gebruik van (loop)hulpmiddelen
Voor mensen met COPD zijn er loophulpmiddelen beschikbaar die het hen mogelijk maken bepaalde fysieke activiteiten met minder symptomen en/of langer te kunnen uitvoeren. In het algemeen zijn hulpmiddelen zaken die de mobiliteit vergroten, de patiënt minder afhankelijk kunnen maken van hulp en de kwaliteit van leven verbeteren. Het zal van de specifieke fysieke activiteit, de noodzaak ervan en de zorgvraag van de patiënt afhangen of een bepaald hulpmiddel wordt ingezet en/of een bepaalde voorziening wordt aangevraagd (LAN 2016). De therapeut helpt bij de selectie en het leren omgaan met een loophulpmiddel en indien nodig zal er contact worden opgenomen met de ergotherapeut.
Het gebruik van een loophulpmiddel, zoals een rollator, is bijvoorbeeld te overwegen bij patiënten met een beperkte score op de Zes Minuten Wandeltest (6MWT) (< 350 m) (Probst 2004; Vaes 2012, 2015). Als het behandeldoel ‘weer kunnen traplopen’ niet haalbaar is, kan het plaatsen van een traplift een oplossing zijn (LAN 2016).
Bij de selectie van een vervoermiddel voor iets langere afstanden kan een elektrische fiets worden overwogen (waardoor de patiënt nog zoveel mogelijk zelfredzaam blijft). Als dat niet (meer) lukt kan een passievere oplossing worden overwogen, zoals een scootmobiel. Bij advies over (loop)hulpmiddelen dient contact met de ergotherapeut overwogen te worden.
Adviseren bij sociale voorzieningen en lotgenotencontact
Voorzieningen in de thuissituatie, denk aan huishoudelijke hulp of hulp bij ADL, kunnen worden aangevraagd bij zorgverzekeraars, bij gemeenten op basis van de ‘Wet maatschappelijke ondersteuning’ (Wmo) of bij andere instanties. Het aanbod en waar een aanvraag voor specifieke zorg/hulp/voorziening gedaan moet worden, is afhankelijk van de op dat moment geldende wetgeving.
Een therapeut kan een patiënt verwijzen naar een zorgcoördinator of MEE. MEE heeft vestigingen over het gehele land en ondersteunt patiënten op alle terreinen van het dagelijks leven met informatie en advies. Om in aanmerking te komen voor ondersteuning van MEE is geen verwijzing of indicatie nodig (LAN 2016).
Voor lotgenotencontact kan worden verwezen naar een Longpunt. Een Longpunt is een bijeenkomst voor patiënten die vier keer per jaar op zo’n 60 locaties in Nederland wordt gehouden. Longpunten dragen tevens bij aan het vergroten van kennis en stimuleren van de eigen regie.
Literatuur
Voor het beantwoorden van de uitgangsvraag is in overleg met de werkgroep en de klankbordgroep om pragmatische redenen besloten geen systematisch literatuuronderzoek uit te voeren.
- Arbillaga-Etxarri A, Gimeno-Santos E, Barberan-Garcia A, Balcells E, Benet M, Borrell E, et al. Long-term efficacy and effectiveness of a behavioural and community-based exercise intervention (Urban Training) to increase physical activity in patients with COPD: a randomised controlled trial. Eur Respir J. 2018;52(4).
- ATS/ERS. An official American Thoracic Society/European Respiratory Society statement: key concepts and advances in pulmonary rehabilitation. American Thoracic Society/European Respiratory Society (ATS/ERS). Am J Respir Crit Care Med. 2013;188(8):e13-64.
- Cannon D, Buys N, Sriram KB, Sharma S, Morris N, Sun J. The effects of chronic obstructive pulmonary disease self-management interventions on improvement of quality of life in COPD patients: A meta-analysis. Respir Med. 2016;121:81-90.
- Cleutjens FA, Franssen FM, Spruit MA, Vanfleteren LE, Gijsen C, Dijkstra JB, et al. Domain-specific cognitive impairment in patients with COPD and control subjects. Int J Chron Obstruct Pulmon Dis. 2016;12:1-11.
- Cleutjens FAHM, Spruit MA, Ponds RWHM, Vanfleteren LEGW, Franssen FME, Gijsen C, et al. Cognitive impairment and clinical characteristics in patients with chronic obstructive pulmonary disease. Chron Respir Dis. 2018;15(2):91-102.
- Houben-Wilke S, Augustin IM, Wouters BB, Stevens RA, Janssen DJ, Spruit MA, et al. The patient with a complex chronic respiratory disease: a specialist of his own life? Expert Rev Respir Med. 2017;11(12):919-24.
- Jonkman NH, Westland H, Trappenburg JC, Groenwold RH, Bischoff EW, Bourbeau J, et al. Characteristics of effective self-management interventions in patients with COPD: individual patient data meta-analysis. Eur Respir J. 2016;48(1):55-68.
- Lakerveld-Heyl K, Boomsma LJ, Flikweert S, van Ravensberg CD. Paramedische zorg voor patiënten met COPD. Resultaten uit literatuuronderzoek. Amersfoort: Nederlands Paramedisch Instituut; 2005.
- LAN. Zorgstandaard COPD. Amersfoort: Longalliantie Nederland; 2016.
- Lenferink A, Brusse-Keizer M, van der Valk PD, Frith PA, Zwerink M, Monninkhof EM, et al. Self-management interventions including action plans for exacerbations versus usual care in patients with chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2017;8:CD011682.
- LESA. Landelijke eerstelijns Samenwerkings Afspraak COPD (LESA). Huisarts Wet 2007;50(8):S21-7.
- Marques A, Jácome C, Cruz J, Gabriel R, Brooks D, Figueiredo D. Family-based psychosocial support and education as part of pulmonary rehabilitation in COPD: a randomized controlled trial. Chest. 2015;147(3):662-72.
- Naderloo H, Vafadar Z, Eslaminejad A, Ebadi A. Effects of Motivational Interviewing on Treatment Adherence among Patients with chronic obstructive pulmonary disease: a randomized controlled clinical trial. Tanaffos. 2018;17(4):241-49.
- Nakken N, Janssen DJA, van den Bogaart EHA, Muris JWM, Vercoulen JH, Custers FL, Bootsma GP, Gronenschild MHM, Wouters EFM, Spruit MA. Knowledge gaps in patients with COPD and their proxies. BMC Pulm Med. 2017;17(1):136.
- Nivel. Cijfers en trends over de zorg- en leefsituatie van mensen met een longziekte. Bilthoven: Nivel; 2018. Prieur G, Combret Y, Medrinal C, Arnol N, Bonnevie T, Gravier FE, Quieffin J, Lamia B, Reychler G, Borel JC.
- Energy conservation technique improves dyspnea when patients with severe COPD climb stairs: a randomised crossover study. Thorax. 2020. pii: thoraxjnl-2019-214295.
- Probst VS, Troosters T, Coosemans I, Spruit MA, Pitta Fde O, Decramer M, Gosselink R. Mechanisms of improvement in exercise capacity using a rollator in patients with COPD. Chest. 2004;126(4):1102-7.
- Ries AL, Kaplan RM, Limberg TM, Prewitt LM. Effects of pulmonary rehabilitation on physiologic and psychosocial outcomes in patients with chronic obstructive pulmonary disease. Ann Intern Med. 1995;122(11):823-32.
- Stoilkova-Hartmann A, Franssen FME, Augustin IML, Wouters EFM, Barnard KD. COPD patient education and support – Achieving patient-centredness. Patient Educ Couns. 2018;101(11):2031-6.
- Vaes AW, Annegarn J, Meijer K, Cuijpers MWJ, Franssen FME, Wiechert J, et al. The effects of a ‘new’ walking aid on exercise performance in patients with COPD: a randomized crossover trial. Chest. 2012;141(5):1224-32.
- Vaes AW, Meijer K, Delbressine JM, Wiechert J, Willems P, Wouters EF, et al. Efficacy of walking aids on self-paced outdoor walking in individuals with COPD: A randomized cross-over trial. Respirology. 2015;20(6):932-9.
- Wang T, Tan JY, Xiao LD, Deng R. Effectiveness of disease-specific self-management education on health outcomes in patients with chronic obstructive pulmonary disease: An updated systematic review and meta-analysis. Patient Educ Couns. 2017;100(8):1432-46.
- Zwerink M, Brusse-Keizer M, van der Valk PD, Zielhuis GA, Monninkhof EM, van der Palen J, et al. Self management for patients with chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2014;(3):CD002990.
C.2 Optimaliseren van fysieke activiteit
Bied interventies ter bevordering van de fysieke activiteit aan bij patiënten met onvoldoende fysieke activiteit (profiel 3, 5 en 6). Wees bij patiënten die voldoende actief zijn alert op overbelasting.
Focus op een gedragsverandering die gericht is op het optimaliseren van fysieke activiteit van de patiënt en houd daarbij rekening met de fasen van gedragsverandering. Overweeg hierbij de inzet van Motiverende Gespreksvoering.
Zet onder meer de volgende activiteiten in per fase van de gedragsverandering:
- Informeer en controleer of de patiënt de informatie begrijpt (weten).
- Stel samen doelen op op het gebied van functionele fysieke activiteiten (willen).
- Oefen gezamenlijk de fysieke activiteiten (ervaren/kunnen).
- Maak afspraken voor in de thuissituatie (doen) en evalueer deze (blijven doen).
Bespreek en houd rekening met mogelijke bevorderende en belemmerende fysieke, psychologische, sociale en/of externe factoren.
Zet waar mogelijk een activiteitenmeter in om de patiënt inzicht te geven in zijn activiteitenpatroon en bespreek samen met de patiënt de resultaten.
Toelichting
Uitgangsvraag
Op welke wijze kan de therapeut fysieke activiteit tijdens ADL bij patiënten met COPD optimaliseren?
Aanleiding
Het optimaliseren van fysieke activiteit wordt als wezenlijk element beschouwd bij de behandeling van COPD (GOLD 2020), aangezien de positieve invloed van oefentherapie op de fysieke capaciteit bij patiënten met COPD zich niet automatisch vertaalt in meer fysieke activiteit (Cindy Ng 2012; Mesquita 2017; Osadnik 2018; Spruit 2015). De aanwezigheid van een bepaalde mate van fysieke capaciteit lijkt echter wel voorwaardelijk om tot een toename van de fysieke activiteit te komen (Osadnik 2018).
Fysieke capaciteit en fysieke activiteit zijn gerelateerde, maar twee verschillende aandachtsgebieden voor een therapeut (zie ook A.3.3 ‘Aangrijpingspunten voor fysiotherapie en oefentherapie C/M’). Fysieke capaciteit en fysieke activiteit verhouden zich positief tot elkaar, maar zijn niet een op een inwisselbaar (Bootsma-Van der Wiel 2001; Koolen 2019). Dit blijkt onder meer uit het feit dat 14% van de patiënten met COPD die voor het eerst door de huisarts werden verwezen voor een consult bij de longarts, een redelijke tot goede fysieke capaciteit hebben (> 70% van de voorspelde waarden op de 6MWT), maar toch fysiek inactief waren (< 5000 stappen per dag, de zogenaamde ‘underachievers’); 21% van de verwezen patiënten was echter ondanks een beperkte fysieke capaciteit met > 5000 stappen per dag toch fysiek actief (de zogenaamde ‘overachievers’; Koolen 2019; Tudor-Locke 2013).
Uit deze bevindingen blijkt dat naast een beperkte fysieke capaciteit, psychologische en sociale factoren de fysieke activiteit bij patiënten met COPD kunnen beïnvloeden (Gimeno-Santos 2014; Koolen 2019; Kosteli 2017). Tevens laten deze resultaten zien dat niet bij alle patiënten met COPD de nadruk moet liggen op het bevorderen van de fysieke activiteit. Bij beide groepen is het belangrijk om een goede balans te vinden tussen belasting en belastbaarheid en deze toe te passen in het dagelijks leven. Bij de ‘overachievers’ kan de nadruk bij de behandeling daarom liggen op het verminderen van de fysieke activiteit en het beter verdelen van de energie over de dag, mede door middel van het toepassen van energiebesparende maatregelen (Vaes 2019; Velloso 2006).
Literatuur en overwegingen
Aanbevolen fysieke activiteit bij COPD
Internationale en nationale richtlijnen voor de hoeveelheid fysieke activiteit voor de algemene populatie adviseren minstens vijf dagen per week 30 minuten per dag (totaal ≥ 150 minuten per week) matige tot intensieve fysieke activiteit (Garber 2011), gecombineerd met minimaal tweemaal per week spier- en botversterkende activiteiten en balansoefeningen voor ouderen en zo min mogelijk stilzitten (Gezondheidsraad 2017). Het activiteitenniveau van patiënten met COPD is doorgaans veel lager dan dat van de algemene populatie (Pitta 2005; Tudor-Locke 2001; Wallaert 2013; Waschki 2012).
In deze richtlijn wordt, behalve bovenstaand algemeen advies, een afkappunt gehanteerd van 5000 stappen per dag om bij patiënten met COPD te kunnen spreken van voldoende fysieke activiteit (Depew 2012; Tudor-Locke 2013). De literatuur spreekt van succesvolle interventies voor het verhogen van fysieke activiteit bij patiënten met COPD indien de interventie leidt tot een toename van 600 tot 1100 stappen per dag (Demeyer 2016). Dit komt voort uit een studie waarin een afgenomen risico voor ziekenhuisopname als gevolg van een longaanval is waargenomen bij patiënten met COPD die na drie maanden revalidatie meer dan 600 stappen zijn vooruitgegaan (Demeyer 2016). Afhankelijk van de situatie van de patiënt is het belangrijk om samen met de patiënt een haalbaar doel te stellen voor de vooruitgang van het aantal stappen.
Inzet van eHealth
Het monitoren van de hoeveelheid bewegen door middel van beweegdagboeken of het dragen van activiteitenmeters kan inzicht geven in het activiteitenniveau. Met e-health krijgt de therapeut concrete informatie over hoeveel de patiënt daadwerkelijk beweegt; het gezamenlijk bespreken van deze data geeft de patiënt inzicht in zijn vooruitgang en zijn verdeling van fysieke activiteiten over de dag.
Verschillende studies hebben een verhoging van fysieke activiteit gerapporteerd door het gebruik van beweegdagboeken of het dragen van activiteitenmeters, ook bij patiënten met COPD. In de toegepaste interventies werden activiteitenmeters alleen of in combinatie met andere strategieën voor gedragsverandering toegepast; Mantoani 2017; Strath 2018). Er is op dit moment weinig evidentie dat het gebruik van activiteitenmeters de mate van fysieke activiteit op de lange termijn bij patiënten met COPD kan verhogen. Activiteitenmeters kunnen worden ingezet als middel om de patiënt en de therapeut inzicht te geven in de mate van bewegen.
Het is een optie om de patiënt een digitaal beweegprogramma aan te bieden, maar daarbij wordt supervisie van een therapeut noodzakelijk geacht (‘blended care’) (Spruit 2015). Het zonder begeleiding inzetten van digitale ondersteuning voor zelfmanagement is onvoldoende voor het bevorderen of het behoud van fysieke activiteit op de lange termijn (12 maanden) (Hoaas 2016).
Patiënten met voldoende fysieke activiteit
Voor patiënten die beschikken over voldoende fysieke capaciteit én over voldoende fysieke activiteit, is fysio- of oefentherapie niet geïndiceerd. Het is de taak van de therapeut de patiënt te stimuleren om de huidige fysieke activiteit onderhouden door adviezen te geven, informatie te verstrekken en/of te verwijzen naar het aanbod van regionale of landelijke beweeg- en/of sportactiviteiten indien de patiënt zelf daar nog geen passende opties voor heeft gevonden. De therapeut staat de patiënt actief bij in het overstappen naar deze reguliere activiteiten. Volhouden van het gewenste gedrag kan worden bevorderd door te bespreken welke belemmerende factoren zich in de toekomst voor zouden kunnen doen en daarbij dan een passend plan te bedenken. Voor aanvullende beweegtips bij COPD kan de patiënt verwezen worden naar de website van het Longfonds (Longfonds 2019).
Bij patiënten die fysieke voldoende actief zijn, maar niet beschikken over voldoende fysieke capaciteit, is het de taak van de therapeut om voornamelijk in te spelen op het bevorderen van die fysieke capaciteit. Daarnaast is het goed de fysieke activiteit te monitoren en zo nodig bij te sturen. Omdat patiënten in deze groep over onvoldoende fysieke capaciteit beschikken, is het belangrijk om alert te zijn op symptomen van overbelasting (de belasting door de fysieke activiteit is groter dan de belastbaarheid). Het is belangrijk om de patiënten te informeren over deze balans en over hoe ze hun energie over de dag goed kunnen verdelen (temporiseren). Zie C.1 ‘Voorlichting en educatie’. Hierbij kunnen de principes van gedragsverandering gebruikt worden.
Patiënten met onvoldoende fysieke activiteit
Voor patiënten met voldoende fysieke capaciteit, maar onvoldoende fysieke activiteit heeft de therapeut als belangrijkste taak om in te spelen op de gedragsverandering op het gebied van fysieke activiteit. Bij patiënten die onvoldoende fysiek actief zijn én niet beschikken over voldoende fysieke capaciteit, is het de taak van de therapeut om interventies in te zetten op beide aangrijpingspunten.
Het veranderen van het beweeggedrag waarbij de patiënt weer fysieke activiteiten gaat uitvoeren, kan een langdurig proces zijn, doordat bij het veranderen van beweeggedrag verschillende factoren een rol spelen. Programma’s met fysieke oefeningen of longrevalidatie die meer dan 12 weken duurden en zich richtten op verhogen van fysieke activiteit bij patiënten met COPD (en comorbiditeit) komen uit de literatuur naar voren als een succesvolle methode (Mantoani 2016, 2017). Voor het bevorderen van fysieke activiteit worden bij voorkeur de principes van gedragsverandering toegepast.
Principes van gedragsverandering
Volgens de principes van gedragsverandering worden bij het bewerkstelligen van gedrag vijf fasen doorlopen: 1) open staan (weten), 2) willen, 3) ervaren (kunnen), 4) doen en 5) blijven doen/volhouden (Poelgeest 2010; Prochaska 1992).
Stap 1 en 2: open staan (weten) en willen
In stap 1 en 2 kunnen het open staan en willen gestimuleerd worden door het informeren van de patiënt over het belang van bewegen en het bespreken van de ervaren bevorderende en belemmerende factoren van de patiënt om optimaal fysiek actief te zijn (Kosteli 2017). Belemmerende en bevorderende factoren kunnen liggen op diverse vlakken: motoriek (bij een goede fysieke capaciteit speelt motoriek een kleinere rol), psychologische factoren, sociale factoren of externe factoren.
Bevorderende factoren voor fysieke activiteit voor patiënten met COPD kunnen zijn (Kosteli 2017; Mesquita 2017; Thorpe 2012, 2014):
- sociale steun
- professionele ondersteuning
- persoonlijke drijfveren (interne motivatie om meer te kunnen of minder klachten te hebben)
- het ervaren van persoonlijke voordelen van fysieke activiteit (zich beter voelen)
- controle hebben over hun eigen aandoening (eigen regie)
- (specifieke) doelen stellen
- therapiespecifieke factoren (bereikbaarheid, veilige omgeving, supervisie, ziektespecifieke oefeningen, etc.)
Belemmerende factoren voor fysieke activiteit voor patiënten met COPD kunnen zijn (Thorpe 2012, 2014; Pitta 2006; Watz 2008, 2009):
- veranderende ziektestatus (longaanvallen en verergering van symptomen)
- comorbiditeiten of fysiek letsel
- persoonlijke factoren (angst, depressie, beperkte gezondheidsvaardigheden, oncomfortabel voelen tijdens fysieke oefeningen, drukte met andere zaken zoals werk en familie, luiheid, etc.)
- gebrek aan support (alleenstaand), externe factoren (vervoer, financieel, het weer, etc.)
- blijven roken
- therapiespecifieke barrières (onbekendheid met zorgverlener, onzekere of negatieve zorgverlener ten aanzien van mogelijke voordelen van fysieke activiteit, het niet ervaren van persoonlijke voordelen en negatieve eerdere ervaringen met oefentherapie, zoals een onprettig voorval, te hoge intensiteit, te weinig follow-up).
Het is belangrijk alert te zijn op de aanwezigheid van bevorderende en belemmerende factoren en deze bespreekbaar te maken. De therapeut kan adviezen geven over het omgaan met belemmerende factoren (zie C.1 ‘Voorlichting en educatie’). Ook kan de therapeut fysieke belemmerende factoren, zoals een verminderde balans en verhoogd valrisico, betrekken bij de invulling van de behandeling. Daarbij kan het stellen van doelen op het gebied van fysieke activiteiten de patiënt stimuleren om de fysieke activiteit af te stemmen (optimaliseren) op de fysieke capaciteit (zie B.6 ‘Doelen stellen’).
Stap 3: ervaren/kunnen
De therapeut oefent in stap 3 reële functionele activiteiten met de patiënt in de praktijk en bootst de situatie van de patiënt zoveel mogelijk na. Het is belangrijk om de patiënt tijdens de behandeling te laten ervaren waar de grens van onder- of overbelasting zit en hoe de patiënt ADL-activiteiten kan uitvoeren, zoals het oefenen van activiteiten als stofzuigen, koffiezetten, traplopen of naar de bakker lopen op de hoek van de straat. Ook bij deze stap spelen de bevorderende en belemmerende factoren een rol. Te denken valt aan de vorm van de trap of de kwaliteit van het voetpad (vlak dan wel ongelijk). De therapeut kan de patiënt vragen om foto’s of filmpjes van de thuissituatie te maken om inzicht te geven in de thuissituatie. Vervolgens wordt de omgeving van de patiënt zoveel mogelijk in de therapeutische setting nagebootst. Waar mogelijk wordt de activiteit daadwerkelijk in de thuissituatie of buiten uitgevoerd. De therapeut begeleidt de patiënt bij het adequaat inspelen op de lichaamssignalen en symptomen die de patiënt ervaart en benoemt.
Stap 4: doen
Om in stap 4 het doen te bevorderen, kunnen tussen de verschillende sessies subdoelen worden opgesteld, waarmee de patiënt zelf aan de slag gaat. Deze subdoelen worden dan vervolgens samen met de therapeut geëvalueerd. Tijdens de evaluatie bespreekt de therapeut opnieuw de mogelijke aanwezigheid van belemmerende en bevorderende factoren. De doelen ten aanzien van fysieke activiteiten kunnen vervolgens steeds meer uitgebreid worden. Motiverende gespreksvoering, persoonlijke doelen stellen, management van belemmerende factoren al dan niet gecombineerd met oefentherapie hebben in dit opzicht zeker potentie (Mantoani 2017). Het meeste bewijs is gevonden voor een combinatie van advisering en uitvoering van fysieke activiteiten met coaching waarin feedback op individuele doelen wordt gegeven (bijv. door middel van feedback van een activiteitenmeter) (Mantoani 2016, 2017; Spruit 2015).
Stap 5: blijven doen/volhouden
Tijdens stap 5 zit de uitdaging in het behoud van de verandering op langere termijn en het optimaliseren van matig-intensieve fysieke activiteit. De therapeut kan adviezen geven, informeren en verwijzen naar regionale of landelijke beweeg- en/of sportactiviteiten, indien de patiënt zelf nog geen passende opties heeft gevonden om voldoende actief te zijn. Voor aanvullende informatie voor de patiënt kan verwezen worden naar de website van het Longfonds voor beweegtips bij COPD (Longfonds 2019).
Literatuur
Voor het beantwoorden van de uitgangsvraag is in overleg met de werkgroep en de klankbordgroep om pragmatische redenen besloten geen systematisch literatuuronderzoek uit te voeren. De literatuur over dit onderwerp is op niet-systematische wijze vergaard.
- Bootsma-van der Wiel A, Gussekloo J, de Craen AJ, van Exel E, Knook DL, Lagaay AM, et al. Disability in the oldest old: ‘can do’ or ‘do do’? J Am Geriatr Soc. 2001 Jul;49(7):909-14.
- Cindy Ng LW, Mackney J, Jenkins S, Hill K. Does exercise training change physical activity in} people with COPD? A systematic review and meta-analysis. Chron Respir Dis. 2012;9(1):17-26.
- Demeyer H, Burtin C, Hornikx M, Camillo CA, Van Remoortel H, Langer D, et al. The minimal important difference in physical activity in patients with COPD. PLoS One. 2016 Apr 28;11(4):e0154587.
- Depew ZS, Novotny PJ, Benzo RP. How many steps are enough to avoid severe physical inactivity in patients with chronic obstructive pulmonary disease? Respirology. 2012;17(6):1026-7.
- Garber CE, Blissmer B, Deschenes MR, Franklin BA, Lamonte MJ, Lee IM, et al. Quantity and quality of exercise for developing and maintaining cardiorespiratory, musculoskeletal, and neuromotor fitness in apparently healthy adults: guidance for prescribing exercise. Med Sci Sports Exerc. 2011;43(7):1334-59.Gezondheidsraad. Beweegrichtlijnen 2017. Adviesrapport nr. 2017/08. 22 augustus 2017. Den Haag: Gezondheidsraad.
- Gimeno-Santos E, Frei A, Steurer-Stey C, de Batlle J, Rabinovich RA, Raste Y, et al. Determinants and outcomes of physical activity in patients with COPD: a systematic review. Thorax. 2014;69(8):731-9.
- GOLD. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. Global Initiative for Chronic Obstructive Lung Disease (GOLD); 2020.
- Hoaas H, Morseth B, Holland AE, Zanaboni P. Are physical activity and benefits maintained after long-term telerehabilitation in COPD? Int J Telerehabil. 2016;8(2):39-48.
- Koolen EH, van Hees HW, van Lummel RC, Dekhuijzen R, Djamin RS, Spruit MA, et al. ‘Can do’ versus ‘do do’: A novel concept to better understand physical functioning in patients with chronic obstructive pulmonary disease. J Clin Med. 2019;8(3).
- Kosteli MC, Heneghan NR, Roskell C, Williams SE, Adab P, Dickens AP, et al. Barriers and enablers of physical activity engagement for patients with COPD in primary care. Int J Chron Obstruct Pulmon Dis. 2017 Mar 28;12:1019-31.
- Longfonds. Beweegtips; Meer bewegen, minder benauwd. Amersfoort: Longfonds; 2019.
- Mantoani LC, Rubio N, McKinstry B, MacNee W, Rabinovich RA. Interventions to modify physical activity in patients with COPD: a systematic review. Eur Respir J. 2016;48(1):69-81. Mantoani LC, Dell’Era S, MacNee W, Rabinovich RA. Physical activity in patients with COPD: the impact of comorbidities. Expert Rev Respir Med. 2017;11(9):685-98.
- Mesquita R, Meijer K, Pitta F, Azcuna H, Goërtz YMJ, Essers JMN, et al. Changes in physical activity and sedentary behaviour following pulmonary rehabilitation in patients with COPD. Respir Med. 2017;126:122-9.
- Osadnik CR, Loeckx M, Louvaris Z, Demeyer H, Langer D, Rodrigues FM, et al. The likelihood of improving physical activity after pulmonary rehabilitation is increased in patients with COPD who have better exercise tolerance. Int J Chron Obstruct Pulmon Dis. 2018;13:3515-27.
- Pitta F, Troosters T, Spruit MA, Probst VS, Decramer M, Gosselink R. Characteristics of physical activities in daily life in chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2005 May 1;171(9):972-7.
- Pitta F, Troosters T, Probst VS, Spruit MA, Decramer M, Gosselink R. Physical activity and hospitalization for exacerbation of COPD. Chest. 2006;129(3):536-44.
- Poelgeest A, Noordstar J, Mares M, Luijnenburg-Kroes P, Balm M. Gezond bewegen kun je leren. Den Haag: Boom Lemma, 2010.
- Prochaska JO, DiClemente CC, Norcross JC. In search of how people change. Applications to addictive behaviors. Am Psychol. 1992 Sep;47(9):1102-14.
- Spruit MA, Pitta F, McAuley E, ZuWallack RL, Nici L. Pulmonary rehabilitation and physical activity patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2015;192(8):924-33.
- Strath SJ, Rowley TW. Wearables for promoting physical activity. Clin Chem. 2018 Jan;64(1):53-63.
- Thorpe O, Johnston K, Kumar S. Barriers and enablers to physical activity participation in patients with COPD: a systematic review. J Cardiopulm Rehabil Prev. 2012;32(6):359-69.
- Thorpe O, Kumar S, Johnston K. Barriers to and enablers of physical activity in patients with COPD following a hospital admission: a qualitative study. Int J Chron Obstruct Pulmon Dis. 2014;9:115-28.
- Tudor-Locke CE, Myers AM. Methodological considerations for researchers and practitioners using pedometers to measure physical (ambulatory) activity. Res Q Exerc Sport. 2001;72(1):1-12.
- Tudor-Locke C, Craig CL, Thyfault JP, Spence JC. A step-defined sedentary lifestyle index: <5000 steps/day. Appl Physiol Nutr Metab. 2013;38(2):100-14.
- Vaes AW, Delbressine JML, Mesquita R, Goertz YMJ, Janssen DJA, Nakken N, et al. Impact of pulmonary rehabilitation on activities of daily living in patients with chronic obstructive pulmonary disease. J Appl Physiol (1985). 2019;126(3):607-15.
- Velloso M, Jardim JR. Study of energy expenditure during activities of daily living using and not using body position recommended by energy conservation techniques in patients with COPD. Chest. 2006;130(1):126-32.
- Wallaert B, Monge E, Le Rouzic O, Wémeau-Stervinou L, Salleron J, Grosbois JM. Physical activity in daily life of patients with fibrotic idiopathic interstitial pneumonia. Chest. 2013 Nov;144(5):1652-8.
- Waschki B, Spruit MA, Watz H, Albert PS, Shrikrishna D, Groenen M, et al. Physical activity monitoring in COPD: compliance and associations with clinical characteristics in a multicenter study. Respir Med. 2012;106(4):522-30.
- Watz H, Waschki B, Boehme C, Claussen M, Meyer T, Magnussen H. Extrapulmonary effects of chronic obstructive pulmonary disease on physical activity: a cross-sectional study. Am J Respir Crit Care Med. 2008;177(7):743-51.
- Watz H, Waschki B, Kirsten A, Müller KC, Kretschmar G, Meyer T, Holz O, Magnussen H. The metabolic syndrome in patients with chronic bronchitis and COPD: frequency and associated consequences for systemic inflammation and physical inactivity. Chest. 2009;136(4):1039-46.
C.3 Bevorderen fysieke capaciteit
Deze module betreft:
- Duur-/intervaltraining (module C.3.1)
- Spierkrachttraining (module C.3.2)
- Hydrotherapie (module C.3.3)
- Trainen in relatie tot zuurstofdesaturatie (module C.3.4)
- Neuromusculaire elektrostimulatie (module C.3.5)
C.3.1 Duur-/intervaltraining
Bied duur-/intervaltraining aan bij patiënten met COPD en een beperkte fysieke capaciteit (profiel 4, 5 en 6) en maak dan als volgt gebruik van de FITT-factoren (frequentie, intensiteit, type en tijdsduur):

Overweeg intervaltraining in te zetten indien:
- uit de maximale inspanningstest (CPET) blijkt dat de patiënt ventilatoir gelimiteerd is en/of een inspannings-geïnduceerde transcutaan gemeten zuurstofdesaturatie heeft en daarnaast de inspanning < 10 minuten volhoudt tijdens een uithoudingsfietstest op 75% van de maximale fietsbelasting, en/of
- verhoging van de tijdsduur en/of intensiteit bij duurtraining niet (meer) haalbaar is.
Overweeg in alle andere gevallen duurtraining.
Overweeg de duur-/intervaltraining deels of volledig te vervangen door spierkrachttraining indien duur-/intervaltraining (nagenoeg) onmogelijk wordt vanwege bijvoorbeeld een te lage spierfunctie en/of ernstige kortademigheid. Zie C.3.2 ‘Spierkrachttraining’.
Toelichting
Uitgangsvragen
- Wat is de beste vorm van training ter bevordering van fysieke capaciteit bij patiënten met COPD: intervaltraining of duurtraining?
- Op welke wijze (FITT) dient duur-/intervaltraining toegepast te worden bij patiënten met COPD?
Aanleiding
Fysieke training is een essentieel onderdeel van de therapie, dat tot doel heeft de fysieke capaciteit bij patiënten met COPD te vergroten (ATS/ERS 2013). Daarnaast leidt fysieke training tot een afname in de dagelijkse symptomen (zoals minder kortademigheid, vermoeidheid, angst en depressie) en een toename in de kwaliteit van leven, terwijl de mate van luchtwegobstructie gelijk blijft (McCarthy 2015; Harrison 2012, Van Herck 2019). De fysieke capaciteit van patiënten met COPD zal niet verbeteren als er enkel educatie (zonder fysieke training) wordt geboden (Ries 1995).
Er zijn verschillende vormen van fysieke training die kunnen worden ingezet om de fysieke capaciteit te vergroten. Er kan gekozen worden tussen duurtraining, intervaltraining en spierkrachttraining.
Het nut en de haalbaarheid van de verschillende trainingsvormen zal worden beschreven in het licht van de cardiocirculatoire, ventilatoire en/of perifere factoren die gerelateerd zijn aan de beperkte fysieke capaciteit (ERS 2019). De mate waarin deze factoren kunnen bijdragen aan de beperkte fysieke capaciteit kan per persoon sterk uiteenlopen. Daarom wordt elk van deze factoren afzonderlijk geëvalueerd en wordt de fysieke training aangepast aan de individuele behoeften en mogelijkheden van de patiënt. Hierbij dient men er ook rekening mee te houden dat vaak de combinatie van factoren leidt tot een beperkte fysieke capaciteit. Verder dient het besef te bestaan dat door middel van therapie initieel beperkende factoren (deels) worden verholpen, waardoor andere factoren een grotere invloed krijgen op de fysieke capaciteit (Saey 2003).
In dit gedeelte van de richtlijn wordt antwoord gegeven op de vraag op welke wijze duur-/intervaltraining vormgegeven dient te worden en in het bijzonder wanneer er gekozen wordt voor duurtraining en wanneer voor intervaltraining.
1 Wat is de beste vorm van training bij patiënten met COPD: intervaltraining of duurtraining?
Literatuur
Om te bepalen of duurtraining of intervaltraining de voorkeur verdient, is een systematisch literatuuronderzoek uitgevoerd. Hieruit zijn geen significante verschillen gevonden tussen duurtraining en intervaltraining ter verbetering van de fysieke capaciteit en kwaliteit van leven of vermindering van kortademigheid. De bewijskracht van de gevonden studies is laag tot matig.
Overwegingen
Niet alle patiënten met COPD zijn in staat zijn om een duurtraining op de juiste intensiteit en/of duur te volbrengen (Maltais 1997; Puhan 2008). Hierdoor is de trainingsstimulus mogelijk niet toereikend om de fysieke capaciteit te vergroten. Het betreft veelal patiënten met ernstige luchtwegobstructie en verzwakte bovenbeenspieren (Spruit 2007). Op basis van de factoren die de fysieke capaciteit beperken, in combinatie met de doelen en voorkeuren van de patiënt, dient de therapeut weloverwogen de meest optimale trainingsvorm(en) te selecteren. In de volgende figuur is een stroomdiagram afgebeeld om te komen tot meest optimale trainingsvorm op basis van de inspanningslimitatie.
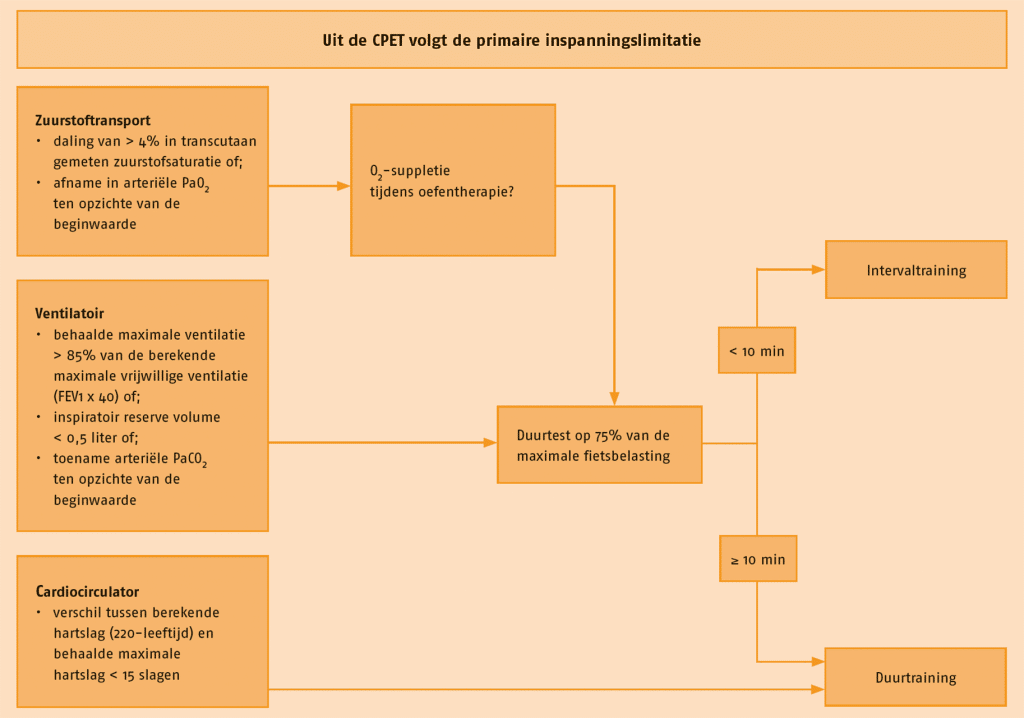
Als patiënten tijdens de maximale inspanningstest een beperkt cardiocirculatoir vermogen hebben (< 15 slagen verwijderd van de berekende maximale hartslag (220 – leeftijd)), lijkt duurtraining aangewezen.
Bij patiënten met COPD die ventilatoir gelimiteerd zijn (de verhouding maximale ventilatie en de berekende of de gemeten maximale vrijwillige ventilatie > 85% of een inspirator reservevolume < 0,5 liter of een toename van de arteriële PaCO2 ten opzichte van de beginwaarde), dient een uithoudingsfietstest te worden uitgevoerd op 75% van de maximale fietsbelasting (Van ’t Hul 2003). Als deze uithoudingsfietstest ≥ 10 minuten kan worden volgehouden, kan de patiënt duurtraining krijgen. Wordt de uithoudingsfietstest echter korter dan 10 minuten volgehouden, dan lijkt deze patiënt eerder een kandidaat voor intervaltraining.
Tijdens een sessie intervaltraining hebben patiënten met COPD minder dynamische hyperinflatie in vergelijking met een sessie duurtraining en is de ventilatie (t.o.v. de maximale vrijwillige ventilatie; MVV) significant lager (Kortianiou 2010; Sabapathy 2004; Vogiatzis 2004). Dit kan mede verklaren waarom patiënten in staat zijn om een hoge trainingsintensiteit te bereiken met relatief lage scores voor kortademigheid en met minder onderbrekingen van de trainingssessie en waarom deze trainingsvorm dus beter wordt verdragen (Puhan 2008; Vogiatzis 2002, 2005).
Als de training nog steeds erg moeizaam verloopt vanwege van de hoge mate van inspanningsgeïnduceerde kortademigheid, kan de therapeut de patiënt naar muziek laten luisteren. Patiënten met COPD kunnen zich namelijk langer inspannen op een hoge intensiteit met minder symptomen van kortademigheid als ze naar zelfgekozen muziek luisteren in vergelijking met fysieke inspanning zonder muziek (Lee 2018). Therapeuten kunnen ook overwegen om de belasting op het gestoorde respiratoire systeem te beperken of de belastbaarheid vergroten.
De belasting op het gestoorde respiratoire systeem wordt verminderd door de hoeveelheid actieve spiermassa tijdens de fysieke training te reduceren met behulp van eenbenig trainen (zie C.3.2 ‘Spierkrachttraining’). De belastbaarheid van het gestoorde respiratoire systeem kan worden vergroot door middel van niet-invasieve ademhalingsondersteuning. Dit lijkt het meest geïndiceerd te zijn voor patiënten met hypercapnie, verlaagde inademingsspierkracht en/of sterk verhoogde statische hyperinflatie van de longen. De klinische waarde van training dient nog wel beter te worden onderzocht (Menadue 2014).
Indien bij een patiënt met COPD tijdens de maximale inspanningstest een daling van > 4% in transcutaan gemeten zuurstofsaturatie wordt gemeten of een afname in arteriële PaO2 ten opzichte van de beginwaarde, is deze patiënten mogelijk kandidaat voor zuurstofsuppletie tijdens de duur- en/of intervaltraining. (Zie C.3.4 ‘Trainen in relatie tot zuurstofdesaturatie’).
2 Op welke wijze (FITT) dient duur-/intervaltraining toegepast te worden bij patiënten met COPD?
Waar mogelijk worden bij patiënten met COPD de algemene trainingsadviezen van het ‘American College of Sports Medicine’ voor gezonde ouderen toegepast (ACSM 1998, 2009).
Tijdens duurtraining wordt veelal een langere periode (> 10 minuten) fysieke inspanning geleverd op een matige tot hoge intensiteit (60-80% van de maximale belasting zoals vastgesteld met een maximale inspanningstest). Duurtraining vindt veelal plaats op een loopband en/of een stationaire fiets (Spruit 2014). Daarnaast is ‘nordic walking’ een trainingsmodaliteit die kan leiden tot een vergroting van de fysieke capaciteit (Breyer 2010). Het is belangrijk om bij het kiezen van de trainingsvorm rekening te houden met de doelstelling van de individuele patiënt.
Intervaltraining wordt gekenmerkt door hoogintense fysieke inspanning (85-100% van de maximale belasting zoals vastgesteld met een maximale inspanningstest) voor een korte duur (30-60 seconden) met voldoende rust tussen de inspanningsblokjes (1-2 min). Deze vorm van oefentherapie is veilig en effectief gebleken ter verbetering van de fysieke capaciteit en de kwaliteit van leven (Vogiatzis 2002), zelfs bij zeer kwetsbare patiënten die op de wachtlijst staan voor longtransplantatie (Gloeckl 2012).
De trainingsintensiteit en/of -duur van de hiervoor beschreven algemene trainingsvormen worden veelal lineair opgebouwd op geleide van de symptomen (score van 4-6 op een Borgschaal 0-10) om de fysieke capaciteit bij patiënten met COPD te vergroten (McCarthy 2015; Li 2019). De niet-lineair geperiodiseerde inspanningstraining lijkt zelfs tot nog grotere effecten te leiden op de fysieke capaciteit in vergelijking met conventionele, lineair opgebouwde trainingsvormen (Klijn 2013).
Literatuur over duurtraining of intervaltraining
Voor de eerste uitgangsvraag naar de beste trainingsvorm, duurtraining of intervaltraining, is een systematisch literatuuronderzoek verricht.
Uitkomstmaten
Kwaliteit van leven, kortademigheid, longaanvallen en fysiek functioneren in ADL zijn aangemerkt als patiëntrelevante en voor de besluitvorming cruciale uitkomstmaten. Fysiek inspanningsvermogen, perifere spierkracht en ongewenste voorvallen zijn aangemerkt als patiëntrelevante en belangrijke uitkomstmaten voor de besluitvorming.
Zoeken en selecteren
Zoekactie
Gezien de overlap van de uitgangsvragen is een gezamenlijke search uitgevoerd naar literatuur voor alle uitgangsvragen naar FITT-factoren van oefentherapie. Vanwege de grootte van het onderwerp is de zoekstrategie naar FITT-factoren van oefentherapie uitgevoerd in twee stappen: eerst een search naar systematische reviews (SR’s), en vervolgens een search naar gerandomiseerde gecontroleerde trials (RCT’s) om de meest relevante SR te kunnen actualiseren.
Door middel van een systematische zoekactie is op 29 mei 2018 met relevante zoektermen gezocht naar SR’s van RCT’s in onder andere de databases ‘PubMed’, ‘EMBASE’, ‘Web of Science’, ‘Cochrane Library’, ‘CENTRAL’ en ‘EmCare’. In dezelfde databases is vervolgens op 21 februari 2019 gezocht naar RCT’s met betrekking tot FITT- factoren van oefentherapie. De zoekverantwoording naar SR’s en RCT’s is weergegeven in bijlage C.3.1 (opent in nieuw tabblad).
Literatuurselectie
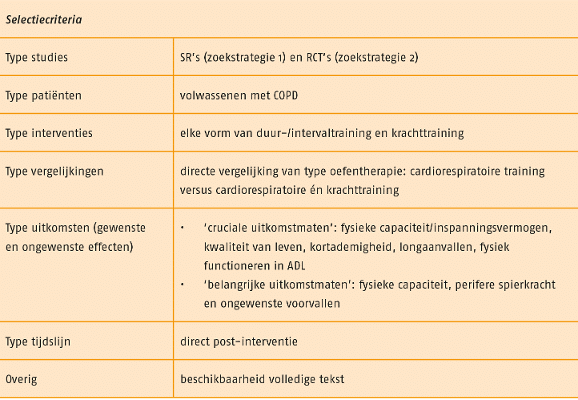
Studies werden geselecteerd op grond van de selectiecriteria in de volgende tabel.

De zoekstrategie naar SR’s leverde 783 referenties op. Hieruit zijn de SR’s Beauchamp 2010 en Zainuldin 2011 geselecteerd als best passend bij de uitgangsvraag. Deze SR’s vormen de basis van deze literatuurstudie. Vervolgens leverde de zoekstrategie naar RCT’s 1607 referenties op. Selectie op titel, samenvatting en de volledige tekst leverde geen nieuwe recente RCT’s op die konden worden toegevoegd aan de systematische reviews van Beauchamp 2010 en Zainuldin 2011.
In eerste instantie waren de SR van Beauchamp (2010) en de Cochranereview van Zainuldin (2011) geïncludeerd. De review van Beauchamp (2010) bevatte echter één studie die in de review van Zainuldin (2011) was geëxcludeerd. De reden van exclusie was dat het intervalprogramma drie dagen intervaltraining en twee dagen duurtraining omvatte. Daardoor kon de vergelijking tussen intervaltraining en duurtraining niet zuiver worden gemaakt. De Cochranereview van Zainuldin (2011) bevat daarnaast nog een nieuwe RCT, die vóór de review van Beauchamp (2010) nog niet gepubliceerd was. Om deze redenen is voor de beantwoording van de uitgangsvraag uitgegaan van de Cochranereview van Zainuldin (2011).
Samenvatting literatuur
Beschrijving studies
In acht van de 11 studies uit de SR van Zainuldin (2011) werden duurtraining en intervaltraining met elkaar vergeleken. In deze acht studies waren in totaal 367 patiënten opgenomen met stabiele COPD en een FEV1/ FVC-ratio van < 0,7.
De duur- en intervaltraining werden bij de meeste studies uitgevoerd op een fietsergometer en bij één studie op een loopband of fietsergometer. De duurtraining bestond uit matig- tot hoogintensieve training (50-80% van de maximale fietsbelasting) gedurende 20-45 minuten, exclusief warming-up en coolingdown.
De intervaltraining bestond uit hoogintensieve training (80-100% van maximale fietsbelasting) gedurende 20-180 seconden, afgewisseld met 30-180 seconden matig- tot laagintensieve training (30-75% van de maximale fietsbelasting) of rust. De totale trainingsduur bij de intervaltraining was 27 tot 45 minuten. De behandelfrequentie was 2 tot 5 keer per week en de behandelduur 3 tot 16 weken.
Gedetailleerde informatie over de kenmerken van de geïncludeerde studies is opgenomen in de evidencetabel in bijlage C.3.1 (opent in nieuw tabblad).
Individuele studiekwaliteit
Van alle acht studies zijn de studieopzet en -uitvoering (‘risk of bias’, RoB) met de Cochrane RoB-tool beoordeeld met laag, hoog, of onduidelijk risico op zes oorzaken voor vertekening, namelijk ‘random sequence generation’, ‘allocation concealment’, ‘blinding’, ‘incomplete outcome data’, ‘selective outcome reporting’ en ‘other issues’). Een overzicht van de beoordeling van de studiekwaliteit (RoB) per studie is weergegeven in de volgende tabel.
Risk of bias: Intervaltraining versus duurtraining

Resultaten en bewijskracht per uitkomstmaat
De resultaten zijn overgenomen uit de review van Zainuldin (2011).
Functionele fysieke capaciteit
In vijf studies is de functionele fysieke capaciteit gemeten door middel van de Zes Minuten Wandeltest (6MWT). Er was geen significant verschil tussen de groepen (MD = -3,10; 95%-BI = -17,88 tot 11,69).
Voor de uitkomstmaat functionele fysieke capaciteit (6MWT) is de bewijskracht met twee niveaus verlaagd wegens beperkingen in studie-uitvoering (incomplete data van de uitkomstmaat) en imprecisie. De bewijskracht komt hiermee uit op laag.
Kwaliteit van leven
De kwaliteit van leven is in drie studies gemeten met de ‘Chronic Respiratory Disease Questionnaire’ (CRQ). Er was geen significant verschil tussen de groepen (MD = 2,51; 95%-BI = -1,32 tot 6,34).
Voor de uitkomstmaat kwaliteit van leven (CRQ) is de bewijskracht met één niveau verlaagd wegens selectieve rapportage in één studie. De bewijskracht komt hiermee uit op matig.
Spierkracht
Geen van de studies heeft spierkracht gemeten.
Kortademigheid
In vijf studies is kortademigheid gemeten door middel van de modified Borgschaal ‘Kortademigheid’ (schaal 0-10). Er was geen significant verschil tussen de groepen (SMD = 0,09; 95%-BI = = -0,18 tot 0,35). In één studie is kortademigheid gemeten door middel van de Borgschaal ‘Kortademigheid’ (schaal 6-20). Ook in deze studie was geen significant verschil tussen de groepen (MD = 0,2; 95%-BI = -0,15 tot 0,55).
Voor de uitkomstmaat kortademigheid is de bewijskracht met twee niveaus verlaagd wegens beperkingen in de studieopzet en -uitvoering De bewijskracht komt hiermee uit op laag.
Ongewenste effecten
Deze zijn gerapporteerd in een van de geïncludeerde RCT’s en in die RCT waren geen ongewenste effecten opgetreden.
Longaanvallen
Geen van de studies heeft longaanvallen gerapporteerd.
Fysiek functioneren in de ADL
Geen van de studies heeft fysiek functioneren in de ADL gemeten.
Overwegingen
De richting en sterkte van de aanbeveling worden niet alleen bepaald door bevindingen in de literatuur. Ook andere overwegingen spelen daarbij een rol, maar zoals kosten, aanvaardbaarheid en haalbaarheid.
De overwegingen betroffen:
Gewenste effecten Vanuit de literatuur zijn er geen aantoonbare verschillen tussen de effecten van duurtraining en effecten van intervaltraining bij patiënten met COPD.
Ongewenste effecten Er zijn in de geïncludeerde studies geen ongewenste effecten van een van beide trainingsvormen gerapporteerd.
Kwaliteit gewenste effecten De bewijskracht is, afhankelijk van de uitkomstmaat, laag tot matig.
Balans tussen gewenste en ongewenste effecten Gezien de afwezigheid van de gevonden effecten is deze balans niet te beoordelen.
Waarde aan gewenste effecten Fysieke training, zowel duurtraining als intervaltraining, is effectief in het verbeteren van fysieke capaciteit bij patiënten met COPD (ATS/ERS 2013; ERS 2019).
Variatie in waarde aan gewenste effecten Niet alle COPD-patiënten zijn in staat zijn om een duurtraining op de juiste intensiteit en/of duur te voltooien (Maltais 1997; Puhan 2008). Dit kan ertoe leiden dat de trainingsstimulus niet toereikend is voor het vergroten van de fysieke capaciteit. Veelal betreft het COPD-patiënten met ernstige luchtwegobstructie en verzwakte bovenbeenspieren (Spruit 2007). Door middel van een maximale inspanningstest kan de juiste trainingsvorm gekozen worden. Daarnaast dient rekening gehouden te worden met de doelen en voorkeuren van de patiënt.
Benodigde middelen (kosten) Er is geen verschil in kosten tussen beide trainingsvormen.
Variatie in benodigde middelen (kosten) Er is geen variatie in benodigde middelen tussen beide trainingsvormen.
Kosteneffectiviteit Niet van toepassing.
Aanvaardbaarheid Beide trainingsvormen zijn aanvaardbaar voor zowel de patiënt als de therapeut, mits er rekening gehouden wordt met de belastbaarheid van de patiënt.
Haalbaarheid Beide trainingsvormen worden momenteel al veelvuldig toegepast en worden als haalbaar beschouwd.
Literatuur over de FITT-factoren duur-/intervaltraining
In overleg met de werkgroep en de klankbordgroep is om pragmatische redenen besloten geen systematische zoekactie uit te voeren voor het beantwoorden van de tweede uitgangsvraag, maar de informatie op niet- systematische wijze te vergaren.
- ACSM. American College of Sports Medicine position stand. Exercise and physical activity for older adults. Med Sci Sports Exerc. 2009 Jul;41(7):1510-30.
- ACSM. American College of Sports Medicine Position Stand. The recommended quantity and quality of exercise for developing and maintaining cardiorespiratory and muscular fitness, and flexibility in healthy adults. Med Sci Sports Exerc. 1998;30(6):975-91.
- Arnardóttir RH, Boman G, Larsson K, Hedenström H, Emtner M. Intervaltraining compared with continuous training in patients with COPD. Respir Med. 2007;101(6):1196-204.
- ATS/ERS. An official American Thoracic Society/European Respiratory Society statement: key concepts and advances in pulmonary rehabilitation. Am J Respir Crit Care Med. 2013;188(8):e13-64.
- Beauchamp MK, Nonoyama M, Goldstein RS, Hill K, Dolmage TE, Mathur S, Brooks D. Interval versus continuous training in individuals with chronic obstructive pulmonary disease – a systematic review. Thorax. 2010 Feb;65(2):157-64.
- Breyer MK, Breyer-Kohansal R, Funk GC, Dornhofer N, Spruit MA, Wouters EF, Burghuber OC, Hartl S. Nordic walking improves daily physical activities in COPD: a randomised controlled trial. Respir Res. 2010;11:112.
- ERS. ERS statement on standardisation of cardiopulmonary exercise testing in chronic lung diseases. European Respiratory Society (ERS). Eur Respir Rev. 2019b;28(154).
- Gloeckl R, Halle M, Kenn K. Interval versus continuous training in lung transplant candidates: a randomized trial. J Heart Lung Transplant. 2012;31(9):934-41.
- Harrison SL, Greening NJ, Williams JE, Morgan MD, Steiner MC, Singh SJ. Have we underestimated the efficacy of pulmonary rehabilitation in improving mood? Respir Med. 2012;106(6):838-44.
- Klijn P, van Keimpema A, Legemaat M, Gosselink R, van Stel H. Nonlinear exercise training in advanced chronic obstructive pulmonary disease is superior to traditional exercise training. A randomized trial. Am J Respir Crit Care Med. 2013;188(2):193-200.
- Kortianou EA, Nasis IG, Spetsioti ST, Daskalakis AM, Vogiatzis I. Effectiveness of interval exercise training in patients with COPD. Cardiopulm Phys Ther J. 2010;21(3):12-9.
- Lee AL, Dolmage TE, Rhim M, Goldstein RS, Brooks D. The impact of listening to music during a high-intensity exercise endurance test in people with COPD. Chest. 2018;153(5):1134-41.
- Li N, Li P, Lu Y, Wang Z, Li J, Liu X, Wu W. Effects of resistance training on exercise capacity in elderly patients with chronic obstructive pulmonary disease: a meta-analysis and systematic review. Aging Clin Exp Res. 2019 Sep 7.
- Mador MJ, Krawza M, Alhajhusian A, Khan AI, Shaffer M, Kufel TJ. Intervaltraining versus continuous training in patients with chronic obstructive pulmonary disease. J Cardiopulm Rehabil Prev. 2009;29(2):126-32.
- Maltais F, LeBlanc P, Jobin J, Bérubé C, Bruneau J, Carrier L, et al. Intensity of training and physiologic adaptation in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 1997;155(2):555-61.
- McCarthy B, Casey D, Devane D, Murphy K, Murphy E, Lacasse Y. Pulmonary rehabilitation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2015 Feb 23;(2):CD003793.
- Menadue C, Piper AJ, van ‘t Hul AJ, Wong KK. Non-invasive ventilation during exercise training for people with chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2014;(5):CD007714.
- Nasis IG, Vogiatzis I, Stratakos G, Athanasopoulos D, Koutsoukou A, Daskalakis A, Spetsioti S, Evangelodimou A, Roussos C, Zakynthinos S. Effects of interval-load versus constant-load training on the BODE index in COPD patients. Respir Med. 2009;103(9):1392-8.
- Puhan MA, Büsching G, Schünemann HJ, vanOort E, Zaugg C, Frey M. Interval versus continuous high-intensity exercise in chronic obstructive pulmonary disease: a randomized trial. Ann Intern Med. 2006;145(11):816-25.
- Puhan MA, Schünemann HJ, Buesching G, vanOort E, Spaar A, Frey M. COPD patients’ ability to follow exercise influences short-term outcomes of rehabilitation. Eur Respir J. 2008;31(2):304-10.
- Ries AL, Kaplan RM, Limberg TM, Prewitt LM. Effects of pulmonary rehabilitation on physiologic and psychosocial outcomes in patients with chronic obstructive pulmonary disease. Ann Intern Med. 1995;122(11):823-32.
- Sabapathy S, Kingsley RA, Schneider DA, Adams L, Morris NR. Continuous and intermittent exercise responses in individuals with chronic obstructive pulmonary disease. Thorax. 2004;59(12):1026-31.
- Saey D, Debigare R, LeBlanc P, Mador MJ, Cote CH, Jobin J, et al. Contractile leg fatigue after cycle exercise: a factor limiting exercise in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2003;168(4):425-30.
- Spruit MA, Pitta F, Garvey C, ZuWallack RL, Roberts CM, Collins EG, et al. Differences in content and organisational aspects of pulmonary rehabilitation programmes. Eur Respir J. 2014;43(5):1326-37.
- Spruit MA, Troosters T, Gosselink R, Kasran A, Decramer M. Acute inflammatory and anabolic systemic responses to peak and constant-work-rate exercise bout in hospitalized patients with COPD. Int J Chron Obstruct Pulmon Dis. 2007;2(4):575-83.
- van Herck M, Antons J, Vercoulen JH, Goërtz YMJ, Ebadi Z, Burtin C, et al. Pulmonary rehabilitation reduces subjective fatigue in COPD: A responder analysis. J Clin Med. 2019;8(8).
- van ’t Hul A, Gosselink R, Kwakkel G. Constant-load cycle endurance performance: test-retest reliability and validity in patients with COPD. J Cardiopulm Rehabil. 2003;23(2):143-50.
- Varga J, Porszasz J, Boda K, Casaburi R, Somfay A. Supervised high intensity continuous and interval training vs. self-paced training in COPD. Respir Med. 2007;101(11):2297-304.
- Vogiatzis I, Nanas S, Kastanakis E, Georgiadou O, Papazahou O, Roussos Ch. Dynamic hyperinflation and tolerance to interval exercise in patients with advanced COPD. Eur Respir J. 2004;24(3):385-90.
- Vogiatzis I, Nanas S, Roussos C. Interval training as an alternative modality to continuous exercise in patients with COPD. Eur Respir J. 2002;20(1):12-9.
- Vogiatzis I, Terzis G, Nanas S, Stratakos G, Simoes DC, Georgiadou O, et al. Skeletal muscle adaptations to interval training in patients with advanced COPD. Chest. 2005;128(6):3838-45.
- Zainuldin R, Mackey MG, Alison JA. Optimal intensity and type of leg exercise training for people with chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2011 Nov 9;(11):CD008008.
C.3.2 Spierkrachttraining
Bied bij voorkeur spierkrachttraining aan indien er sprake is van beperkte fysieke capaciteit en:
- spierkracht verminderd is en ten doel gesteld is deze te verbeteren en/of;
- er sprake is van (herstel na) een longaanval en/of;
- duur-/intervaltraining nagenoeg onmogelijk is vanwege bijvoorbeeld een te lage spierfunctie en/of ernstige kortademigheid. Zie C.3.1 ‘Duur-/intervaltraining’.
Indien spierkrachttraining aangeboden wordt, maak dan als volgt gebruik van de FITT-factoren (frequentie, intensiteit, type en tijdsduur):

Overweeg spierkrachttraining te vervangen door neuromusculaire elektrostimulatie (NMES) indien actief oefenen omwille van uitgesproken kortademigheid helemaal niet mogelijk is. Zie C.3.5 ‘Neuromusculaire elektrostimulatie’.
Maak bij voorkeur geen gebruik van een trilplaat bij het geven van spierkrachttraining. Indien er sprake is van balansproblemen kan het gebruik van een trilplaat overwogen worden.
Toelichting
Uitgangsvraag
- Wat is de waarde van spierkrachttraining bij patiënten met COPD?
- Op welke wijze (FITT) dient spierkracht training toegepast te worden bij patiënten met COPD?
- Wat is de toegevoegde waarde van een trilplaat tijdens het toepassen van spierkrachttraining?
Aanleiding
Er zijn verschillende vormen van fysieke training die kunnen worden ingezet om de fysieke capaciteit te vergroten. Hierbij bestaat de keuze onder meer uit duurtraining, intervaltraining en spierkrachttraining. Echter, op basis van de limiterende factoren van de fysieke capaciteit in combinatie met de doelen en voorkeuren van de patiënt, dient de therapeut een weloverwogen selectie te maken aangaande de meest optimale trainingsvorm(en). Waar mogelijk worden bij patiënten met COPD de algemene trainingsadviezen van het ‘American College of Sports Medicine’ voor gezonde ouderen toegepast (ACSM 1998, 2009).
Hier worden aanbevelingen gedaan over de toepassing van spierkrachttraining. Daarnaast wordt antwoord gegeven op de vraag op welke wijze spierkrachttraining vormgegeven wordt en of het gebruik van een trilplaat van toegevoegde waarde is.
1 Spierkrachttraining en duur-/intervaltraining versus enkel duur-/intervaltraining
Literatuur
Uit het systematisch literatuuronderzoek zijn geen significante effecten gevonden op fysieke capaciteit, kwaliteit van leven en dyspneu, wanneer spierkrachttraining als additionele therapie naast duur-/intervaltraining vergeleken wordt met enkel duur-/intervaltraining. De bewijskracht is zeer laag. Er wordt echter wel een matig effect gevonden op spierkracht in het voordeel van de spierkracht en duur-/intervalgroep. De bewijskracht hiervan is laag.
Overwegingen
Verzwakking van de spiergroepen van de onderste extremiteit kunnen mede bijdragen tot het vroegtijdig stoppen van fysieke inspanning bij patiënten met COPD (Gosselink 1996; Man 2003; Singer 2011). Dit kan tijdens een maximale fietstest onder meer tot uiting komen door symptoomscores van ≥ 7 punten op een Borgschaal 0-10. Daarnaast zullen deze patiënten een verlaagde functie van de m. quadriceps hebben op specifieke spierkrachttests (Robles 2011; Seymour 2010). Spierkrachttraining van grotere spiergroepen van de onderste extremiteit is een effectieve trainingsmethodiek om de spiermassa en -kracht te laten toenemen, wat bijdraagt aan een grotere fysieke capaciteit (Li 2019). De spierkrachttraining vindt veelal plaats met behulp van trainingsapparaten waarmee de therapeut na het bepalen van het 1RM, de trainingsintensiteit adequaat kan instellen. Het grote voordeel van spierkrachttraining is de relatief lage belasting op het beperkte respiratoire systeem, waardoor patiënten met COPD veel minder klachten van kortademigheid ervaren in vergelijking met duurtraining (Probst 2006; Sillen 2008). De belasting op het gestoorde respiratoire systeem kan verder worden verminderd door de hoeveelheid actieve spiermassa tijdens de fysieke training te reduceren met behulp van eenbenig trainen. In vergelijking met tweebenig trainen, leidt eenbenig trainen tot een lagere ventilatie en een grotere verbetering in de fysieke capaciteit bij patiënten met COPD. Uiteraard verdubbelt de trainingsduur. Op basis van de literatuur en overwegingen wordt spierkrachttraining conditioneel aanbevolen bij patiënten met COPD en een beperkte fysieke capaciteit (profiel 4, 5 en 6) indien duur-/intervaltraining nagenoeg onmogelijk wordt vanwege bijvoorbeeld een te geringe spierfunctie en/of ernstige kortademigheid of in combinatie met duur-/interval training als de grotere spiergroepen van de onderste extremiteit verzwakt zijn (Spruit 2013).
2 Op welke wijze (FITT) dient spierkracht training toegepast te worden bij patiënten met COPD?
Waar mogelijk worden bij patiënten met COPD de algemene trainingsadviezen van het American College of Sports Medicine voor gezonde ouderen toegepast (ACSM 1998; ACSM 2009).
De trainingsintensiteit en/of -duur van de spierkrachttraining wordt veelal lineair opgebouwd op geleide van de maximale spierkracht (60-80% van het 1RM). De niet-lineaire geperiodiseerde inspanningstraining lijkt zelfs nog grotere effecten te geven op de fysieke capaciteit in vergelijking met conventionele, lineair opgebouwde trainingsvormen (Klijn 2013). Het gebruik van apparatuur heeft als voordeel dat de intensiteit goed bepaald kan worden. Functionele spierkrachtoefeningen kunnen echter beter toe te passen zijn in het ADL. Beide oefenvormen zijn dus geschikt.
3 Wat is de toegevoegde waarde van een trilplaat tijdens het toepassen van spierkrachttraining?
Trilplaattrainingen is een aanvullende interventie die laatste jaren steeds vaker wordt toegepast bij klinisch stabiele patiënten met COPD (Zhou 2018). Een trilplaat, waar de patiënt op staat tijdens het uitvoeren van krachtoefeningen, geeft mechanische prikkels ter verbetering van de neuromusculaire functie van de onderste extremiteit. Er worden trillingen aangeboden in frequenties tussen de 15 en 60 Hz en amplitudes variërend van 1 tot 10 mm.
Literatuur
Het gebruik van de trilplaat tijdens spierkrachttraining geeft mogelijk een kleine verbetering op functionele fysieke capaciteit en kwaliteit van leven ten opzichte van reguliere spierkrachttraining. De bewijskracht is laag. Het gebruik van de trilplaat geeft mogelijk een grote verbetering op balans ten opzichte van reguliere spierkrachttraining. De bewijskracht is zeer laag.
Overwegingen
De effecten van de trilplaat op fysieke capaciteit en kwaliteit van leven zijn klein en de bewijskracht is laag. Op balans zou echter een groter effect mogelijk zijn, hoewel ook hier de bewijskracht zeer laag is. Kosten van een trilplaat zijn relatief hoog en er zijn bovendien goedkopere alternatieven beschikbaar om balans te trainen. Op basis van deze overwegingen wordt een conditionele aanbeveling tegen het gebruik van de trilplaat geformuleerd, waarbij de trilplaat eventueel overwogen kan worden bij balansproblemen.
Literatuur over de waarde van spierkrachttraining als additionele trainingsvorm naast duur-/intervaltraining
Voor het beantwoorden van de uitgangsvraag over de waarde van spierkrachttraining, is een systematisch literatuuronderzoek uitgevoerd.
Uitkomstmaten
Kwaliteit van leven, kortademigheid, longaanvallen, fysieke capaciteit (inspanningsvermogen) en fysiek functioneren in ADL zijn aangemerkt als patiëntrelevante en cruciale uitkomstmaten voor de besluitvorming. Fysieke capaciteit (inspanningsvermogen) is aangemerkt als cruciale uitkomstmaat omdat krachttraining mogelijk een aanvullende waarde voor deze uitkomstmaten heeft. Perifere spierkracht en ongewenste voorvallen zijn aangemerkt als patiëntrelevante en belangrijke uitkomstmaten voor de besluitvorming.
Zoeken en selecteren
Zoekactie
Gezien de overlap van de uitgangsvragen is een gezamenlijke search uitgevoerd naar literatuur voor alle uitgangsvragen naar FITT-factoren van oefentherapie (zie C.3.1 ‘Duur-/intervaltraining’, C.3.2 ‘Spierkrachttraining’ en C.5.1 ‘Duur en frequentie van therapie’).Omdat het een breed onderwerp betreft, is de zoekstrategie naar FITT-factoren van oefentherapie uitgevoerd in twee stappen: eerst is een search gedaan naar SR’s, en vervolgens een search naar gerandomiseerde gecontroleerde studies (RCT’s) met als doel de relevante SR te actualiseren.
Door middel van een systematische zoekactie is op 29 mei 2018 met relevante zoektermen gezocht naar SR’s van RCT’s in onder andere ‘PubMed’, ‘EMBASE’, ‘Web of Science’, ‘Cochrane Library’, ‘CENTRAL’ en ‘EmCare’. In dezelfde databases is vervolgens op 21 februari 2019 gezocht naar RCT’s naar FITT-factoren van oefentherapie. De zoekverantwoordingen naar SR’s en RCT’s naar FITT-factoren van oefentherapie (duur-interval- én spierkrachttraining) zijn weergegeven in bijlage C.3.1 (opent in nieuw tabblad).
Literatuurselectie
Studies werden geselecteerd op grond van de selectiecriteria in de volgende tabel.
De zoekstrategie naar SR’s leverde 783 referenties op. Hieruit is de SR van Iepsen (2015) geselecteerd als best passend bij de uitgangsvraag. Deze SR vormt de basis van deze literatuurstudie.
De zoekstrategie naar RCT’s leverde 1607 referenties op. Na selectie op titel, samenvatting en de volledige tekst zijn aan Iepsen 2015 vier RCT’s toegevoegd (Aquino 2016; Covey 2014; Daabis 2017; Pereira 2010).
De SR van Iepsen 2015 bevat 11 relevante RCT’s. Hier zijn vervolgens vier recente RCT’s aan toegevoegd. In totaal beslaat deze literatuurstudie 15 RCT’s met in totaal 494 deelnemers.
Beschrijving studies
De 15 geïncludeerde studies beschrijven de effecten van cardiorespiratoire training én spierkrachttraining ten opzichte van alleen cardiorespiratoire training bij mensen met COPD. In totaal zijn er 494 patiënten geïncludeerd. 13 studies vonden plaats in een eerstelijnssetting en twee studies tijdens opname in een revalidatiecentrum. In één studie (Aquino 2016) week de frequentie van oefentherapie sterk af van die in de andere 14 studies; in die studie werd 10 keer in de week getraind, tegenover twee á drie keer per week in de andere studies.
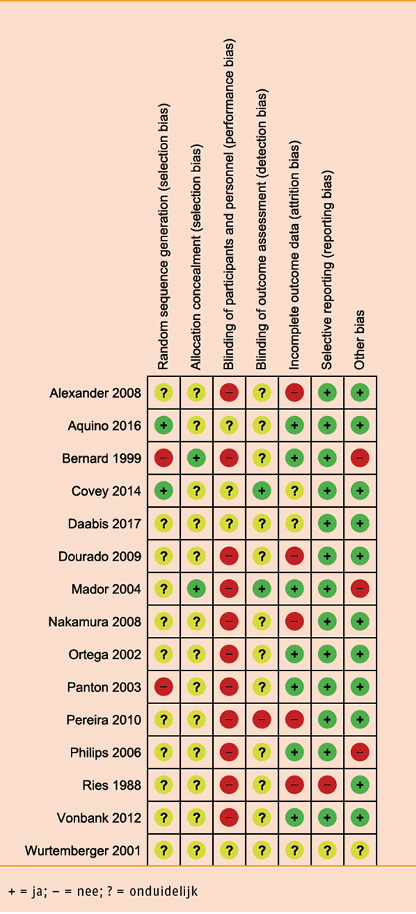
Individuele studiekwaliteit
Van alle 15 studies zijn de studieopzet en -uitvoering (‘risk of bias’, RoB) met de Cochrane RoB-tool beoordeeld met laag, hoog, of onduidelijk risico op zes oorzaken voor vertekening, namelijk ‘random sequence generation’, ‘allocation concealment’, ‘blinding’, ‘incomplete outcome data’, ‘selective outcome reporting’ en ‘other issues’). Een overzicht van de beoordeling van de studiekwaliteit (RoB) per studie is weergegeven in de volgende tabel.
Risk of bias: Duur-/intervaltraining versus kracht- én duur-/intervaltraining
Resultaten en bewijskracht per uitkomstmaat
Functionele fysieke capaciteit
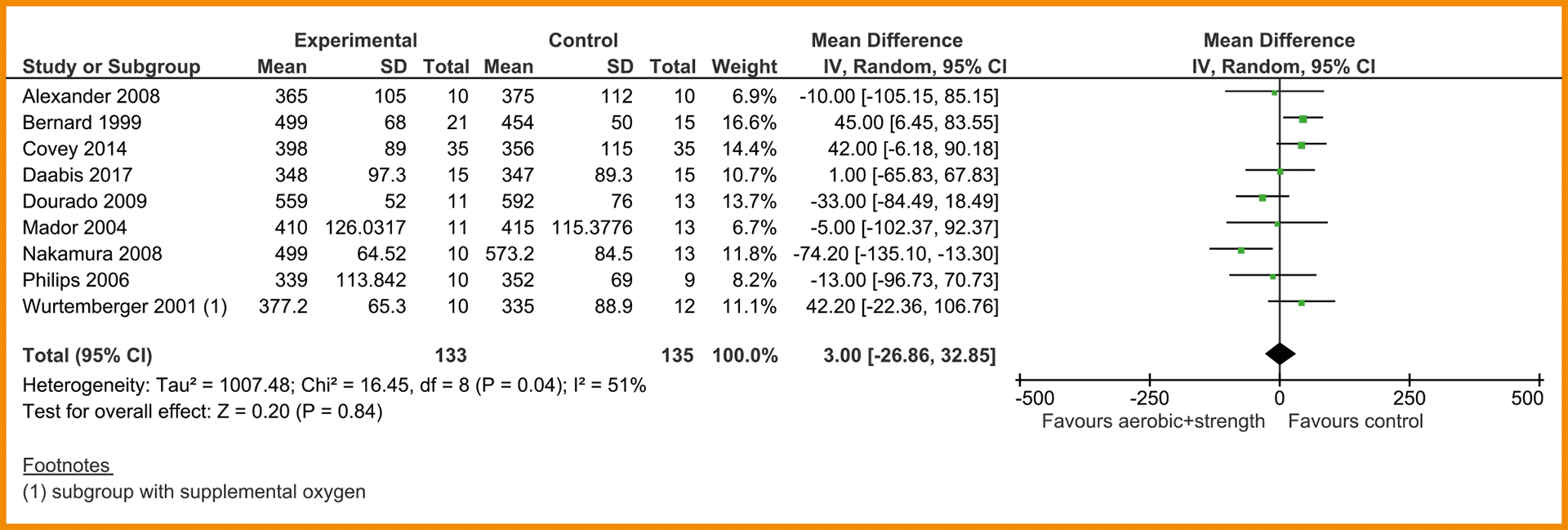
In negen studies is de functionele fysieke capaciteit gemeten door middel van de 6MWT (Alexander 2008; Bernard 1999; Covey 2014; Daabis 2017; Dourado 2009; Mador 2004; Nakamura 2008; Philips 2006; Wurtemberger 2001). De meta-analyse van deze 9 studies, waarin combinatietraining (n = 133) met enkel cardiorespiratoire training (n = 135) met elkaar vergeleken werden, laat geen klinisch-relevant verschil zien tussen de groepen (MD = 3,00 meter; 95%-BI = -26,86 tot 32,85). Zie de forestplot.
De bewijskracht voor de uitkomstmaat functionele (fysieke) capaciteit is met twee niveaus verlaagd door een beperkte studieopzet en één niveau vanwege imprecisie. De bewijskracht komt hiermee uit op zeer laag.
Forestplot van de effectiviteit van spierkrachttraining op de functionele fysieke capaciteit
Spierkracht
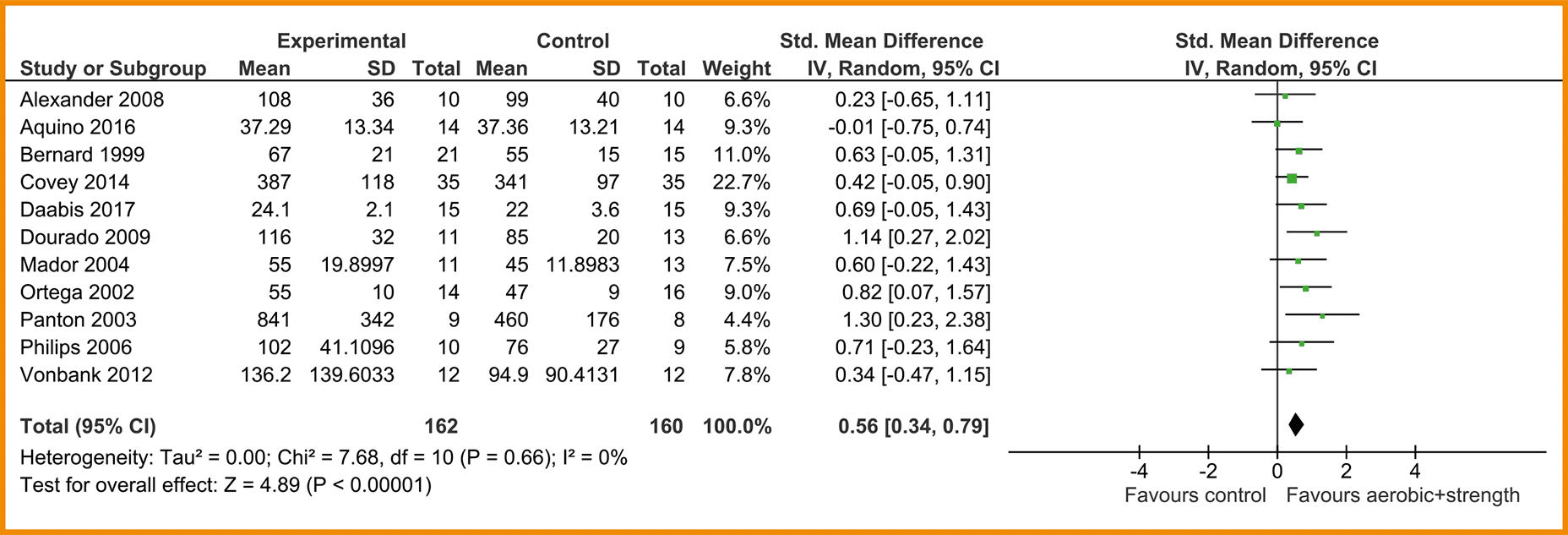
In de SR van Iepsen (2015) werden ‘leg press’ en ‘leg extension data’ van acht studies gepooled, waaraan drie recente RCT’s zijn toegevoegd (Alexander 2008; Aquino 2016; Bernard 1999; Covey 2014; Daabis 2017; Dourado 2009; Mador 2004; Ortega 2002; Panton 2003; Philips 2006; Vonbank 2012). Deze gepoolde data toonde een redelijk effect in het voordeel van de combinatietraining (n = 162) in vergelijking met enkel cardiorespiratoire training (n = 160) (SMD = 0,56; 95%-BI = 0,34 tot 0,79). Zie de forestplot.
De bewijskracht voor de uitkomstmaat spierkracht is met twee niveaus verlaagd wegens een beperkte studieopzet. De bewijskracht komt hiermee uit op laag.
Forestplot van de effectiviteit van spierkrachttraining op de spierkracht
Kwaliteit van leven
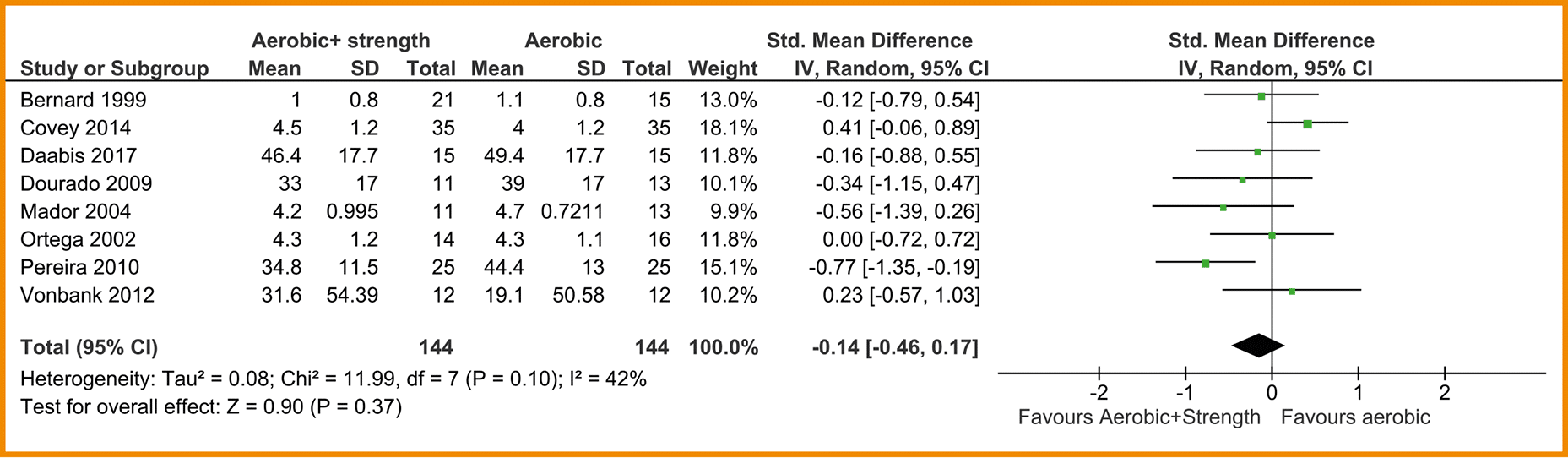
In acht studies is de kwaliteit van leven gemeten met de ‘St George’s Respiratory Questionnaire’ (SGRQ) of met de CRQ (Bernard 1999; Covey 2014; Daabis 2017; Dourado 2009; Mador 2004; Ortega 2002; Pereira 2010; Vonbank 2012). Data van deze studies zijn gepoold, waarbij er een vergelijking gemaakt is tussen combinatietraining (n = 144) en enkel cardiorespiratoire training (n = 144). Er werd geen klinisch-relevant verschil aangetoond tussen de groepen (SMD = -0,14; 95%-BI = -0,46 tot 0,17). Zie de forestplot.
De bewijskracht voor de uitkomstmaat kwaliteit van leven is met twee niveaus verlaagd wegens beperkingen in studieopzet en uitvoering en één niveau vanwege imprecisie. De bewijskracht komt hiermee uit op zeer laag.
Forestplot van de effectiviteit van spierkrachttraining op de kwaliteit van leven
Kortademigheid
In de RCT van Daabis (2017) is kortademigheid gemeten met de ‘modified Medical Research Council Dyspnoe vragenlijst’ (mMRC). Hierbij is geen klinisch-relevant verschil gevonden tussen combinatietraining (n = 15; 46% verbetering t.o.v. baseline) en enkel cardiorespiratoire training (n = 15; 44% verbetering t.o.v. baseline).
De bewijskracht voor de uitkomstmaat kortademigheid is met twee niveaus verlaagd door een beperkte studieopzet en één niveau vanwege imprecisie. De bewijskracht komt hiermee uit op zeer laag.
Ongewenste effecten
In vier RCT’s zijn eventuele ongewenste effecten geïnventariseerd. (n = 105; Bernard 1999; Panton 2004; Philips 2006; Ries 1988). In twee van die RCT’s kwamen geen ongewenste effecten voor; in twee ervan wel: twee gevallen van rugpijn, mogelijk door de combinatietraining en één geval van heuppijn, mogelijk door cardiorespiratoire training. De bewijskracht voor de uitkomstmaat ongewenste effecten is met twee niveaus verlaagd door een beperkte studieopzet en één niveau vanwege imprecisie. De bewijskracht komt hiermee uit op zeer laag.
Longaanvallen
Geen van de studies heeft longaanvallen gerapporteerd.
Fysiek functioneren in de ADL
Geen van de studies heeft fysiek functioneren in de ADL gemeten.
Overwegingen
De richting en sterkte van de aanbeveling worden niet alleen bepaald door bevindingen in de
literatuur. Ook andere overwegingen spelen daarbij een rol, zoals kosten, aanvaardbaarheid en haalbaarheid.
Gewenste effecten De literatuur beschrijft een redelijk effect van spierkrachttraining op spierkracht als deze gecombineerd wordt met cardiorespiratoire training. Op fysieke capaciteit, kwaliteit van leven en kortademigheid werd geen effect van spierkrachttraining gevonden.
Ongewenste effecten Er zijn in de geïncludeerde studies enkele milde ongewenste effecten (rugpijn) van spierkrachttraining gerapporteerd.
Kwaliteit gewenste effecten De bewijskracht is, afhankelijk van de uitkomstmaat, laag tot zeer laag.
Balans tussen gewenste en ongewenste effecten De positieve effecten op spierkracht overtreffen waarschijnlijk het kleine risico op ongewenste effecten, zoals rugpijn.
Waarde aan gewenste effecten Spierkrachttraining van grotere spiergroepen van de onderste extremiteit als opzichzelfstaande interventie is een effectieve trainingsmethodiek om de spiermassa en -kracht te laten toenemen, wat bijdraagt aan een grotere fysieke capaciteit (Li 2019). Het grote voordeel van spierkrachttraining is de relatief lage belasting op het beperkte respiratoire systeem, waardoor patiënten met COPD bij krachttraining veel minder klachten van kortademigheid ervaren dan bij duurtraining (Probst 2006; Sillen 2008).
Variatie in waarde aan gewenste effecten Verzwakking van de spiergroepen van de onderste extremiteit kunnen mede bijdragen tot het vroegtijdig stoppen van fysieke inspanning bij patiënten met COPD (Gosselink 1996; Man 2003; Singer 2011). Dit kan tijdens een maximale fietstest onder meer tot uiting komen door symp-
toomscores van ≥ 7 punten op een Borgschaal 0-10. Daarnaast zullen deze patiënten een verlaagde functie van de musculus (m.) quadriceps hebben op specifieke spierkrachttests (Robles 2011; Seymour 2010). Met name voor laag belastbare patiënten kan spierkrachttraining dus grote waarde hebben.
Benodigde middelen (kosten) De spierkrachttraining vindt veelal plaats met behulp van trainingsapparaten die de therapeut in staat stellen om na het bepalen van het 1RM, de trainingsintensiteit adequaat in te stellen. Aan de aanschaf van deze apparaten zijn uiteraard relatief hoge kosten verbonden, maar de apparaten zijn in veel praktijken reeds aanwezig.
Variatie in benodigde middelen (kosten) Er is geen variatie in benodigde middelen.
Kosteneffectiviteit Geen studies beschikbaar.
Aanvaardbaarheid Spierkrachttraining is aanvaardbaar voor zowel de (met name laag belastbare) patiënt als de therapeut.
Haalbaarheid Spierkrachttraining wordt momenteel al veelvuldig toegepast en wordt als haalbaar beschouwd.
Literatuur over de toepassing van spierkrachttraining (FITT-factoren)
Voor het beantwoorden van de vraag op welke wijze spierkrachttraining uitgevoerd dient te worden (FITT) is in overleg met werkgroep en de klankbordgroep gekozen voor een niet-systematische wijze voor het vergaren en analyseren van de literatuur.
Literatuur over de toegevoegde waarde van een trilplaat tijdens spierkrachttraining
Bij het beantwoorden van de uitgangsvraag naar de gewenste en ongewenste effecten van het gebruik van een trilplaat bij krachtoefeningen bij patiënten met COPD ten opzichte van krachtoefeningen op de grond is de recente SR van Zhou 2018 overgenomen.
Uitkomstmaten
Kwaliteit van leven, fysieke capaciteit, balans en ongewenste effecten zijn aangemerkt als patiëntrelevante en voor de besluitvorming cruciale uitkomstmaten.
Zoeken en selecteren
De systematische review (SR) van Zhou 2018 sluit goed aan bij de uitgangsvraag en is zeer recent. Daarom is besloten deze SR over te nemen en zelf geen extra systematisch literatuuronderzoek uit te voeren.
Beschrijving studies
In de SR van Zhou 2018 zijn drie RCT’s geïncludeerd die de effectiviteit van krachtoefeningen (kniebuigingen) op de trilplaat vergelijken met de effectiviteit van dezelfde kniebuigingen op de grond (Gloeckl 2012, 2017; Spielmans 2017).
De drie studies betreffen samen 172 patiënten. Het aantal sessies varieerde tussen negen (3x/wk gedurende 3 wkn) en 13 (1x/wk gedurende 3 mnd). Hierbij werd een zijdelings alternerende plaat gebruikt op een frequentie van 24-26 Hz en een amplitude van 3 tot 6 mm. De krachtoefeningen bestonden uit kniebuigingen in sets van 4×2 min. of 3×3 min. of kniebuigingen gedurende 90 min.
Individuele studiekwaliteit
De opzet en uitvoering van de individuele studies (‘risk of bias’; RoB) is door Zhou (2018) beoordeeld met behulp van de Cochrane Risk-of-Biastool. Informatie over blindering van patiënten en zorgpersoneel is in geen enkele studie gerapporteerd. Andere veelvoorkomende potentiële oorzaken voor vertekening betreffen beperkingen in geblindeerde toewijzing (‘allocation concealment’) en blindering van uitkomstbeoordelaars. Een overzicht van de beoordeling van de studiekwaliteit (RoB) per studie is weergegeven in de volgende tabel.
Risk of bias: Toegevoegde waarde van een trilplaat tijdens spierkrachttraining (Bron: Zhou 2018)

Resultaten en bewijskracht per uitkomstmaat
Kwaliteit van leven
Effecten van gebruik van de trilplaat op de kwaliteit van leven zijn gemeten met de ziektespecifieke vragenlijsten ‘COPD Assessment Test’ (CAT; Spielmanns 2017) en de ‘Chronic Respiratory Disease Questionnaire’ (CRQ; Gloeckl 2012). De twee vragenlijsten hebben een andere richting. Waar een hoge score op de CAT duidt op een slechte kwaliteit van leven, duidt een hoge score op de CRQ op een goede kwaliteit van leven. Om de resultaten van beide vragenlijsten samen te kunnen nemen zijn de uitkomsten op de CRQ omgescoord. De twee studies (n = 100) tonen een kleine, niet-significante, verbetering op de kwaliteit van leven (SMD = -0,20; 95%-BI = -0,66 tot 0,26). Zie de forestplot.
De bewijskracht voor de kwaliteit van leven is met twee niveaus verlaagd, gezien de beperkingen in de studieopzet en -uitvoering (RoB) en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Forestplot van de effectiviteit van trilplaatgebruik op de kwaliteit van leven
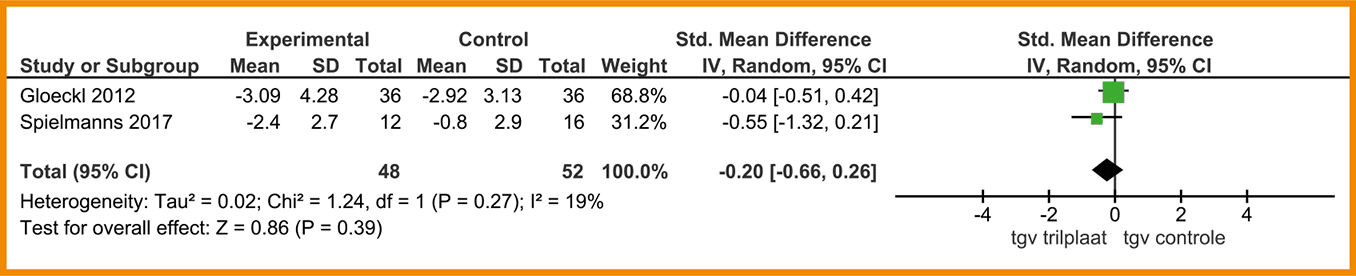
Fysieke capaciteit
De fysieke capaciteit, ook wel het functioneel fysiek functioneren genoemd, is in alle drie de studies gemeten met de 6MWT en de ‘Sit to Stand Test’ (SST) (5 herhalingen). Training op een trilplaat toonde een kleine, significante, maar niet klinisch-relevante verbetering in de wandelafstand. Patiënten die op de trilplaat hadden getraind, verbeterden hun loopafstand die werd gemeten met de 6MWT met 20 meter meer dan patiënten die kniebuigingen op de vaste grond hadden geoefend (MD = 19,90 meter; 95%-BI = 3,56 tot 36,24). Zie de forestplot.
Forestplotvan de effectiviteit van trilplaatgebruik op de fysieke capaciteit: 6MWT in meters
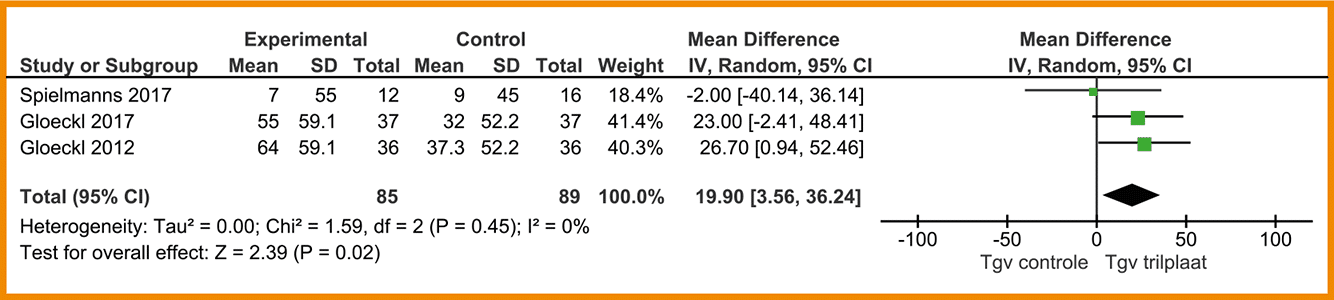
Trainen op een trilplaat toonde een kleine, niet-significante vermindering in de tijd die patiënten nodig hadden om vijf keer de SST uit te voeren (5x uit een stoel opstaan en er weer op gaan zitten) ten opzichte van trainen zonder trilplaat (MD = -1,38 sec; 95%-BI = -4,64 tot 1,88). Zie de forestplot.
De bewijskracht voor de fysieke capaciteit is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (RoB) en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Forestplot van de effectiviteit van trilplaatgebruik op de fysieke capaciteit: SST in seconden
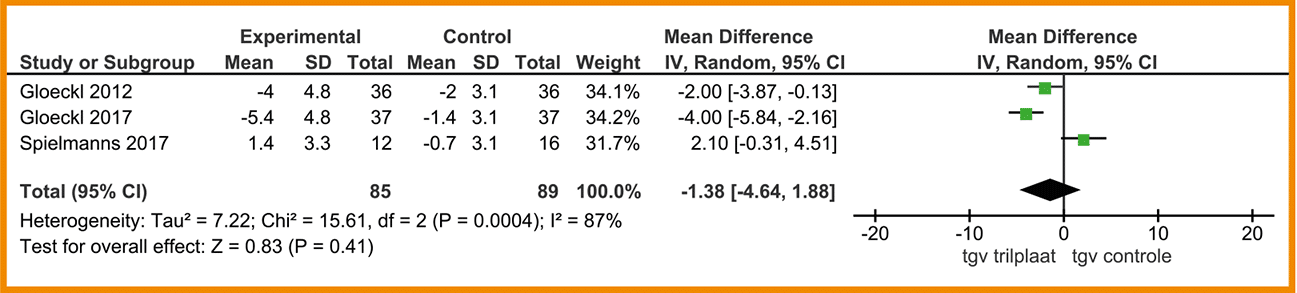
Balans
De balans is in één studie (Gloeckl 2017; n = 74) gemeten. Bij deze balanstests werd patiënten gevraagd gedurende 10 seconden zo stil mogelijk te blijven staan in vier verschillende posities. Patiënten die op een trilplaat hadden getraind, toonden in alle posities een vermindering in het zwaaien van het lichaam. De verschillen tussen trilplaat en controlegroep bedroegen:
- Romberg-stand met ogen gesloten; MD = -76 mm (95%-BI = -202 tot 30)
- stand met één voet naar voren (semitandem) en ogen gesloten, MD = -348 mm (95%-BI = -504 tot -193)
- stand met één voet naar voren (semitandem) en open ogen, MD = -78 mm (95%-BI = -155 tot -1)
- stand op één been met ogen open, MD = -187 (95%-BI = -327 tot -48 mm).
De bewijskracht voor balans is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (RoB) en het zeer geringe aantal patiënten (twee niveaus; imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Ongewenste effecten
Het voorkomen van ongewenste voorvallen is in één studie (Spielmanns 2017; n = 28) gerapporteerd. In deze studie zijn geen ongewenste voorvallen geobserveerd (RV = 0).
De bewijskracht voor het voorkomen van ongewenste voorvallen is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (RoB) en het zeer geringe aantal patiënten (twee niveaus; imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Een overzicht van de effecten en de bewijskracht op alle uitkomsten is weergegeven in de volgende tabel.
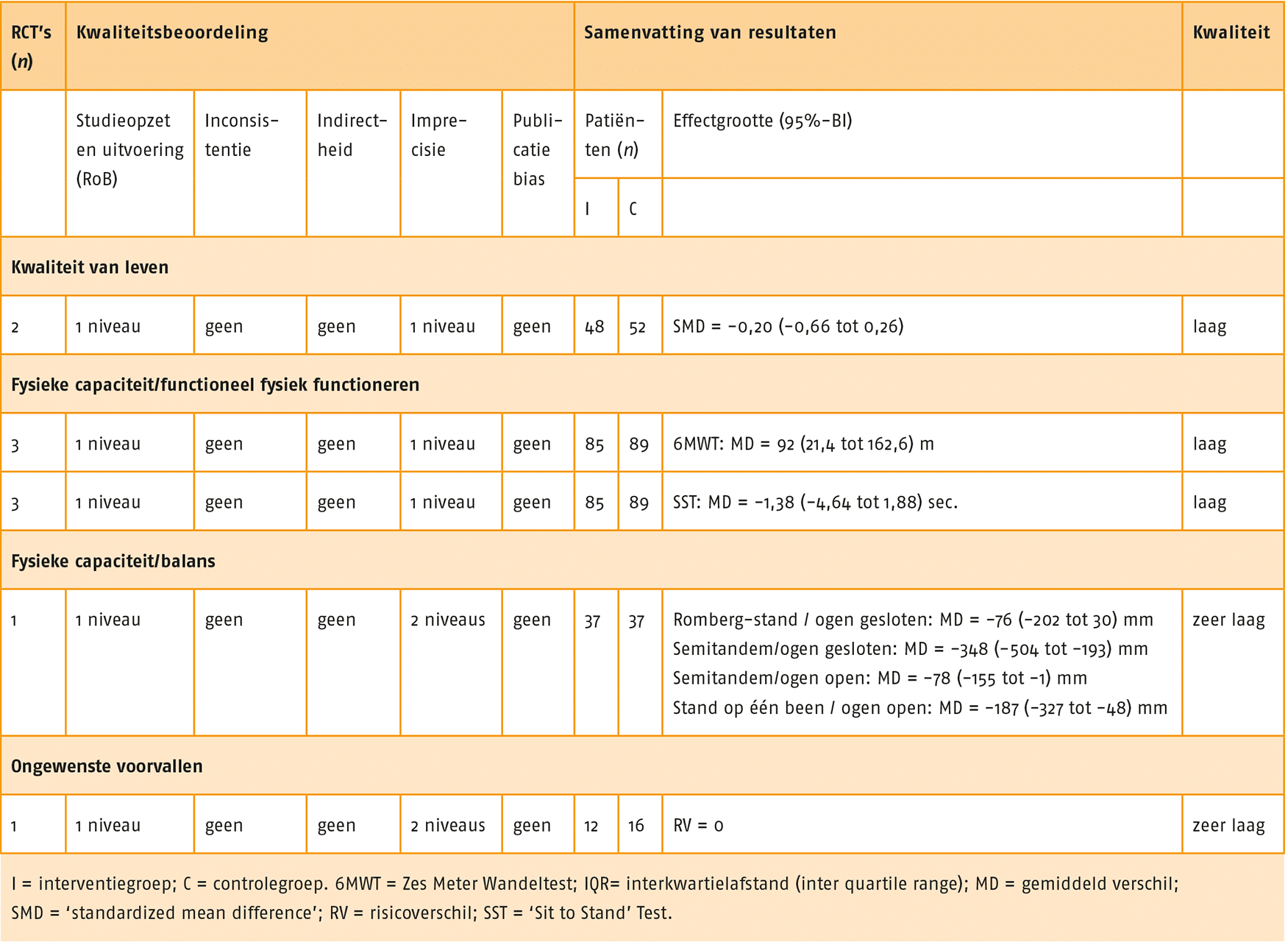
Overwegingen
De richting en sterkte van de aanbeveling worden niet alleen bepaald door bevindingen in de literatuur. Ook andere overwegingen spelen daarbij een rol, zoals kosten, aanvaardbaarheid en haalbaarheid.
De overwegingen betroffen:
Gewenste effecten De effecten van de trilplaat op fysieke capaciteit zijn laag. Voor balans zijn de effecten van de trilplaat redelijk.
Ongewenste effecten Er zijn geen ongewenste effecten van de trilplaat gerapporteerd in de geïncludeerde studies.
Kwaliteit gewenste effecten De kwaliteit van geïncludeerde literatuur met betrekking tot de gewenste effecten is, afhankelijk van de uitkomstmaat, laag tot zeer laag.
Balans tussen gewenste en ongewenste effecten Aangezien er geen ongewenste effecten gerapporteerd zijn, overtreffen de gewenste effecten van de interventie de ongewenste effecten.
Waarde aan gewenste effecten De effecten op de cruciale uitkomstmaat fysieke capaciteit zijn klein en hier wordt dus niet veel waarde aan gehecht.
Variatie in waarde aan gewenste effecten Voor patiënten met balansproblemen kan de trilplaat meerwaarde hebben. Echter, de verwachting is dat in plaats van een trilplaat ook andere trainingsattributen gebruikt kunnen worden die – in tegenstelling tot de trilplaat – wél in het bezit zijn van een therapeut.
Benodigde middelen (kosten) Kosten van een trilplaat zijn relatief hoog in vergelijking met alternatieve trainingsattributen die als doel hebben de balans te verbeteren.
Variatie in benodigde middelen (kosten) Kosten van een trilplaat lopen uiteen, maar zijn relatief hoog in vergelijking met alternatieve trainingsattributen die als doel hebben de balans te verbeteren.
Kosteneffectiviteit Er zijn geen studies bekend die de kosteneffectiviteit van de trilplaat aantonen. Gezien de kleine effecten is de verwachting dat trainen met behulp van een trilplaat niet kosteneffectiever is dan reguliere trainingsvormen.
Aanvaardbaarheid Gezien de beperkte meerwaarde van de trilplaat en de relatief hoge kosten is de verwachting dat toepassing van de trilplaat voor veel therapeuten niet aanvaardbaar is.
Haalbaarheid Gezien de beperkte aanvaardbaarheid is het gebruik van een trilplaat in de praktijk naar verwachting niet haalbaar. Therapeuten die de mogelijkheid hebben om met een trilplaat te trainen, kunnen overwegen deze in te zetten indien een patiënt balansproblemen heeft. Het is echter ook mogelijk om hiervoor andere attributen in te zetten.
- Alexander JL, Phillips WT, Wagner CL. The effect of strength training on functional fitness in older patients with chronic lung disease enrolled in pulmonary rehabilitation. Rehabil Nurs. 2008;33(3):91-7.
- Aquino G, Iuliano E, di Cagno A, Vardaro A, Fiorilli G, Moffa S, et al. Effects of combined training vs aerobic training on cognitive functions in COPD: a randomized controlled trial. Int J Chron Obstruct Pulmon Dis. 2016;11:711-8.
- Bernard S, Whittom F, Leblanc P, Jobin J, Belleau R, Bérubé C, et al. Aerobic and strength training in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 1999 Mar;159(3):896-901.
- Covey MK, Collins EG, Reynertson SI, Dilling DF. Resistance training as a preconditioning strategy or enhancing aerobic exercise training outcomes in COPD. Respir Med. 2014;108(8):1141-52.
- Daabis R, Hassan M, Zidan M. Endurance and strength training in pulmonary rehabilitation for COPD patients. Egypt J Chest Dis Tuberc. 2007; 66:231-6. Dourado VZ, Tanni SE, Antunes LC, Paiva SA, Campana AO, Renno AC, et al. Effect of three exercise programs on patients with chronic obstructive pulmonary disease. Braz J Med Biol Res. 2009;42(3):263-71.
- Gloeckl R, Heinzelmann I, Baeuerle S, Damm E, Schwedhelm AL, Diril M, et al. Effects of whole body vibration in patients with chronic obstructive pulmonary disease – A randomized controlled trial. Respir Med. 2012;106(1):75-83.
- Gloeckl R, Jarosch I, Bengsch U, Claus M, Schneeberger T, Andrianopoulos V, et al. What’s the secret behind the benefits of whole-body vibration training in patients with COPD? A randomized, controlled trial. Respir Med. 2017;126:17-24.
- Gosselink R, Troosters T, Decramer M. Peripheral muscle weakness contributes to exercise limitation in COPD. Am J Respir Crit Care Med. 1996;153(3):976-80.
- Iepsen UW, Jørgensen KJ, Ringbæk T, Hansen H, Skrubbeltrang C, Lange P. A combination of resistance and endurance training increases leg muscle strength in COPD: An evidence-based recommendation based on systematic review with meta-analyses. Chron Respir Dis. 2015 May;12(2):132-45.
- Klijn P, van Keimpema A, Legemaat M, Gosselink R, van Stel H. Nonlinear exercise training in advanced chronic obstructive pulmonary disease is superior to traditional exercise training. A randomized trial. Am J Respir Crit Care Med. 2013;188(2):193-200.
- Li N, Li P, Lu Y, Wang Z, Li J, Liu X, et al. Effects of resistance training on exercise capacity in elderly patients with chronic obstructive pulmonary disease: a meta-analysis and systematic review. Aging Clin Exp Res. 2019 Sep 7.
- Mador MJ, Bozkanat E, Aggarwal A, Shaffer M, Kufel TJ. Endurance and strength training in patients with COPD. Chest. 2004;125(6):2036-45.
- Man WD, Soliman MG, Gearing J, Radford SG, Rafferty GF, Gray BJ, et al. Symptoms and quadriceps
- fatigability after walking and cycling in chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2003;168(5):562-7.
- McCarthy B, Casey D, Devane D, Murphy K, Murphy E, Lacasse Y. Pulmonary rehabilitation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2015 Feb 23;(2):CD003793.
- Nakamura Y, Tanaka K, Shigematsu R, Nakagaichi M, Inoue M, Homma T. Effects of aerobic training and recreational activities in patients with chronic obstructive pulmonary disease. Int J Rehabil Res. 2008;31(4):275-83.
- Ortega F, Toral J, Cejudo P, Villagomez R, Sánchez H, Castillo J, et al. Comparison of effects of strength and endurance training in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2002;166(5):669-74.
- Panton LB, Golden J, Broeder CE, Browder KD, Cestaro-Seifer DJ, Seifer FD. The effects of resistance training on functional outcomes in patients with chronic obstructive pulmonary disease. Eur J Appl Physiol. 2004;91(4):443-9.
- Pereira AM, Santa-Clara H, Pereira E, Simões S, Remédios I, Cardoso J, et al. Impact of combined exercise on chronic obstructive pulmonary patients’ state of health. Rev Port Pneumol. 2010;16(5):737-57.
- Phillips WT, Benton MJ, Wagner CL, Riley C. The effect of single set resistance training on strength and functional fitness in pulmonary rehabilitation patients. J Cardiopulm Rehabil. 2006 Sep-Oct;26(5):330-7.
- Probst VS, Troosters T, Pitta F, Decramer M, Gosselink R. Cardiopulmonary stress during exercise training in patients with COPD. Eur Respir J. 2006;27(6):1110-8.
- Ries AL, Ellis B, Hawkins RW. Upper extremity exercise training in chronic obstructive pulmonary disease. Chest. 1988;93(4):688-92.
- Robles PG, Mathur S, Janaudis-Fereira T, Dolmage TE, Goldstein RS, Brooks D. Measurement of peripheral muscle strength in individuals with chronic obstructive pulmonary disease: a systematic review. J Cardiopulm Rehabil Prev. 2011;31(1):11-24.
- Seymour JM, Spruit MA, Hopkinson NS, Natanek SA, Man WD, Jackson A, et al. The prevalence of quadriceps weakness in COPD and the relationship with disease severity. Eur Respir J. 2010;36(1):81-8.
- Sillen MJ, Janssen PP, Akkermans MA, Wouters EF, Spruit MA. The metabolic response during resistance training and neuromuscular electrical stimulation (NMES) in patients with COPD, a pilot study. Respir Med. 2008 May;102(5):786-9.
- Singer J, Yelin EH, Katz PP, Sanchez G, Iribarren C, Eisner MD, et al. Respiratory and skeletal muscle strength in chronic obstructive pulmonary disease: impact on exercise capacity and lower extremity function. J Cardiopulm Rehabil Prev. 2011;31(2):111-9.
- Spielmanns M, Gloeckl R, Gropp JM, Nell C, Koczulla AR, Boeselt T, et al. Whole-body vibration training during a low frequency outpatient exercise training program in chronic obstructive pulmonary disease patients: a randomized, controlled trial. J Clin Med Res. 2017;9(5):396-402.
- Spruit MA, Gosselink R, Troosters T, Kasran A, Gayan-Ramirez G, Bogaerts P, et al. Muscle force during an acute exacerbation in hospitalized patients with COPD and its relationship with CXCL8 and IGF-I. Thorax. 2003;58(9):752-6.
- Vonbank K, Strasser B, Mondrzyk J, Marzluf BA, Richter B, Losch S, et al. Strength training increases maximum working capacity in patients with COPD – randomized clinical trial comparing three training modalities. Respir Med. 2012;106(4):557-63.
- Würtemberger G, Bastian K. (Functional effects of different training in patients with COPD). Pneumologie. 2001;55(12):553-62. German.
- Zhou J, Pang L, Chen N, Wang Z, Wang C, Hai Y, et al. Whole-body vibration training – better care for COPD patients: a systematic review and meta-analysis. Int J Chron Obstruct Pulmon Dis. 2018;13:3243-54.
C.3.3 Hydrotherapie
Bied fysieke training in de vorm van hydrotherapie bij voorkeur niet aan bij patiënten met COPD. Overweeg hydrotherapie enkel indien:
- de patiënt bijkomende fysieke problemen ervaart die de conventionele fysieke training ernstig beperken, zoals gewrichtsartrose en/of uitgesproken zwaarlijvigheid en/of
- de patiënt een sterke voorkeur heeft voor fysieke training in de vorm van hydrotherapie.
Toelichting
Uitgangsvraag
Heeft hydrotherapie bij patiënten met COPD meerwaarde ten opzichte van conservatieve therapie ter verbetering van de fysieke capaciteit?
Aanleiding
Hydrotherapie is het doen van fysieke training (duur-, interval-, en/of krachttraining) in het zwembad. Mede door de opwaartse druk van het water kan hydrotherapie voordelig zijn voor patiënten met bijkomende fysieke problemen, zoals gewrichtsartrose en/of uitgesproken zwaarlijvigheid (McNamara 2013b).
Literatuur
Hydrotherapie verbetert de fysieke capaciteit bij patiënten met COPD in nagenoeg gelijke mate als training op het land (McNamara 2013a).
Overwegingen
In het algemeen zijn de effecten van hydrotherapie gelijk aan die van training op het land en zodoende wegen deze effecten niet op tegen de kosten en de praktische bezwaren van hydrotherapie. Alleen bij patiënten met bijkomende fysieke problemen die de conventionele training op het land ernstig beperken, zoals gewrichtsartrose en/of uitgesproken zwaarlijvigheid, kan hydrotherapie van toegevoegde waarde zijn. Daarnaast kunnen patiënten een sterke voorkeur hebben voor fysieke training in de vorm van hydrotherapie.
Literatuur
Voor het beantwoorden van deze uitgangsvraag is het systematisch literatuuronderzoek van McNamara 2013a overgenomen.
Zoeken en selecteren
In overleg met de werkgroep en de klankbordgroep is besloten geen update uit te voeren van het systematisch literatuuronderzoek (McNamara 2013a).
Samenvatting literatuur
In het systematisch literatuuronderzoek van McNamara 2013a werden vijf (quasi-)gerandomiseerde gecontroleerde studies (RCT’s) geïncludeerd met in totaal 176 patiënten. Vier van deze studies vergeleken hydrotherapie met training op land.
De meta-analyse van deze studies toont geen verschillen aan in kwaliteit van leven, die hier is gemeten met de ‘St George’s Respiratory Questionnaire’ (SGRQ) en de ‘Chronic Respiratory (Disease) Questionnaire’ (CRDQ) (SMD = -0,14; 95%-BI = -0,57 tot 0,28; n = 89; lage bewijskracht).
Ook is er geen verschil in fysieke capaciteit gemeten met de Zes Minuten Wandeltest (6MWT) (MD = 11 meter; 95%-BI = -11 tot 33; n = 62; de bewijskracht is matig) of de ‘Incremental shuttle walk test’ (ISWT; MD = 9 meter; 95%-BI = -15 tot 34; n = 59; de bewijskracht is laag), maar wel als de fysieke capaciteit wordt gemeten met ‘Endurance shuttle walk test’ (ESWT; MD = 313 m; 95%-BI = 232 tot 394; n = 59; de bewijskracht is matig). In twee studies (n = 20) zijn ongewenste voorvallen gerapporteerd. In deze studies is één niet-ernstig voorval beschreven bij hydrotherapie.
Overwegingen
De effecten van hydrotherapie zijn doorgaans gelijk aan die van landtraining. De kosten van een zwembad zijn hoog in aanschaf en onderhoud. Daarnaast zijn er praktische bezwaren, zoals de ruimte die een zwembad met bijbehorende faciliteiten inneemt en de tijd die het patiënten kost om met de training te starten. Voor patiënten met COPD is hydrotherapie echter een acceptabele trainingsvorm (McNamara 2015). Omdat de juiste faciliteiten niet zomaar voorhanden zijn, wordt hydrotherapie momenteel echter nauwelijks ingezet (Spruit 2014). In zijn algemeenheid wegen de voordelen van hydrotherapie niet op tegen de kosten en praktische bezwaren ervan. Hydrotherapie valt alleen te overwegen bij patiënten met bijkomende fysieke problemen die de conventionele training op het land ernstig beperken, zoals gewrichtsartrose en/of uitgesproken zwaarlijvigheid en/of als de patiënt een sterke voorkeur heeft voor fysieke training in de vorm van hydrotherapie.
De overwegingen en aanbevelingen komen voort uit de discussies die in de werkgroep zijn gevoerd aan de hand van het evidence-to-decisionformulier. Zie bijlage C.3.3 (opent in nieuw tabblad).
- McNamara RJ, McKeough ZJ, McKenzie DK, Alison JA. Acceptability of the aquatic environment for exercise training by people with chronic obstructive pulmonary disease with physical comorbidities: Additional results from a randomised controlled trial. Physiotherapy. 2015;101(2):187-92.
- McNamara RJ, McKeough ZJ, McKenzie DK, Alison JA. Water-based exercise training for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2013a;(12):CD008290.
- McNamara RJ, McKeough ZJ, McKenzie DK, Alison JA. Water-based exercise in COPD with physical comorbidities: a randomised controlled trial. Eur Respir J. 2013b;41(6):1284-91.
- Spruit MA, Pitta F, Garvey C, ZuWallack RL, Roberts CM, Collins EG, et al. Differences in content and organisational aspects of pulmonary rehabilitation programmes. Eur Respir J. 014;43(5):1326-37.
C.3.4 Trainen in relatie tot zuurstofdesaturatie
Meet de zuurstofsaturatie met een transcutane SpO2-meter (saturatiemeter).
Start de fysieke test of oefentherapie enkel bij een transcutaan gemeten rust-SpO2 ≥ 90%.
Neem contact op met de verwijzer indien de transcutaan gemeten rust-SpO2 na 10 minuten zitten voordat de patiënt met COPD aan een fysieke test of oefentherapie begint, nog steeds < 90% is.
Stop de fysieke test of oefentherapie bij transcutaan gemeten SpO2 < 85% en neem contact op met de verwijzer.
Monitor bij SpO2-waarden van < 90% tijdens fysieke inspanning het SpO2-herstel na het beëindigen van de fysieke test of oefentherapie. Neem contact op met de verwijzer indien de transcutaan gemeten SpO2 in de herstelfase (2 minuten na de fysieke inspanning) zich onvoldoende herstelt (= pre-inspanningsrust-SpO2).
Toelichting
Uitgangsvraag
De uitgangsvraag is opgedeeld in de volgende subvragen:
- Wat is de minimale transcutaan gemeten rust-SpO2 waarmee een patiënt met COPD mag beginnen met een fysieke test of oefentherapie?
- In hoeverre is medische zuurstofsuppletie bij patiënten met COPD zinvol tijdens een fysieke test of oefentherapie?
- Bij welke transcutaan gemeten SpO2 wordt de fysieke test of oefentherapie gestopt?
Aanleiding
Tijdens fysieke tests of oefentherapie daalt de transcutaan gemeten SpO2 bij 30 tot 40% van de patiënten met COPD (Andrianopoulos 2014, 2016). Deze daling kan ook optreden bij patiënten met een normale arteriële zuurstofspanning in rust (Andrianopoulos 2014). De ervaren mate van kortademigheid en de mate van zuurstofdesaturatie komen heel beperkt overeen. Hierdoor voelen patiënten een door inspanning geïnduceerde zuurstofdesaturatie over het algemeen zelf niet. De SpO2 dient daarom te worden gemeten met een transcutane SpO2-meter (zie B.3.1 ‘Aanbevolen en optionele meetinstrumenten’).
Alhoewel de transcutaan gemeten SpO2 van patiënten met COPD vaak tijdens fysieke tests en oefentherapie wordt gemeten, lijkt een door inspanning geïnduceerde zuurstofdesaturatie bij klinische stabiele patiënten met COPD niet te leiden tot een slechtere algehele gezondheidstoestand (Afzal 2018). Toch vinden therapeuten en patiënten het wenselijk om regelmatig de transcutaan gemeten SpO2 te meten tijdens fysieke inspanning. Het is echter onduidelijk hoe moet worden omgegaan met zuurstofdesaturatie bij fysieke inspanning.
1 Wat is de minimale transcutaan gemeten rust-SpO2 waarmee een patiënt mag beginnen met een fysieke test of oefentherapie?
Literatuur
Een narratief literatuuronderzoek leverde geen studies op naar de effecten van de SpO2-rustwaarde voorafgaand aan inspanning die bijdragen aan de beantwoording van deze subvraag.
Overwegingen
Een door inspanning geïnduceerde SpO2-daling kan de fysieke capaciteit bij patiënten met COPD verminderen en een verlaagde rust-SpO2 vergroot de kans op een door inspanning geïnduceerde SpO2-daling (Andrianopoulos 2016). De fysieke test of oefentherapie dient daarom enkel gestart te worden bij een transcutaan gemeten rust-SpO2 ≥ 90% (ERS/ATS 2014). Indien de transcutaan gemeten rust-SpO2 na 10 minuten zitten nog steeds < 90% is, dient contact opgenomen te worden met de behandelend arts voordat de patiënt met COPD aan een fysieke test of oefentherapie begint.
2 In hoeverre is medische zuurstofsuppletie bij patiënten met COPD zinvol tijdens een fysieke test of oefentherapie?
Literatuur
Bij patiënten met COPD en hypoxemie (PaO2 < 8,0 kPa) in rust, en bij patiënten met door inspanning geïnduceerde zuurstofdesaturatie, kan medische zuurstofsuppletie het inspanningsvermogen direct vergroten (Jarosch 2017). Echter, gebruik van medische zuurstofsuppletie tijdens fysieke training bij patiënten met COPD met een door inspanning geïnduceerde zuurstofdesaturatie lijkt niet te resulteren in een grotere toename van het inspanningsvermogen ten opzichte van fysieke training met kamerlucht (Alison 2019; Nonoyama 2007).
Overwegingen
Medische zuurstoftherapie bij patiënten met COPD kan enkel worden toegepast na afstemming met de behandelend arts. Zuurstofsuppletie bij patiënten met chronische hypoxemie kan namelijk leiden tot hypercapnie (of het verergeren daarvan), omdat zuurstofsuppletie de ademprikkel (‘hypoxic drive’) bij deze patiënten vermindert en leidt tot toename van de V/Q-mismatch (‘hypoxic vasocontstriction’) (Abdo 2012). Alhoewel een te grote daling in SpO2 de fysieke capaciteit van patiënten met COPD kan beperken, volbrengt het merendeel van de patiënten met COPD de oefentherapie veilig wanneer ze in lichte mate desatureren (Alison 2019; Walsh 2019).
Daarom dient bij patiënten met COPD die tijdens een fysieke test of oefentherapie een transcutaan gemeten SpO2 < 85% hebben en geen chronische zuurstoftherapie hebben, contact opgenomen te worden met de behandelend arts om het eventuele gebruik van medische zuurstofsuppletie tijdens fysieke inspanning te bespreken.
Medische zuurstofsuppletie voorkomt niet bij alle patiënten met COPD een daling van de SpO2 tijdens fysieke inspanning (Dyer 2012; Jarosch 2017). Daarom dient de submaximale inspanningstest op 75% van de maximale fietsbelasting eenmaal met en eenmaal zonder medische zuurstofsuppletie te worden gedaan. Als de medische zuurstofsuppletie leidt tot een hogere rust-SpO2 en een kleinere of helemaal geen daling van de transcutaan gemeten SpO2, lijkt het gebruik van medische zuurstofsuppletie geïndiceerd. Ook dient er contact opgenomen te worden met de behandelend arts indien patiënten met chronische zuurstoftherapie tijdens de fysieke test of oefentherapie een transcutaan gemeten SpO2 hebben van < 85%, om te bespreken of de medische zuurstofsuppletie tijdens fysieke inspanning eventueel verhoogd kan worden.
3 Bij welke transcutaan gemeten SpO2 dient de fysieke test of oefentherapie te worden gestopt?
Literatuur
Een narratief literatuuronderzoek leverde geen studies op naar zuurstofdesaturatie tijdens inspanning die bijdragen aan de beantwoording van deze subvraag.
Overwegingen
Een door inspanning geïnduceerde SpO2-daling kan leiden tot een beperking van de fysieke capaciteit. Vermoed wordt dat langdurige, extreme SpO2-daling en de daarmee gepaard gaande ernstige desaturatie, kan leiden tot cardiale ischemie en hartritmestoornissen (Walsh 2019). Daarom dient de fysieke test of oefentherapie bij een transcutaan gemeten SpO2 van < 85% gestopt te worden en contact opgenomen te worden met de verwijzer.
Een door inspanning geïnduceerde daling van de transcutaan gemeten SpO2 is niet direct een reden om de fysieke inspanning te stoppen zolang deze ≥ 85% blijft. Echter, bij SpO2-waarden van < 90% tijdens fysieke inspanning dient wel het SpO2-herstel na het beëindigen van de fysieke test of oefentherapie gemonitord te worden. Met de behandelend arts wordt contact opgenomen indien de transcutaan gemeten SpO2 in de herstelfase (2 minuten na de fysieke inspanning) zich onvoldoende herstelt (= pre-inspanningsrust-SpO2).
Literatuur
Voor het beantwoorden van de drie subvragen is in overleg met de werkgroep en de klankbordgroep besloten geen systematisch literatuuronderzoek uit te voeren.
- Abdo WF, Heunks LM. Oxygen-induced hypercapnia in COPD: myths and facts. Crit Care. 2012;16(5):323.
- Afzal S, Burge AT, Lee AL, Bondarenko J, Holland AE. Should the 6-Minute Walk Test Be Stopped If Oxyhemoglobin Saturation Falls Below 80%? Arch Phys Med Rehabil. 2018;99(11):2370-2.
- Alison JA, McKeough ZJ, Leung RWM, Holland AE, Hill K, Morris NR, et al. Oxygen compared to air during exercise training in COPD with exercise-induced desaturation. Eur Respir J. 2019 May 30;53(5).
- Andrianopoulos V, Celli BR, Franssen FM, Pinto-Plata VM, Calverley PM, Vanfleteren LE, et al. Determinants of exercise-induced oxygen desaturation including pulmonary emphysema in COPD: results from the ECLIPSE study. Respir Med. 2016;119:87-95.
- Andrianopoulos V, Franssen FM, Peeters JP, Ubachs TJ, Bukari H, Groenen M, et al. Exercise-induced oxygen desaturation in COPD patients without resting hypoxemia. Respir Physiol Neurobiol. 2014;190:40-6.
- Dyer F, Callaghan J, Cheema K, Bott J. Ambulatory oxygen improves the effectiveness of pulmonary rehabilitation in selected patients with chronic obstructive pulmonary disease. Chron Respir Dis. 2012;9(2):83-91.
- ERS/ATS. An official European Respiratory Society/American Thoracic Society technical standard: field walking tests in chronic respiratory disease. Eur Resp J. 2014;44(6):1428-46.
- Jarosch I, Gloeckl R, Damm E, Schwedhelm AL, Buhrow D, Jerrentrup A, et al. Short-term effects of supplemental oxygen on 6-min walk test outcomes in patients with COPD: a randomized, placebo-controlled, single-blind, crossover trial. Chest. 2017;151(4):795-803.
- Nonoyama ML, Brooks D, Lacasse Y, Guyatt GH, Goldstein RS. Oxygen therapy during exercise training in chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2007;(2):CD005372.
- Walsh JA, Maddocks M, Man WD. Supplemental oxygen during exercise training in COPD: full of hot air? Eur Respir J. 2019;53(5).
C.3.5 Neuromusculaire elektrostimulatie
Behandel patiënten met stabiel COPD niet met neuromusculaire elektrostimulatie (NMES) wanneer ze in staat zijn om zelf fysieke training uit te voeren.
Overweeg (verwijzing voor) behandeling met NMES wanneer patiënten met stabiel COPD gedurende langere tijd niet in staat zijn om zelf fysieke training uit te voeren.
Deze benadering kan bijvoorbeeld worden toegepast bij patiënten met een hele hoge mate van kortademigheid bij aan- en uitkleden in combinatie met verzwakte beenspieren, bij patiënten met orthopedische klachten, bij bedlegerigheid en/of bij patiënten met een ernstige COPD-longaanval.
Overweeg bij patiënten die vanwege een COPD-longaanval zijn opgenomen in het ziekenhuis NMES-behandeling in combinatie met mobilisatieoefeningen.
Pas NMES-behandeling toe bij patiënten die aan de beademing liggen, langdurig bedlegerig zijn en/of bij ernstig verzwakte patiënten die moeilijk te mobiliseren zijn.
Indien behandeling met NMES is aangewezen, pas deze dan als volgt toe:
- stimuleer ten minste de mm. quadriceps femoris
- plaats bij voorkeur grote, rubberen elektroden zover mogelijk uit elkaar op de spierbuik
- gebruik een rechthoekpuls met een frequentie van minimaal 35 Hz en een pulsduur van minimaal 300 µs in een serietijd met een verhouding van 1:1 tot 1:2
- stel de intensiteit (pulsamplitude) zo hoog dat de contractie zichtbaar en/of voelbaar is, bij voorkeur tot maximale tolerantiegrens zonder pijn
- stimuleer ten minste 15 minuten per sessie gedurende minimaal vier weken, met een behandelfrequentie van drie keer per week
- combineer NMES waar mogelijk met actieve oefeningen
Toelichting
Uitgangsvraag
- Wanneer dient behandeling met neuromusculaire elektrostimulatie (NMES) plaats te vinden bij patiënten met COPD?
- Op welke wijze dient NMES toegepast te worden bij patiënten met COPD?
Aanleiding
Hoewel het positieve effect van oefentherapie voor patiënten met COPD algemeen bekend is, zijn niet alle patiënten met COPD tot reguliere fysieke training in staat vanwege bijvoorbeeld zeer ernstige kortademigheid of omdat ze bedlegerig zijn bij (invasieve) beademing. Mogelijk kan behandeling met neuromusculaire elektrostimulatie (NMES) het fysiek functioneren en de kwaliteit van leven van deze patiënten verbeteren.
1 Wanneer dient behandeling met neuromusculaire elektrostimulatie (NMES) plaats te vinden bij patiënten met COPD?
Literatuur
Bij patiënten met stabiel COPD heeft NMES in combinatie met oefentherapie nauwelijks toegevoegde waarde in vergelijking met oefentherapie zonder NMES (lage tot zeer lage bewijskracht).
Bij patiënten met stabiel COPD die niet fysieke trainen leidt behandeling met NMES tot zeer grote verbetering van het functioneel inspanningsvermogen en een kleine verbetering van de perifere spierkracht in vergelijking met gebruikelijke zorg (lage bewijskracht). Bij patiënten met COPD die vanwege een longaanval zijn opgenomen in het ziekenhuis leidt de combinatie van NMES en mobilisatieoefeningen tot zeer grote verbetering van het fysiek functioneren, het inspanningsvermogen en de perifere spierkracht en een grote vermindering van kortademigheid (laag tot zeer lage bewijskracht).
Er zijn geen aanwijzingen voor een verhoogd risico op mortaliteit (matige bewijskracht) of ongewenste voorvallen die gerelateerd zijn aan de behandeling met NMES (lage bewijskracht).
Overwegingen
Bij patiënten die opgenomen zijn in het ziekenhuis, zijn de effecten van NMES groot en waardevol. Ook bij patiënten met stabiel COPD die niet in staat zijn tot fysieke training kan NMES mogelijk van waarde zijn. De behandeling met NMES is niet pijnlijk en goed aanvaardbaar voor patiënten. De benodigde apparatuur is in de meeste revalidatiecentra en ziekenhuizen en in sommige eerstelijnspraktijken reeds aanwezig.
2 Op welke wijze dient NMES toegepast te worden bij patiënten met COPD?
Bij NMES worden bij voorkeur grote, rubberen elektroden in combinatie met sponsjes en klittenbanden gebruikt (Lieber 1991). De mm. quadriceps femoris wordt gestimuleerd, eventueel in combinatie met de hamstrings of de mm. gastrocnemii. De elektroden worden zover mogelijk uit elkaar op de spierbuik geplaatst, bij voorkeur op de motorische prikkelpunten. Een bifasische rechthoekpuls wordt gebruikt, met een frequentie van minimaal 35 Hz gedurende minimaal 300 µs in een serietijd met een verhouding van 1:1 tot 1:2. De intensiteit (pulseamplitude) moet minimaal leiden tot een zichtbare en/of voelbare contractie, bij voorkeur tot de maximale tolerantiegrens zonder pijn. De duur van de stimulatie is ten minste 15 minuten en wordt minimaal vier weken toegepast met een behandelfrequentie van drie keer per week (Herzig 2015; Maffiuletti 2018; Vivodtzez 2008).
Parameters voor optimale stimulatie
- golfvorm rechthoekpuls
- frequentie minimaal 35 Hz
- pulsduur minimaal 300 µs
- intensiteit maximale tolerantie of bij zichtbare en duidelijk voelbare contractie
- duur van de sessie: minimaal 15 min
- aantal trainingssessies: minimaal 12 sessies
- serietijd (op/af):
- op = minimaal 5 sec. op
- af = maximaal tweemaal zo lang als ‘op’
Om de eerste uitgangsvraag te kunnen beantwoorden, is er een systematische literatuuranalyse verricht naar de volgende reviewvragen (PICO):
- Wat zijn de effecten van behandeling met NMES (‘stand alone’) bij patiënten met stabiel COPD zonder oefentherapie?
- Wat zijn de effecten van behandeling met NMES (‘add on’) bij patiënten met stabiel COPD in aanvulling op de oefentherapie?
- Wat zijn de effecten van behandeling met NMES bij patiënten die met een COPD-longaanval zijn opgenomen in het ziekenhuis (IC of HC)?
Uitkomstmaten
Kwaliteit van leven, fysiek functioneren (bijv. de tijd tot het behalen van specifieke mijlpalen op het gebied van mobiliteit), kortademigheid, (functioneel) inspanningsvermogen, perifere spierkracht, opnameduur (indien van toepassing), mortaliteit en ongewenst voorvallen zijn aangemerkt als patiëntrelevant en cruciaal voor de besluitvorming.
Zoeken en selecteren
Zoekactie
Door middel van een systematische zoekactie is op 7 juni 2018 met relevante zoektermen gezocht naar gerandomiseerde gecontroleerde studies (RCT’s) in onder meer de databases ‘PubMed’, ‘EMBASE’, ‘CENTRAL’, ‘Cochrane Library’, ‘Web of Science’, ‘PeDRO’, ‘Psychinfo’ en ‘EmCare’. De verantwoording van de zoekactie is opgenomen in bijlage C.3.5 (opent in nieuw tabblad).
Literatuurselectie
De studies werden geselecteerd op grond van de volgende selectiecriteria: RCT, gepubliceerd in de Engelse of Nederlandse taal, naar de gewenste effecten (kwaliteit van leven, (functioneel) inspanningsvermogen) en/of ongewenste effecten (ongewenste voorvallen en mortaliteit) van NMES (NMES als op zichzelf staande interventie of in combinatie met oefentherapie (‘add-on’)) bij patiënten met COPD in vergelijking met gebruikelijke zorg (zonder oefentherapie) of alleen oefentherapie.
De recente literatuurstudie van Hill (2018) naar de effectiviteit van NMES bij mensen met COPD is als uitgangspunt gebruikt. De 16 RCT’s binnen deze review zijn allemaal getoetst aan de selectiecriteria van deze uitgangsvraag. Eén studie rapporteerde geen relevante uitkomstmaten (Giavedon 2012) en is zodoende niet geïncludeerd. De overige 15 studies zijn wel in de literatuuranalyse opgenomen.
De literatuurzoekactie leverde nog eens 115 treffers op. De artikelen die werden gepubliceerd vanaf maart 2018 zijn getoetst aan de selectiecriteria op basis van titel, abstract en volledige tekst. Bij deze update is één artikel (Bonnevie 2018) toegevoegd aan de review. Het totale aantal studies in deze literatuuranalyse komt daarmee op 16.
De artikelen die op basis van de volledige tekst zijn geëxcludeerd en de reden van exclusie zijn opgenomen in de bijlagen (opent in nieuw tabblad).
Samenvatting literatuur
Beschrijving studies
De literatuuranalyse van de 16 studies betrof in totaal 329 patiënten met COPD. De gemiddelde leeftijd van de patiënten varieerde tussen de 56 en 76 jaar. De effectiviteit van NMES is onderzocht bij zowel patiënten met een stabiel ziektebeeld (13 studies) als bij patiënten die vanwege een longaanval zijn opgenomen in het ziekenhuis (3 studies).
In 13 van de 16 studies was sprake van een stabiel ziektebeeld bij de patiënten met COPD. NMES werd in deze studies in verschillende settings toegepast: in de thuissituatie (Akinlabi 2013; Bonnevie 2018; Latimer 2013; Maddocks 2016; Tardif 2015; Vieira 2014; Vivodtzev 2012), zowel poliklinisch als thuis (Neder 2002), poliklinisch (Bourjeily-Habr 2002; Dang 2011; Tasdemir 2015), of binnen intramurale revalidatie (Kucio 2016; Vivodtzev 2006). Zes van de 13 studies onderzochten de effectiviteit van NMES als ‘stand alone’-interventie in vergelijking met gebruikelijke medische zorg (Bourjeily-Habr 2002; Latimer 2013; Maddocks 2016; Neder 2002; Vieira 2014; Vivodtzev 2012). In de overige zeven studies werd de effectiviteit van NMES als een toevoeging (‘add-on’) aan oefentherapie onderzocht en vergeleken met oefentherapie zonder NMES (Akinlabi 2013; Dang 2011; Kucio 2016; Tardif 2015; Tasdemir 2015; Vivodtzev 2006; Bonnevie 2018). De toepassing van NMES als ‘stand alone’-interventie en als ‘add-on’-interventie in combinatie met oefentherapie zijn apart geanalyseerd.
Drie van de 16 studies onderzochten de effectiviteit van NMES bij patiënten met COPD die vanwege een longaanval waren opgenomen op de intensive care (IC; Abdellaoui 2011; Akar 2017) of na IC-opname waren opgenomen op de high care (HC; Zanotti 2003). In twee studies werden de patiënten invasief beademd (Akar 2017; Zanotti 2003). De studie van Abdellaoui (2011) betrof patiënten die zowel zuurstofsuppletie, niet-invasieve ventilatie als invasieve ventilatie ontvingen. In de studies van Akar (2017) en Zanotti (2003) werd mobilisatie met NMES vergeleken met actieve mobilisatie zonder NMES. In de studie van Abdellaoui (2011) werd actieve- passieve mobilisatie met NMES vergeleken met actieve-passieve mobilisatie met placebo-NMES onder veelal bedlegerige patiënten met ernstig verzwakte spierfunctie, ernstige functionele beperkingen en een lange periode van immobiliteit. Gezien de kwetsbare gezondheid, verslechterde conditie, duidelijke spieratrofie en langdurige bedlegerigheid van deze patiënten werden de resultaten van deze drie studies apart geanalyseerd. In één studie ontvingen alle deelnemers unilaterale NMES en diende het andere been (zonder NMES) als controlebeen (Latimer 2013). Deze studie randomiseerde dan ook per been in plaats van per deelnemer. In de overige studies werden de deelnemers gerandomiseerd en ontvingen deze in de interventiegroep bilaterale NMES. Alle studies stimuleerden de mm. quadriceps femoris, soms in combinatie met de hamstrings (Abdellaoui 2011; Akinlabi 2013), de kuitspieren (Kucio 2016), de hamstrings én de kuitspieren (Bourjeily-Habr 2002; Vivodtzev 2012) of de mm. gluteii (Zanotti 2003). De stimulatiefrequenties waren 35 Hz (Abdellaoui 2011; Bonnevie 2018; Kucio 2016; Tardif 2015; Vivodtzev 2006; Zanotti 2003), 45 Hz (Dang 2011) en 50 Hz (Akar 2017; Akinlabi 2013; Bourjeily-Habr 2002; Latimer 2013; Maddocks 2016; Neder 2002; Tasdemir 2015; Vieira 2014; Vivodtzev 2012). De pulseduur varieerde tussen de 200 µs (Bourjeily-Habr 2002) en 400 µs (Abdellaoui 2011; Bonnevie 2018; Vivodtzev 2006, 2012).
Er waren 11 studies die informatie rapporteerden over de serietijd; deze informatie werd niet beschreven in de studies van Abdellaoui (2011), Akinlabi (2013), Tardif (2015) en Zanotti (2003). In drie studies (Maddocks 2016; Neder 2002; Vieira 2014) was er geen vaste serietijd, maar liep de serietijd op gedurende de studieperiode: van 2 sec stimulatie en 15 of 18 sec rust in de eerste week, naar 10 sec stimulatie en 15 sec of 30 sec rust in de derde week. In de overige studies was er de gehele studieperiode eenzelfde serietijd. Deze serietijd varieerde van heel korte cycli zoals 0,5 sec stimulatie en 1,5 sec rust in de studie van Bonnevie (2018) en 2 sec stimulatie en 4 sec rust in de studie van Kucio (2016) tot langere cycli zoals 10 sec stimulatie en 20 sec rust in de studie van Tasdemir (2015) en 15 sec stimulatie en 5 sec rust in de studie van Latimer (2013).
De intensiteit van de stimulatie was in de meeste studies ingesteld op de maximale stroom die de patiënt aanvaardbaar vond. In één studie was de intensiteit voldoende voor het opwekken van een spiercontractie en die intensiteit nam met 5 mA per week toe (Bourjeily-Habr 2002); in een andere studie was de ingestelde intensiteit gelijk aan een spiercontractie die overeenkomt met 15 tot 25% van de maximale vrijwillige contractie (Maddocks 2016).
De meeste studies stimuleerden de spieren een- of tweemaal per dag gedurende 30 tot 60 minuten, drie tot zeven dagen per week gedurende vier tot acht weken.
Een gedetailleerd overzicht van de geïncludeerde studies is online beschikbaar als ‘Bijlage Evidencetabellen (opent in nieuw tabblad)’.
Individuele studiekwaliteit
De opzet en uitvoering van de individuele studies (‘risk of bias’; RoB) is beoordeeld met behulp van de ‘Cochrane Risk-of-Biastool’. Het ontbreken van blindering van patiënten en zorgpersoneel was hierbij de meest voorkomende potentiële oorzaak van vertekening. Een overzicht van de beoordeling van de studiekwaliteit (RoB) per studie is weergegeven in de volgende tabel.
Risk of bias: NMES
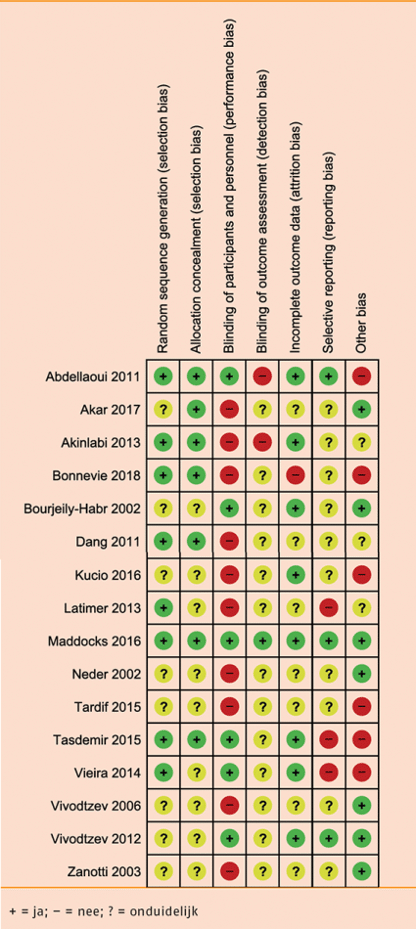
Resultaten en bewijskracht
Hierna worden de resultaten en de bewijskracht beschreven van:
- NMES zonder oefentherapie (‘stand alone’) bij patiënten met stabiel COPD in vergelijking met gebruikelijke zorg
- NMES in combinatie met oefentherapie (‘add on’) in vergelijking met enkel oefentherapie bij patiënten met stabiel COPD
- NMES in combinatie met mobilisatie bij patiënten die met een COPD-longaanval zijn opgenomen in het ziekenhuis (IC of HC)
NMES zonder oefentherapie (‘stand alone’) bij patiënten met stabiel COPD in vergelijking met gebruikelijke zorg
Kwaliteit van leven
Het effect van NMES op de kwaliteit van leven vergeleken met gebruikelijke zorg is gerapporteerd in twee studies (Maddocks 2016; Vieira 2014). Beide studies hebben de ‘St. George’s Respiratory Questionnaire’ (SGRQ) gebruikt. De studies vonden een kleine, klinisch-relevante verbetering van de kwaliteit van leven; de SGRQ-score van patiënten met NMES-behandeling was gemiddeld 4,12 punten lager dan van patiënten die gebruikelijke zorg ontvingen (95%-BI = -12,60 tot 4,35; n = 72). Een verschil van 4 punten wordt internationaal gezien als klinisch-relevant (Jones 2005). Zie de forestplot.
De bewijskracht voor de kwaliteit van leven is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Forestplot van behandeling met NMES (‘stand alone’) bij patiënten met stabiel COPD: kwaliteit van leven
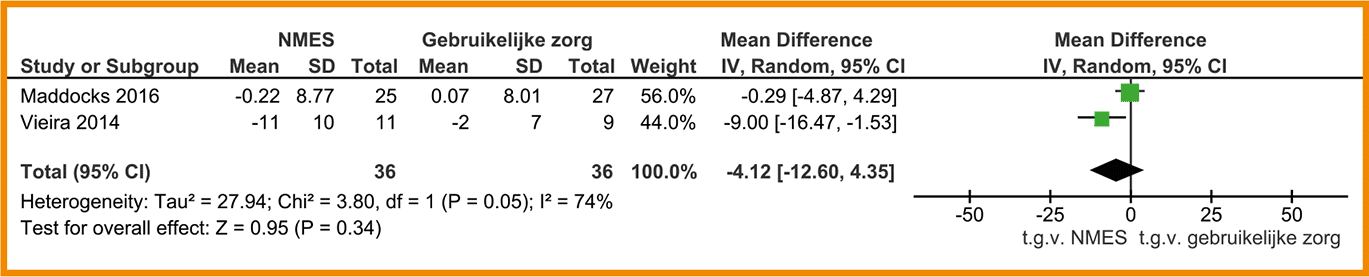
Fysiek functioneren
Effecten van NMES op fysiek functioneren is in geen van de geïncludeerde studies onderzocht.
Kortademigheid
Behandeling met NMES leidt tot een grote vermindering van kortademigheid (Neder 2002; Vieira 2014; Vivodtzev 2012). De effecten van NMES op kortademigheid na afloop van een symptoomgelimiteerde inspanningstest is in alle drie de studies onderzocht met de Borgschaal. Patiënten die waren behandeld met NMES scoorden op de Borgschaal gemiddeld 1,0 punt lager (95%-BI = -2,13 tot 0,06) dan patiënten in de controlegroep.
De studie van Neder (2002) laat tevens een grote, klinisch-relevante vermindering zien van kortademigheid in het dagelijks leven, die in deze studie is gemeten met het domein ‘Dyspneu’ van de ‘Chronic Respiratory Disease Questionnaire’ (CRDQ). Na zes weken behandeling was er gemiddeld 1,2 punten (95%-BI = 0,4 tot 2,0) verschil tussen de groep met NMES en de controlegroep die gebruikelijke zorg kreeg. Een verschil van 0,5 punten per domein wordt gezien als een klinisch-relevante verandering in gezondheidsstatus (Gyatt 1987). Zie de forestplot.
De bewijskracht voor het effect van NMES op kortademigheid is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering, de inconsistentie van de resultaten en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Forestplot van behandeling met NMES (‘stand alone’) bij patiënten met stabiel COPD: kortademigheid
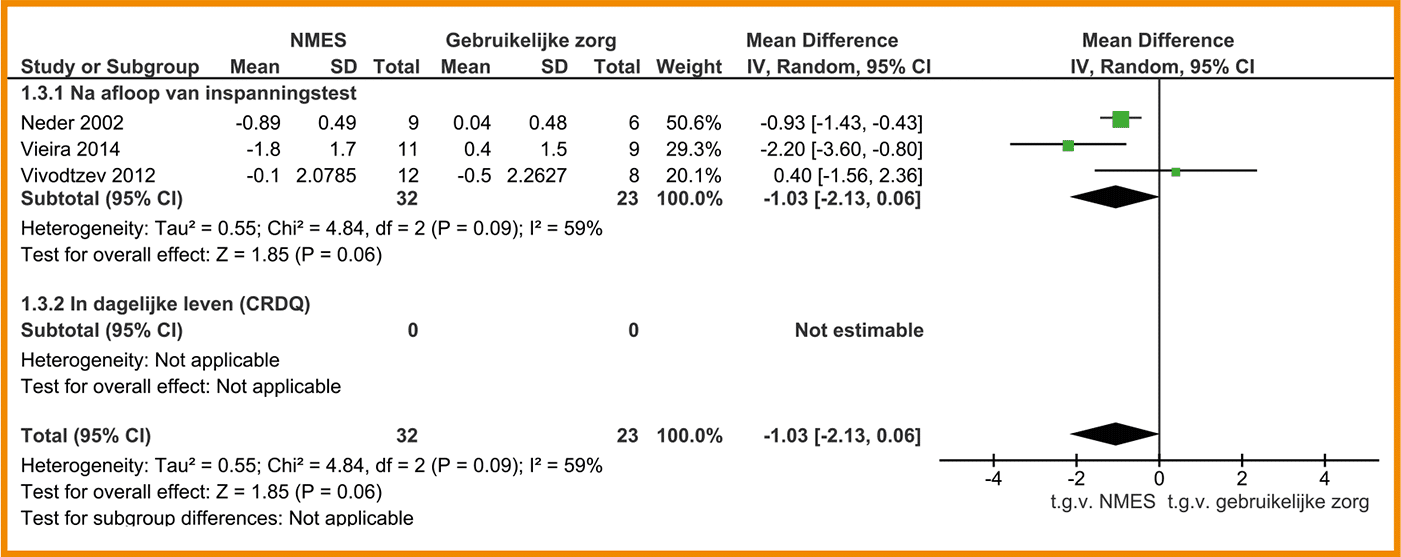
Functioneel inspanningsvermogen
Vijf van de zes studies naar het effect van NMES op het functioneel inspanningsvermogen rapporteren voldoende data voor een meta-analyse. Deze meta-analyse toont een grote tot zeer grote verbetering van het inspanningsvermogen (SMD = 1,20; 95%-BI = 0,64 tot 1,75; n = 127).
Twee van de studies (Maddocks 2016; Vieira 2014) tonen een grote, klinisch-relevante verbetering op de Zes Minuten Wandeltest (6MWT). Patiënten die waren behandeld met NMES liepen gemiddeld 39,3 m verder dan patiënten die geen NMES-behandeling hadden kregen (95%-BI = 16,3 tot 62,2; n = 72). Een verschil van 30 m wordt internationaal gezien als klinisch-relevant (Holland 2015).
Het effect van NMES op het functioneel inspanningsvermogen is in drie studies gemeten met duurtests; de Constant-vermogen-fietstest en de ‘Endurance shuttle walk test’ (ESWT). Patiënten die NMES-behandeling kregen, toonden een zeer grote verbetering op deze tests; zij hielden het gemiddeld 3,62 minuten langer vol (95%-BI = 2,33 tot 4,91; n = 55). Ook Bourjeily-Habr (2002) tonen een significant effect van NMES aan op de fysieke capaciteit, die hier is gemeten met de ‘Incremental Shuttle Walk Test’ (ISWT; n = 18; effectgrootte onbekend: geen data beschikbaar). Zie de forestplot.
De bewijskracht voor functioneel inspanningsvermogen is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Forestplot van behandeling met NMES (‘stand alone’) bij patiënten met stabiel COPD: functioneel inspanningsvermogen
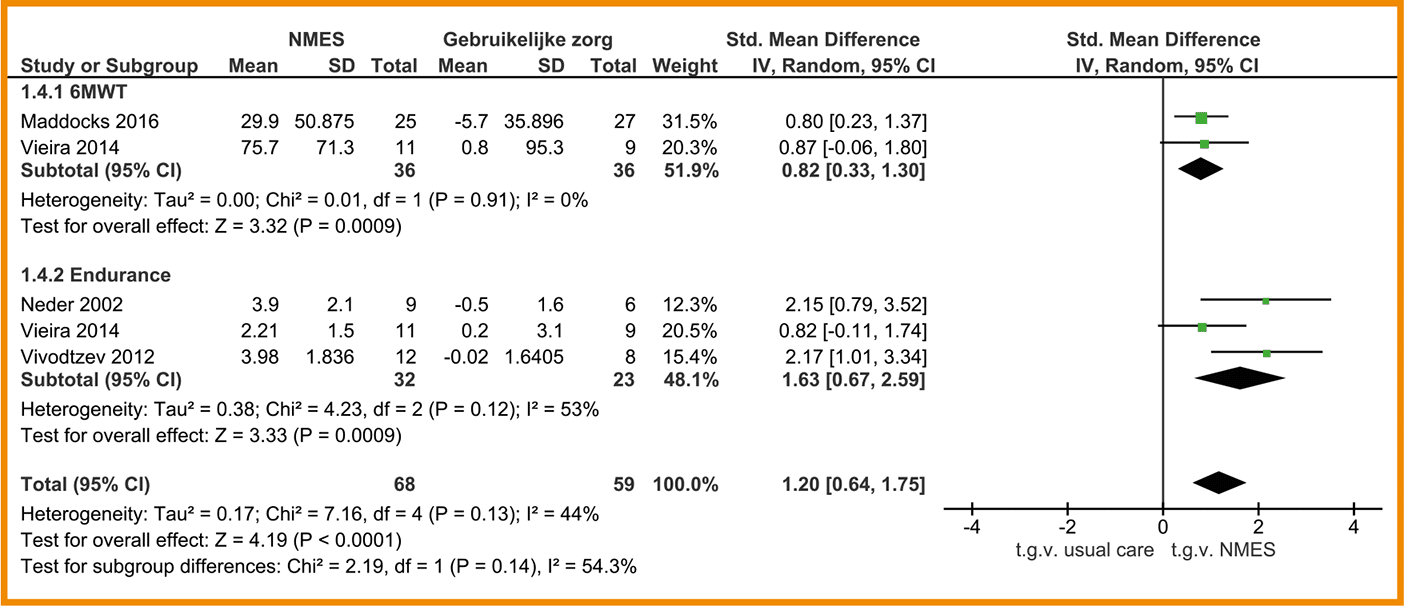
Perifere spierkracht
Vijf studies vinden een kleine toename van kracht van de m. quadriceps na NMES-behandeling (SMD = 0,34; 95%-BI = 0,00 tot 0,68; n = 137). Bourjeily-Habr (2002) toont tevens een toename in kracht van de hamstrings. Zie de forestplot.
De bewijskracht voor het effect op perifere spierkracht is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Forestplot behandeling met NMES (‘stand alone’) bij patiënten met stabiel COPD: perifere spierkracht
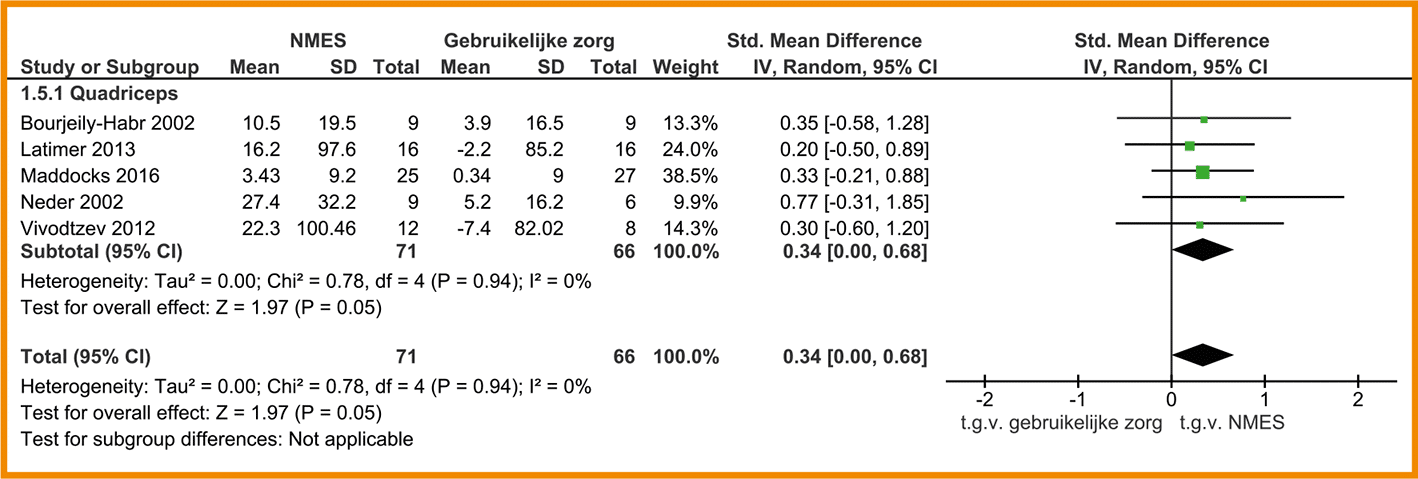
Mortaliteit
Mortaliteit is in 12 studies gerapporteerd. In deze studies is geen risicoverschil (RV) gevonden tussen NMES en gebruikelijke zorg (5 studies; n = 131; RV = -0,02; 95%-BI = -0,08 tot 0,05).
De bewijskracht voor het ernstig ongewenste voorval mortaliteit is met één niveau verlaagd gezien het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op matig.
Ongewenste voorvallen
Uit de vijf studies naar ongewenste voorvallen die zijn gerelateerd aan NMES komt geen verhoogd risico naar voren in vergelijking met gebruikelijke zorg (RV = 0%; 95%-BI = -0,07 tot 0,07; n = 139).
De bewijskracht voor ongewenste voorvallen die zijn gerelateerd aan de interventie is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Een overzicht van de effecten en de bewijskracht op alle uitkomsten is weergegeven in de volgende tabel.
GRADE-evidenceprofiel van behandeling met NMES zonder oefentherapie (‘stand alone’) in vergelijking met gebruikelijke zorg bij patiënten met stabiel COPD
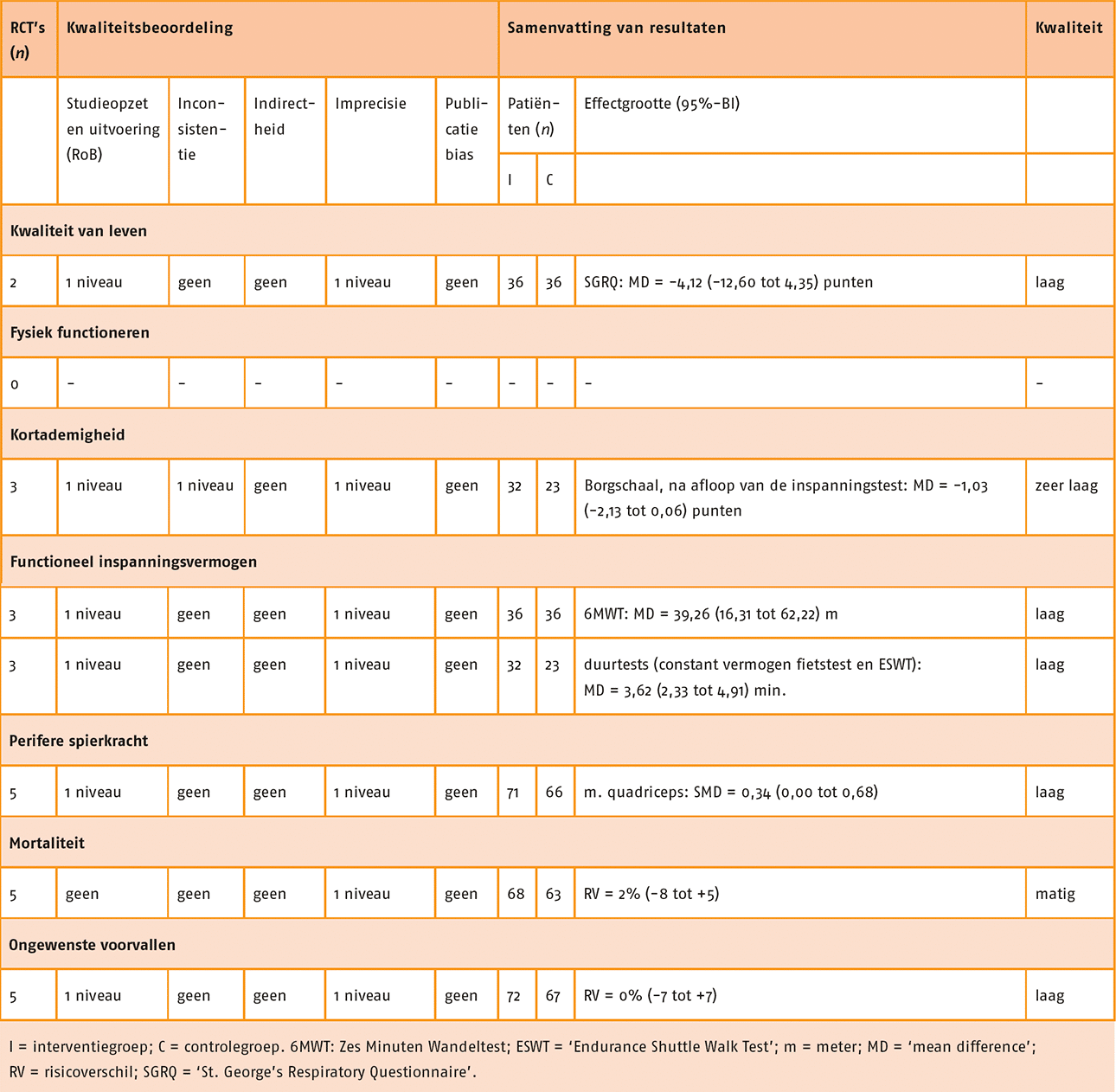
NMES in combinatie met oefentherapie (‘add on’) in vergelijking met enkel oefentherapie bij patiënten met stabiel COPD
Kwaliteit van leven
Het effect van NMES in combinatie met oefentherapie op de kwaliteit van leven is gerapporteerd in vijf studies (Akinlabi 2013; Bonnevie 2018; Dang 2011; Tardif 2015; Vivodtzev 2006). In de studies is de SGRQ (3 studies), gebruikt, de ‘Chronic Respiratory Disease Questionnaire’ (CRDQ) en de ‘Maugeri Respiratory Failure’ (MRF-28). De meta-analyse laat een matig tot groot effect (SMD = -0,55; 95%-BI = -0,96 tot -0,13; n = 146) zien ten gunste van NMES met oefentherapie ten opzichte van enkel oefentherapie. Zie de forestplot.
De bewijskracht voor de kwaliteit van leven is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Forestplot van behandeling met NMES (‘add on’) bij patiënten met stabiel COPD: Kwaliteit van leven
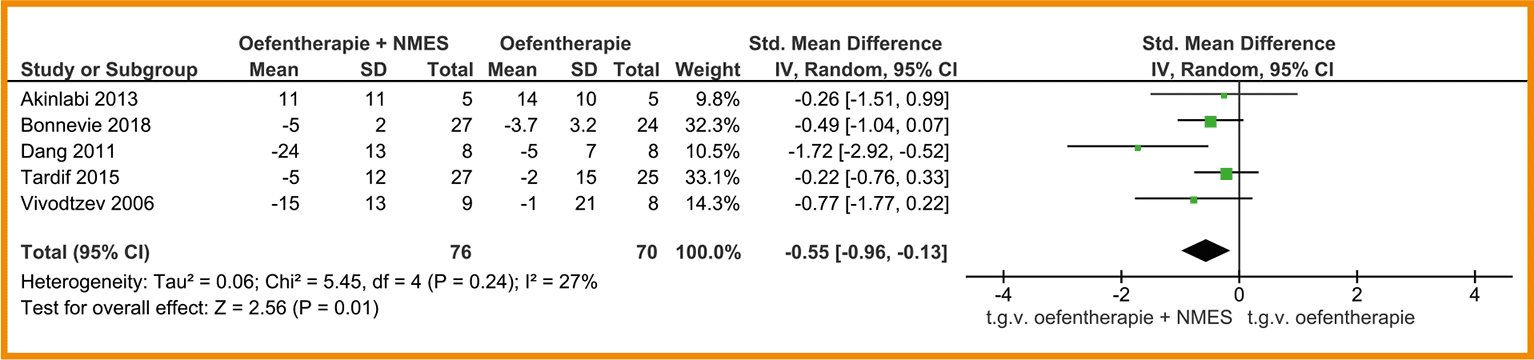
Fysiek functioneren
Effecten van NMES op fysiek functioneren is in geen van de geïncludeerde studies onderzocht.
Kortademigheid
De mate van kortademigheid in het dagelijks leven is in twee studies onderzocht (Dang 2011; Vivodtzev 2006). Echter, beide studies rapporteren onvoldoende data voor een meta-analyse. In de studie van Dang (2011) was het onduidelijk of er verschil was tussen de verbetering van de interventie- en die van de controlegroep. Het verschil in de studie van Vivodtzev (2006) was op de grens van significantie (p = 0,05).
De effecten van NMES op kortademigheid direct na afloop van een symptoomgelimiteerde inspanningstest zijn in drie studies onderzocht met behulp van de Borgschaal (Bonnevie 2018; Tasdemir 2015; Vivodtzev 2006). Patiënten in de NMES-groep scoorden 0,22 punten lager op deze schaal dan patiënten in de controlegroep (95%-BI = -0,83 tot 0,40; n = 95); een klein effect. Zie de forestplot.
De bewijskracht voor (functioneel) inspanningsvermogen is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Forestplot van behandeling met NMES (‘add on’) bij patiënten met stabiel COPD: kortademigheid
Functioneel inspanningsvermogen
In combinatie met oefentherapie heeft NMES geen effect (zelfs een zeer klein negatief effect) op het functioneel inspanningsvermogen vergeleken met reguliere oefentherapie zonder NMES. In zes studies liepen patiënten die oefentherapie plus NMES ontvingen gemiddeld drie meter minder dan patiënten die oefentherapie zonder NMES ontvingen (95%-BI = -7,6 tot 1,4; n = 174). De ISWT toonde ook geen significante effecten aan van oefentherapie plus NMES op het inspanningsvermogen, maar de ESWT wel (Tasdemir 2015; onvoldoende data gerapporteerd voor de berekening van de effectgrootte en/of opname in meta-analyse). Zie de forestplot.
De bewijskracht voor het functioneel inspanningsvermogen is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Forestplot van behandeling met NMES (‘add on’) bij patiënten met stabiel COPD: functioneel inspanningsvermogen
Perifere spierkracht
Drie studies (Dang 2011; Tasdemir 2015; Vivodtzev 2006) rapporteerden een kleine toename in spierkracht van de m. quadriceps (SMD = 0,20; 95%-BI = -0,32 tot 0,71; n = 60). Zie de forestplot.
De bewijskracht voor het effect op de perifere spierkracht is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het gering aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Forestplot van behandeling met NMES (‘add on’) bij patiënten met stabiel COPD: perifere spierkracht
Mortaliteit
Tussen oefentherapie met en zonder NMES is mogelijk geen risicoverschil in mortaliteit. In geen van de vijf studies die data over mortaliteit rapporteren is een patiënt overleden (RV = 0,00; 95%-BI = -0,06 tot 0,06;
n = 142). Zie de forestplot.
De bewijskracht voor de uitkomstmaat mortaliteit is met één niveau verlaagd gezien het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op matig.
Forestplot van behandeling met NMES (‘add on’) bij patiënten met stabiel COPD: mortaliteit
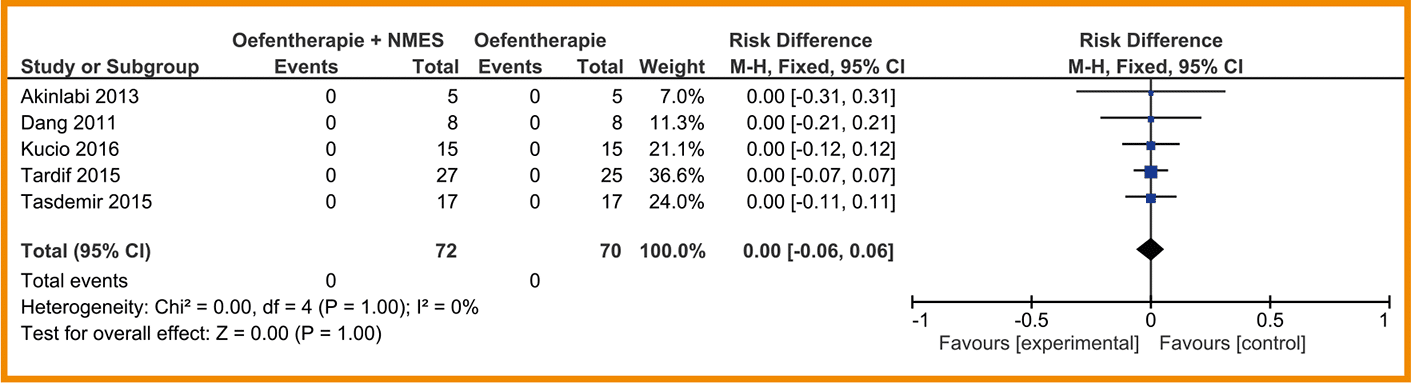
Ongewenste voorvallen
NMES geeft mogelijk geen verhoging van het risico op ongewenste voorvallen bij oefentherapie met NMES ten opzichte van oefentherapie zonder NMES (zes studies; n = 144; RV = 0,0; 95%-BI = -0,05 tot 0,05).
De bewijskracht voor ongewenste voorvallen gerelateerd aan de interventie is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (o.a. blindering) en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Een overzicht van de effecten en de bewijskracht op alle uitkomsten is weergegeven in de volgende tabel.
GRADE-evidenceprofiel van de resultaten van NMES in combinatie met de oefentherapie (‘add on’) in vergelijking met enkel oefentherapie bij patiënten met stabiel COPD
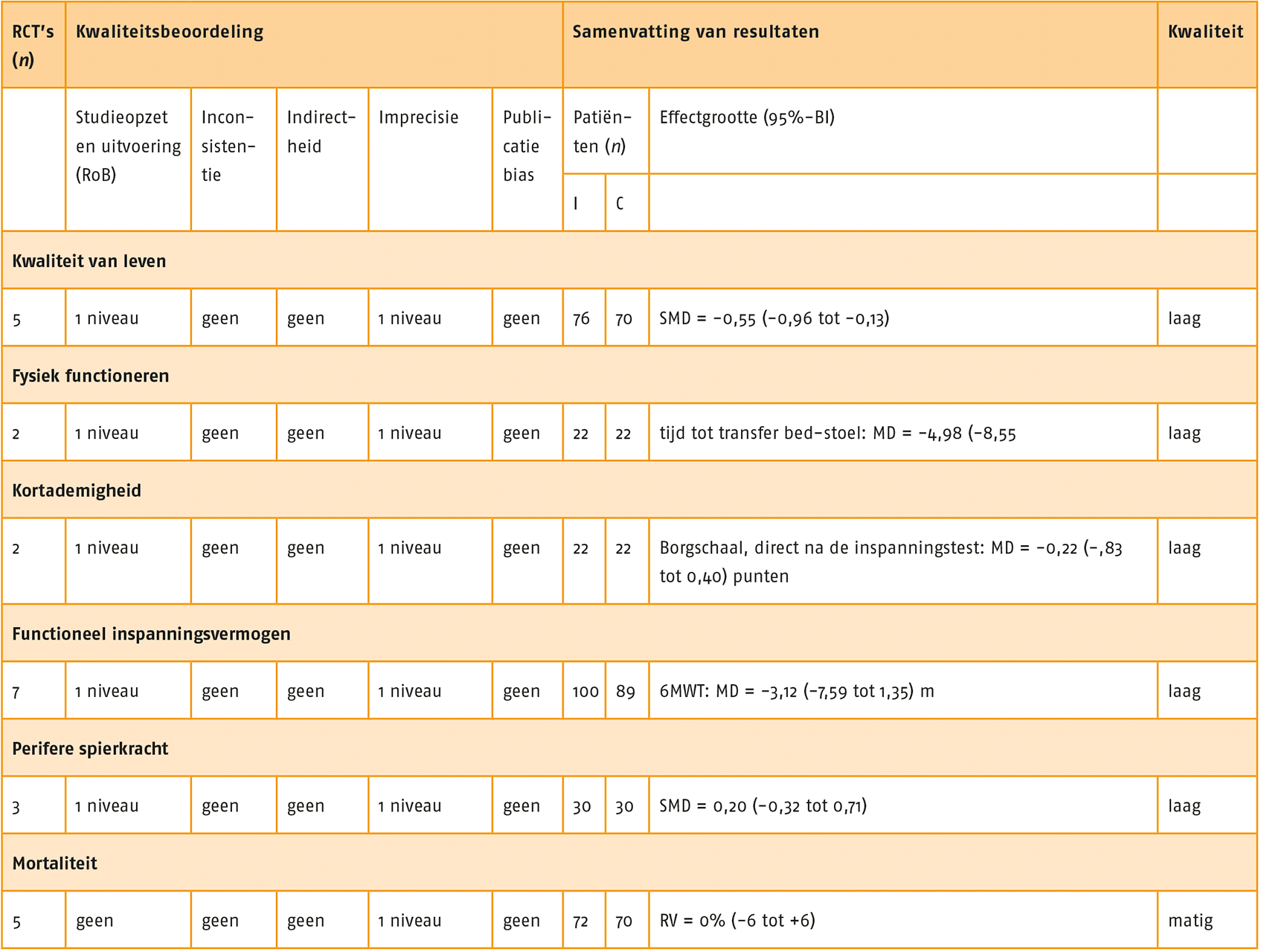
Overwegingen
De overwegingen en aanbevelingen komen voort uit de discussies die in de werkgroep zijn gevoerd aan de hand van evidence-to-decisionformulieren. Zie bijlage C.3.5 (opent in nieuw tabblad).
De overwegingen betroffen:
Gewenste effecten Bij patiënten met stabiel COPD die in staat zijn tot fysieke training lijkt toepassing van NMES in combinatie met fysieke training (‘add-on’) nauwelijks van toegevoegde waarde vergeleken met oefentherapie zonder NMES. Gezien deze resultaten lijkt behandeling met NMES geen waarde toe te voegen aan fysieke training bij patiënten met stabiel COPD en lijkt behandeling met NMES bij deze patiënten niet zinvol. Wanneer patiënten met stabiel COPD geen fysieke training ontvangen, geeft toepassing van NMES mogelijk wel verbetering van bijvoorbeeld het inspanningsvermogen en de perifere spierkracht vergeleken met gebruikelijke zorg. Men kan hierbij denken aan patiënten die niet in staat zijn tot fysieke training, bijvoorbeeld omdat zij bedlegerig zijn en/of een ernstige longaanval doormaken. Het is ook mogelijk dat patiënten niet in staat zijn tot fysieke training vanwege orthopedische klachten. Hoewel er geen studies bekend zijn naar de effecten van NMES bij patiënten met COPD én orthopedische klachten zijn er wel literatuurstudies waaruit positieve effecten blijken van NMES bij deze patiëntengroep, maar dan zónder COPD (Gatewood 2017; Herzig 2015). Bij patiënten met COPD die vanwege een longaanval zijn opgenomen in het ziekenhuis geeft NMES in combinatie met mobilisatie-oefeningen grote tot zeer grote verbeteringen van het fysiek functioneren, kortademigheid, inspanningsvermogen en de perifere spierkracht.
Ongewenste effecten Behandeling met NMES lijkt veilig; er zijn geen situaties gevonden die leiden tot een verhoogd risico op mortaliteit of ongewenste voorvallen die zijn gerelateerd aan de interventie.
Balans tussen gewenste en ongewenste effecten De gewenste effecten van NMES bij patiënten met COPD overtreffen waarschijnlijk de ongewenste effecten. NMES leidt immers tot gewenste effecten bij patiënten die vanwege een longaanval zijn opgenomen in het ziekenhuis en bij patiënten met stabiel COPD zonder fysieke training (‘stand alone’). Bovendien is er geen verhoogd risico op ongewenste effecten. Bij patiënten met stabiel COPD die in staat zijn tot fysieke training lijken er nauwelijks gewenste effecten te zijn van NMES; zodoende weegt voor NMES voor die groep niet op tegen mogelijke ongewenste effecten.
Waarde van de gewenste effecten Voor patiënten die vanwege een longaanval zijn opgenomen in het ziekenhuis is NMES van grote waarde voor het fysiek functioneren (transfer van bed naar stoel), de kortademigheid en het inspanningsvermogen. Ook wanneer patiënten met stabiel COPD geen fysieke training kunnen uitvoeren, kan NMES een positief effect hebben op deconditionering.
Variatie in de waarde van de gewenste effecten Welke waarde patiënten aan NMES toekennen, zal sterk uiteenlopen. De effecten van NMES zijn van grote waarde voor ziekenhuispatiënten, maar voor patiënten die in staat zijn om zelf hun uithoudingsvermogen te trainen, is de waarde van NMES zeer gering.
Benodigde middelen (kosten) De kosten van NMES voor de therapeut bestaan uit de aanschaf van de NMES-apparatuur; deze kosten bedragen circa 600 euro voor een vierkanaals spierstimulatieapparaat. Voor patiënten zijn er geen extra kosten verbonden aan behandeling met NMES wanneer zij zijn opgenomen in het ziekenhuis of in een revalidatiecentrum (de behandeling is inbegrepen en wordt vergoed uit de basisverzekering). Voor patiënten zonder indicatie voor ziekenhuisbehandeling of longrevalidatie vallen de kosten van NMES-behandeling onder de reguliere behandeling van de therapeut.
Variatie in benodigde middelen (kosten) De variatie in benodigde middelen is hoog. In ziekenhuizen en longrevalidatiecentra is de apparatuur meestal aanwezig. Echter, de apparatuur is geen onderdeel van de standaarduitrusting van eerstelijnspraktijken en is hier dus niet altijd aanwezig. Is behandeling met NMES aangewezen en de praktijk bezit niet over de juiste apparatuur, dan wordt de patiënt verwezen naar een praktijk die wel NMES-behandeling kan toepassen.
Kosteneffectiviteit Studies naar kosteneffectiviteit zijn niet gevonden. De kosteneffectiviteit van NMES wordt gunstig ingeschat. Gezien de positieve effecten op het fysiek functioneren kan NMES bij ziekenhuispatiënten mogelijk de opnameduur verkorten. Ook in de eerstelijnspraktijk lijkt kosteneffectiviteit van behandeling met NMES gunstig. Bij de behandeling van een longaanval en het tegengaan van verdere deconditionering kan ziekenhuisopname mogelijk worden voorkomen.
Aanvaardbaarheid Patiënten voelen wel de spiercontractie, maar ervaren geen pijn van neuromusculaire elektrostimulatie.
Haalbaarheid De implementatie van NMES in de dagelijkse praktijk is waarschijnlijk haalbaar. In ziekenhuizen en revalidatiecentra is het NMES-apparaat meestal beschikbaar. Houd rekening met beschikbaarheid van het NMES-apparaat bij behandeling in een eerstelijnspraktijk en verwijs de patiënt naar een praktijk die in bezit is van een NMES-apparaat.
NMES in combinatie met mobilisatie bij patiënten die met een COPD-longaanval zijn opgenomen in het ziekenhuis (IC of HC)
Kwaliteit van leven
Het effect van NMES op de kwaliteit van leven is niet gerapporteerd.
Fysiek functioneren
Twee studies onder IC-patiënten onderzochten de tijd tot zitten buiten bed (Akar 2017; Zanotti 2003). Deze studies tonen een zeer groot effect van NMES in combinatie met mobilisatie op het fysiek functioneren; patiënten in de interventiegroep konden gemiddeld vijf dagen eerder buiten bed zitten (95%-BI = -8,6 tot -1,4; n = 44). Zie de forestplot.
De bewijskracht voor fysiek functioneren is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Forestplot van behandeling met NMES bij patiënten die met een COPD-longaanval zijn opgenomen in het ziekenhuis (IC of HC): fysiek functioneren
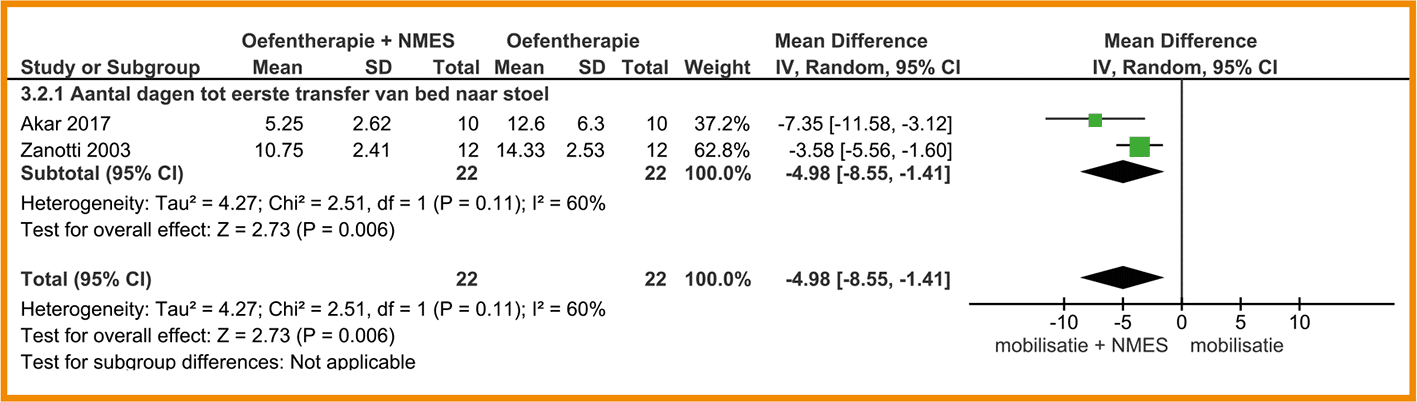
Kortademigheid
Symptomen van kortademigheid zoals gemeten met de ‘Medical Research Council Dyspnoe’ vragenlijst (MRC) zijn na behandeling met NMES één punt meer afgenomen dan na placebobehandeling (Abdellaoui 2011). De bewijskracht voor kortademigheid is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (1 niveau) en het geringe aantal patiënten (imprecisie; 2 niveaus). De bewijskracht komt hiermee uit op zeer laag.
Functioneel inspanningsvermogen
NMES geeft mogelijk een zeer grote, klinisch-relevante verbetering van het functioneel inspanningsvermogen. In de studie van Abdellaoui (2011) liepen patiënten die mobilisatie met NMES ontvingen gemiddeld 164,0 (± 68,2) meter en patiënten die mobilisatie met placebo-NMES ontvingen gemiddeld 72 (± 68,5) meter. Met 92,0 meter was het verschil in loopafstand zeer groot (95%-BI = 21,36 tot 162,64; n = 15). De bewijskracht voor kortademigheid is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (1 niveau) en het geringe aantal patiënten (imprecisie; 2 niveaus). De bewijskracht komt hiermee uit op zeer laag.
Perifere spierkracht
Zanotti (2003) toont een zeer groot effect aan van NMES op de spierkracht. Gemeten met een MRC-schaal van 0 (geen zichtbare of voelbare contractie) tot 5 (normale kracht) leidde mobilisatie met NMES tot een grotere verbetering van de spierkrachtscore (gemiddelde score= 2,16 ±1,02) dan mobilisatie zonder NMES (score = 1,25±0,75; SMD = 1,20; 95%-BI = 0,32 tot 2,08).
Ook Abdelloui (2011) toont een grotere toename in spierkracht aan van de m. quadriceps na mobilisatie met NMES (mediaan MVC = 10; IQR = 4,7-11,5 kg) dan na mobilisatie met placebo-NMES (mediaan MVC = 3; IQR = 1-5 kg; p = 0,02).
De bewijskracht voor kortademigheid is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (1 niveau) en het geringe aantal patiënten (imprecisie; 1 niveau). De bewijskracht komt hiermee uit op laag.
Opnameduur
Eén studie rapporteert informatie over de opnameduur. Deze studie van Akar (2017) toont 30% (95%-BI = -0,10 tot 0,70) grotere kans op ontslag van de IC-afdeling binnen vier weken na behandeling met mobilisatie plus NMES (8 van de 10 patiënten werden binnen 4 weken ontslagen van de IC) in vergelijking met patiënten die alleen mobilisatie ontvingen (5 van de 10 patiënten). Zie de forestplot.
De bewijskracht voor opnameduur is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (1 niveau) en het zeer geringe aantal patiënten (imprecisie; 2 niveaus). De bewijskracht komt hiermee uit op zeer laag.
Forestplot van behandeling met NMES bij patiënten die met een COPD-longaanval zijn opgenomen in het ziekenhuis (IC of HC): opnameduur
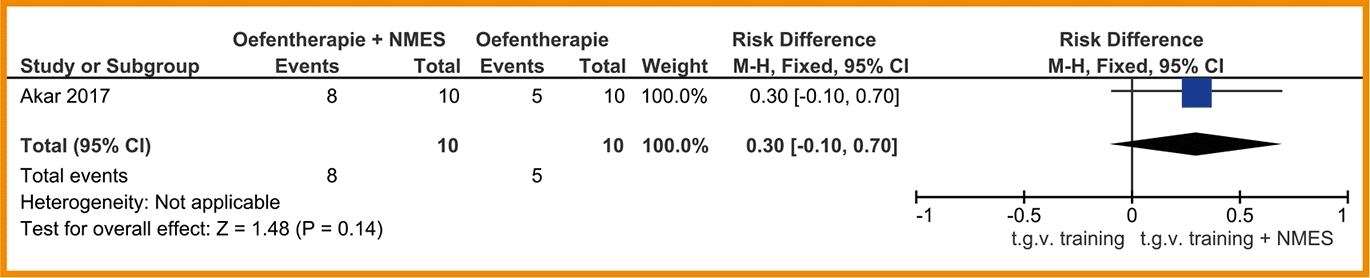
Mortaliteit
Behandeling met NMES geeft mogelijk geen verhoogd risico op overlijden (Zanotti 2003; Abdellaoui 2011).
De bewijskracht voor kortademigheid is met één niveau verlaagd gezien het geringe aantal patiënten (imprecisie) en komt hiermee uit op matig.
Ongewenste voorvallen
NMES geeft mogelijk geen verhoogd risico op ongewenste voorvallen (Abdellaoui 2011).
De bewijskracht voor ongewenste voorvallen is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (1 niveau) en het geringe aantal patiënten (imprecisie; 2 niveaus). De bewijskracht komt hiermee uit op zeer laag.
Een overzicht van de effecten en de bewijskracht op alle uitkomsten is weergegeven in de volgende tabel.
GRADE-evidenceprofiel NMES in combinatie met mobilisatie (‘add-on’) in vergelijking met enkel mobilisatie bij patiënten met COPD die zijn opgenomen op de IC- of de HC-afdeling van het ziekenhuis
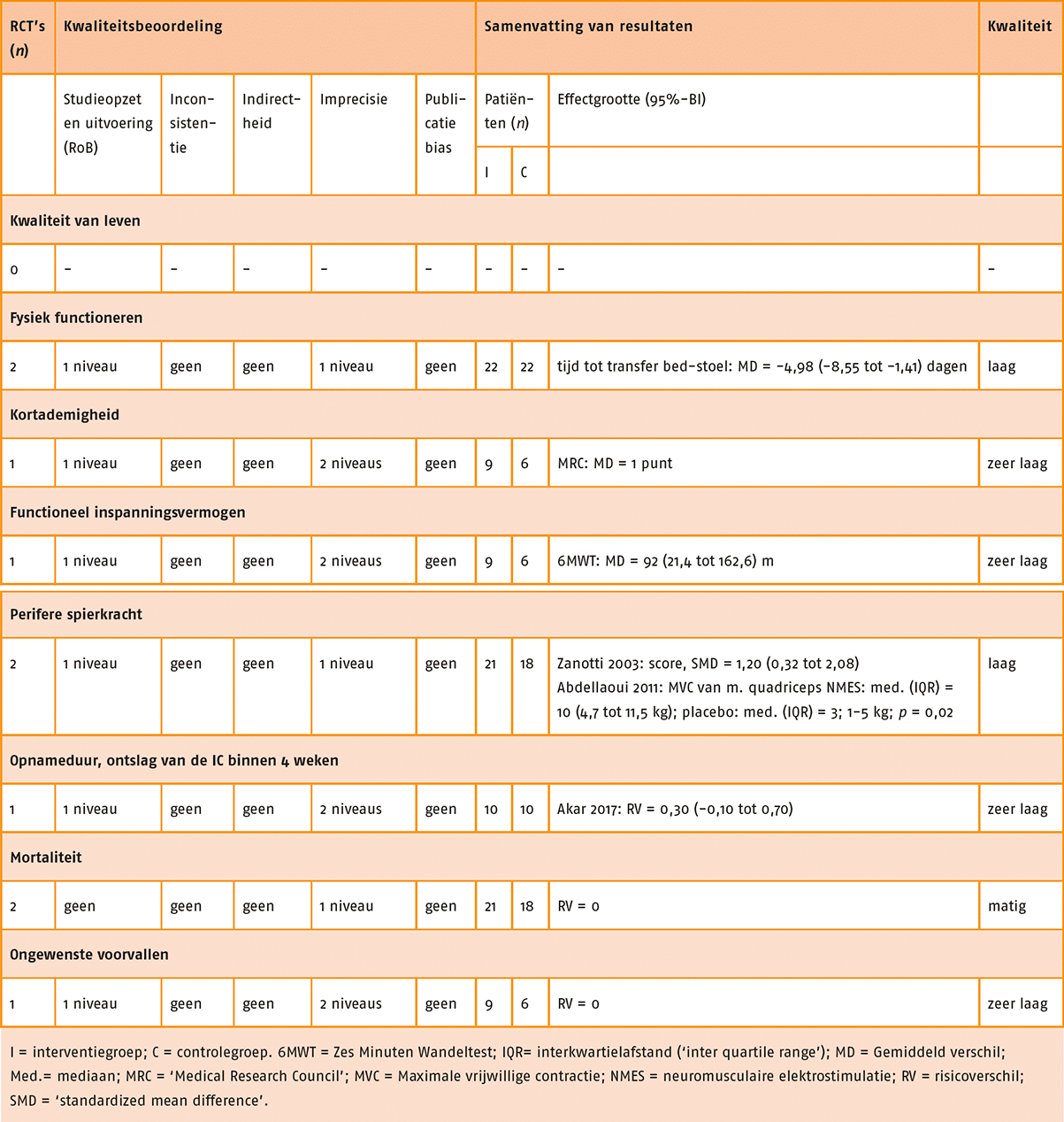
Literatuur over de toepassing van NMES
Voor het beantwoorden van de uitgangsvraag* over de wijze van toepassing van NMES is in overleg met de werkgroep en de klankbordgroep om pragmatische redenen besloten geen systematisch literatuuronderzoek uit te voeren. De literatuur over dit onderwerp is op niet-systematische wijze vergaard en staat in onderstaande literatuurlijst vermeld.
- Abdellaoui A, Prefaut C, Gouzi F, Couillard A, Coisy-Quivy M, Hugon G, et al. Skeletal muscle effects of electrostimulation after COPD exacerbation: a pilot study. European Respiratory Journal 2011;38(4):781-8.
- Akar O, Gunay E, Ulasli SS, Ulasli AM, Kacar E, Sariaydin M, et al. Efficacy of neuromuscular electrical stimulation in patients with COPD followed in intensive care unit. Clin Resp J. 2017;11(6):743-50.
- Akinlabi K, Main E, Garrod R, Harvey A. Neuromuscular electrical stimulation (NMES), a new strategy in the pulmonary rehabilitation of patients with severe and very severe MRC 4 and 5 chronic obstructive pulmonary disease (COPD) [abstract]. Thorax. 2013;68(Suppl 3):A17(S28).
- Bonnevie T, Gravier FE, Debeaumont D, Viacroze C, Muir JF, Cuvelier A, et al. Home-based neuromuscular electrical stimulation as an add-on to pulmonary rehabilitation does not provide further benefits in patients with chronic obstructive pulmonary disease: a multicenter randomized trial. Arch Phys Med Rehabil. 2018 Aug;99(8):1462-70.
- Bourjeily G, Palermo F, Rochester C, Mohsenin V. Transcutaneous electrical stimulation of the lower extremities improves muscle mass, strength and exercise endurance in severe chronic obstructive pulmonary disease (COPD). Am J Resp Crit Care Med. 2001;163(5 Suppl):A21.
- Bourjeily-Habr G, Rochester CL, Palermo F, Snyder P, Mohsenin V. Randomised controlled trial of transcutaneous electrical muscle stimulation of the lower extremities in patients with chronic obstructive pulmonary disease. Thorax. 2002;57(12):1045-9.
- Dang DN, Gluck M, Pirnay F, Louis R, Vanderthommen M. Interest of neuromuscular electro-stimulation (NMES) in COPD patients during an ambulatory comprehensive respiratory rehabilitation program [abstract]. Eur Resp J. 2011;38(55):P4807.
- Gatewood CT, Tran AA, Dragoo JL. The efficacy of post-operative devices following knee arthroscopic surgery: a systematic review. Knee Surg Sports Traumatol Arthrosc. 2017;25(2):501-16.
- Guyatt GH, Berman LB, Townsend M, Pugsley SO, Chambers LW. A measure of quality of life for clinical trials in chronic lung disease. Thorax. 1987;42(10):773-8.
- Herzig D, Maffiuletti NA, Eser P. The application of neuromuscular electrical stimulation training in various non-neurologic patient populations: a narrative review. PM R. 2015;7(11):1167-78.
- Hill K, Cavalheri V, Mathur S, Roig M, Janaudis-Ferreira T, Robles P, et al. Neuromuscular electrostimulation for adults with chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2018;5:CD010821.
- Holland AE, Spruit MA, Singh SJ. How to carry out a field walking test in chronic respiratory disease. Breathe (Sheff). 2015;11(2):128-39.Jones PW. St. George’s Respiratory Questionnaire: MCID. COPD. 2005;2(1):75-9.
- Kucio C, Niesporek J, Kucio E, Narloch D, Wegrzyn B. Evaluation of the effects of neuromuscular electrical stimulation of the lower limbs combined with pulmonary rehabilitation on exercise tolerance in patients with chronic obstructive pulmonary disease. J Hum Kinet. 2016;54:75-82.
- Latimer L, Greening N, Morgan M, Singh S, Bradding P, Steiner M. Unilateral neuromuscular electrical stimulation (NMES) of the quadriceps muscles in stable COPD. Eur Resp J. 2013;42:P3571.
- Lieber RL, Kelly MJ. Factors influencing quadriceps femoris muscle torque using transcutaneous neuromuscular electrical stimulation. Phys Ther. 1991;71(10):715-721; discussion 722-723.
- Lopez Lopez L, Granados Santiago M, Donaire Galindo M, Torres Sanchez I, Ortiz Rubio A, et al. Efficacy of combined electrostimulation in patients with acute exacerbation of COPD: randomised clinical trial. Med Clin (Barc). 2018. pii: S0025-7753(18)30212-4.
- Maddocks M, Nolan CM, Man WD, Polkey MI, Hart N, Gao W, et al. Neuromuscular electrical stimulation to improve exercise capacity in patients with severe COPD: a randomised double-blind, placebo-controlled trial. Lancet Respir Med. 2016;4:27-36.
- Maffiuletti NA, Gondin J, Place N, Stevens-Lapsley J, Vivodtzev I, Minetto MA. Clinical use of neuromuscular electrical stimulation for neuromuscular rehabilitation: what are we overlooking? Arch Phys Med Rehabil. 2018;99(4):806-12.
- Neder JA, Sword D, Cochrane LK, Mackay E, Ward SA, Clark CJ. A new rehabilitative strategy for severely-disabled patients with advanced COPD: neuromuscular electrical stimulation. Am J Resp Critical Care Med. 2001;163(5 Suppl):A967.
- Neder JA, Sword D, Ward SA, Mackay E, Cochrane LM, Clark CJ. Home based neuromuscular electrical stimulation as a new rehabilitative strategy for severely disabled patients with chronic obstructive pulmonary disease (COPD). Thorax 2002;57(4):333-7.
- Neves L, Vieira P, Chiappa A, Cipriano G, Umpierre D, Arena R, et al. Neuromuscular electrical stimulation improves clinical and physiological function in COPD patients (Abstract). Eur Respir J. 2014;44:P1289.
- Roy AL, Dupuis J, Viacroze C, Debeaumont D, Quieffin J, Marques MH, et al. Effects of neuromuscular electrical stimulation in addition to a rehabilitation program in patients with chronic obstructive pulmonary disease (Abstract). Ann Phys Rehab Med. 2013;56:e327.
- Tardif C, Roy AL, Viacroze C, Debeaumont D, Quieffin J, Marques MH, et al. Does neuromuscular electrical stimulation of the quadriceps during rehabilitation in COPD outpatients adds a benefit? Eur Respir J. 2015;46:OA1755.
- Tasdemir F, Inal-Ince D, Ergun P, Kaymaz D, Demir N, Demirci E, et al. Effects of exercise training and neuromuscular electrical stimulation on symptoms, muscle strength, exercise capacity, activities of daily living, and quality of life in COPD [abstract]. Eur Respir J. 2012;40:P2835.
- Tasdemir F, Inal-Ince D, Ergun P, Kaymaz D, Demir N, Demirci E, et al. Neuromuscular electrical stimulation as an adjunct to endurance and resistance training during pulmonary rehabilitation in stable chronic obstructive pulmonary disease. Expert Rev Respir Med. 2015;9:493-502.
- Vieira PJ, Chiappa AM, Cipriano G Jr, Umpierre D, Arena R, Chiappa GR. Neuromuscular electrical stimulation improves clinical and physiological function in COPD patients. Respir Med. 2014;108(4):609-20.
- Vivodtzev I, Debigare R, Dube A, Pare M-E, Gagnon P, Mainguy V. Molecular mechanisms of muscle hypertrophy after neuromuscular electrical stimulation in patients with severe COPD [abstract]. Am J Respir Critical Care Med. 2010;181:A3762.
- Vivodtzev I, Debigare R, Gagnon P, Mainguy V, Saey D, Dube A, et al. Functional and muscular effects of neuromuscular electrical stimulation in patients with severe COPD: a randomized clinical trial. Chest. 2012;141(3):716-25.
- Vivodtzev I, Gagnon P, Mainguy V, Belanger M, Maltais F. Mechanisms of improvement in exercise tolerance after neuromuscular electrical stimulation training in patients with severe COPD (Abstract). European Respiratory Society 19th Annual Congress; 2009 Sept 12-15; Vienna. 2009.
- Vivodtzev I, Lacasse Y, Maltais F. Neuromuscular electrical stimulation of the lower limbs in patients with chronic obstructive pulmonary disease. J Cardiopulm Rehabil Prev. 2008;28(2):79-91.
- Vivodtzev I, Pepin J-L, Vottero G, Mayer V, Porsin B, Levy P, et al. Improvement in quadriceps strength and dyspnea in daily tasks after 1 month of electrical stimulation in severely deconditioned and malnourished COPD. Chest 2006;129 (6):1540-8.
- Zanotti E, Felicetti G, Maini M, Fracchia C. Peripheral muscle strength training in bed-bound patients with COPD receiving mechanical ventilation: effect of electrical stimulation. Chest. 2003;124(1):292-6.
C.4 Interventies gericht op het adembewegingsapparaat
Deze module betreft:
- Ademspiertraining (module C.4.1)
- Ademhalingstechnieken (module C.4.2)
- Ontspanningstechnieken (module C.4.3)
- Houdingsaanpassingen (module C.4.4)
- Mucusklaring (module C.4.5)
C.4.1 Ademspiertraining
Bied bij voorkeur ademspiertraining aan bij patiënten met verminderde ademspierfunctie (PImax < 70% van de voorspelde waarde):
- indien er sprake is van kortademigheid en als het doel is om deze kortademigheid te verminderen en/of;
- indien ernstige kortademigheid duur-/intervaltraining nagenoeg onmogelijk maakt.
Bied ademspiertraining enkel aan indien de patiënt voldoende motivatie en vaardigheden heeft om (na instructie) de ademspiertraining zelfstandig te volbrengen en bereid is om de benodigde apparatuur aan te schaffen.
Indien ademspiertraining aangeboden wordt, maak dan als volgt gebruik van de FITT-factoren (frequentie, intensiteit, type en tijdsduur):

Toelichting
Uitgangsvraag
De uitgangsvraag is opgedeeld in de volgende subvragen:
- Wat is de waarde van inspiratoire ademspiertraining bij patiënten met COPD?
- Op welke wijze (FITT) dient inspiratoire ademspiertraining toegepast te worden bij patiënten met COPD?
Aanleiding
Ademspiertraining is een interventie die toegepast wordt om inspiratoire spierkracht te verbeteren met als doel kortademigheid bij patiënten COPD (of andere longaandoeningen) te verminderen (Clini 2018). Een patiënt heeft een verminderde ademspierfunctie indien de maximale inspiratoire monddruk (PImax) kleiner is dan 70% van de voorspelde waarde (ERS 2019; Rodrigues 2017). De ademspiertraining kan op verschillende manieren worden toegepast, met gebruik van de FITT-factoren.
1 Wat is de waarde van inspiratoire ademspiertraining bij patiënten met COPD?
Literatuur
Er is geen effect gevonden van ademspiertraining op de uitkomstmaat kwaliteit van leven. Ademspiertraining leidt echter wel tot een matige verbetering van de fysieke capaciteit en mogelijk tot sterke afname van kortademigheid (afhankelijk van het meetinstrument) ten opzichte van geen therapie. De bewijskracht is laag.
Overwegingen
Aangezien ademspiertraining als een op zichzelf staande interventie tot een matige verbetering van de fysieke capaciteit en mogelijk tot sterke afname van kortademigheid leidt ten opzichte van geen therapie, is besloten tot een conditionele aanbeveling. Dit betekent dat de interventie aanbevolen wordt bij patiënten met een verminderde ademspierfunctie (< 70% van de voorspelde waarde) in combinatie met kortademigheid bij patiënten bij wie het doel is deze kortademigheid te verminderen en/of bij patiënten met zo ernstige kortademigheid dat duur-/intervaltraining nagenoeg onmogelijk is. Daarnaast moet de patiënt voldoende gemotiveerd zijn om (na instructie) de ademspiertraining zelfstandig te volbrengen en bereid zijn om de benodigde apparatuur aan te schaffen.
2 Op welke wijze (FITT) dient inspiratoire ademspiertraining toegepast te worden bij patiënten met COPD?
Literatuur en overwegingen
De training kan bestaan uit weerstandstraining met ‘threshold, flow-resistive’ of een combinatie van ‘threshold’ en ‘flow-resistive’ (Bellman 1988; Göhl 2016; Larson 1988, 2015). De intensiteit is afhankelijk van het gebruikte toestel, maar aanbevolen wordt ongeveer 30 ademhalingen te trainen op 30 tot 50% van de PImax (Clini 2018; Hill 2010). Inspiratie (contractie) moet zo snel en zo diep mogelijk uitgevoerd worden; uitademing (relaxatie) rustig en volledig. De optimale verhouding tussen in- en uitademing is één deel inademing en twee tot drie delen uitademing. Indien dit te snel is en de patiënt dreigt te hyperventileren en/of duizelig te worden, dan is het aan te raden om na elke uitademing kort te pauzeren alvorens met de volgende inademing te beginnen. Ook kan om de 10 ademhalingen een korte pauze genomen worden (Langer 2015).
Bij 32 van de 37 geïncludeerde studies in de review van Beaumont wordt een frequentie van vijf dagen per week aangehouden (Beaumont 2018). Dit wordt gezien als het minimum aantal dagen per week om effect op ademspierfunctie te bewerkstelligen, waarbij er ten minste vier weken aaneengesloten getraind moet worden om ook een relevant trainingsresultaat te bereiken (Clini 2018). Eén tot twee keer per dag worden 30 ademhalingen geoefend, wat ongeveer vijf minuten in beslag neemt. Deze korte intensieve trainingssessies lijken effectiever te zijn dan lange, minder intensieve trainingssessies van 15 minuten of meer (Hill 2006; Langer 2015; Sturdy 2003). Ter behoud van de ademspierfunctie wordt aanbevolen twee tot drie keer per week een trainingssessie uit te voeren (Weiner 2004).
Literatuur over de waarde van inspiratoire ademspiertraining
Voor het beantwoorden van de eerste uitgangsvraag over de waarde van inspiratoire ademspiertraining zijn de conclusies van het systematisch literatuuronderzoek van Beaumont (2018) overgenomen.
Uitkomstmaten
Kwaliteit van leven, fysieke capaciteit en kortademigheid zijn aangemerkt als patiëntrelevante en voor de besluitvorming cruciale uitkomstmaten. Het optreden van ongewenste voorvallen is aangemerkt als een patiëntrelevante en belangrijke uitkomstmaat voor de besluitvorming.
Zoeken en selecteren
Omdat er reeds een zeer recente systematische review (SR) was geïdentificeerd (Beaumont 2018) die past bij deze uitgangsvraag, is besloten zelf geen systematisch literatuuronderzoek uit te voeren. De resultaten van het systematisch literatuuronderzoek van Beaumont (2018) zijn overgenomen.
De SR van Beaumont werd geselecteerd op grond van de selectiecriteria in de volgende tabel.

Samenvatting literatuur
Beschrijving studies
In de SR van Beaumont (2018) werden 43 studies geïncludeerd, met in totaal 1427 patiënten met COPD. In de SR werd ‘inspiratory muscle training’ (IMT) en ‘geen IMT’ met elkaar vergeleken als ‘stand-alone’ interventie en als additionele interventie (‘add on’) naast inspanningstraining. In vier studies was er sprake van IMT als additionele trainingvorm. In de overige studies werd IMT als ‘stand-alone’ interventie onderzocht.
Een inclusiecriterium binnen deze review was het gebruik van een thresholdapparaat. Zowel patiënten in een stabiele fase als patiënten met een longaanval konden worden geïncludeerd.
Individuele studiekwaliteit
De individuele studiekwaliteit is door Beaumont (2018) beoordeeld met de ‘Physiotherapy Evidence Database (PEDro) scale’ (RCT’s) en de ‘Downs and Black tool’ (observationele studies). De methodologische kwaliteit van de RCT’s varieerde van 3 tot 8/10 (PEDro-score) en de kwaliteit van de observationele studies varieerde van 1151 tot 1236 (‘Downs and Black score’).
Resultaten en bewijskracht
Functionele fysieke capaciteit
Het effect van ademspiertraining is in 33 studies onderzocht op functionele fysieke capaciteit. In 22 van deze 33 studies is deze gemeten met de Zes Minuten Wandeltest (6MWT). De meta-analyse uit de SR (Beaumont 2018) laat een matig, klinisch-relevant verschil zien in het voordeel van ademspiertraining (MD 42,68 m; 95%-BI = 16,90 tot 68,47; n = 615). In vijf studies is de functionele fysieke capaciteit gemeten met de 12MWT en in drie studies met de ‘Incremental Shuttle Walk Test’ (ISWT). De meta-analyse toonde ook een kleine, klinisch-relevante verbetering aan op deze meetinstrumenten (ISWT: 53,96 (95-% BI = -32,19-140,11); 12MWT: 114,55 (95-% BI = -89,54 tot 318,63).
De bewijskracht voor het effect van ademspiertraining op de functionele fysieke capaciteit is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering. De bewijskracht komt hiermee uit op laag.
Kortademigheid
In totaal hebben 23 studies het effect van ademspiertraining onderzocht op kortademigheid. Gemeten met de Borgschaal of de ‘Visual Analogue Scale’ (VAS), laat de meta-analyse uit de SR (Beaumont 2018) geen verschil zien tussen de twee groepen (MD = -0,52; 95%-BI = -1,09 tot 0,05). Gemeten met de ‘Baseline-Transition Dyspnea Index’ (BDI-TDI), laat de meta-analyse een groot verschil zien in het voordeel van ademspiertraining (MD 2,30; 95%-BI = 1,67 tot 2,93).
De bewijskracht voor het effect van ademspiertraining op de kortademigheid is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering. De bewijskracht komt hiermee uit op laag.
Kwaliteit van leven
In totaal hebben negen studies het effect van ademspiertraining onderzocht op kwaliteit van leven. Gemeten met de ‘St George’s Respiratory Questionnaire’ (SGRQ) (5 studies), laat de meta-analyse uit de SR (Beaumont 2018) geen verschil zien tussen de groep die wel en de groep die geen ademspiertraining kreeg (MD -2,40; 95%-BI = -4,89 tot 0,09).
De bewijskracht voor het effect van ademspiertraining op de functionele fysieke capaciteit is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering. De bewijskracht komt hiermee uit op laag.
Ongewenste effecten
In de SR van Beaumont wordt geen uitspraak gedaan over mogelijke ongewenste effecten.
Overwegingen
De overwegingen en aanbevelingen komen voort uit de discussies die in de werkgroep zijn gevoerd aan de hand van evidence-to-decisionformulieren. Zie bijlage C.4.1 (opent in nieuw tabblad).
De overwegingen betroffen:
Gewenste effecten Er wordt geen effect gevonden op de uitkomstmaat kwaliteit van leven. Ademspiertraining leidt echter tot een matige verbetering van de fysieke capaciteit en mogelijk tot grote vermindering van kortademigheid (afhankelijk van het meetinstrument) ten opzichte van geen therapie. Er wordt echter geen verschil in effect gevonden op de uitkomstmaten fysieke capaciteit en kortademigheid tussen groepen waarbij ademspiertraining als additionele interventie wordt toegevoegd aan fysieke training. Voor de verschillen op de uitkomstmaat kwaliteit van leven zijn geen studies geïdentificeerd.
Ongewenste effecten Deze werden niet gerapporteerd.
Kwaliteit van de gewenste effecten De bewijskracht van de genoemde effecten is laag.
Balans tussen gewenste en ongewenste effecten Ongewenste effecten zijn niet bekend.
Waarde van de gewenste effecten Naar verwachting kennen de patiënten geen grote waarde toe aan de gewenste effecten.
Variatie in de waarde van de gewenste effecten Naar verwachting is er een redelijk grote variatie in de waarde die patiënten aan de training toekennen. Dit hangt wellicht samen met de motivatie om een trainingsprogramma te volgen.
Benodigde middelen (kosten) Voor ademspiertraining moet een apparaat aangeschaft worden van enkele tientallen euro’s. Om hygiënische redenen wordt aangeraden dat patiënten dit apparaat zelf te kopen, maar het apparaat wordt niet vergoed door de zorgverzekeraar.
Variatie in benodigde middelen (kosten) Het zal per patiënt verschillen of deze de financiële middelen (over) heeft voor een dergelijk apparaat.
Kosteneffectiviteit Niet gerapporteerd.
Aanvaardbaarheid Er zijn geen redenen om aan te nemen dat het implementeren van deze interventie niet aanvaardbaar is.
Haalbaarheid Er zijn geen redenen om aan te nemen dat het implementeren van deze interventie niet haalbaar is.
Gezien de effecten die ademspiertraining heeft op fysieke capaciteit en kortademigheid in vergelijking met geen therapie, wordt besloten tot een conditionele aanbeveling voor de interventie. Dit betekent dat de interventie aanbevolen wordt indien:
- er sprake is van kortademigheid en als het doel is om deze kortademigheid te verminderen en/of ernstige kortademigheid duur-/intervaltraining nagenoeg onmogelijk maakt en;
- de patiënt voldoende motivatie en vaardigheden heeft om de ademspiertraining (na instructie) zelfstandig te volbrengen en bereid is de benodigde apparatuur aan te schaffen.
Literatuur over de wijze van toepassing (FITT) inspiratoire ademspiertraining
Voor het beantwoorden van de uitgangsvraag over de wijze van toepassing van inspiratoire ademspiertraining is in overleg met de werkgroep en de klankbordgroep besloten geen systematisch literatuuronderzoek uit te voeren. De literatuur over dit onderwerp is op niet-systematische wijze vergaard.
- Beaumont M, Forget P, Couturaud F, Reychler G. Effects of inspiratory muscle training in COPD patients: A systematic review and meta-analysis. Clin Respir J. 2018;12(7):2178-88.
- Belman MJ, Shadmehr R. Targeted resistive ventilatory muscle training in chronic obstructive pulmonary disease. J Appl Physiol (1985). 1988;65(6):2726-35.
- Clini E, Holland AE, Pitta F, Troosters T. Textbook of pulmonary rehabilitation. New York: Springer International Publishing; 2018.
- ERS. ERS statement on respiratory muscle testing at rest and during exercise. Eur Respir J. 2019a Jun 13;53(6).
- Göhl O, Walker DJ, Walterspacher S, Langer D, Spengler CM, Wanke T, et al. [Respiratory Muscle Training: State of the Art]. Pneumologie. 2016;70(1):37-48.
- Hill K, Cecins NM, Eastwood PR, Jenkins SC. Inspiratory muscle training for patients with chronic obstructive pulmonary disease: a practical guide for clinicians. Arch Phys Med Rehabil. 2010;91(9):1466-70.
- Hill K, Jenkins SC, Philippe DL, Cecins N, Shepherd KL, Green DJ, et al. High-intensity inspiratory muscle training in COPD. Eur Respir J. 2006;27(6):1119-28.
- Langer D, Charususin N, Jácome C, Hoffman M, McConnell A, Decramer M, et al. Efficacy of a novel method for inspiratory muscle training in people with chronic obstructive pulmonary disease. Phys Ther. 2015;95(9):1264-73.
- Larson JL, Kim MJ, Sharp JT, Larson DA. Inspiratory muscle training with a pressure threshold breathing device in patients with chronic obstructive pulmonary disease. Am Rev Respir Dis. 1988;138(3):689-96.
- Rodrigues A, Da Silva ML, Berton DC, Cipriano G Jr, Pitta F, O’Donnell DE, et al. Maximal inspiratory pressure: does the choice of reference values actually matter? Chest. 2017;152(1):32-9.
- Sturdy G, Hillman D, Green D, Jenkins S, Cecins N, Eastwood P. Feasibility of high-intensity, interval-based respiratory muscle training in COPD. Chest. 2003;123(1):142-50.
- Weiner P, Magadle R, Beckerman M, Weiner M, Berar-Yanay N. Maintenance of inspiratory muscle training in COPD patients: one year follow-up. Eur Respir J. 2004;23(1):61-5.
C.4.2 Ademhalingstechnieken
Pas bij voorkeur ademhalingsinterventies toe bij patiënten met COPD ter vermindering van kortademigheid.
Overweeg het aanleren van ‘pursed lip breathing’ (PLB) bij patiënten met inspanningsgebonden kortademigheid en bij patiënten die PLB nog niet automatisch toepassen. Maak alle patiënten bewust van de toepassing, het effect van deze techniek (ook als patiënten deze al automatisch toepassen) en dat PLB toegepast kan worden tijdens en na inspanning.
Leer de diafragma-ademhaling bij voorkeur niet aan bij patiënten met COPD, met name niet bij patiënten met hyperinflatie en/of het teken van Hoover.
Overweeg ventilatiefeedback enkel toe te passen indien een feedbackapparaat reeds in de praktijk aanwezig is. Pas de interventie bij voorkeur niet toe indien de patiënt hier te vermoeid voor is.
Overweeg een combinatie van verschillende hiervoor genoemde ademhalingstechnieken, maar overweeg ten minste PLB toe te passen. Overweeg daarnaast de toepassing van ademhalingstechnieken in combinatie met beweeginterventies. Beoordeel na instructie van een ademhalingstechniek (rekening houdend met de voorkeuren van de patiënt) welke additionele ademhalingsinterventie daarnaast van toegevoegde waarde kan zijn.
Leer de ademhalingstechnieken aan bij activiteiten in het dagelijks leven waarbij de patiënt hinder ondervindt als gevolg van kortademigheid.
Onderbouwing
Uitgangsvraag
Wat is de waarde van ademhalingstechnieken bij patiënten met COPD?
Aanleiding
Verschillende ademhalingstechnieken kunnen mogelijk de kortademigheid van patiënten met COPD verminderen. Voorbeelden van ademhalingstechnieken zijn ‘pursed lip breathing’ (PLB) en diafragma-ademhaling. In welke mate interventies bijdragen aan het aanleveren van deze technieken en welke technieken hierbij de voorkeur hebben, is echter onbekend.
Op basis van de resultaten zijn de volgende ademhalingstechnieken geselecteerd:
- ‘pursed lip breathing’ (PLB)
- diafragma-ademhaling
- ventilatiefeedback
- gecombineerde ademhalingsinterventies
1 Pursed lip breathing (PLB)
Literatuur
- Direct na de interventie geeft PLB ten opzichte van geen ademhalingsinterventie een matige afname van kortademigheid. De bewijskracht is zeer laag.
- Acht weken na de interventie geeft PLB ten opzichte van geen ademhalingsinterventie een zeer grote toename op fysieke capaciteit. De bewijskracht is zeer laag.
- Acht weken na de interventie geeft PLB ten opzichte van geen ademhalingsinterventie een matige verbetering van de kwaliteit van leven. De bewijskracht is zeer laag.
- Het risico op adverse events is onbekend; adverse events zijn niet gerapporteerd.
Overwegingen
PLB is een veilige en makkelijk toe te passen ademhalingsinterventie met positieve resultaten en heeft nauwelijks tot geen ongewenste effecten. Er is variatie in de effecten en de kwaliteit van het wetenschappelijk bewijs is zeer laag. Het is belangrijk PLB aan te leren bij patiënten die deze techniek nog niet kunnen toepassen en om patiënten die deze techniek al onbewust gebruiken, zich hiervan bewust te maken en uit te leggen in welke situaties ze PLB nog meer kunnen toepassen. Dit leidt tot een conditionele aanbeveling voor de interventie.
2 Diafragma-ademhaling
Literatuur
- Vier weken na de interventie geeft diafragma-ademhaling ten opzichte van geen ademhalingsinterventie een kleine afname van kortademigheid met een lage bewijskracht; een matige toename van fysieke capaciteit met een lage bewijskracht en een grote verbetering van de kwaliteit van leven met een lage bewijskracht.
- Het risico op adverse events is onbekend.
Overwegingen
Van diafragma-ademhaling is slechts één RCT bekend met matig-positieve resultaten en de kwaliteit van bewijs is laag. De effecten in de praktijk en uit de overige literatuur variëren sterk en het is nog niet duidelijk bij welke patiëntengroep diafragma-ademhaling wel of niet werkt. Als belangrijke overweging wordt genoemd dat bij aanwezigheid van hyperinflatie en/of het teken van Hoover diafragma-ademhaling niet toegepast moet worden. Beweeglijkheid van het diafragma is niet of nauwelijks meer mogelijk door de hyperinflatie en een verdere nadruk op diafragma-ademhaling is mechanisch ongunstig en energetisch inefficiënt. Symptomen van kortademigheid kunnen hierdoor mogelijk verergeren. Onder therapeuten wordt het aanleren van diafragma- ademhaling tegenwoordig zeer weinig meer toegepast. Op basis van bovenstaande overwegingen wordt er een conditionele aanbeveling gedaan tegen het aanleren van diafragma-ademhaling.
3 Ventilatiefeedback
Literatuur
- Na afronding van de interventie geeft ademhalingstraining met behulp van ventilatiefeedback ten opzichte van geen ademhalingsinterventie een kleine afname van kortademigheid. De bewijskracht is zeer laag.
- 4 en 15 weken na de interventie geeft ademhalingstraining met behulp van ventilatiefeedback ten opzichte van geen ademhalingsinterventie een kleine toename van de fysieke capaciteit en een kleine verbetering van de kwaliteit van leven. De bewijskracht van beide is zeer laag.
- Het risico op adverse events is onbekend, deze zijn niet gerapporteerd.
Overwegingen
Ventilatiefeedback heeft een klein effect en de apparatuur is erg duur in aanschaf. Ventilatiefeedback kan uitgevoerd worden door therapeuten die dit apparaat in de praktijk hebben. Therapeuten moeten opletten dat de patiënt niet te vermoeid is om de interventie uit te voeren. Deze overwegingen hebben geleid tot een conditionele aanbeveling tegen de interventie in het algemeen. Mocht de therapeut het apparaat in de praktijk hebben, dan kan het apparaat ingezet worden en inzicht geven.
4 Gecombineerde ademhalingsinterventies
Literatuur
- Direct en twee maanden na de interventie geven gecombineerde ademhalingsinterventies ten opzichte van geen ademhalingsinterventie een grote vermindering van kortademigheid en een zeer grote toename van de fysieke capaciteit. De bewijskracht van beide is zeer laag.
- Na afronding van de interventie geven gecombineerde ademhalingsinterventies ten opzichte van geen ademhalingsinterventie een kleine tot grote verbetering van de kwaliteit van leven ten opzichte van geen ademhalingstraining. De bewijskracht is zeer laag.
- Het risico op adverse events is onbekend; deze zijn niet gerapporteerd.
Overwegingen
Een gecombineerde ademhalingsinterventie is klinisch goed toepasbaar omdat deze interventie individuele begeleiding en zorg op maat mogelijk maakt. Het is een veilige en makkelijk toe te passen interventie met positieve resultaten en geen ongewenste effecten. Er is wat variatie in de effecten, omdat het soms zoeken is wat werkt voor de patiënt en omdat afstemming van verschillende interventies aandacht vergt. Het aanleren van PLB lijkt in ieder geval belangrijk. Verder wordt aangeraden om niet meerdere ademhalingsinterventies tegelijkertijd aan te leren, maar één ademhalingsinterventie tegelijk en daarna te beoordelen welke additionele ademhalingsinterventie van toegevoegde waarde zou kunnen zijn voor deze individuele patiënt. Deze overwegingen leiden tot een conditionele aanbeveling voor de interventie.
Om de uitgangsvraag te kunnen beantwoorden, is er een systematische literatuuranalyse verricht naar de volgende reviewvraag:
- ‘Wat zijn de gunstige (effectiviteit) en ongunstige (bijwerkingen) effecten van ademhalingstechnieken op de kortademigheid, fysieke capaciteit en kwaliteit van leven van patiënten met COPD?’
Uitkomstmaten
Kortademigheid, fysieke capaciteit, kwaliteit van leven en ongewenste effecten zijn aangemerkt als patiëntrelevante en zowel cruciale als belangrijke uitkomstmaten voor de besluitvorming.
Voor de uitkomstmaat kortademigheid wordt bij voorkeur de ‘Medical Research Council’ (MRC) dyspnoeschaal gebruikt, en anders de Borgschaal. Voor de uitkomstmaat fysieke capaciteit wordt bij voorkeur de Zes Minuten Wandeltest (6MWT) gebruikt en voor de uitkomstmaat kwaliteit van leven de totaalscore van de ‘St. George’s Respiratory Questionnaire’ (SGRQ). Ten aanzien van de kwaliteit van leven zijn bij de gecombineerde ademhalingstechnieken ook apart de score op de centrale apneu-index (CAI) getoond, omdat niet bekend was of deze schaal met de andere meetinstrumenten gepoold kon worden, omdat de richting richting van de schaal en de schaalverdeling niet bekend waren.
Zoeken en selecteren
Zoekactie
Voor het beantwoorden van deze uitgangsvraag werd de systematische review (SR) van Holland (2012) als basis gebruikt. Vervolgens is de review is geüpdatet. De systematische zoekactie is herhaald op 3 augustus 2018 in de databases ‘PubMed’, ‘EMBASE’, ‘Web of Science’, ‘Cochrane Library’, ‘CENTRAL’, ‘EmCare’, ‘PsycINFO’, ‘ERIC’ en ‘PEDro’. Er is met relevante zoektermen gezocht naar nieuwe gerandomiseerde gecontroleerde studies die zijn gepubliceerd in het Engels of Nederlands vanaf 2012 (jaartal zoekactie Holland 2012).
Literatuurselectie
Alle 16 RCT’s binnen de review van Holland (2012) zijn getoetst aan de selectiecriteria bij deze uitgangsvraag. Vervolgens zijn acht studies in de literatuuranalyse opgenomen. De overige acht studies rapporteerden geen relevante uitkomstmaten. De artikelen die op basis van de volledige tekst zijn geëxcludeerd en de reden van exclusie staan in bijlage C.4.2.
De aanvullende zoekactie leverde in totaal 1828 unieke treffers op. De gevonden studies werden geselecteerd op grond van de volgende selectiecriteria: het betreft een gerandomiseerde gecontroleerde parallelle trial (RCT), de studie is uitgevoerd bij patiënten met COPD, de interventie omvat ademhalingstechnieken en rapporteert de uitkomstmaten kortademigheid, kwaliteit van leven en/of fysieke capaciteit.
Na selectie op basis van titel en abstract is de volledige tekst van 15 studies geraadpleegd. 12 studies zijn vervolgens op basis van de volledige tekst alsnog geëxcludeerd. De werkgroep heeft tijdens het proces ook verschillende artikelen aangedragen, die allemaal zijn gecontroleerd, maar ze voldeden niet aan de inclusiecriteria (zie bijlage C.4.2 voor de reden van exclusie). Sommige studies zijn in de overwegingen meegenomen als extra informatie.
De drie studies (Borge 2014; Valenza 2016; Xi 2015) die zijn geselecteerd, onderzochten ventilatiefeedback (Borge 2014) of combinaties van verschillende ademhalingstechnieken (Valenza 2014; Xi 2015) en vergeleken de interventie met gebruikelijke zorg (‘usual care’) of een groep die vergelijkbare therapie ontving zonder ademhalingstechnieken. De studies includeerden patiënten met gemiddelde tot ernstige COPD (Borge 2015; Xi 2015) of patiënten die net waren opgenomen in het ziekenhuis met een acute longaanval (Valenza 2016). De drie studies zijn toegevoegd aan de SR van Holland (2012).
Samenvatting literatuur
Beschrijving studies
De 11 geïncludeerde studies beschrijven effecten van vier ademhalingsinterventies: ‘pursed lip breathing’ (PLB, 4 studies, totaal 130 patiënten met stabiele COPD), diafragma-ademhaling (1 studie, 20 patiënten met stabiele COPD), ventilatiefeedback (3 studies, 281 patiënten met stabiele COPD) en gecombineerde/andere ademhalingstechnieken (3 studies, 265 patiënten met stabiele COPD).
In de studie van Holland (2012) is niet altijd gerapporteerd in welke condities (in rust of tijdens activiteiten) of in welke setting de ademhalingstechniek werd toegepast. In de studies werd de ademhalingstechniek vergeleken met geen ademhalingstechniek of werd een oefenprogramma plus de ademhalingstechniek vergeleken met alleen het oefenprogramma.
In de drie studies naar ventilatiefeedback (ook wel biofeedback) werd begeleide diepe ademhaling toegepast in rust, met ventilatiefeedback tijdens inspanning en ventilatiefeedback in onbekende setting.
Gecombineerde/andere ademhalingsinterventies omvatten veelal een combinatie van ademhalingstechnieken zoals PLB, actieve expiratie, buikademhaling of diafragma-ademhaling, en gecontroleerde ademhaling in combinatie met het uitvoeren van oefeningen/activiteiten.
Een gedetailleerd overzicht van de geïncludeerde studies is online beschikbaar als ‘Bijlage Evidencetabellen (opent in nieuw tabblad)’.
Individuele studiekwaliteit
De opzet en uitvoering van de individuele studies (‘risk of bias’; RoB) is beoordeeld met behulp van de Cochrane Risk-of-Biastool. Dit literatuuronderzoek naar ademhalingstechnieken bevat in totaal 11 studies; acht studies uit de review van Holland 2012 en drie recente studies uit de update. Uit deze 11 studies zijn de resultaten op de uitkomstmaten kortademigheid, fysieke capaciteit en kwaliteit van leven (KvL) geëxtraheerd. De beoordeling van de individuele studiekwaliteit van de 11 geïncludeerde studies is opgenomen in de volgende tabel.
Risk of bias: Ademhalingstechnieken

Pursed lip breathing (PLB)
Kortademigheid
Kortademigheid is, bij vergelijking van PLB versus geen ademhalingstraining, gemeten met de ‘modified Medical Research Council Dyspnoe vragenlijst’ (mMRC) en de ‘California San Diego Shortness of Breath Questionnaire’ (CSDSBQ). Meteen na de interventie blijkt uit twee studies (Nield 2007; Zhang 2008) onder 49 patiënten, dat bij patiënten met COPD PLB een matig effect heeft op kortademigheid ten opzichte van geen ademhalingstraining (SMD = -0,75; 95%-BI = -1,34 tot -0,17).
De bewijskracht voor de uitkomstmaat kortademigheid is met 2 niveaus verlaagd op basis van de beperkingen in de studieopzet en -uitvoering (RoB) en met 1 niveau op basis van het geringe aantal patiënten (imprecisie) voor de studies van Nield (2007) en Zhang (2008). De bewijskracht is zeer laag.
Fysieke capaciteit
De 6MWT is gebruikt om fysieke capaciteit te meten bij de vergelijking van PLB versus geen ademhalingstraining. Acht weken na de interventie blijkt uit één studie (Zhang 2008) onder 30 patiënten, dat bij patiënten met COPD PLB een zeer groot effect heeft op de fysieke capaciteit ten opzichte van geen ademhalingstraining (SMD = 2,71; 95%-BI = 1,68 tot 3,73).
De bewijskracht voor de uitkomstmaat fysieke capaciteit is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (RoB) en het geringe aantal patiënten (imprecisie) voor de studie van Zhang (2008). De bewijskracht is zeer laag.
Kwaliteit van leven
De aan kortademigheid gerelateerde kwaliteit van leven is subjectief beoordeeld met de Hirastsuka-schaal bij de vergelijking van PLB versus geen ademhalingstraining. Uit twee studies (Wu 2006; Zhang 2008) onder in totaal 60 patiënten, blijkt volgens de ‘Hirastsuka Scale’ dat bij patiënten met COPD PLB een matig effect heeft op de kwaliteit van leven ten opzichte van geen ademhalingstraining (SMD = -0,71; 95%-BI = -1,25 tot -0,17). De bewijskracht voor de uitkomstmaat kwaliteit van leven is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (RoB) en het geringe aantal patiënten (imprecisie) voor de studies van Wu (2006) en Zhang (2008). De bewijskracht is zeer laag.
Ongewenste voorvallen
Het risico op ongewenste voorvallen is onbekend; dergelijke voorvallen zijn niet gerapporteerd.
Voor ongunstige effecten is geen GRADE-beoordeling van de bewijskracht uitgevoerd; er zijn geen studies die ongewenste voorvallen rapporteren.
Een overzicht van de effecten en de bewijskracht op alle uitkomsten is weergegeven in de volgende tabel.
GRADE-evidenceprofiel pursed lip breathing
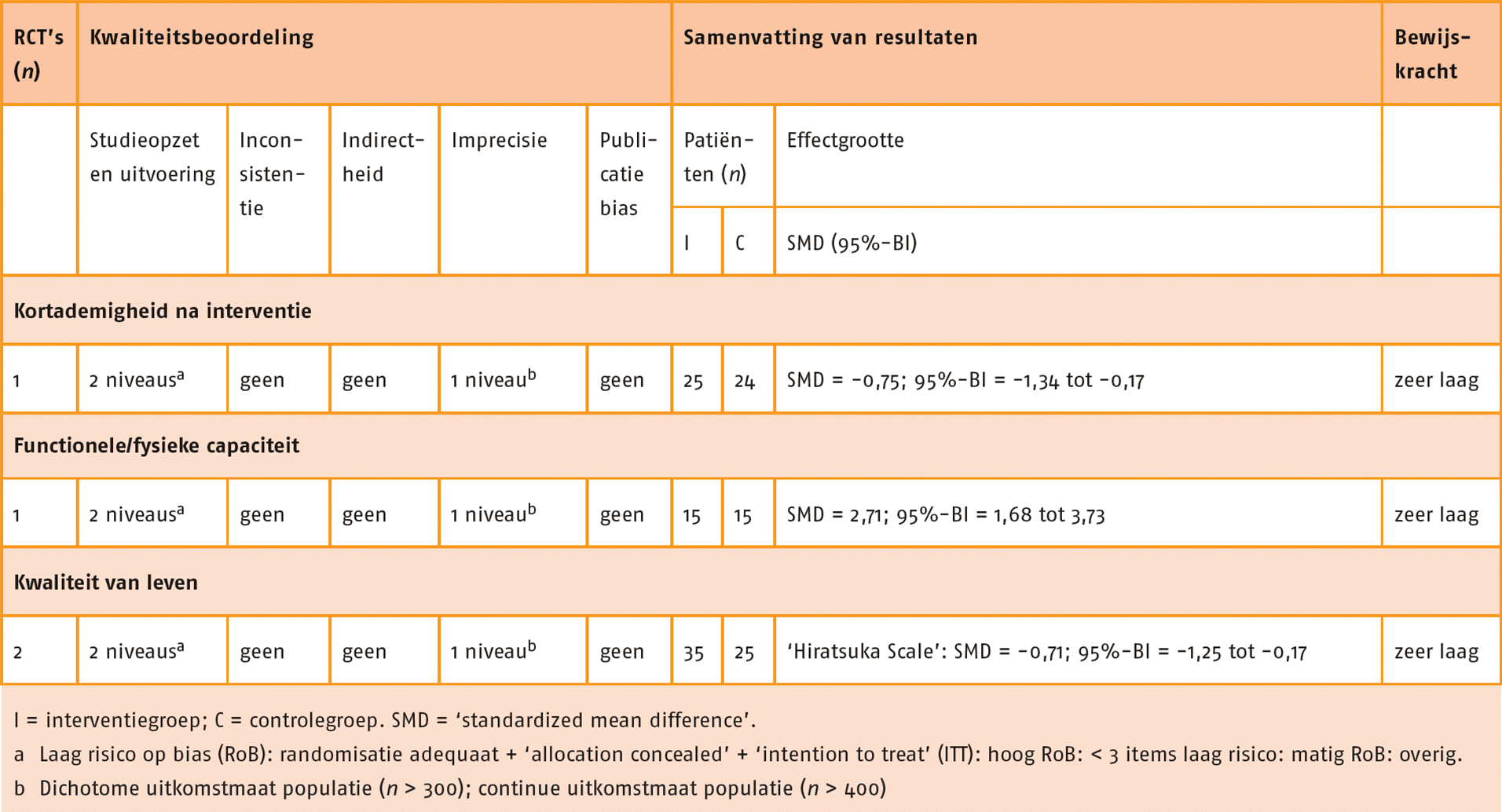
Overwegingen PLB
De overwegingen en aanbevelingen komen voort uit de discussies die in de werkgroep zijn gevoerd aan de hand van evidence-to-decisionformulieren. Zie bijlage C.4.2 (opent in nieuw tabblad).
De overwegingen betroffen:
Gewenste effecten Het toepassen van PLB heeft een matig effect op kortademigheid en op de kwaliteit van leven, en een zeer groot effect op de fysieke capaciteit.
Ongewenste effecten Er is een klein ongewenst effect. Verstoring van de regulatie van de ademhaling is mogelijk, maar wordt zelden gezien in praktijk. Soms denken patiënten dat ze altijd PLB moeten toepassen, maar door inzicht te krijgen in de toepassing ervan lukt het hen om PLB op het juiste moment toe te passen. Kortademigheid bij het verkeerd toepassen van de techniek is mogelijk. Men is het, in eerste instantie, niet gewend. Door de techniek samen met de therapeut meerdere keren kort te oefenen, kunnen patiënten met COPD de techniek alsnog leren zonder kortademig te worden. PLB kan ook heel goed werken bij het herstellen na kortademigheid.
Kwaliteit gewenste effecten De kwaliteit van de gewenste effecten is zeer laag.
Balans tussen gewenste en ongewenste effecten Er is een gunstige balans van gewenste en ongewenste effecten. Er zijn nauwelijks ongewenste effecten en alleen positieve effecten van deze ademhalingstechniek. De gunstige effecten overtreffen de ongunstige effecten.
Waarde aan gewenste effecten Er wordt een redelijke waarde toegekend aan de gewenste effecten. Patiënten doen PLB in principe automatisch, maar doen ze dat niet, dan is het wel belangrijk om PLB aan te leren.
Evalueer de kortademigheid altijd met een Borgschaal, want PLB werkt niet bij iedereen meteen of mogelijk averechts. Bij patiënten die PLB al automatisch toepassen, is het vaak belangrijk om ze hiervan bewust te maken en uit te leggen in welke situaties zij PLB nog meer kunnen toepassen. Patiënten hechten redelijk waarde aan PLB, met name bij inspanning of voor toename van het inspanningsvermogen (Gosselink 2016).
Variatie in waarde aan gewenste effecten Er is matige variatie in de waarde die wordt toegekend aan de effecten, omdat veel patiënten PLB al toepassen. Bij de patiënten die PLB nog niet toepassen, wordt meer waarde aan de gewenste effecten gehecht.
Benodigde middelen (kosten) Er zijn geen extra kosten verbonden aan de interventie en de interventie levert ook vrijwel geen besparingen op. Voor de therapeut is echter wel extra scholing nodig.
Variatie in benodigde middelen (kosten) Niet gerapporteerd.
Kosteneffectiviteit Geen studies bekend.
Aanvaardbaarheid Er zijn geen redenen om aan te nemen dat het implementeren van deze interventie niet aanvaardbaar is.
Haalbaarheid Er zijn geen redenen om aan te nemen dat het implementeren van deze interventie niet haalbaar is.
PLB is een veilige en makkelijk toe te passen interventie met positieve resultaten en nauwelijks tot geen ongewenste effecten. Er is wat variatie in de effecten en de kwaliteit van het wetenschappelijk bewijs is zeer laag. Het is belangrijk PLB aan te leren bij patiënten die het nog niet kunnen en om patiënten die het automatisch doen zich hiervan bewust te maken en uit te leggen in welke situaties ze PLB nog meer kunnen toepassen.
Diafragma-ademhaling
Kortademigheid
Kortademigheid is bij de vergelijking van diafragma-ademhaling versus geen ademhalingstraining gemeten met de mMRC. Vier weken na de interventie blijkt uit één studie (Yamaguti 2012) onder 30 patiënten (stabiele COPD met gemiddelde FEV1 42%), dat bij patiënten met COPD diafragma-ademhaling een klein effect heeft op kortademigheid ten opzichte van geen ademhalingstraining (SMD = -0,38; 95%-BI = -1,11 tot 0,34).
De bewijskracht voor de uitkomstmaat kortademigheid is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (RoB) en het geringe aantal patiënten (imprecisie) voor de studie van Yamaguti (2012). De bewijskracht is laag.
Fysieke capaciteit
Voor fysieke capaciteit is bij de vergelijking van diafragma-ademhaling versus geen ademhalingstraining de 6MWT gebruikt. Vier weken na de interventie blijkt uit één studie (Yamaguti 2012) onder 30 patiënten, dat bij patiënten met COPD diafragma-ademhaling een matig tot groot effect heeft op de fysieke capaciteit ten opzichte van geen ademhalingstraining (SMD = 0,79; 95%-BI = 0,04 tot 1,54).
De bewijskracht voor de uitkomstmaat fysieke capaciteit is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (RoB) en het geringe aantal patiënten (imprecisie) voor de studie van Yamaguti (2012). De bewijskracht is laag.
Kwaliteit van leven
De SGRQ is gebruikt om kwaliteit van leven te meten bij de vergelijking van diafragma-ademhaling versus geen ademhalingstraining. Vier weken na de interventie blijkt uit één studie (Yamaguti 2012) onder 30 patiënten, dat bij patiënten met COPD diafragma-ademhaling een groot effect heeft op de kwaliteit van leven ten opzichte van geen ademhalingstraining (SMD = -1,01; 95%-BI = -1,77 tot -0,24).
De bewijskracht voor de uitkomstmaat kwaliteit van leven is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (RoB) en het geringe aantal patiënten (imprecisie) voor de studie van Yamaguti (2012). De bewijskracht is laag.
Ongewenste effecten
Het risico op ongunstige effecten is onbekend, deze zijn niet gerapporteerd.
Voor ongewenste effecten is geen GRADE-beoordeling van de bewijskracht uitgevoerd, er zijn geen studies die ongunstige effecten rapporteren.
Een overzicht van de effecten en de bewijskracht op alle uitkomsten is weergegeven in de volgende tabel.
GRADE-evidenceprofiel diafragma-ademhaling

Overwegingen diafragma-ademhaling
De overwegingen en aanbevelingen komen voort uit de discussies die in de werkgroep zijn gevoerd aan de hand van evidence-to-decisionformulieren. Zie bijlage C.4.2 (opent in nieuw tabblad).
De overwegingen betroffen:
Gewenste effecten De literatuur laat diverse positieve effecten (klein, matig en groot) zien op de drie uitkomstmaten.
Ongewenste effecten Uit andere studies dan de geïncludeerde studies komt naar voren komt dat diafragmaademhaling niet altijd positieve effecten heeft. Deze studies zijn geëxcludeerd voor het literatuuronderzoek in deze richtlijn vanwege het studiedesign, omdat er veelal niet werd vergeleken met een controlegroep. Twee studies (Gosselink 1995; Vitacca 1998) geven aan dat diafragma-ademhaling negatieve effecten heeft op onder andere bewegingen van de borstkas, mechanische efficiëntie en de mate van kortademigheid. Het effect van diafragma-ademhaling is volgens Cahalin (2002) en Gosselink (2004) nog steeds onduidelijk; het is nog niet duidelijk uit de literatuur voor welke patiënten diafragma-ademhaling wel of niet effectief is. Diafragmaademhaling kan niet helpen bij ernstige COPD in geval van (ernstige) hyperinflatie. Bij diafragma-ademhaling ligt de focus op het activeren van het diafragma tijdens ademhaling en tegelijkertijd het minimaliseren van activiteiten van andere spiergroepen. Bij ernstige COPD met hyperinflatie is de slechte bewegingsmogelijkheid van het diafragma door de hyperinflatie een reden voor de mogelijke wegblijvende en negatieve effecten van diafragma-ademhaling op kortademigheid (Cahalin 2002). Aanvullend wordt diafragma-ademhaling onwenselijk beschouwd bij patiënten met het teken van Hoover. Bij ernstige benauwdheid of ernstige hyperinflatie dient de interventie niet te worden toegepast.
Het literatuuronderzoek in deze richtlijn laat wel positieve resultaten zien op kortademigheid en kwaliteit van leven en functionele capaciteit (waarvan de laatste twee uitkomstmaten niet zijn meegenomen in de andere studies). Dit resultaat is gebaseerd op 1 studie onder 30 patiënten. De studie van Yamaguti (2012) haalt ook bovengenoemde studies aan en geeft aan dat er verschillen zijn in onder andere de studieopzet en -populatie. Wel laat hun interventie positieve resultaten zien bij deze groep patiënten, of dat ook zo is bij een groep patiënten met ernstigere COPD (zoals bij de hiervoor genoemde studies) moet verder worden onderzocht. Vanwege de beperkte bewijslast en doelgroep in het onderzoek van Yamaguti en de aanvullende overige overwegingen van de doelgroep, worden de ongewenste effecten gesteld op matig. De kwaliteit van de gewenste effecten is laag volgens GRADE.
Balans tussen gewenste en ongewenste effecten In de praktijk zijn wisselende effecten gezien (net als in de literatuur). Aangegeven wordt dat bij het overgrote deel van de patiënten, door aanwezigheid van hyperinflatie de ongunstige effecten groter zijn dan de gunstige effecten. Mogelijk heeft diaframaal ademen bij een kleine groep patiënten positieve effecten en zou dan de moeite waard kunnen zijn.
Waarde aan gewenste effecten Men hecht er weinig waarde aan; bij mensen met een hyperinflatiestand kun je de techniek diafragmaal ademen niet aanleren.
Variatie in waarde aan gewenste effecten Er is variatie in de effecten, omdat effecten mede afhankelijk zijn van de voorwaarde om tot goede uitvoering te komen (afhankelijk van houding, ontspanning en kracht) en van de context van de patiënt. Ook uit de literatuur blijkt nog veel discussie over de effecten.
Benodigde middelen (kosten) Er is niets extra’s nodig voor het toepassen van deze interventie. Het aanleren van diafragma-ademhaling kost echter wel veel tijd, evenals het toepassen ervan. Die tijd gaat af van de behandeltijd die ook besteed kan worden aan het oefenen. Daarnaast zijn er andere ademhalingstechnieken (zoals PLB) waarvan het aanleren minder tijdrovend is en die hetzelfde effect hebben. Echter, PLB heeft wel een ander doel (PLB is gericht op kortademigheid) dan diafragma-ademhaling (ter bevordering van de ventilatie) (Gosselink 2016). Ter bevordering van de ventilatie kan het aanleren van diafragma-ademhaling een optie zijn.
Variatie in benodigde middelen (kosten) Geen.
Kosteneffectiviteit Geen studies bekend.
Aanvaardbaarheid Vanwege inhoudelijke bezwaren van experts uit het werkveld over de werkingsmechanismen en mogelijke negatieve effecten en het beperkte bewijs is de aanvaardbaar waarschijnlijk onvoldoende aanwezig.
Haalbaarheid Gezien de beperkt aanwezige aanvaardbaarheid is toepassing van deze interventie waarschijnlijk niet realistisch.
Er is één RCT bekend over diafragma-ademhaling dat matig-positieve resultaten rapporteert; de gerapporteerde kwaliteit van bewijs is echter laag. De effecten in de praktijk en uit de narratieve literatuur variëren sterk en het is nog niet duidelijk bij welke patiëntengroep diafragma-ademhaling wel of niet werkt. Er zijn aanwijzingen dat bij (ernstige) hyperinflatie het toepassen van diafragma-ademhaling geen toegevoegde waarde heeft, aangezien beweeglijkheid van het diafragma niet of nauwelijks meer mogelijk is door de hyperinflatie.
Aanvullend wordt benoemd om bij aanwezigheid van het teken van Hoover of ernstige kortademigheid de diafragma-ademhaling niet toe te passen.
In het algemeen wordt er een conditionele aanbeveling gedaan tegen het gebruik van diafragma-ademhaling. Bij patiënten met stabiele COPD (vergelijkbaar met de patiënten in het onderzoek van Yamaguti 2012) bij wie geen hyperinflatie aanwezig is (FEV1 circa 42%) zou men diafragma-ademhaling kunnen overwegen ter bevordering van de ventilatie.
Ventilatiefeedback
Kortademigheid
Kortademigheid is bij de vergelijking van ventilatiefeedback versus geen ademhalingstraining gemeten met de Borgschaal of de MRC-dyspnoeschaal. Uit drie studies (Borge 2015; Collins 2008; Van Gestel 2011) onder 164 patiënten, blijkt dat bij patiënten met COPD ventilatiefeedback een klein effect heeft op kortademigheid ten opzichte van geen ademhalingstraining (SMD = -0,41; 95%-BI = -0,71 tot -0.1).
De bewijskracht voor de uitkomstmaat kortademigheid is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (RoB) en het geringe aantal patiënten (imprecisie) voor de studies van Borge (2015), Collins (2008) en van Gestel (2011). De bewijskracht is zeer laag.
Fysieke capaciteit
De 6MWT is gebruikt om fysieke capaciteit te meten bij de vergelijking van ventilatiefeedback versus geen ademhalingstraining. Vier weken na de interventie blijkt uit één studie (Van Gestel 2011) onder 40 patiënten, dat bij patiënten met COPD ventilatietechniek een klein effect heeft op de fysieke capaciteit ten opzichte van geen ademhalingstraining (SMD = -0,33; 95%-BI = -0,95 tot 0,30). 15 weken na de interventie blijkt uit één studie (Collins 2008) onder 33 patiënten, dat bij patiënten met COPD ventilatietechniek een klein effect heeft op de fysieke capaciteit ten opzichte van geen ademhalingstraining (SMD = 0,44; 95%-BI = -0,25 tot 1,13).
De bewijskracht voor de uitkomstmaat fysieke capaciteit bij de vergelijking van ventilatiefeedback versus geen ademhalingstraining na vier weken is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (‘risk of bias’), en het geringe aantal patiënten (imprecisie) (Van Gestel 2011). De bewijskracht is zeer laag.
De bewijskracht voor de uitkomstmaat fysieke capaciteit bij de vergelijking van ventilatiefeedback versus geen ademhalingstraining na 15 weken is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (RoB), het geringe aantal patiënten (imprecisie) en de kans op publicatiebias lijkt reëel (Collins 2008). De bewijskracht is zeer laag.
Kwaliteit van leven
Kwaliteit van leven is gemeten met de SGRQ bij de vergelijking van ventilatiefeedback versus geen ademhalingstraining. Uit drie studies (Borge 2015; Collins 2008; Van Gestel 2011) onder 166 patiënten, blijkt dat bij patiënten met COPD ventilatietechniek een klein effect heeft op de kwaliteit van leven ten opzichte van geen ademhalingstraining (SMD = 0,20; 95%-BI = -0,32 tot 0,72).
De bewijskracht voor de uitkomstmaat kwaliteit van leven is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (RoB), tegenstrijdige resultaten (inconsistentie) en het geringe aantal patiënten (imprecisie) voor de studies van Borge (2015), Collins (2008) en Van Gestel (2011). De bewijskracht is zeer laag.
Ongewenste effecten
Het risico op ongunstige effecten is onbekend, deze zijn niet gerapporteerd.
Voor ongunstige effecten is geen GRADE-beoordeling van de bewijskracht uitgevoerd; er zijn geen studies die ongunstige effecten rapporteren.
Een overzicht van de effecten en de bewijskracht op alle uitkomsten is weergegeven in de volgende tabel.
GRADE-evidenceprofiel ventilatiefeedback
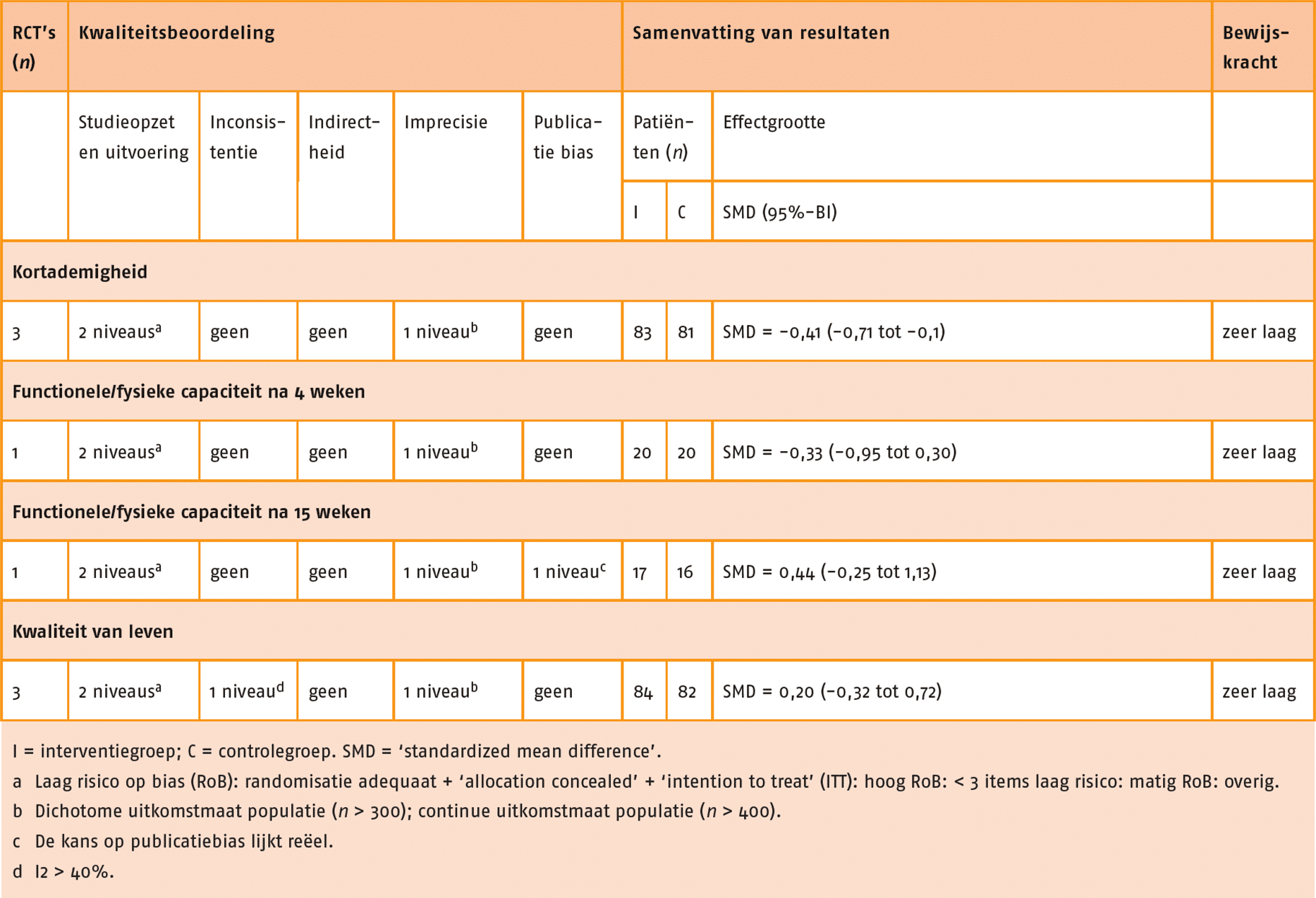
Overwegingen ventilatiefeedback
De overwegingen en aanbevelingen komen voort uit de discussies die in de werkgroep zijn gevoerd aan de hand van evidence-to-decisionformulieren. Zie bijlage C.4.2 (opent in nieuw tabblad).
Deze overwegingen betreffen:
Gewenste effecten Er is een klein effect voor alle drie de uitkomstmaten voor ventilatiefeedback (in rust en inspanning).
Ongewenste effecten Ventilatiefeedback is niet geschikt voor elke patiënt want het kost veel energie.
Kwaliteit gewenste effecten Deze is zeer laag volgens GRADE.
Balans tussen gewenste en ongewenste effecten Over het algemeen zijn er geen grote ongewenste effecten, maar wel kleine positieve effecten van deze ademhalingstechniek. De gunstige effecten overtreffen waarschijnlijk de ongunstige effecten.
Waarde aan gewenste effecten Men hecht waarde aan ventilatiefeedback. Het is belangrijk dat patiënten zelf leren voelen/ervaren/inschatten hoe het met hen gaat, waarmee de eigen regie bevorderd wordt. Hiermee geef je de patiënt terug wat deze onbewust al doet en kun je aspecten makkelijk uitleggen en de patiënt stimuleren om ermee te spelen. Het helpt om instructies te geven en metingen te doen.
Variatie in waarde aan gewenste effecten Er is matige variatie in de effecten, omdat ventilatiefeedback niet op iedere patiënt toe te passen is, omdat de techniek erg veel energie vraagt van de patiënt. Je kunt ventilatiefeedback alleen in de praktijk zelf gebruiken; het apparaat kan niet door de patiënt mee naar huis genomen worden.
Benodigde middelen (kosten) Er is een heel duur apparaat nodig dat de mate van in- en uitademen meet en daaraan feedback koppelt. Bij dit apparaat hoort ook gerichte software die je niet mee kunt geven aan de patiënt.
Variatie in benodigde middelen (kosten) Er zijn verschillende apparaten beschikbaar, maar de variatie in kosten is niet heel hoog.
Kosteneffectiviteit Geen studies bekend.
Aanvaardbaarheid Waarschijnlijk is ventilatiefeedback niet aanvaardbaar gezien de beperkte effectiviteit en hoge kosten.
Haalbaarheid Waarschijnlijk niet haalbaar
Ventilatiefeedback heeft een klein effect en de aanschafkosten van de apparatuur zijn hoog. De interventie kan uitgevoerd worden door de therapeut die in de praktijk over het apparaat beschikt. De interventie kan beter niet toegepast worden als de patiënt hier te vermoeid voor is. Deze overweging heeft geleid tot een conditionele aanbeveling tegen de therapie in het algemeen. Mocht de therapeut het apparaat in de praktijk hebben, dan kan het ingezet worden en inzichtgevend werken.
Gecombineerde ademhalingsinterventies
Kortademigheid
Kortademigheid is gemeten bij de vergelijking van gecombineerde ademhalingstechnieken versus geen ademhalingstraining. Uit drie studies (Valenza 2014; Xi 2015; Zhang 2008) onder 138 patiënten blijkt dat bij patiënten met COPD gecombineerde ademhalingstechnieken een groot effect hebben op kortademigheid ten opzichte van geen ademhalingstraining (SMD = -0,90; 95%-BI = -1,90 tot 0,11).
De bewijskracht voor de uitkomstmaat kortademigheid is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (RoB) en met één niveau gezien het geringe aantal patiënten (imprecisie) voor de studies van Valenza (2014), Xi (2015) en Zhang (2008). De bewijskracht is zeer laag.
Fysieke capaciteit
De 6MWT is gebruikt om de fysieke capaciteit te meten bij de vergelijking van gecombineerde ademhalingstechnieken versus geen ademhalingstraining. Acht weken na de interventie blijkt uit één studie (Zhang 2008) onder 32 patiënten, dat bij patiënten met COPD gecombineerde ademhalingstechnieken een zeer groot effect hebben op de fysieke capaciteit ten opzichte van geen ademhalingstraining (SMD = 4,53; 95%-BI = 3,15 tot 5,90). Een andere studie (Xi 2015) onder 60 patiënten laat zien dat direct na een interventie van een jaar bij patiënten met COPD gecombineerde ademhalingstechnieken een zeer groot effect hebben op de fysieke capaciteit ten opzichte van geen ademhalingstraining (SMD = 2,35; 95%-BI = 1,69 tot 3,02).
De bewijskracht voor de uitkomstmaat fysieke capaciteit acht weken na de interventie is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (RoB) en en met één niveau gezien het geringe aantal patiënten (imprecisie) voor de studie van Zhang (2008). De bewijskracht is zeer laag.
De bewijskracht voor de uitkomstmaat fysieke capaciteit na één jaar (direct na de interventie) is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (RoB) en één niveau gezien het geringe aantal patiënten (imprecisie) voor de studie van Xi (2015). De bewijskracht is zeer laag.
Kwaliteit van leven
De kwaliteit van leven is gemeten met de SGRQ bij de vergelijking van gecombineerde ademhalingstechnieken versus geen ademhalingstraining. Uit twee studies (Xi 2015; Zhang 2008) onder 92 patiënten blijkt dat bij patiënten met COPD gecombineerde ademhalingstechnieken een klein effect hebben op de kwaliteit van leven ten opzichte van geen ademhalingstraining (SMD = -0,91; 95%-BI = -1,35 tot -0,48).
Uit één studie (Sun 2003) onder 89 patiënten, blijkt volgens de CAI bij patiënten met gecombineerde ademhalingstechnieken een groot effect op kwaliteit van leven ten opzichte van geen ademhalingstraining (SMD =
-0,89; 95%-BI = -1,32 tot -0,45 ).
De bewijskracht voor de uitkomstmaat kwaliteit van leven is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (RoB) en één niveau gezien het geringe aantal patiënten (imprecisie) voor de studies van Xi (2015) en Zhang (2008). De bewijskracht is zeer laag.
De bewijskracht voor de uitkomstmaat kwaliteit van leven met de totaalscore op de CAI is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (RoB) en één niveau gezien het geringe aantal patiënten (imprecisie) voor de studie van Sun (2003). De bewijskracht is zeer laag.
Ongunstige effecten
Het risico op ongunstige effecten is onbekend, deze zijn niet gerapporteerd.
Voor ongewenste effecten is geen GRADE-beoordeling van de bewijskracht uitgevoerd; er zijn geen studies die ongunstige effecten rapporteren.
Een overzicht van de effecten en de bewijskracht op alle uitkomsten is weergegeven in de volgende tabel.
GRADE-evidenceprofiel van andere/gecombineerde ademhalingsinterventies
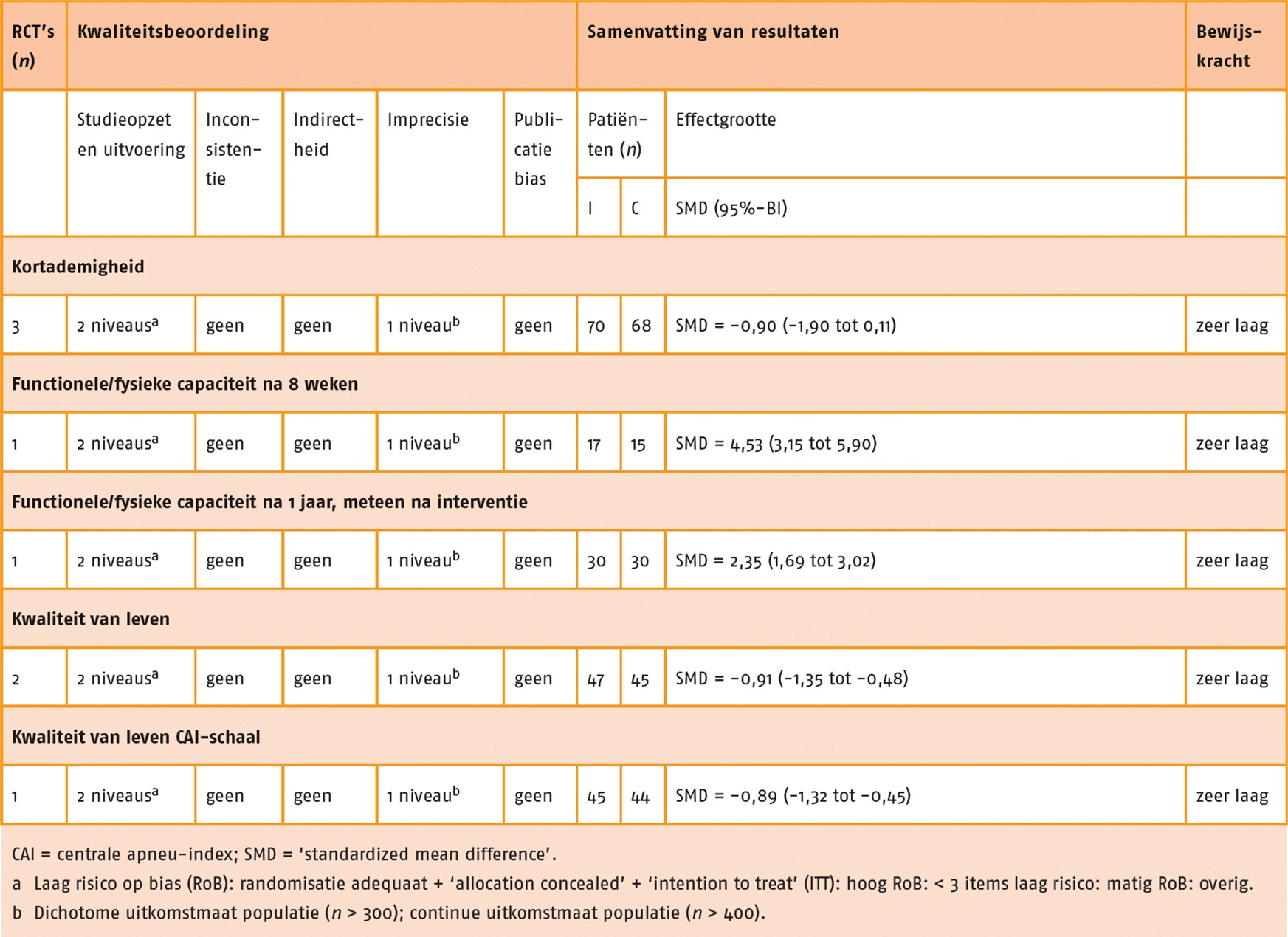
Overwegingen gecombineerde ademhalingsinterventies
De overwegingen en aanbevelingen komen voort uit de discussies die in de werkgroep zijn gevoerd aan de hand van evidence-to-decisionformulieren. Zie bijlage C.4.2 (opent in nieuw tabblad).
De overwegingen betreffen:
Gewenst effect Er is een (zeer) groot effect voor alle drie de uitkomstmaten.
Ongewenste effecten Hier is goede individuele begeleiding mogelijk en er zijn geen ongewenste effecten.
Kwaliteit gewenste effecten Zeer laag volgens GRADE.
Balans gewenste-ongewenste effecten Over het algemeen zijn er geen ongewenste, maar vooral positieve effecten van een gecombineerde interventie. De gunstige effecten overtreffen de ongunstige effecten.
Waarde aan gewenste effecten Een combinatie van ademhalingsinterventies biedt de mogelijkheid om samen met de patiënt na te gaan wat werkt in de dagelijkse setting van de patiënt. Houd het vooral functioneel, en probeer verschillende mogelijkheden. In alle studies werd PLB toegepast en mogelijk verklaart dit het grote effect. Het is belangrijk om in ieder geval PLB toe te passen.
Variatie in waarde aan gewenste effecten Er is matige variatie in de effecten, omdat het soms zoeken is wat werkt voor de patiënt en omdat afstemming van verschillende interventies inspanning vergt. Focus daarbij op één techniek, probeer niet teveel tegelijk. Effecten kunnen elkaar tegenwerken of niet samengaan, zoals PLB niet in combinatie met diafragma-ademhaling kan worden toegepast. Begin met één techniek en kijk daarna op welk gebied nog aanvulling nodig is; de keuze is afhankelijk van het doel.
Benodigde middelen (kosten) Het ligt eraan welke interventies je combineert.
Variatie in benodigde middelen (kosten) Het ligt aan de combinatie van interventies, daardoor kan de variatie matig zijn.
Aanvaardbaarheid Een combinatie van ademhalingstechnieken lijkt aanvaardbaar.
Haalbaarheid Een combinatie van ademhalingstechnieken lijkt haalbaar.
Een gecombineerde ademhalingsinterventie wordt ervaren als een zeer prettige interventie omdat zo’n interventie individuele begeleiding en zorg op maat mogelijk maakt. Het is een veilige en makkelijke toe te passen interventie met positieve resultaten en geen ongewenste effecten. Er is wat variatie in de effecten, omdat het soms zoeken is wat werkt voor de patiënt en afstemming van verschillende interventies vergt inspanning. PLB lijkt in ieder geval belangrijk.
Dit heeft geleid tot een conditionele aanbeveling voor een gecombineerde ademhalingsinterventie, waarbij ten minste PLB toegepast wordt. Daarnaast dient de toepassing van ademhalingsinterventies gecombineerd te worden met beweeginterventies. De technieken dienen aangeleerd te worden bij activiteiten in het dagelijks leven waarbij de patiënt hinder ondervindt als gevolg van kortademigheid. Aanbevolen wordt om niet direct meerdere ademhalingstechnieken aan te leren, maar na instructie van een ademhalingstechniek te beoordelen welke additionele ademhalingsinterventie van toegevoegde waarde zou kunnen zijn.
- Borge CR, Hagen KB, Mengshoel AM, Omenaas E, Moum T, Wahl AK. Effects of controlled breathing exercises and respiratory muscle training in people with chronic obstructive pulmonary disease: results from evaluating the quality of evidence in systematic reviews. BMC Pulm Med. 2014;14:184.
- Collins EG, Fehr L, Bammert C, O’Connell S, Laghi F, Hanson K, et al. Effect of ventilation-feedback training on endurance and perceived breathlessness during constant work-rate leg-cycle exercise in patients with COPD. J Rehabil Res Dev. 2003;40:35-44.
- Collins EG, Langbein WE, Fehr L, Bammert C, O’Connell S, Hagarty E, et al. Can ventilation-feedback training augment exercise tolerance in patients with COPD? American Thoracic Society 2005 International Conference; 2005; San Diego California. 2005; Vol. A26, Poster 511.
- Collins EG, Langbein WE, Fehr L, Bammert C, O’Connell S, Hanson K, et al. Can ventilation-feedback training decrease exertional dyspnoea and improve exercise tolerance in patients with COPD? (Abstract). American Thoracic Society 99th International Conference. 2003; Vol. B023, Poster 910
- Collins EG, Langbein WE, Fehr L, O’Connell S, Jelinek C, Hagarty E, et al. Can ventilation-feedback training augment exercise tolerance in patients with chronic obstructive pulmonary disease? Am J Resp Crit Care Med. 2008;177:844-52.
- Gosselink R, Decramer M. Revalidatie bij chronisch obstructieve longziekten. Houten: Springer Media B.V.; 2016. Holland AE, Hill CJ, Jones AY, McDonald CF. Breathing exercises for chronic obstructive pulmonary disease.
- Cochrane Database Syst Rev. 2012;10:CD008250.
- Nield M, Soo Hoo G, Roper J, Santiago S. Pursed-lips breathing decreases dyspnea and improves health-related quality of life in 4-group randomized, controlled study. Chest 2004;126:805S-a.
- Nield MA, Soo Hoo GW, Roper JM, Santiago S. Efficacy of pursed-lips breathing: a breathing pattern retraining strategy for dyspnea reduction. J Cardiopulm Rehabil Prev. 2007;27:237-44.
- Sun JX, Yin MX, Shao H, Li ZS, Li SW. Effect of respiratory muscle gymnastics on lung function and quality of life in the old patients with chronic obstructive pulmonary disease. Zhonghua Linchuang Kangfu Zazhi 2003;7:3698-9.
- Valenza MC, Valenza-Peña G, Torres-Sánchez I, González-Jiménez E, Conde-Valero A, Valenza-Demet G.Effectiveness of controlled breathing techniques on anxiety and depression in hospitalized patients with COPD: a randomized clinical Trial. Respir Care. 2014 Feb;59(2):209-15. Correction. Respir Care. 2016;61(11):e3.
- van Gestel AJ, Kohler M, Steier J, Teschler S, Russi EW, Teschler H. The effects of controlled breathing during pulmonary rehabilitation in patients with COPD. Respiration 2011;82: abstracts 67-107.
- van Gestel AJR, Kohler M, Steier J, Teschler S, Russi EW, Teschler H. The effect of controlled breathing during pulmonary rehabilitation in patients with COPD. Respiration. 2012;83:115-24.
- Wu X, Hou L, Bai W. Effects of breathing training on quality of life and activities of daily living in elderly patients with stable severe chronic obstructive pulmonary disease. Zhongguo Kangfu Yixue Zazhi 2006;21:307-10.
- Xi F, Wang Z, Qi Y, Brightwell R, Roberts P, Stewart A, Sim M, Wang W. Long-term effect of respiratory training for chronic obstructive pulmonary disease patients at an outpatient clinic: a randomised controlled trial. Clin Transl Med. 2015;4(1):31.
- Yamaguti W, Claudino R, Neto A, Moriya H, Gomes A, Chammas M, et al. Diaphragmatic breathing training in COPD patients: a randomized, controlled and blinded trial. Eur Resp Soc Ann Congress. 2010: P4901.
- Yamaguti WP, Claudino RC, Neto AP, Chammas MC, Gomes AC, Salge JM, et al. Diaphragmatic breathing training program improves abdominal motion during natural breathing in patients with chronic obstructive pulmonary disease: a randomized controlled trial. Arch Phys Med Rehabil. 2012;93(4):571-7.
- Zhang ZQ, Chen RC, Yang QK, Li P, Wang CZ, Zhang ZH. A randomized controlled trial study of pulmonary rehabilitation with respiratory physiology as the guide on prognosis in patients with chronic obstructive pulmonary disease. Chinese Critical Care Medicine 2008;20:607-10.
- Zhang ZQ, Chen RC, Yang QK, Li P, Wang CZ, Zhang ZH. Effects of respiratory training in relation to respiratory pathophysiology on respiratory muscle function and exercise tolerance in chronic obstructive pulmonary disease patients. J Clin Rehab Tissue Engineering Res 2008;12:3966-71.
C.4.3 Ontspanningstechnieken
Overweeg de inzet van ontspanningstechnieken bij patiënten met COPD die kortademig zijn, slaapproblemen hebben, gestrest zijn en/of hoge spierspanning hebben, om daarmee de kortademigheid, spanning en/of angst te verminderen. Bespreek met de patiënt waar de spanning/ angst door veroorzaakt kan worden.
Wanneer er sprake is van aanhoudende of zeer grote mate van angst (mogelijk zelfs paniek) bij kortademigheid, en wanneer het uitvoeren van ontspanningsoefeningen niet leidt tot angstreductie, overleg met behandelend arts of zorgcoördinator of er een indicatie is voor verwijzing naar een psycholoog.
Stem in samenspraak met de patiënt de ontspanningstechniek af op de voorkeuren van de patiënt, zodat de techniek ook thuis ingezet kan worden bij toegenomen kortademigheid.
Onderbouwing
Uitgangsvraag
Welke ontspanningstechnieken kan men uitvoeren ter vermindering van kortademigheid?
Aanleiding
Door kortademigheid ervaren patiënten mogelijk ernstige vermoeidheid, hoogstwaarschijnlijk mede veroorzaakt door slaapproblemen (Spruit 2017). Patiënten met COPD kunnen door kortademigheid en vermoeidheid ook gespannen, angstig of gestrest raken. Tevens kan er sprake zijn van een wisselwerking; door een toename in spanning kan de patiënt vermoeider en/of kortademiger raken (Halpin, 2016; Yilmaz, 2016). Welke ontspanningstechnieken je kunt uitvoeren, wordt in deze module uitgewerkt.
Literatuur en overwegingen
Ontspanningsoefeningen kunnen toegepast worden om kortademigheid te reduceren én bij geringe (passende) spanning of angst. Het is daarbij tevens belangrijk de patiënten te leren dat ze niet bang hoeven te zijn voor hun kortademigheid. Wanneer er echter sprake is van aanhoudende of zeer grote mate van angst (of paniek) bij kortademigheid, waarbij het uitvoeren van ontspanningsoefeningen niet tot angstreductie leidt, is overleg met de verwijzer noodzakelijk. Verwijzing naar een psycholoog kan vervolgens overwogen worden.
In het algemeen wordt aanbevolen om ontspanningstechnieken te integreren in de therapie. Het is daarbij belangrijk om ten aanzien van het type ontspanningsoefening rekening te houden met de voorkeur van de patiënt. In meerdere studies worden kleine positieve effecten aangetoond van ontspanningstechnieken op zowel het psychologisch welzijn als het respiratoir functioneren, waaronder kortademigheid (Cafarella 2012; Gosselink 2003; Hyland 2016; Yilmaz 2016; Volpato 2015).
Er zijn diverse ontspanningstechnieken die laagdrempelig ingezet kunnen worden in de therapie. Alle ontspanningstechnieken hebben een vorm van mentale focus. Dat het lichaam zijn of de eigen houding, het hier en nu, het in gedachten naar een ‘veilige plek’ gaan of abstractere aspecten, zoals tellen in een bepaalde volgorde. Veelal gaat het om het verleggen en concentreren van de aandacht.
Er is onderzoek gedaan naar de voorkeur van patiënten (met COPD) met betrekking tot zes ontspanningstechnieken (Hyland 2016). In dit onderzoek beoordeelden patiënten, na het uitvoeren van iedere techniek, hoe effectief deze was voor de vermindering van angst en kortademigheid en hoe waarschijnlijk ze het achtten dat ze deze techniek ook zouden blijven toepassen in de eigen situatie. Alle technieken kwamen positief naar voren uit het onderzoek, maar de volgende drie technieken werden als beste beoordeeld:
- ‘Guided imagery Patiënten denken aan een fijne plek waar ze zich gelukkig en ontspannen voelden en concentreren zich vervolgens op de ervaring die het verblijven op die mooie plek oproept.
- Progressieve spierrelaxatie (‘progressive muscle relaxation’) van Jacobson Deze techniek bestaat uit het bewust aanspannen en ontspannen van grote spiergroepen van de handen tot de voeten om zo de spierspanning te laten afnemen. Patiënten worden zich zo bewust van de spanningstoestand in de spieren.
- Tellen Patiënten tellen van één tot vijf en blijven dit herhalen.
De andere technieken die ook positief beoordeeld werden, maar in minder mate, waren:
- Woordherhaling Patiënten herhalen een betekenisloos woord, zodat ze dat woord gaan associëren met ontspanning.
- Positieve beeldspraak Patiënten krijgen de opdracht om een positieve emotie te genereren door zich een bal van licht voor te stellen die ze vult met stralen van geluk en liefde.
- Versimpelde vorm van Kundalini yoga Patiënten krijgen de instructie om zich te concentreren op het langzaam optillen en laten zakken van de hand.
Daarnaast lijkt progressieve spierrelaxatie een positief effect te hebben op kortademigheid, vermoeidheid en slaapproblemen en worden positieve bijeffecten gerapporteerd, zoals energieker, vrolijker, vredig of opgefrist zijn, en zich mentaal en fysiek verlicht voelen (Yilmaz 2017).
De onderzoekers (Hyland 2016) concluderen dat het belangrijk is om samen met de patiënt af te stemmen welke ontspanningstechniek bij hem past. Dit maakt het voor de patiënt makkelijker om de oefening thuis te blijven herhalen en in te zetten op het moment dat de kortademigheid toeneemt.
Behalve de genoemde ontspanningstechnieken zijn er nog meer technieken die mogelijk effectief zijn bij de behandeling van patiënten met COPD. Het was in het kader van deze richtlijn echter niet mogelijk om alle technieken te evalueren.
Voor het beantwoorden van de uitgangsvraag is in overleg met de werkgroep en de klankbordgroep besloten geen systematisch literatuuronderzoek uit te voeren. De literatuur over dit onderwerp is op niet-systematische wijze vergaard.
- Cafarella PA, Effing TW, Usmani ZA, Frith PA. Treatments for anxiety and depression in patients with chronic obstructive pulmonary disease: a literature review. Respirology. 2012;17(4):627-38.
- Gosselink R. Controlled breathing and dyspnea in patients with chronic obstructive pulmonary disease (COPD). Rehabil Res Dev. 2003;40(5 Suppl2):25-33.
- Hyland ME, Halpin DM, Blake S, Seamark C, Pinnuck M, Ward D, et al. Preference for different relaxation techniques by COPD patients: comparison between six techniques. Int J Chron Obstruct Pulmon Dis. 2016;11:2315-19.
- Spruit MA, Vercoulen JH, Sprangers MAG, Wouters EFM; FAntasTIGUE consortium. Fatigue in COPD: an important yet ignored symptom. Lancet Respir Med. 2017 Jul;5(7):542-4.
- Volpato E, Banfi P, Rogers SM, Pagnini F. Relaxation techniques for people with chronic obstructive pulmonary disease: a systematic review and a meta analysis. Evid Based Complement Alternat Med. 2015;2015:628365.
- Yilmaz CK, Kapucu S. The effect of progressive relaxation exercises on fatigue and sleep quality in individuals with COPD. Holist Nurs Pract. 2017;31(6):369-77.
C.4.5 Mucusklaring
Pas bij voorkeur technieken ter bevordering van mucusklaring toe bij patiënten met COPD (zowel bij stabiel COPD als bij een longaanval) en symptomatische hypersecretie.
Start met het aanleren van actieve ademhalingstechnieken waarmee de patiënt zelf de mucusklaring kan bevorderen.
Zet bij voorkeur een hulpmiddel in wanneer de patiënt de actieve ademhalingstechnieken onder de knie heeft, maar het sputum nog niet voldoende en/of efficiënt kan ophoesten (retentie).
Indien een hulpmiddel ingezet wordt, maak dan gebruik van ‘positive expiratory pressure’ (PEP) of ‘oscillating positive expiratory pressure’ (O-PEP).
Gebruik bij voorkeur geen passieve technieken zoals vibratie, percussie en/of houdingsdrainage.
Onderbouwing
Uitgangsvraag
Welke technieken voor het bevorderen van mucusklaring zijn aangewezen bij COPD?
Deze vraag is opgedeeld in de volgende subvragen:
- Welke technieken voor het bevorderen van mucusklaring zijn aangewezen bij patiënten met stabiel COPD?
- Welke technieken voor het bevorderen van mucusklaring zijn aangewezen bij COPD bij een longaanval?
Aanleiding
Veelvoorkomende symptomen van COPD zoals chronisch hoesten en verhoogde sputumproductie zijn gerelateerd aan een verhoogd risico op longaanvallen, ziekenhuisopname en voortijdig overlijden vanwege COPD (Burgel 2009; Ekberg-Aronsson 2005; Lange 1990; Prescott 1995). Wanneer een patiënt moeite heeft met het mobiliseren en evacueren van sputum uit de luchtwegen kunnen ondersteunende interventies worden ingezet om de mucusklaring te bevorderen en de complicaties die zijn geassocieerd met sputumretentie te verminderen. Mucusklaring kan worden bevorderd door middel van conventionele technieken, ademhalingstechnieken, gebruik van PEP-apparaten met of zonder trilling, maar ook de inzet van grotere en geavanceerdere apparatuur is een mogelijkheid.
De conventionele technieken zoals vibratie, percussie en houdingsdrainage (als opzichzelfstaande interventie) zijn ontstaan vanuit de gedachte dat de opgewekte trillingen het sputum zullen losmaken van de wand van de luchtwegen. Zij worden echter nog zelden uitgevoerd. De intrapulmonale luchtmassa, het vetweefsel, het spierweefsel, het longweefsel en de thoraxwand slorpen de trillingen op, wat deze technieken weinig effectief maakt. Bovendien zijn zij arbeidsintensief, patiënten zijn afhankelijk van de therapeut en de therapietrouw is laag.
Toepassing van actieve ademhalingstechnieken en gebruik van (O)-PEP-apparaten zijn daarentegen interventies die patiënten zelf kunnen inzetten. Actieve ademhalingstechnieken die patiënten kunnen aanle- ren om de mucusklaring te bevorderen zijn: de ‘active cycle of breathing technique’ (ACBT), huffen, ofwel de ‘forced expiration technique’ (FET), autogene drainage (AD) en ‘expiration with an open glottis in the lateral posture’ (ELTGOL). PEP-apparaten zorgen via een masker of mondstuk voor een positieve uitademingsdruk (‘positive expiratory pressure’; PEP). O-PEP-apparaten combineren de positieve uitademingsluchtdruk met een hoogfrequente oscillatie.
1 Welke technieken voor het bevorderen van mucusklaring zijn aangewezen bij patiënten met stabiel COPD?
Literatuur
PEP en O-PEP hebben waarschijnlijk zeer gunstige effecten op de kwaliteit van leven, kortademigheid en fysieke capaciteit. Mogelijk kunnen zij ook het risico op een longaanval verkleinen.
Er zijn geen studies gevonden naar de effecten van ademhalingstechnieken (ACBT, huffen/FET, AD of ELTGOL).
Overwegingen
Op basis van de gunstige effecten wordt een conditionele aanbeveling geformuleerd voor technieken ter bevordering van mucusklaring. Aanbevolen wordt om te starten met het aanleren van technieken waarmee de patiënt zelf de mucusklaring kan bevorderen. Wanneer de patiënt deze techniek onder de knie heeft, maar het sputum nog niet voldoende en/of efficiënt op kan hoesten (retentie), wordt aanbevolen een hulpmiddel in te zetten. Hierbij worden de PEP of O-PEP aanbevolen, gezien de aangetoonde effectiviteit van deze hulpmiddelen. Bij het gebruik van hulpmiddelen is het raadzaam de hygiëne te bespreken. Bij voorkeur worden geen passieve technieken toegepast, zoals vibratie, percussie of houdingsdrainage.
2 Welke technieken voor het bevorderen van mucusklaring zijn aangewezen tijdens een longaanval?
Bij patiënten met een longaanval worden geen of nauwelijks effecten gevonden van ademhalingstechnieken, manuele technieken en gebruik van PEP op kwaliteit van leven, kortademigheid, opnameduur, beademing, fysieke capaciteit en toekomstige longaanvallen en longgerelateerde ziekenhuisopname (gewenste effecten) en minor adverse events en mortaliteit (ongewenste effecten). Er zijn alleen aanwijzingen gevonden dat ademhalingstechnieken mogelijk de kortademigheid kunnen verminderen en dat PEP bij patiënten met non-invasieve (NIV) beademing mogelijk de duur van deze beademing met twee dagen kan verkorten.
Overwegingen
Hoewel de effecten van technieken ter bevordering van mucusklaring beperkt zijn, is het onwaarschijnlijk dat deze effecten minder groot zijn bij patiënten met een longaanval dan bij patiënten met stabiel COPD. Daarom gelden ten aanzien van ademhalingstechnieken, hulpmiddelen (PEP en O-PEP) en andere technieken, zoals vibratie, percussie of houdingsdrainage, tijdens een longaanval dezelfde aanbevelingen als bij stabiel COPD.
Literatuur
Om de uitgangsvragen te kunnen beantwoorden, is een systematisch literatuuronderzoek verricht.
Onder ademhalingstechnieken worden verschillende technieken samengenomen, zoals de ‘active cycle of breathing technique’ (ACBT), huffen ofwel ‘forced expiration technique’ (FET), ‘autogene drainage’ (AD) en /of ‘expiration with an open glottis in the lateral posture’ (ELTGOL).
Interventies die zeer beperkt worden toegepast, zoals ‘intrapulmonary percussive ventilation’ (IPV of IPPV) en ‘high-frequency chest wall oscillation’ (HFCWO), evenals conventionele interventies die nauwelijks meer worden toegepast, zoals percussie en vibratie, zijn buiten beschouwing gelaten. Ook het uitzuigen van de luchtwegen, ademhalingstechnieken voor andere doeleinden dan mucusklaring zoals ‘pursed-lip breathing’ (zie C4.2 ‘Ademhalingstechnieken’), interventies tegen hyperinflatie tijdens inspanning, en training van de ademhalingsspieren (zie C4.1 ‘Ademspiertraining’) zijn hier buiten beschouwing gelaten.
Uitkomstmaten
Bij stabiele COPD zijn kwaliteit van leven, kortademigheid, longaanvallen, longgerelateerde ziekenhuisopname en fysieke capaciteit (gewenste effecten), en ‘minor adverse events’ en mortaliteit (ongewenste effecten), aangemerkt als patiëntrelevante en zowel cruciale als belangrijke uitkomstmaten voor de besluitvorming.
Bij een longaanval zijn dat de uitkomstmaten kwaliteit van leven, kortademigheid, opnameduur ziekenhuis/ IC (‘length of stay’; LoS), beademing (invasief/non-invasief, duur), fysieke capaciteit en toekomstige longaanvallen en longgerelateerde ziekenhuisopname (gewenste effecten) en minor adverse events en mortaliteit (ongewenste effecten).
Hoewel uitkomstmaten als FEV en maten van sputumklaring in veel studies worden gerapporteerd, zijn dit geen goede succesindicatoren voor effectiviteit van interventies ter bevordering van de mucusklaring. De maten van longfunctie correleren slecht met patiëntrelevante uitkomstmaten en maten van sputumklaring zijn moeilijk te interpreteren (Osadnik 2014).
In sommige studies (bijv. Mascardi 2016; Nicolini 2014, 2018a) is kortademigheid met meerdere instrumenten gemeten. Per uitkomstmaat kunnen slechts de resultaten van één meetinstrument worden verwerkt om overrepresentatie van deze studies te voorkomen. Wanneer zowel de ‘modified Medical Research Council Dyspnoe’ vragenlijst (mMRC) als de BCSS zijn afgenomen in dezelfde studiepopulatie is ervoor gekozen de resultaten op de mMRC in de meta-analyse op te nemen, omdat de mMRC bredere bekendheid geniet dan de BCSS en om die reden gemakkelijker te interpreteren is.
Zoeken en selecteren
Zoekactie
Uitgangspunt van deze literatuuranalyse was de systematische review (SR) van Osadnik (2012) naar de effectiviteit van verschillende interventies voor het bevorderen van mucusklaring bij patiënten met stabiel COPD en bij patiënten met een COPD-longaanval. Door middel van een systematische zoekactie is op 3 augustus 2018 met relevante zoektermen gezocht in de databases ‘PubMed’, ‘EMBASE’, ‘CENTRAL’, ‘Cochrane Library’, ‘PeDRO’ en ‘EmCare’ naar nieuwe (vanaf 1 januari 2012) gerandomiseerde gecontroleerde studies (RCT’s) voor het aanvullen en updaten van deze review. Dit leverde leverde 549 treffers op.
Literatuurselectie
De literatuur is geselecteerd en vervolgens geanalyseerd voor:
- Mucusklaring bij stabiel COPD :
- Positieve uitademingsdruk (PEP) bij patiënten met stabiel COPD
- Trillende positieve uitademingsdruk (oscillating-PEP, O-PEP) bij patiënten met stabiel COPD
- Ademhalingstechnieken (autogene drainage/ACBT/FET/ELTGOL) bij patiënten met stabiel COPD
- Mucusklaring bij een longaanval:
- Ademhalingstechnieken bij patiënten met een COPD-longaanval
- Manuele technieken bij patiënten met een COPD-longaanval
- Positieve uitademingsdruk (PEP) bij patiënten met een COPD-longaanval
- PEP met trilling (oscillerende-PEP, O-PEP) bij patiënten met COPD-longaanval
1 Mucusklaring bij stabiel COPD
In totaal zijn er 14 studies geselecteerd voor de literatuuranalyses naar mucusklaring bij stabiel COPD (n = 14). Dit zijn acht studies uit de review van Osadnik (2012: Cegla 1997, 2002; Christensen 1990, 1991a,b; Weiner 1996; Wolkove 2002, 2004). Vervolgens zijn hier naar aanleiding van de systematisch zoekactie zes recente artikelen aan toegevoegd (Fridlender 2012; Gastaldi 2015; Mascardi 2016; Nicolini 2014, 2018a; Sethi 2014). Tevens zijn gerandomiseerde gecontroleerde trials (RCT’s) uit andere reviews (zoals Andrews 2013; Fagevik 2009; Ides 2011; Lewis 2012; McCool 2006; Reychler 2018; Strickland 2013) beoordeeld aan de hand van de selectiecriteria. Dit leverde uiteindelijk geen nieuwe trials op. Het totale aantal studies in deze literatuuranalyse naar mucusklaring bij stabiel COPD komt hiermee uit op 14.
De selectiecriteria voor studies naar interventies bij stabiel COPD zijn opgenomen in de volgende tabel.
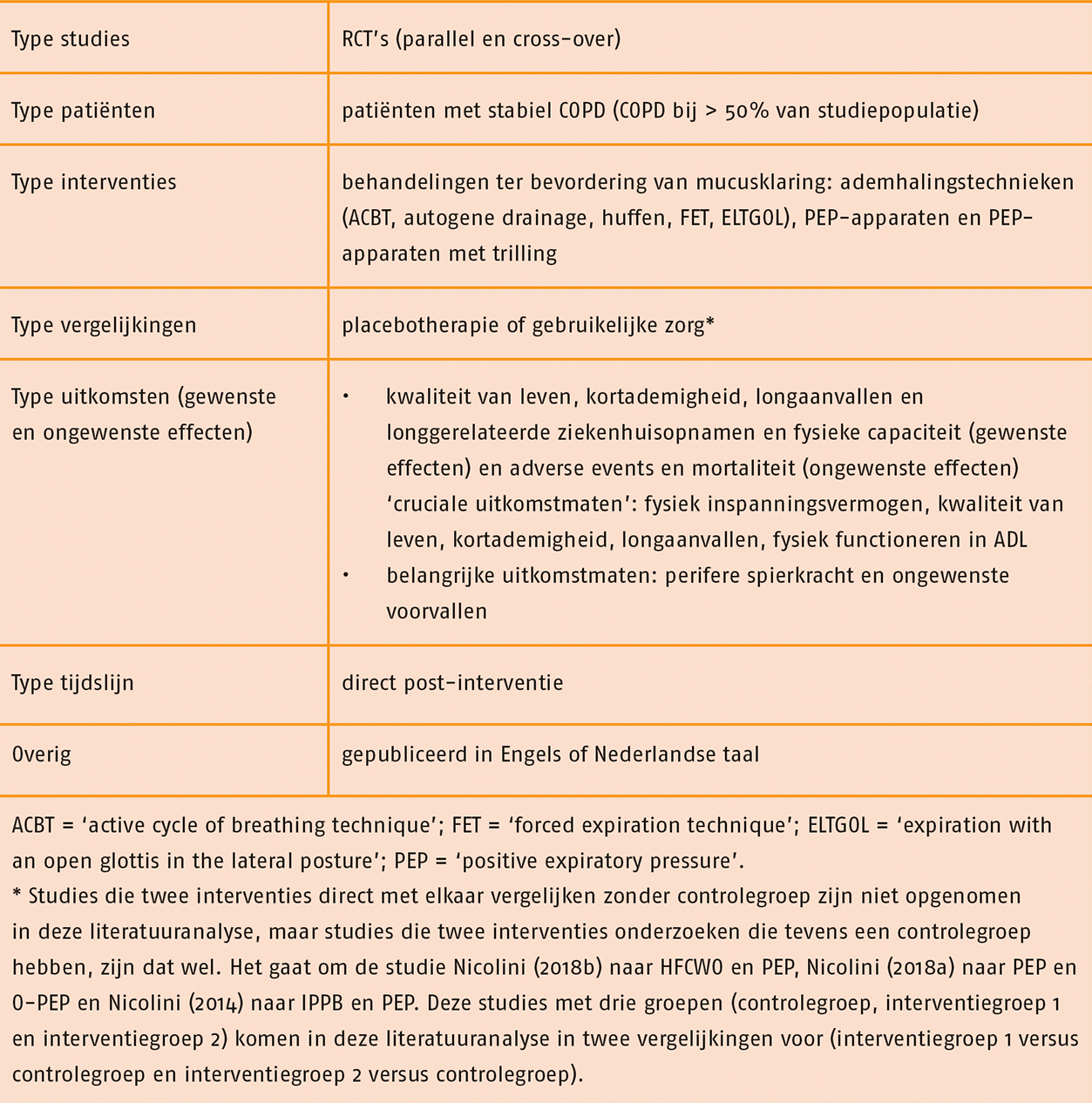
Het gebrek aan klinisch-relevante uitkomstmaten was de meest voorkomende reden van exclusie. Meer informatie over redenen van exclusie is opgenomen in bijlage C.4.5 (opent in nieuw tabblad).
Samenvatting literatuur
Beschrijving studies
De literatuuranalyse beslaat 15 studies met in totaal 645 patiënten met stabiel COPD. De gemiddelde leeftijd van de patiëntenpopulaties varieerde tussen 54 (Christensen 1991a) en 72 (Nicolini 2014, 2018a) jaar. De longfunctie (luchtstroombeperking uitgedrukt in FEV) van patiënten varieerde tussen 0,75 l (Wolkove 2002) en 2,1 l (Christensen 1991b) of tussen 29% (Wolkove 2002) en 50% (Sethi 2014) van de voorspelde waarde. Ervaren symptoomlast als deze wordt gemeten met de ‘COPD Assessment Test’ (CAT) varieerde tussen de 23 (Mascardi 2016) en de 27 (Nicolini 2014).
De geïncludeerde studies evalueren de effectiviteit van twee verschillende interventies, namelijk positieve uitademingsdruk (PEP) en PEP met trilling (O-PEP).
Een overzicht van interventies ter bevordering van mucusklaring bij stabiel COPD met bijbehorende studies ziijn opgenomen in de volgende tabel.
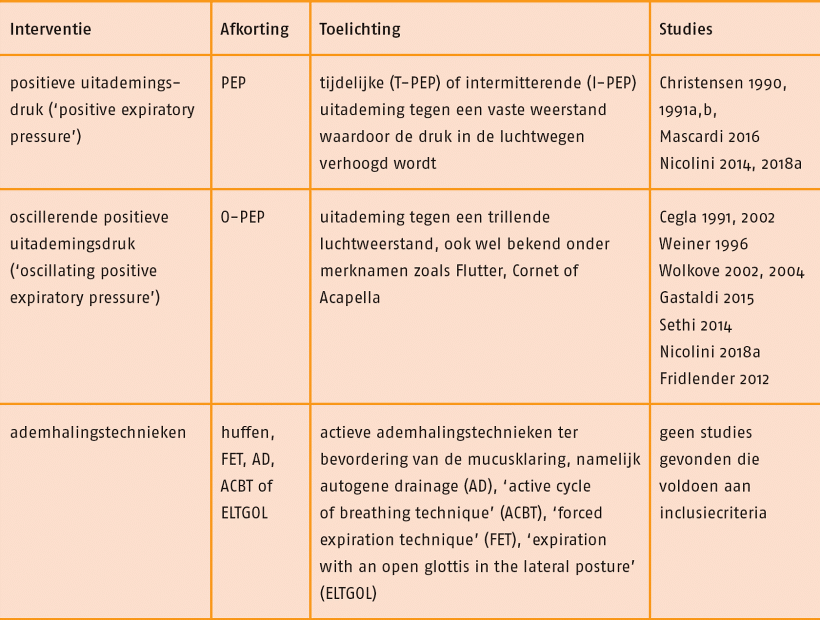
De controlegroep ontving placebotherapie (bijv. hetzelfde apparaat en masker zonder luchtdruk, of flutter zonder stalen bal) of enkel de gebruikelijk zorg.
Een gedetailleerd overzicht van de geïncludeerde studies is online beschikbaar als ‘Bijlage Evidencetabellen (opent in nieuw tabblad)’.
Individuele studiekwaliteit (RoB)
Van alle studies zijn de studieopzet en -uitvoering (‘risk of bias’, RoB) met de Cochrane RoB-tool beoordeeld met laag, hoog, of onduidelijk risico op zes potentiële oorzaken voor vertekening, namelijk ‘random sequence generation’, ‘allocation concealment’, ‘blinding’, ‘incomplete outcome data’, ‘selective outcome reporting’ en ‘other issues’).
Uit deze beoordeling komt naar voren dat de informatie over de methode voor het bepalen van de randomisatievolgorde en hoe deze toewijzing verborgen werd gehouden, in een groot aantal studies ontbreekt. In een aantal studies zijn patiënten, personeel en uitkomstbeoordelaars niet geblindeerd en ook is sprake van cross-over trials.
Een overzicht van de beoordeling van de individuele studiekwaliteit (RoB) is weergegeven in de volgende tabel.
Risk of bias: Mucusklaring bij stabiel COPD
Resultaten en bewijskracht
Hierna worden de resultaten en de bewijskracht beschreven van:
- positieve uitademingsdruk (PEP) bij patiënten met stabiel COPD
- trillende positieve uitademingsdruk (oscillating-PEP, O-PEP) bij patiënten met stabiel COPD
- ademhalingstechnieken (autogene drainage/ACBT/FET/ELTGOL) bij patiënten met stabiel COPD
Positieve uitademingsdruk (PEP) bij patiënten met stabiel COPD
Kwaliteit van leven
Gebruik van PEP geeft een enorm grote verbetering in de kwaliteit van leven (Nicolini 2014, 2018a; Mascardi 2014). De interventiegroepen scoorden gemiddeld tussen de 4,9 en 7,0 punten lager op de CAT dan de controlegroepen (MD = -4,92; 95%-BI = -5,14 tot -4,70; n = 178). Zie de forestplot.
De bewijskracht voor de kwaliteit van leven is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag uit.
Forestplot van mucusklaring bij stabiel COPD: kwaliteit van leven
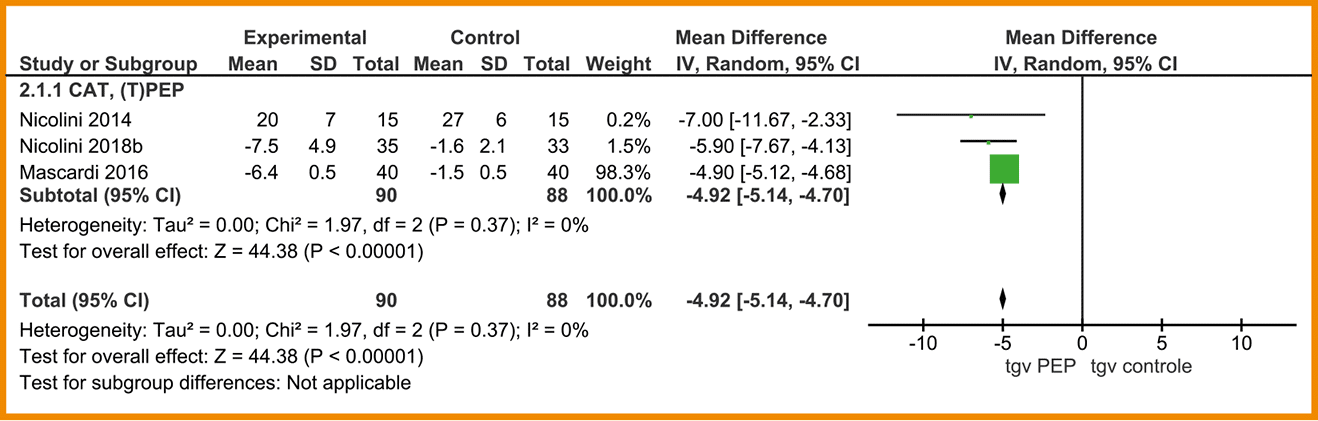
Kortademigheid
Het effect van PEP op kortademigheid is enorm groot; het gemiddelde verschil op de mMRC in de studies van Mascardi (2016), Nicolini (2014, 2018a) bedroeg -0,65 punten (95%-BI = -0,85 tot -0,45; n = 178) ten gunste van PEP. Echter, twee eerdere studies (Christensen 1990, 1991b; n = 85) vonden met andere meetinstrumenten geen effect van PEP op de kortademigheid.
De bewijskracht voor kortademigheid is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag uit.
Fysieke capaciteit en/of fysiek functioneren
PEP geeft een enorme verbetering van de fysieke capaciteit bij meting ervan met de 6MWT (Mascardi 2016; Nicolini 2018a). De gemiddelde toename in loopafstand bedroeg 30,8 meter (95%-BI = 16,9 tot 44,8; n = 133). Echter, Christensen 1990 (n = 47) toont een niet-significante verslechtering in zelfgerapporteerd fysiek functioneren. Patiënten rapporteerden het maximale niveau van fysieke activiteit dat werd beperkt door kortademigheid op een 20 cm VAS (negatieve waarden vertegenwoordigen verbetering). De mediane score (range) in de PEP-groep was 4 mm (-88 tot 115) en in de controlegroep -1 mm (-88 tot 83; niet significant).
De bewijskracht voor fysieke capaciteit is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag uit.
Longaanvallen
Vier studies rapporteren het effect van PEP op het risico op een longaanval (Christensen 1990, 1991b; Mascardi 2016; Nicolini 2018a).
Christensen 1990 (n = 60) vond geen significante verschillen in het aantal longaanvallen (geen data gerapporteerd). In de overige studies was het risico op een longaanval binnen één maand na PEP verlaagd met 11% (95%-BI = -0,29 tot 0,08; n = 163) (Christensen 1991b, Mascardi 2016, Nicolini 2018a). In de drie maanden na PEP was het risico op longaanvallen met 28% (95%-BI = 0,41 tot -0,14; n = 133) verlaagd (Mascardi 2016; Nicolini 2018a). En in de zes maanden na PEP was het risico verlaagd met 13% (95%-BI = -0,34 tot 0,08;
n = 68; Nicolini 2018a). Zie de forestplot.
De bewijskracht voor het risico op longaanvallen is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag uit.
Forestplot van mucusklaring bij stabiel COPD: risico op longaanvallen
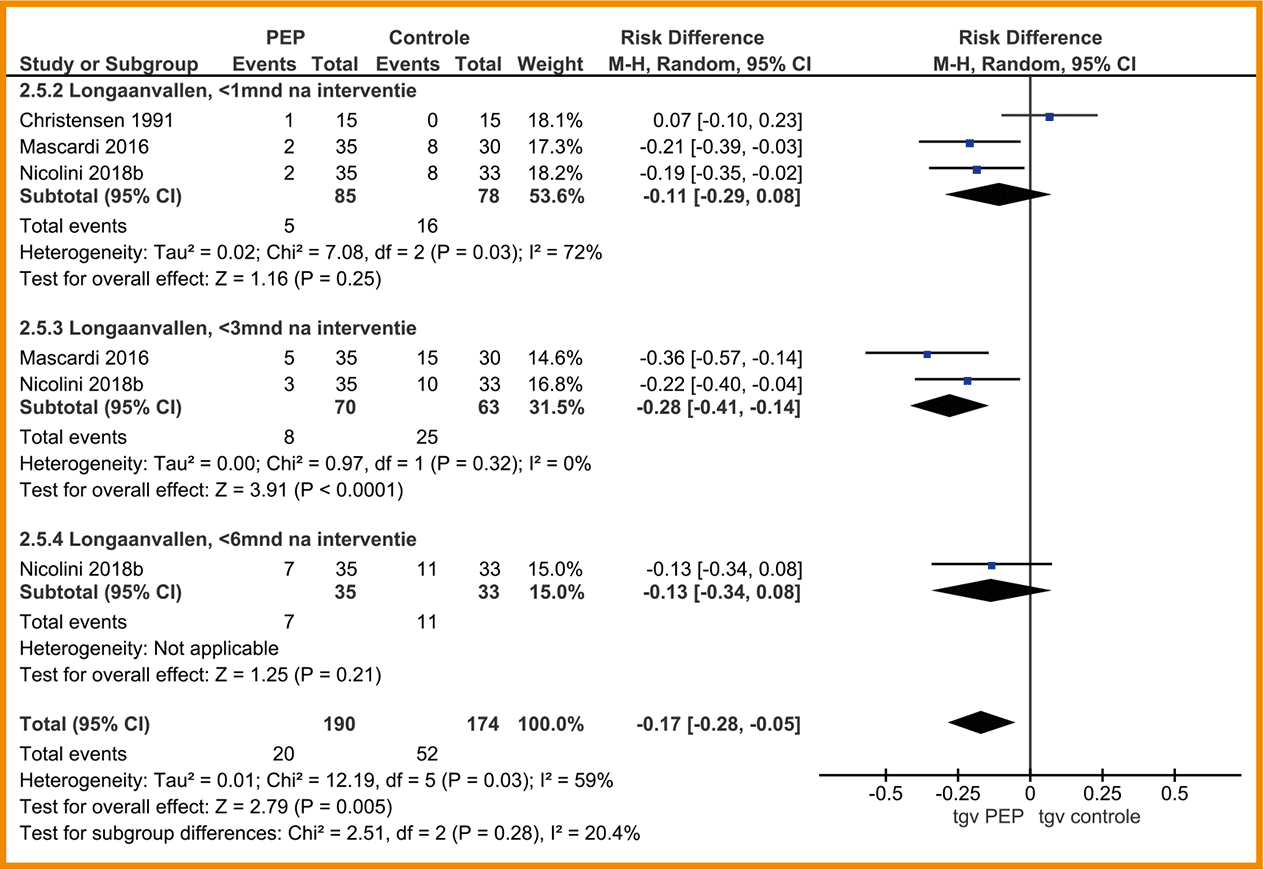
Longgerelateerde ziekenhuisopname
Het effect van PEP op longgerelateerde ziekenhuisopnamen is gerapporteerd in Christensen 1990 (n = 60). Deze studie vond geen significante verschillen in het aantal ziekenhuisopnamen of de opnameduur (geen data gerapporteerd). De bewijskracht voor longgerelateerde ziekenhuisopname is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en met twee niveaus vanwege het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Ongewenste effecten
De studies van Christensen (1990, 1991a,b) rapporteren dat er geen ongewenste effecten van PEP zijn voorgevallen gedurende de studieperiode (n = 87).
De bewijskracht voor longgerelateerde ziekenhuisopname is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het zeer geringe aantal events en patiënten (imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Een overzicht van de effecten en de bewijskracht op alle uitkomstmaten is weergegeven in de volgende tabel.
GRADE-evidenceprofiel: PEP ter bevordering van mucusklaring bij patiënten met stabiel COPD
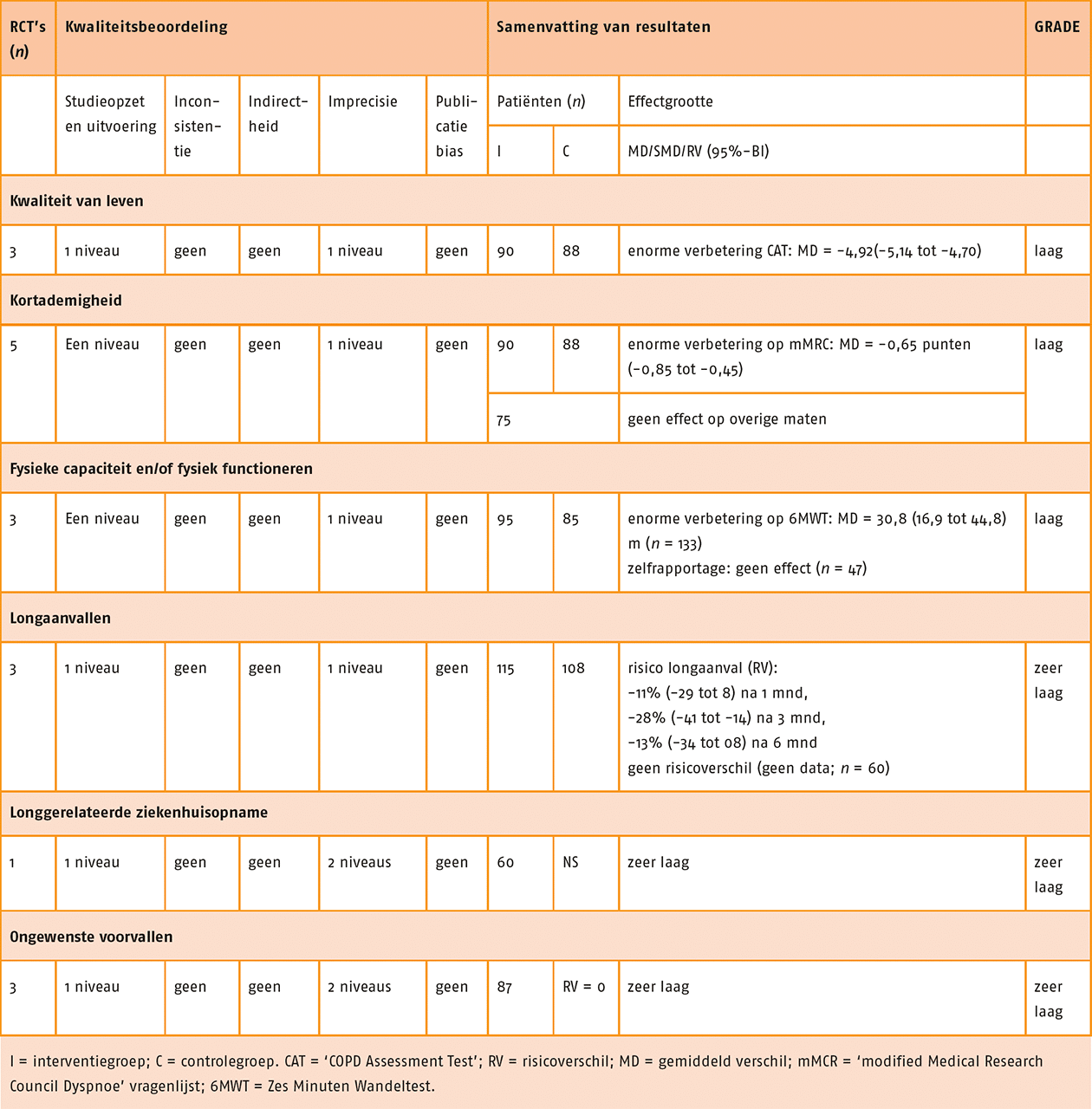
Trillende positieve uitademingsdruk (oscillating-PEP, O-PEP) bij patiënten met stabiel COPD
Kwaliteit van leven
Trillende positieve uitademingsdruk (‘oscillating positive expiratory pressure’, O-PEP) geeft mogelijk een grote verbetering van de kwaliteit van leven (Nicolini 2018a; Weiner 1996; Wolkove 2004), hoewel niet alle studies dit bevestigen (Fridlender 2012). Patiënten met O-PEP scoren veel beter op de CAT (MD = 4,8 punten lager, 95%-BI = -5,9 tot -3,7; n = 69; Nicolini 2018a) en op de ‘St George’s Respiratory Questionnaire’ (SGRQ: MD = 6,1 punten lager; 95%-BI = -8,9 tot -3,3; n = 15; Wolkove 2004) treedt een klinisch-relevante verbetering op (MCID = 4 punten; Jones 1991). Ook het zelfgerapporteerd algemeen welzijn was significant verbeterd (geen data gerapporteerd, Weiner 1996; n = 20). Eén studie toont echter geen significant verschil aangetoond (aan op de ‘Chronic Respiratory Disease Questionnaire’ (CRQ; geen data gerapporteerd, Fridlender 2012, n = 22).
De bewijskracht voor de kwaliteit van leven is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (o.a. geen blindering) en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Kortademigheid
Behandeling met O-PEP vermindert de mate van kortademigheid (Nicolini 2018a; Sethi 2014; Weiner 1996; Wolkove 2002, 2004). Patiënten met O-PEP-behandeling scoren gemiddeld 0,5 (95%-BI = -0,8 tot -0,2; n = 138) punten lager op de mMRC (Nicolini 2018a, Sethi 2014), tonen een significante langetermijnverbetering van de kortademigheid (geen data gerapporteerd; n = 20; Weiner 1996) en tonen na O-PEP een significante maar niet klinisch-relevante (MCID Borgschaal = 1,0 punt; Borg 1982; Solway 2002) afname van -0,3 punten op de Borgschaal voor kortademigheid (95%-BI = -0,5 tot -0,1; n = 23; Wolkove 2002). Tot slot ervaarden patiënten na één week O-PEP-behandeling tijdens de 6MWT 0,5 punt minder toename van kortademigheid op de Borgschaal, ondanks een grotere loopafstand (p < 0,05; n = 15; Wolkove 2004). Eén studie toonde echter geen significant verschil aan op de CRQ Dyspneu-subschaal (geen data gerapporteerd; Fridlender 2012, n = 22)
De bewijskracht voor kortademigheid is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Fysieke capaciteit en/of fysiek functioneren
O-PEP leidt tot grote verbeteringen op de fysieke capaciteit als deze wordt gemeten met de 6MWT (Nicolini 2018a; Sethi 2014, Wolkove 2002, 2004) en 12MWT (Weiner 1996).
In de studies van Nicolini 2018a en Stehi 2014 liepen patiënten na O-PEP-behandeling in zes minuten gemiddeld 25,6 meter verder (95%-BI = 5,6 tot 45,6; n = 138). In de studie van Weiner (1996) liepen zij in twaalf minuten gemiddeld 111,0 meter (95%-BI = 66,5 tot 155,5; n = 20) verder dan patiënten in de controlegroep.
Ook de studies van Wolkove (2002, 2004) tonen significante verbeteringen op de 6MWT met een toename in loopafstand van gemiddeld 12,9 m (95%-BI = 6,0 tot 19,9; n = 38), evenals de studie van Fridlender (geen data gerapporteerd; n = 22).
De bewijskracht voor de kwaliteit van leven is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Longaanvallen en longgerelateerde ziekenhuisopname
Tijdens en binnen één maand na O-PEP is het risico op longaanvallen en longgerelateerde ziekenhuisopnamen met 16% significant gedaald (95%-BI = -30% tot -3%; n = 138; Sethi 2014; Nicolini 2018a). In deze studies lag het aantal longaanvallen tijdens de zes maanden interventieperiode 21% lager (95%-BI = -0,41 tot -0,00; Sethi 2014; n = 69) en in de maand na afloop van een twaalfdaagse O-PEP behandeling lag het aantal longaanvallen 13% lager (95%-BI = -0,31 tot 0,05; Nicolini 2018a).
Op de lange termijn vond Cegla 2002 (n = 50) een significante afname in het aantal longgerelateerde ziekenhuisopnamen van 28% (95%-BI -0,53 tot -0,03). Nicolini 2018a (n = 69) vond een afname van 8% drie maanden na O-PEP (95%-BI =-29% tot 13%) en een afname van 8% zes maanden na O-PEP (95%-BI = -30% tot 13%).
De bewijskracht voor longaanvallen en longgerelateerde ziekenhuisopname is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Ongewenste effecten
Ongewenste effecten van O-PEP zijn niet bekend; ze zijn niet gerapporteerd.
Een overzicht van de effecten en de bewijskracht op alle uitkomstmaten is weergegeven in de volgende tabel.
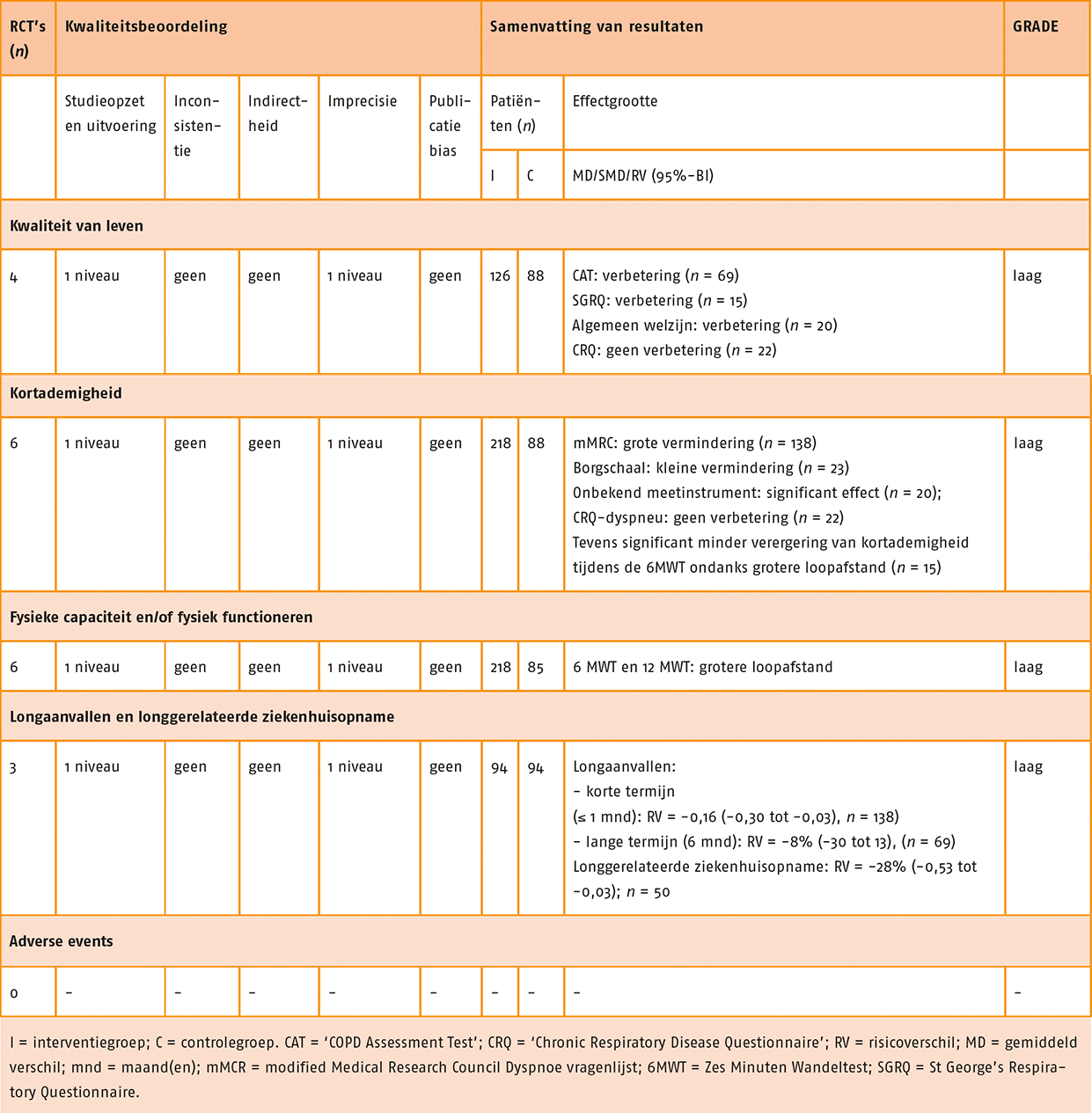
Ademhalingstechnieken (autogene drainage/ACBT/FET/ELTGOL) bij patiënten met stabiel COPD
Er zijn geen RCT’s gevonden naar effecten van ademhalingstechnieken (ter bevordering van de mucusklaring) op kwaliteit van leven, kortademigheid, fysieke capaciteit en/of fysiek functioneren, longaanvallen en longgerelateerde ziekenhuisopname, opnameduur of ongewenste effecten/voorvallen.
2 Mucusklaring bij een longaanval
De selectiecriteria voor studies naar interventies bij een longaanval zijn opgenomen in de volgende tabel.
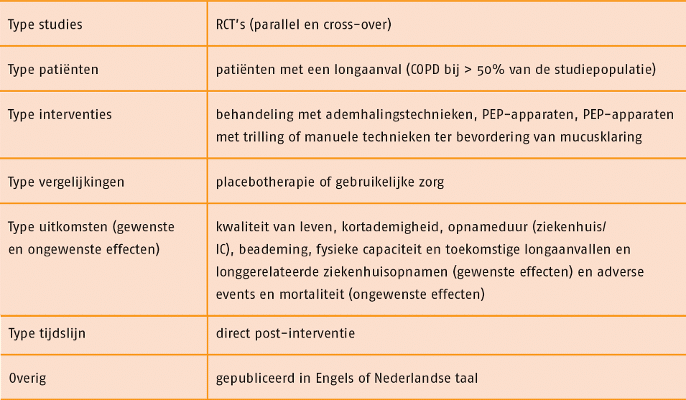
Net als bij literatuur over mucusklaring bij stabiel COPD, was het gebrek aan klinisch-relevante uitkomstmaten de meest voorkomende reden van exclusie. Meer informatie over redenen van exclusie is opgenomen in bijlage C.4.5.
In totaal zijn er 6 studies geselecteerd voor de literatuuranalyses naar mucusklaring bij een longaanval (n = 6). In de literatuuranalyse naar mucusklaring bij een longaanval zijn drie studies uit de review van Osadnik (2012) opgenomen (Bellone 2002; Kodric 2009; Inal-Ince 2004). Als resultaat van de zoekactie zijn er nog eens drie artikelen aan de review toegevoegd (Osadnik 2014; Basri 2017; Cross 2012). Tevens zijn trials uit andere reviews (zoals Tang 2010; Hill 2010; Andrews 2013; Fagevik 2009; Reychler 2018; Ides 2011; Strickland 2013; Lewis 2012) beoordeeld aan de hand van de selectiecriteria. Dit leverde uiteindelijk geen nieuwe trials op. Het totale aantal studies in deze literatuuranalyse naar de effecten van mucusklaring bij een longaanval komt hiermee uit op zes (Basri 2017; Bellone 2002; Cross 2012; Inal-Ince 2004; Kodric 2009; Osadnik 2014).
Samenvatting literatuur
Beschrijving studies
De literatuuranalyse beslaat zes artikelen met in totaal 802 patiënten met een COPD-longaanval die zijn opgenomen in het ziekenhuis. De gemiddelde leeftijd van de patiëntenpopulaties varieerde tussen de 54 en 70 jaar. De geïncludeerde studies evalueren de effectiviteit van drie verschillende interventies: 1) ademhalingstechnieken (zoals ‘active cycle of breathing technique’, autogene drainage of geforceerde uitademingstechnieken), 2) manuele technieken (houdingsdrainage, percussie, vibratie) en 3) positieve uitademingsdruk (PEP). De controlegroep ontving een placebotherapie (bijv. hetzelfde apparaat en masker zonder luchtdruk) of enkel de gebruikelijk zorg.
Een overzicht van interventies ter bevordering van mucusklaring bij een longaanval, met bijbehorende studies is opgenomen in de volgende tabel.
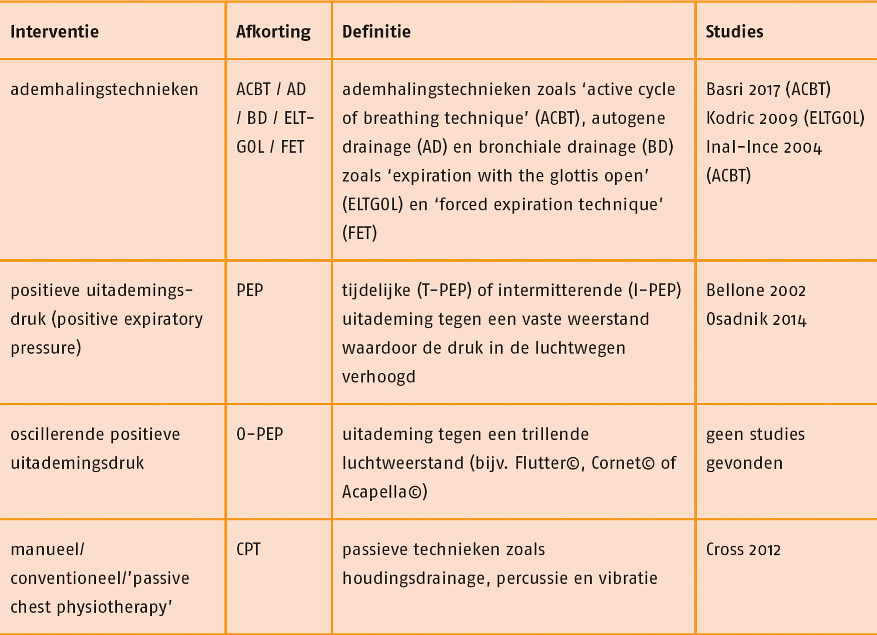
Een gedetailleerd overzicht van de geïncludeerde studies is online beschikbaar als ‘Bijlage Evidencetabellen (opent in nieuw tabblad)’.
Individuele studiekwaliteit
Van alle zes studies zijn de studieopzet en -uitvoering (‘risk of bias’, RoB) met de Cochrane RoB-tool beoordeeld met laag, hoog, of onduidelijk risico op zes potentiële oorzaken voor vertekening, namelijk ‘random sequence generation’, ‘allocation concealment’, ‘blinding’, ‘incomplete outcome data’, ‘selective outcome reporting’ en ‘other issues’).
Uit deze beoordeling komt naar voren dat de informatie over de methode voor het bepalen van de randomisatievolgorde en hoe deze toewijzing verborgen werd gehouden, in een groot aantal studies ontbreekt. In een aantal studies zijn de patiënten, personeel en uitkomstbeoordelaars niet geblindeerd en ook is sprake van cross-over trials.
Een overzicht van de beoordeling van de studiekwaliteit (RoB) per studie is weergegeven in de volgende tabel.
Risk of bias: Mucusklaring bij een COPD-longaanval

Ademhalingstechnieken bij patiënten met een COPD-longaanval
Kwaliteit van leven
Behandeling met ELTGOL toonde geen verschil aan in kwaliteit van leven als deze wordt gemeten met SGRQ (MD = 0,30; 95%-BI = -9,13 tot 9,73; n = 59; Kodric 2009).
De bewijskracht voor de kwaliteit van leven is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het zeer geringe aantal patiënten (imprecisie) en komt hiermee uit op zeer laag.
Kortademigheid
ELTGOL vermindert de kortademigheid tijdens inspanning, hier gemeten met de Borgschaal (MD = -1,30;
95%-BI = -2,14 tot -0,46; n = 59; Kordic 2009). Ook ABCT toonde in de studie van Basri (2017) een enorme verbetering van de kortademigheid (MD = -4,38; 95%-BI = -4,84 tot -3,92; n = 60), die in deze studie is gemeten met de 100 mm VAS. Op de ELTGOL wordt echter geen verschil in kortademigheid in ADL gemeten, in deze studie uitgevoerd met de MRC (MD = -0,40; 95%-BI = -1,04 tot 0,24; n = 59; Kordic 2009).
De bewijskracht voor kortademigheid is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie) en komt hiermee uit op laag.
Fysieke capaciteit en/of fysiek functioneren
Er zijn geen studies gevonden naar het effect van ademhalingstechnieken ter bevordering van de mucusklaring op de fysieke capaciteit of het fysiek functioneren.
Beademing
Het risico op beademing was na ACBT -6% lager (95%-BI = -24% tot 11%; n = 27; Inal-Ince 2004).
Ten aanzien van de duur van de ventilatie was het aantal dagen met NIV na ACBT 1,7 dagen korter (MD = -1,70 dagen; 95%-BI = -3,41 tot 0,01) en NIV duurde 19 uur korter bij ACBT (MD = -19,20; 95%-BI = -41,61 tot 3,21) in vergelijking met de controleconditie (Inal-Ince 2004; n = 34).
Invasieve beademing via een endotracheale intubatie was nodig bij één patiënt in elke groep, met een risicoverschil van 0% (95%-BI = -16 tot 16; n = 34; Inal-Ince 2004).
De bewijskracht voor het risico op beademing en de duur ervan is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie) en komt hiermee uit op laag.
Opnameduur
De ziekenhuisopname was na inzet van ELTGOL met een halve dag verkort (MD = -0,50; 95%-BI = -1,94 tot 0,94; n = 59; Kodric 2009). Opname op de IC was na ACBT met 1,4 dagen verkort (opnameduur ACBT= 8,0 dagen, controle = 9,4 dagen; MD = -1,40; 95%-BI = -4,19 tot 1,39; n = 34; Inal-Ince 2004).
De bewijskracht voor opnameduur is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en
-uitvoering en het zeer geringe aantal patiënten (imprecisie) en komt hiermee uit op zeer laag.
Toekomstige longaanvallen en longgerelateerde ziekenhuisopname
Kodric (2009; n = 22) vond zes maanden na de inzet van ELTGOL tijdens een longaanval een kleine afname van het risico op toekomstige longaanvallen en een zeer kleine afname in longgerelateerde ziekenhuisopnamen (longaanval: MD = -0,60; 95%-BI = -2,64 tot 1,44; ziekenhuisopname: MD = 0,40; 95%-BI = -1,35 tot 2,15).
De bewijskracht voor toekomstige longaanvallen en longgerelateerde ziekenhuisopnamen is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het zeer geringe aantal patiënten (imprecisie) en komt hiermee uit op zeer laag.
Ongewenste effecten
Ongewenste voorvallen bestonden uit drukzweren op de neus (ACBT= 7 patiënten; C= 6 patiënten), irritatie van de ogen (ACBT= 2 patiënten; C= 1 patiënt), en één bloedneus in de controlegroep (Inal-Ince 2004).
De bewijskracht voor ongewenste voorvallen is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie) en komt hiermee uit op laag.
Mortaliteit
In studie van Inal-Ince 2004 zijn er op korte termijn in beide groepen geen sterfgevallen opgetreden (RV = 0%; 95%-BI = -11 tot 11; n = 34). Ook op lange termijn vindt (Kodric 2009) geen verschil, in beide groepen was er één sterfgeval (RV = 0%; 95%-BI = -22 tot 22; n = 24).
De bewijskracht voor mortaliteit is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en
-uitvoering en het geringe aantal patiënten (imprecisie) en komt hiermee uit op laag.
Manuele technieken bij patiënten met een COPD-longaanva
Kwaliteit van leven
De grote studie Cross (2012; n = 372) toonde een verwaarloosbaar nihil effect (SMD = -0,02) van de inzet van ACBT met manuele longfysiotherapietechnieken bestaande uit houdingsdrainage, percussie, vibratie en hoesttechnieken ten opzichte van enkel ACBT op de kwaliteit van leven, die hier is gemeten met de SGRQ bij patiënten die vanwege een longaanval waren opgenomen in het ziekenhuis (MD = -0.36; 95%-BI = -4,31 tot 3,59). Analyse van de verschillende SGRQ-subschalen gaf hetzelfde beeld. Dezelfde studie toonde ook met een ander meetinstrument voor de kwaliteit van leven geen effect aan (EQ-5D score MD = -0,03; 95%-BI = -0,10 tot 0,04; EQ-5D VAS MD = 0,96; 95%-BI = -3,37 tot 5,29).
De bewijskracht voor de kwaliteit van leven is met één niveau verlaagd gezien de beperkingen in de studieopzet en -uitvoering (o.a. blindering en uitval). De bewijskracht komt hiermee uit op matig.
Kortademigheid
Manuele longfysiotherapie bij patiënten met een longaanval heeft geen effect op klachten van kortademigheid, hoest en sputum, in deze studie gemeten met de BCSS (MD = -0,06; 95%-BI = -0,55 tot 0,66; n = 372; Cross 2012).
De bewijskracht voor kortademigheid is met één niveau verlaagd gezien de beperkingen in de studieopzet en -uitvoering (o.a. blindering en uitval). De bewijskracht komt hiermee uit op matig.
Beademing
Er zijn geen studies gevonden naar het effect van manuele technieken bij een longaanval op het risico op of de duur van beademing.
Opnameduur
Inzet van manuele longfysiotherapietechnieken heeft geen effect op het aantal opnamedagen gedurende zes maanden follow-up (RR= 1,07; 95%-BI = 0,91 tot 1,24; n = 372; Cross 2012).
De bewijskracht voor opnameduur is met één niveau verlaagd gezien de beperkingen in de studieopzet en -uitvoering (o.a. blindering en uitval). De bewijskracht komt hiermee uit op matig.
Fysieke capaciteit en/of fysiek functioneren
Er zijn geen studies gevonden naar het effect van manuele technieken bij een longaanval op de fysieke capaciteit of het fysiek functioneren.
Toekomstige longaanvallen en longgerelateerde ziekenhuisopname
Er zijn geen studies gevonden naar het effect van manuele technieken bij een longaanval op het risico op toekomstige longaanvallen of longgerelateerde ziekenhuisopnamen.
Mortaliteit
Er zijn geen studies gevonden naar het effect van manuele technieken bij een longaanval op mortaliteit.
Ongewenste effecten
Ongewenste effecten van manuele therapietechnieken betreffen verergering van de kortademigheid (n = 5), pijn (n = 5), aritmie (n = 3), bronchospasme (n = 1) en thoracaal hematoom (n = 1).
De bewijskracht voor kortademigheid is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering (o.a. blindering en uitval) en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Positieve uitademingsdruk (PEP) bij patiënten met een COPD-longaanval
Kwaliteit van leven
Osdnik (2014; n = 90) vond nauwelijks effect van PEP op de kwaliteit van leven. Het verschil op de SGRQ bedroeg na 8 weken 0,8 punten (95%-BI = -6,7 tot 8,3) en na zes maanden 1,4 punten (95%-BI = -6,1 tot 9,0). De bewijskracht voor de kwaliteit van leven is met twee niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Kortademigheid
Het effect van PEP op kortademigheid als die wordt gemeten met de mMRC is niet eenduidig. Bij ontslag was de kortademigheid na PEP ernstiger (MD = 0,40; 95%-BI = -0,17 tot 0,97), na acht weken minder ernstig (-0,40; 95%-BI = -1,02 tot 0,22) en na zes maanden weer ernstiger 0,50 (95%-BI = -0,12 tot 1,12) dan bij patiënten in de controlegroep (Osdnik 2014; n = 90).
De bewijskracht voor kortademigheid is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering, inconsistente resultaten en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Beademing
Alle patiënten in de studie van Bellone (2002) ontvingen NIV-beademing. Behandeling met PEP verkortte de duur van de NIV-beademing met gemiddeld twee dagen (MD = -2,10; 95%-BI = -2,67 tot -1,53; n = 27; Bellone 2002). Het aantal patiënten bij wie NIV onvoldoende was en die invasieve beademing nodig hadden via endotracheale intubatie was na PEP-behandeling 7% lager (95%-BI = -25% tot 11%; n = 27; Bellone 2002).
Echter, in de studie van Osadnik (2014) hadden de meeste patiënten (80%) geen beademing nodig. Onder deze minder ernstige groep patiënten had PEP geen effect op de kans dat de patiënt beademing nodig had of op de duur van de beademing.
De bewijskracht voor de duur van de beademing is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Opnameduur
Geen verschil in duur van de ziekenhuisopname (Osadnik 2014).
Fysieke capaciteit en/of fysiek functioneren
Het effect van PEP op de fysieke capaciteit is klein, inconsistent en noch klinisch-, noch statistisch-significant (Osadnik 2014; n = 90). In de studie van Osadnik bedraagt het gemiddeld verschil in loopafstand bij ontslag (MD = -26,00 m; 95%-BI = -89,53 tot 37,53), na acht weken (MD = 28,00 m; 95%-BI = -38,18 tot 94,18) en na zes maanden (MD = -4,00 m; 95%-BI = -82,39 tot 74,39).
De bewijskracht voor fysieke capaciteit is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering, inconsistente resultaten en het geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Toekomstige longaanvallen en longgerelateerde ziekenhuisopname
Het gebruik van PEP verlaagt het risico op een longaanval binnen zes maanden niet (RV = -0,00; 95%-BI =
-0,06 tot 0,06; Osadnik 2014; n = 90). Ook is er nauwelijks verschil in het aantal longgerelateerde ziekenhuisopnamen (heropnamen) (RV = -0,02; 95%-BI = -0,08 tot 0,04; Osadnik 2014; n = 90).
De bewijskracht voor risico op longaanvallen en longgerelateerde ziekenhuisopnamen is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het zeer geringe aantal events en patiënten (imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Mortaliteit
In de studies Osadnik 2014 en Bellone 2002 verlaagt PEP het overlijdensrisico met 5% (95%-BI = -0,16 tot 0,06; n = 116).
De bewijskracht voor mortaliteit is met drie niveaus verlaagd gezien de beperkingen in de studieopzet en -uitvoering en het zeer geringe aantal events en patiënten (imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Ongewenste effecten
Ongewenste voorvallen zijn niet gerapporteerd.
PEP met trilling (oscillerende-PEP, O-PEP) bij patiënten met COPD-longaanval
Er zijn geen studies gevonden naar de effectiviteit van O-PEP op de kwaliteit van leven, kortademigheid, beademing, opnameduur, fysieke capaciteit of fysiek functioneren, risico op toekomstige longaanvallen of longgerelateerde ziekenhuisopnamen, mortaliteit of andere ongewenste voorvallen.
Overwegingen
De overwegingen en aanbevelingen komen voort uit de discussies die in de werkgroep zijn gevoerd aan de hand van evidence-to-decisionformulieren. Zie bijlage C.4.5 (opent in nieuw tabblad).
Effecten Bij patiënten met stabiele COPD geven de PEP en O-PEP grote tot zeer grote verbeteringen in kwaliteit van leven, kortademigheid en fysieke capaciteit. PEP heeft weinig tot geen effect op het risico op longaanvallen of longgerelateerde ziekenhuisopname. O-PEP leidt tot een kleine afname in longaanvallen en een grote afname van het aantal longgerelateerde ziekenhuisopnamen. Risico op ongewenste effecten van PEP en O-PEP zijn niet bekend. In de literatuurstudie zijn geen studies gevonden die ademhalingstechnieken vergelijken met een controleconditie bij patiënten met stabiele COPD.
Bij patiënten met een longaanval hebben ademhalingstechnieken, manuele technieken en gebruik van PEP geen of nauwelijks effect op de kwaliteit van leven, kortademigheid, opnameduur, beademing, fysieke capaciteit, toekomstige longaanvallen en longgerelateerde ziekenhuisopname. Er zijn alleen aanwijzingen gevonden dat ademhalingstechnieken mogelijk de kortademigheid kunnen verminderen bij een longaanval en dat PEP bij patiënten met NIV mogelijk de duur van de non-invasieve beademing (NIV) met twee dagen kan bekorten.
Balans tussen gewenste en ongewenste effecten Manuele/passieve technieken worden als minder veilig beschouwd bij patiënten met COPD in vergelijking met actieve technieken (Ides 2011). Verdere ongewenste effecten van ademhalingstechnieken en hulpmiddelen zijn niet bekend.
Waarde van de gewenste effecten De effecten kwaliteit van leven, kortademigheid en inspanningsvermogen zijn klinisch-relevant en daarmee van belang. Het aantal ziekenhuisopnamen en de opnameduur zijn van groot belang, niet alleen voor de patiënt, maar ook vanuit maatschappelijk oogpunt.
De gevonden effecten verschillen tussen de onderzoekspopulaties. Studies naar de effecten van mucusklaring bij patiënten met stabiele COPD laten positieve resultaten zien, terwijl deze resultaten bij een longaanval vanuit de literatuur minder goed te onderbouwen zijn. Het is vanuit klinisch oogpunt echter onwaarschijnlijk dat effecten van mucusklaring minder groot zijn bij een longaanval dan in een stabiele fase.
Variatie in waarde van de gewenste effecten Ligt aan de mate van zelfstandigheid: PEP en O-PEP moet een patiënt zelf kunnen toepassen. Benodigde middelen en variatie in benodigde middelen (kosten). De kosten van PEP en O-PEP bedragen minder dan € 100,– en worden vergoed door de zorgverzekeraar. Ze zijn na instructie goed thuis toe te passen. Aan ademhalingstechnieken zijn geen kosten verbonden en de patiënt kan deze zelfstandig uitvoeren.
Kosteneffectiviteit Geen studies
Aanvaardbaarheid Er is geen aanleiding om aan te nemen dat de interventie niet aanvaardbaar is. Voor de interventies is echter wel goede therapietrouw nodig. Acceptatie van PEP en O-PEP is onderzocht in de studie van Nicolini (2018b) met behulp van een 7-punts Likertschaal (1 = ‘zeer ongerieflijk’ tot 7 = ‘zeer weinig ongerief’). Beide interventies worden goed geaccepteerd; er is bij geen van beide interventies een significant verschil met de controleconditie (alleen de gebruikelijke medicatie): PEP vs. controleconditie: 4,73 vs. 5,27; O-PEP vs. controleconditie: IC 4,27 vs. 5,28). Er is geen verschil gevonden in acceptatie tussen de apparaten voor PEP en O-PEP.
Haalbaarheid Zowel ademhalingstechnieken als PEP en O-PEP kunnen aan iedereen aangeboden worden die instrueerbaar is en kunnen zelfstandig door patiënten worden toegepast.
Gezien de gunstige effecten wordt een conditionele aanbeveling geformuleerd ten aanzien van de inzet van technieken ter bevordering van mucusklaring bij patiënten met stabiel COPD. Aanbevolen wordt om te starten met het aanleren van technieken waarmee de patiënt zelf de mucusklaring kan bevorderen. Wanneer de patiënt deze techniek onder de knie heeft, maar de mucus nog niet voldoende en/of efficiënt op kan hoesten (retentie), wordt aanbevolen een hulpmiddel in te zetten. Hierbij worden PEP of O-PEP aanbevolen, gezien de aangetoonde effectiviteit van deze hulpmiddelen. Bij voorkeur worden geen andere technieken toegepast, zoals vibratie, percussie of houdingsdrainage, aangezien deze technieken arbeidsintensief zijn en de patiënt afhankelijk maken van de therapeut.
Het is onwaarschijnlijk dat de technieken ter bevordering van mucusklaring bij een longaanval minder effect hebben bij een longaanval dan bij stabiel COPD, hoewel de gevonden effecten beperkt zijn. Daarom gelden bij een longaanval dezelfde aanbevelingen als bij stabiel COPD als het gaat om ademhalingstechnieken, hulpmiddelen (PEP en O-PEP) en andere technieken, zoals vibratie, percussie of houdingsdrainage.
- Andrews J, Sathe NA, Krishnaswami S, McPheeters ML. Nonpharmacologic airway clearance techniques in hospitalized patients: a systematic review. Respir Care. 2013;58(12):2160-86.
- Antonaglia V, Lucangelo U, Zin WA, Peratoner A, De Simoni L, Capitanio G, et al. Intrapulmonary percussive ventilation improves the outcome of patients with acute exacerbation of chronic obstructive pulmonary disease using a helmet. Critical Care Medicine 2006; 34(12):2940-5.
- Baltzan MA, Kamel H, Rotaple M, Wolkove N. Daily use of a Mucus Clearance Device (MCD) improves the disability and quality of life in patients with stable severe chronic obstructive pulmonary disease (COPD). Chest 2002; 122(4):140S.
- Basri R, Tahir M, Naseem M. Short-term effects of chest physiotherapy in acute exacerbation of chronic obstructive pulmonary disease. J Med Sci. 2017;25(3):323-7.
- Bellone A, Spagnolatti L, Massobrio M, Bellei E, Vinciguerra R, Barbieri A, et al. Short-term effects of expiration under positive pressure in patients with acute exacerbation of chronic obstructive pulmonary disease and mild acidosis requiring non-invasive positive pressure ventilation. Intensive Care Med. 2002;28(5):581-5.
- Borg GA. Psychophysical bases of perceived exertion. Med Sci Sports Exerc. 1982; 14(5):377-81.
- Burgel PR, Nesme-Meyer P, Chanez P, Caillaud D, Carre P, Perez T, et al. Cough and sputum production are associated with frequent exacerbations and hospitalizations in COPD subjects. Chest. 2008/11/20 2009;135(4):975-82.
- Cegla UH, Bautz M, Frode G, Werner T. (Physical therapy in patients with COPD and tracheobronchial instability
- comparison of 2 oscillating PEP systems (RC-Cornet, VRP1 Desitin). Results of a randomized prospective study of 90 patients) (German). Pneumologie. 1997; 51(2):129-36.
- Cegla UH, Jost HJ, Harten A, Weber T, Wissmann S. Course of severe COPD with and without physiotherapy with the RC-Cornet (German). Pneumologie. 2002; 56(7):418-24.
- Christensen EF, Dahl R. Treatment of chronic bronchitis with terbutaline inhaled from a cone spacer with and without positive expiratory pressure. Lung. 1991b; 169(6):325-33.
- Christensen EF, Norregaard O, Dahl R. Nebulized terbutaline and positive expiratory pressure in chronic obstructive pulmonary disease. Pneumologie. 1991a; 45(3):105-9.
- Christensen HR, Simonsen K, Lange P, Clementsen P, Kampmann JP, Viskum K, et al. PEEP-masks in patients with severe obstructive pulmonary disease: a negative report. Eur Respir J. 1990;3(3):267-72.
- Cross JL, Elender F, Barton G, Clark A, Shepstone L, Blyth A, et al. Evaluation of the effectiveness of manual chest physiotherapy techniques on quality of life at six months post exacerbation of COPD (MATREX): a randomised controlled equivalence trial. BMC Pulm Med. 2012;12:33.
- Ekberg-Aronsson M, Pehrsson K, Nilsson JA, Nilsson PM, Lofdahl CG. Mortality in GOLD stages of COPD and its dependence on symptoms of chronic bronchitis. Resp Res. 2005;6:98.
- Fagevik Olsén M, Westerdahl E. Positive expiratory pressure in patients with chronic obstructive pulmonary disease – a systematic review. Respiration. 2009;77(1):110-8.
- Fridlender ZG, Arish N, Laxer U, Berkman N, Leibovitz A, Fink G, et al. Randomized controlled crossover trial of a new oscillatory device as add-on therapy for COPD. COPD. 2012;9(6):603-10.
- Gastaldi AC, Paredi P, Talwar A, Meah S, Barnes PJ, Usmani OS. Oscillating positive expiratory pressure on respiratory resistance in chronic obstructive pulmonary disease with a small amount of secretion: a randomized clinical trial. Medicine. 2015;94(42):e1845.
- Hill K, Patman S, Brooks D. Effect of airway clearance techniques in patients experiencing an acute exacerbation of chronic obstructive pulmonary disease: a systematic review. Chron Respir Dis. 2010;7(1):9-17.
- Ides K, Vissers D, De Backer L, Leemans G, De Backer W. Airway clearance in COPD: need for a breath of fresh air? A systematic review. COPD. 2011;8(3):196-205.
- Inal-Ince D, Savci S, Topeli A, Arikan H. Active cycle of breathing techniques in non-invasive ventilation for acute hypercapnic respiratory failure. Aust J Physiother. 2004;50(2):67-73.
- Jones PW, Quirk FH, Baveystock CM. The St George’s Respiratory Questionnaire. Respir Med. 1991; 85 (suppl B):25-31; discussie 33-7.
- Kodric M, Garuti G, Colomban M, Russi B, Porta RD, Lusuardi M, Confalonieri M. The effectiveness of a bronchial drainage technique (ELTGOL) in COPD exacerbations. Respirology. 2009;14(3):424-8.
- Lange P, Nyboe J, Appleyard M, Jensen G, Schnohr P. Relation of ventilatory impairment and of chronic mucus hypersecretion to mortality from obstructive lung disease and from all causes. Thorax. 1990;45(8):579-85.
- Lewis LK, Williams MT, Olds TS. The active cycle of breathing technique: a systematic review and meta-analysis. Respir Med. 2012;106(2):155-72.
- Mascardi V, Grecchi B, Barlascini C, Banfi P, Nicolini A. Effectiveness of temporary positive expiratory pressure (T-PEP) at home and at hospital in patients with severe chronic obstructive pulmonary disease. J Thorac Dis. 2016;8(10):2895-902.
- May DB, Munt PW. Physiologic effects of chest percussion and postural drainage in patients with stable chronic bronchitis. Chest 1979; 75(1):29-32.
- McCool FD, Rosen MJ. Nonpharmacologic airway clearance therapies: ACCP evidence-based clinical practice guidelines. Chest. 2006;129(1 Suppl):250S-259S.
- Nicolini A, Mascardi V, Grecchi B, Ferrari-Bravo M, Banfi P, Barlascini C. Comparison of effectiveness of temporary positive expiratory pressure versus oscillatory positive expiratory pressure in severe COPD patients. Clin Respir J. 2018;12(3):1274-82.
- Nicolini A, Mollar E, Grecchi B, Landucci N. Comparison of intermittent positive pressure breathing and temporary positive expiratory pressure in patients with severe chronic obstructive pulmonary disease. Arch Broncopneumol. 2014;50(1):18-24.
- Osadnik CR, McDonald CF, Holland AE. Clinical issues of mucus accumulation in COPD. Int J Chron Obstruct Pulmon Dis. 2014;9:301-2.
- Osadnik CR, McDonald CF, Miller BR, Hill CJ, Tarrant B, Steward R, et al. The effect of positive expiratory pressure (PEP) therapy on symptoms, quality of life and incidence of re-exacerbation in patients with acute exacerbations of chronic obstructive pulmonary disease: a multicentre, randomised controlled trial. Thorax. 2014;69(2):137-43.
- Prescott E, Lange P, Vestbo J. Chronic mucus hypersecretion in COPD and death from pulmonary infection. Eur Resp J. 1995;8:1333–8.
- Reychler G, Debier E, Contal O, Audag N. intrapulmonary percussive ventilation as an airway clearance technique in subjects with chronic obstructive airway diseases. Respir Care. 2018;63(5):620-31.
- Sethi S, Yin J, Anderson PK. Lung flute improves symptoms and health status in COPD with chronic bronchitis: A 26 week randomized controlled trial. Clin Transl Med. 2014;3:29.
- Solway S, Brooks D, Lau L, Goldstein R. The short-term effect of a rollator on functional exercise capacity among individuals with severe COPD. Chest. 2002; 122(1):56-65.
- Strickland SL, Rubin BK, Drescher GS, Haas CF, O’Malley CA, Volsko TA, et al. American Association for Respiratory Care, Irving, Texas. AARC clinical practice guideline: effectiveness of nonpharmacologic airway clearance therapies in hospitalized patients. Respir Care. 2013 Dec;58(12):2187-93.
- Tang CY, Taylor NF, Blackstock FC. Chest physiotherapy for patients admitted to hospital with an acute exacerbation of chronic obstructive pulmonary disease (COPD): a systematic review. Physiotherapy. 2010;96(1):1-13.
- Weiner P, Zamir D, Waizman J, Weiner M. Physiotherapy in chronic obstructive pulmonary disease: oscillatory breathing with flutter VRP1. Harefuah 1996; 131(1-2):14-7;71.
- Wolkove N, Baltzan Jr MA, Kamel H, Rotaple M. A randomized trial to evaluate the sustained efficacy of a mucus clearance device in ambulatory patients with chronic obstructive pulmonary disease. Can Resp J. 2004;11(8):567-72.
- Wolkove N, Kamel H, Rotaple M, Baltzan MA, Jr. Use of a mucus clearance device enhances the bronchodilator response in patients with stable COPD. Chest. 2002;121(3):702-7.
C.5 Supervisie van de therapeut
Deze module betreft:
- Duur en frequentie van supervisie (module C.5.1)
- Oefentherapie in groepsverband (module C.5.2)
C.5.1 Duur en frequentie van supervisie
Streef in de intensieve behandelfase naar het bereiken van het behandeldoel. Streef in de afbouwfase naar behoud van het behandeldoel en de overgang naar reguliere sport en beweegactiviteiten in de onderhoudsfase.
Stem de duur en frequentie van supervisie af op de behandeldoelen van de patiënt, maar overweeg hierbij maximaal de volgende behandelaantallen aan te houden (de aanbevolen maximale behandelaantallen kunnen afwijken van de vergoedingsaanspraak):
Profiel 1 ➝ 0 behandelingen (geen indicatie fysio-/oefentherapie C/M);
Profiel 2 ➝ maximaal 6 behandelingen;
Profiel 3 ➝ maximaal 42 behandelingen;
Profiel 4 ➝ maximaal 62 behandelingen;
Profiel 5 ➝ maximaal 70 behandelingen;
Profiel 6 ➝ n.v.t. (tweede- of derdelijns longrevalidatie).
Bij patiënten in profiel 2: start geen behandeling, tenzij er een indicatie is voor interventies voor het adembewegingsapparaat waarbij de patiënt in enkele sessies geïnstrueerd dient te worden.
Bij patiënten in profiel 3, 4 of 5: Integreer interventies gericht op voorlichting en educatie en interventies gericht op het adembewegingsapparaat waar mogelijk in de sessies die zich primair richten op het bevorderen van fysieke activiteit en/of het bevorderen van fysieke capaciteit.
Het aanbevolen maximale behandelaantal is niet van toepassing voor patiënten die in aanmerking komen voor onderhoudsbehandeling. Zie B.5 ‘Patiëntenprofielen’. Overweeg bij deze patiënten blijvend een behandelfrequentie van één keer per week. Sluit de onderhoudsbehandeling af indien de patiënt in staat is tot het zelfstandig uitvoeren van sport- en/of beweegactiviteiten.
Onderbouwing
Uitgangsvragen
- Wat is de optimale duur van de behandelepisode bij patiënten met COPD?
- Wat is de optimale frequentie van supervisie gedurende een behandelepisode bij patiënten met COPD?
Literatuur en overwegingen
Duur van de behandelepisode
Vanuit het literatuuronderzoek werd één systematic review geïdentificeerd. Hierin werd gezocht naar studies met een vergelijking tussen een kortdurend en langdurend oefenprogramma (Beauchamp 2011). De geïncludeerde RCT’s maakten vergelijkingen tussen oefenprogramma’s van 4 en 7 weken, 8 en 20 weken, en 6 en 18 maanden.
- In drie van de vier studies die rapporteerden over kwaliteit van leven werd direct na de interventie een verschil in effect gevonden in het voordeel van een langdurend programma. Wel was de bewijskracht laag tot zeer laag.
- In een van de vier studies die rapporteerden over fysieke capaciteit werd direct na de interventie een verschil gevonden in het voordeel van een langdurend programma. De bewijskracht was echter zeer laag.
- In geen van de studies werd gerapporteerd over fysieke activiteit (middels een activiteitenmeter) of over ongewenste effecten.
- Omdat de vergelijkingen in de geïdentificeerde studies sterk uiteenlopen en de bewijslast van de bevindingen zeer laag is, is vanuit de literatuur geen eenduidige optimale behandelduur te benoemen.
Op basis van studies die de effectiviteit van fysieke training aantonen, is het mogelijk om te stellen dat er ongeveer 8 tot 12 weken nodig zijn om een klinisch-relevant effect op fysieke capaciteit te bereiken (McCarthy 2015). Deze periode komt overeen met de principes die zijn opgesteld door ‘The American College of Sports Medicine’ (ACSM 2009). Toch is het verlengen van trainingsperiode zinvol, omdat door een langere trainingsperiode de trainingseffecten langer behouden blijven (Jenkins 2018; Pitta 2008). Daarnaast kost het bewerkstelligen van gedragsverandering tijd (Mantoani 2016, 2017). De conclusie is dan ook dat de lengte van de behandelepisode sterk patiëntafhankelijk is. Het is dan ook niet mogelijk om per patiëntenprofiel een aanbeveling te formuleren over de optimale behandelduur.
Langdurig behandelen is belastend voor zowel de patiënt als het zorgsysteem. Het is dan ook wenselijk om ernaartoe te werken dat de patiënt het fysiek functioneren zelfstandig kan onderhouden. De behandeling dient te worden afgesloten zodra de patiënt in staat is tot het zelfstandig uitvoeren van beweeg- en/of sportactiviteiten.
Er wordt aanbevolen om de behandeling als onderhoudsprogramma blijvend voort te zetten met als doel de symptoomlast, fysieke capaciteit en fysieke activiteit stabiel te houden, bij patiënten die vanwege zeer hoge kwetsbaarheid niet in staat zijn tot het zelfstandig uitvoeren van beweeg- en/of sportactiviteiten. Zie voor een definitie van de zeer kwetsbare patiënt B.5 ‘Patiëntenprofielen’.
Frequentie van supervisie
Vanuit het literatuuronderzoek werden twee RCT’s geïdentificeerd waarin oefentherapie (drie sessies per week) uitgevoerd werd. Hierbij werd twee keer per week supervisie (en één keer zonder supervisie) vergeleken met één keer per week supervisie (en twee keer zonder supervisie) (Lidell 2010; O’Neil 2007).
- Direct na de interventie bleek in beide studies geen klinisch-relevant verschil in kwaliteit van leven tussen de groepen die één en twee keer per week supervisie supervisie kregen. De bewijskracht is laag.
- Ook ten aanzien van fysieke capaciteit werd geen klinisch-relevant verschil gevonden tussen de groepen. De bewijskracht is laag.
- In geen van de studies werd gerapporteerd over fysieke activiteit (middels een activiteitenmeter) of over ongewenste effecten.
In de twee geïdentificeerde studies werd in behandelepisoden van respectievelijk zes en acht weken, waarin drie keer per week oefentherapie uitgevoerd werd, één of twee keer per week supervisie aangeboden. In studies die de effectiviteit van oefentherapie bij patiënten met COPD aantonen, wordt echter gemiddeld een frequentie van supervisie van twee tot drie keer per week aangehouden gedurende acht tot twaalf weken (McCarthy 2015).
Daarnaast is de uitval in de twee geïdentificeerde studies zeer hoog (27-33%) en tevens selectief (patiënten met slechtere baselinescores vielen in hogere mate uit). Hierdoor is het niet mogelijk om op basis van deze twee studies de optimale frequentie van supervisie te bepalen waarmee de gewenste effecten met oefentherapie behaald kunnen worden (McCarthy 2015).
Frequente supervisie is vooral wenselijk in de eerste weken van een traject ter bevordering van de fysieke capaciteit. Met supervisie verwerft de patiënt sneller ziekte-inzicht en kennis van de trainingsprincipes. Daarnaast is de verwachting dat frequente supervisie de kans op vroegtijdige uitval verkleint. Indien alleen gestreefd wordt naar het bevorderen van de fysieke activiteit hoeft supervisie minder frequent te worden ingezet dan bij het bevorderen van fysieke capaciteit, aangezien de patiënt voornamelijk in het dagelijks leven zelfstandig aan de doelstellingen dient te werken.
Na een intensieve behandelfase – waarin is toegewerkt naar het bereiken van het behandeldoel – kan gewerkt worden aan het zelfstandig onderhouden van de bereikte resultaten. In deze afbouwfase kan de frequentie van de supervisie worden afgebouwd.
Optimale duur en frequentie van supervisie
Op basis van de literatuur en overige overwegingen is het niet mogelijk een optimale duur en frequentie van supervisie aan te bevelen. Deze beslissing is sterk patiëntafhankelijk en het dient in principe te worden overgelaten aan de klinische expertise van de therapeut hoe lang en hoe frequent de supervisie moet zijn om de behandeldoelen te bereiken en te behouden. Het is echter wel mogelijk om per profiel een voorbeeld te geven van de supervisie bij een patiënt met COPD. Dit staat uitgewerkt in de volgende tabel (Spruit 2020).
Behandelaantallen
Om doelmatige zorg te bevorderen, worden per profiel echter wel maximale behandelaantallen aanbevolen. (Spruit 2020). Deze aantallen zijn gebaseerd op de supervisie die volgens fysio- en oefentherapeuten C/M in veruit de meeste gevallen maximaal nodig is om behandeldoelen op het gebied van de aangrijpingspunten fysieke capaciteit, fysieke activiteit en het adembewegingsapparaat te behalen en te behouden:
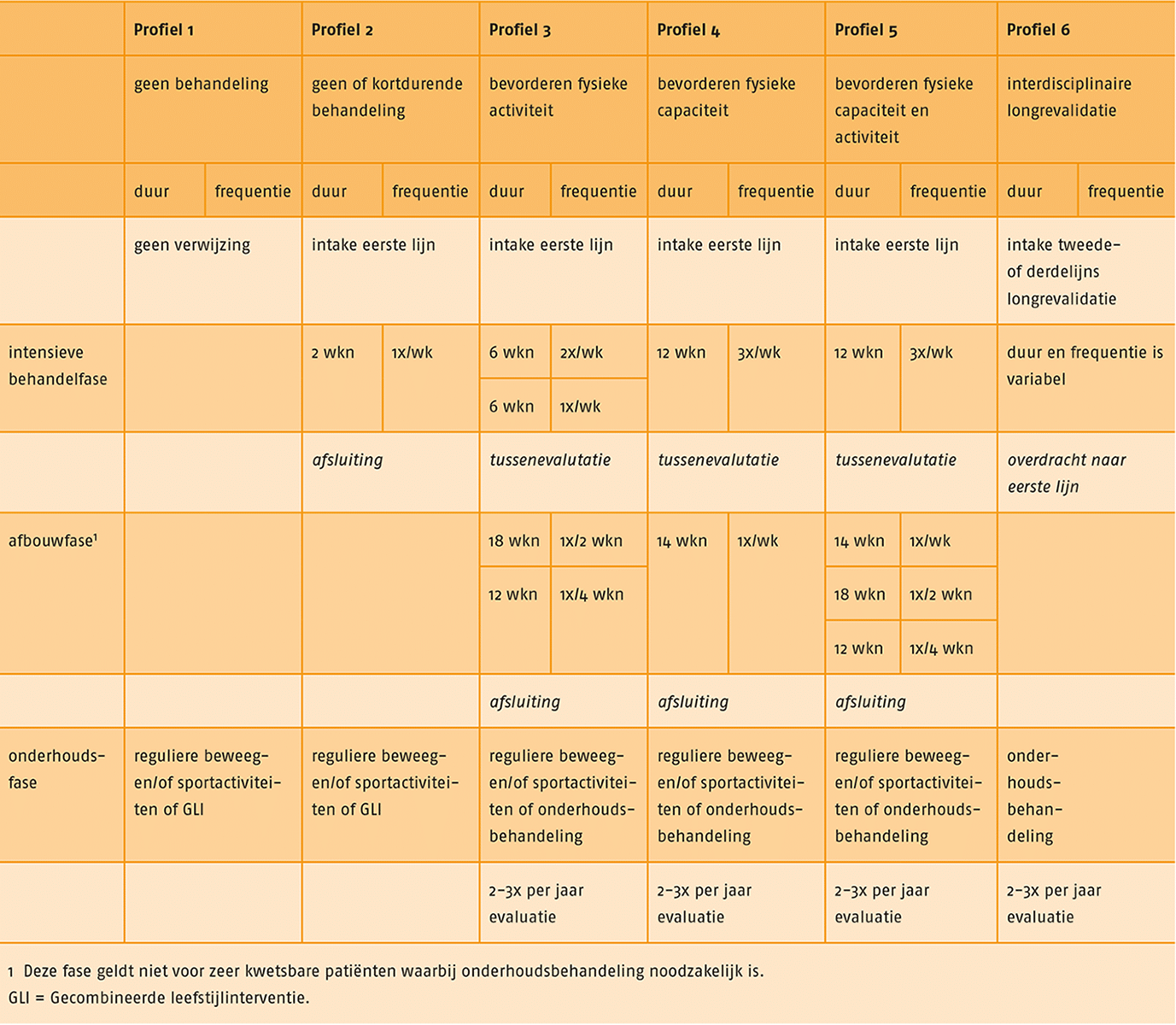
Profiel 1 ➝ 0 behandelingen (geen indicatie fysio- en/of oefentherapie C/M)
Profiel 2 ➝ maximaal 6 behandelingen
Profiel 3 ➝ maximaal 42 behandelingen
Profiel 4 ➝ maximaal 62 behandelingen
Profiel 5 ➝ maximaal 70 behandelingen
Profiel 6 ➝ n.v.t. (tweede- of derdelijns longrevalidatie)
Het maximaal aantal aanbevolen behandelingen geldt voor patiënten die in staat zijn om na de behandelepisode zelfstandig het fysiek functioneren stabiel te houden en dus niet in aanmerking komen voor onderhoudsbehandeling. Bij patiënten die wel in aanmerking komen voor een onderhoudsbehandeling (zie B.5 ‘Patiëntenprofielen’), zou een behandelfrequentie van één keer per week overwogen moeten worden. De onderhoudsbehandeling kan afgesloten worden indien de patiënt in staat is tot het zelfstandig uitvoeren van beweeg- en/of sportactiviteiten.
Voor het beantwoorden van beide uitgangsvragen is een systematisch literatuuronderzoek verricht naar de duur van de behandelperiode en de frequentie van de supervisie .
Literatuur over de duur van de behandelepisode
Zoeken en selecteren
Zoekactie
De gezamenlijke zoekactie naar FITT-factoren van oefentherapie is opgedeeld in twee delen. In het eerste deel van de zoekactie is op 29 mei 2018 gezocht naar systematische reviews (SR’s) van gerandomiseerde gecontroleerde studies (RCT’s). Dit leverde 783 referenties op. Voor het beantwoorden van de deelvraag over duur van de behandelepisode wordt de review van Beauchamp (2011) als basis gebruikt. De search is herhaald op 21 februari 2019 in de databases ‘PubMed’, ‘Embase’, ‘Web of Science’, ‘Cochrane Library’, ‘CENTRAL’, ‘EmCare’, ‘PsycINFO’, ‘ERIC’ en ‘PEDro’.
Er is met relevante zoektermen gezocht naar nieuwe RCT’s naar duur van de behandelepisode die waren gepubliceerd in de Engelse of Nederlandse taal vanaf 2011 (datum zoekactie Beauchamp 2011) en gerandomiseerde gecontroleerde studies naar de frequentie van de supervisie. De zoekverantwoordingen naar SR’s en RCT’s naar FITT-factoren van oefentherapie zijn weergegeven in bijlage C.5.1 (opent in nieuw tabblad). De aanvullende zoekactie leverde in totaal 1607 unieke treffers op.
Literatuurselectie
Alle vijf RCT’s binnen de review van Beauchamp 2011 zijn getoetst aan de selectiecriteria bij deze uitgangsvraag. Deze zijn opgenomen in de volgende tabel.
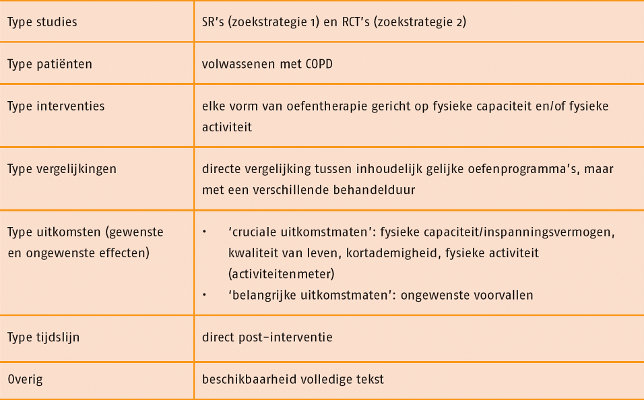
Aangezien alle RCT’s voldeden aan de selectiecriteria, zijn alle RCT’s geïncludeerd. Op basis van titel en abstract werden alle studies uit de aanvullende zoekactie geëxcludeerd, waardoor er geen aanvullende RCT’s naar duur van de behandelepisode geïdentificeerd werden. Het literatuuronderzoek naar duur van de behandelepisode bevat hierdoor enkel de vijf studies uit de review van Beauchamp. Uit deze vijf studies zijn de resultaten op de uitkomstmaten fysieke capaciteit, fysieke activiteit en kwaliteit van leven geëxtraheerd. Over negatieve effecten werd in de geïncludeerde studies niet gerapporteerd.
Bij de aanvullende zoekactie naar de frequentie van de supervisie werd na selectie op basis van titel en abstract de volledige tekst van twee studies geraadpleegd, waarna beide studies geïncludeerd werden. Uit deze twee studies zijn de resultaten op de uitkomstmaten fysieke capaciteit en kwaliteit van leven geëxtraheerd. Over fysieke activiteit (gemeten met een activiteitenmeter) en negatieve effecten werd in de geïncludeerde studies niet gerapporteerd.
Samenvatting literatuur
Beschrijving studies
Vijf studies maakten vergelijkingen tussen een kortdurend en langdurend programma: 4 versus 7 weken (n = 144, Green 2001, Sewell 2006), 8 versus 20 weken (n = 27; Swerts 1990) en 6 versus 18 maanden (n = 280; Berry 2003; Foy 2001). Vier studies rapporteerden over de kwaliteit van leven (Berry 2003; Foy 2001; Green 2001; Sewell 2006) en vier studies rapporteerden over fysieke capaciteit (Berry 2003; Green 2001; Sewell 2006; Swerts 1990). Eén studie rapporteert over fysieke activiteit met behulp van een vragenlijst (Berry 2003). Een vragenlijst wordt echter niet geschikt geacht om fysieke activiteit mee te beoordelen.
Individuele studiekwaliteit
Van alle vijf studies zijn de studieopzet en -uitvoering (‘risk of bias’, RoB) met de Cochrane RoB-tool beoordeeld met laag, hoog, of onduidelijk risico op zes oorzaken voor vertekening, namelijk ‘random sequence generation’, ‘allocation concealment’, ‘blinding’, ‘incomplete outcome data’, ‘selective outcome reporting’ en ‘other issues’.
Een overzicht van de beoordeling van de studiekwaliteit (RoB) per studie is weergegeven in de volgende tabel.
Risk of bias: Duur van de supervisie
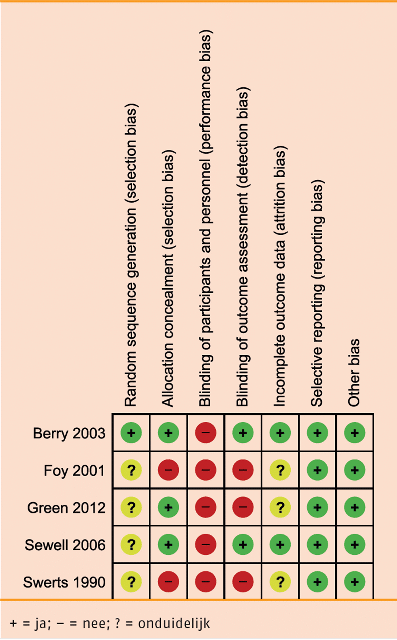
Resultaten en bewijskracht
Gunstige (effectiviteit) en ongunstige effecten (bijwerkingen)
4 weken versus 7 weken
a. Kwaliteit van leven Direct na de interventie vindt één studie (n = 44) een klinisch-relevant verschil op de ‘Chronic Respiratory Questionnaire’ (CRQ; MD = 0,61; 95%-BI = -0,15 tot -1,08) in het voordeel van het langdurend programma (Green 2001). Eén studie (n = 71) vindt direct na de interventie geen klinisch-relevant verschil op de CRQ tussen een kortdurend en langdurend programma, maar rapporteert hierover geen data (Sewell 2006).
De bewijskracht voor de uitkomstmaat functionele (fysieke) capaciteit is met twee niveaus verlaagd door een beperkte studieopzet en één niveau vanwege imprecisie. De bewijskracht komt hiermee uit op zeer laag.
b. Fysieke capaciteit Direct na de interventie vindt één studie (n = 71) een klinisch-relevant verschil op de ‘Endurance Shuttle Walk Test’ (ESWT) (MD = 124,6 sec; 95%-BI = 17 tot 232,2) in het voordeel van een langdurend programma en geen significant verschil (geen data gerapporteerd) op de ‘Incremental Shuttle Walk Test’ (ISWT) tussen een kortdurend en langdurend programma (Sewell 2006). Eén studie (n = 44) vindt direct na de interventie geen klinisch-relevant verschil op de ISWT tussen een kortdurend en langdurend programma (MD -16,9 meter; 95%-BI -58,6 tot 24,81) (Green 2001).
De bewijskracht voor de uitkomstmaat fysieke capaciteit is met twee niveaus verlaagd door een beperkte studieopzet en één niveau vanwege imprecisie. De bewijskracht komt hiermee uit op zeer laag.
c. Fysieke activiteit Niet gerapporteerd.
d. Negatieve effecten Niet gerapporteerd.
8 weken versus 20 weken
a. Kwaliteit van leven Niet gerapporteerd.
b. Fysieke capaciteit Eén studie (n = 26) vond een klein, niet klinisch-relevant verschil op de 12 Minuten
Wandel Test (12MWT) 26 weken na start van de interventie (MD: 60 meter; Swerts 1990).
De bewijskracht voor de uitkomstmaat fysieke capaciteit is met twee niveaus verlaagd door een beperkte studieopzet en één niveau vanwege imprecisie. De bewijskracht komt hiermee uit op zeer laag.
c. Fysieke activiteit Niet gerapporteerd.
d. Negatieve effecten Niet gerapporteerd.
3 maanden versus 18 maanden
a. Kwaliteit van leven Direct na de interventie vindt één studie (n = 210) een klinisch-relevant verschil op de CRQ in het subdomein vermoeidheid in het voordeel van het langdurend programma, terwijl in de overige subdomeinen wel significante, maar geen klinisch-relevant verschillen worden gevonden tussen de groepen (Foy 2001). Eén studie (n = 140) vindt meteen na de interventie een klinisch-relevant verschil op de ‘Fitness Arthritis and Seniors Trial functional performance inventory’ (FAST) tussen een kortdurend en langdurend programma (Berry 2003).
De bewijskracht voor de uitkomstmaat kwaliteit van leven is met twee niveaus verlaagd door een beperkte studieopzet. De bewijskracht komt hiermee uit op laag.
b. Fysieke capaciteit Direct na de interventie vindt één studie een klein, niet klinisch-relevant verschil op de 6 Minuten Wandel Test (6MWT (MD: 30,5 meter)) in het voordeel van een langdurend programma (Berry 2003).
De bewijskracht voor de uitkomstmaat fysieke capaciteit is met twee niveaus verlaagd door een beperkte studieopzet en één niveau vanwege imprecisie. De bewijskracht komt hiermee uit op zeer laag.
c. Fysieke activiteit Niet gerapporteerd via meting met een activiteitenmeter. Eén studie rapporteert over fysieke activiteit met behulp van een vragenlijst. Dit wordt echter niet als geschikt meetinstrument beschouwd.
d Negatieve effecten Niet gerapporteerd.
Literatuur over de frequentie van supervisie
Zoeken en selecteren
Zoekactie
De gezamenlijke zoekactie naar FITT-factoren van oefentherapie is opgedeeld in twee delen. In het eerste deel van de zoekactie is op 29 mei 2018 gezocht naar SR’s van gerandomiseerde gecontroleerde studies (RCT’s). Dit leverde 783 referenties op. Voor het beantwoorden van de deelvraag over frequentie van supervisie werd geen SR gevonden die als basis kon worden gebruikt. De search is herhaald op 21 februari 2019 in de databases PubMed, Embase, Web of Science, Cochrane Library, CENTRAL, EmCare, PsycINFO, ERIC en PEDro. Er is met relevante zoektermen gezocht naar gerandomiseerde gecontroleerde studies naar frequentie van supervisie. De aanvullende zoekactie leverde in totaal 1607 unieke treffers op.
Literatuurselectie
Bij de zoekactie naar de frequentie van supervisie werd na selectie op basis van titel en abstract de volledige tekst van twee studies geraadpleegd, waarna beide studies geïncludeerd werden. Uit deze twee studies zijn de resultaten op de uitkomstmaten fysieke capaciteit en kwaliteit van leven geëxtraheerd. Over fysieke activiteit en negatieve effecten werd in de geïncludeerde studies niet gerapporteerd.
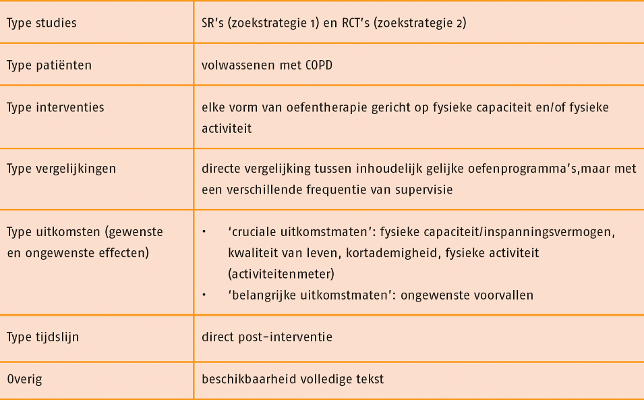
Studies werden geselecteerd op grond van de selectiecriteria in de volgende tabel.
Samenvatting literatuur
Beschrijving studies
Twee studies maakten een vergelijking tussen een supervisie van 1x/week versus 2x/week (Liddell 2010; O’Neill 2007). Beide rapporteerden over kwaliteit van leven en over fysieke capaciteit.
Individuele studiekwaliteit
Van de twee studies zijn de studieopzet en -uitvoering (‘risk of bias’, RoB) met de Cochrane RoB-tool beoordeeld met laag, hoog, of onduidelijk risico op zes oorzaken voor vertekening, namelijk ‘random sequence generation’, ‘allocation concealment’, ‘blinding’, ‘incomplete outcome data’, ‘selective outcome reporting’ en ‘other issues’).
Een overzicht van de beoordeling van de studiekwaliteit (RoB) per studie is weergegeven in de volgende tabel.
Risk of bias: Frequentie van de supervisie

Resultaten en bewijskracht
1x/week versus 2x/week supervisie
a. Kwaliteit van leven Direct na de interventie van 8 weken vindt 1 studie (n = 30) een niet klinisch- relevante verbetering (geen MD vermeld) op de ‘St George’s Respiratory Questionnaire’ (SGRQ) bij 2x/ week supervisie, terwijl deze verbetering afwezig is bij 1x/week supervisie (Liddell 2010). Een andere studie (n = 91) vindt direct na de interventie geen klinisch-relevant verschil op de ‘Chronic Respiratory Disease Questionnaire’ (CRDQ) tussen 1x/week supervisie en 2x/week supervisie (MD = 2,54; 95% = BI -3,16 tot 8,24) (O’Neill 2007).
De bewijskracht voor de uitkomstmaat fysieke capaciteit is met één niveau verlaagd door een beperkte studieopzet en één niveau vanwege imprecisie. De bewijskracht komt hiermee uit op laag.
b. Fysieke capaciteit Eén studie vindt direct na de interventie, noch op de ISWT als op de ESWT, een klinisch-relevant verschil (geen MD vermeld) tussen 1x/week supervisie en 2x/week supervisie (Liddell 2010). Een andere studie vindt ook geen verschil, noch op de ISWT (MD = 13,5 m; 95% = BI -10,1 tot 37,2) als op de ESWT (MD = 72,6 sec; 95% = BI -96,0 tot 241) (O’Neill 2007).
De bewijskracht voor de uitkomstmaat fysieke capaciteit is met één niveau verlaagd door een beperkte studieopzet en met één niveau vanwege imprecisie. De bewijskracht komt hiermee uit op laag.
c. Fysieke activiteit Niet gerapporteerd.
d. Negatieve effecten Niet gerapporteerd.
Overwegingen
De richting en sterkte van de aanbeveling worden niet alleen bepaald door bevindingen in de literatuur. Ook andere overwegingen spelen daarbij een rol, zoals kosten, aanvaardbaarheid en haalbaarheid.
Gewenste effecten Vanuit de systematische search zijn vijf studies geïdentificeerd omtrent de duur van de behandeling en twee omtrent de frequentie van de supervisie. De bewijskracht voor alle uitkomstmaten is echter laag tot zeer laag. Beide studies over de frequentie van supervisie hebben een lage RoB (< 3 items laag-risico). De uitval in beide studies is echter zeer hoog (27-33%) en tevens selectief (met name patiënten met slechtere baseline scores). Vanwege de grote beperkingen in de geïncludeerde studies wordt het als onwenselijk gezien om de resultaten van het literatuuronderzoek als basis te gebruiken voor de beantwoording van beide uitgangsvragen.
Ongewenste effecten In de geïdentificerde studies zijn geen ongewenste effecten gerapporteerd. Bij de behandeling van de aangrijpingspunten fysieke activiteit en fysieke capaciteit zou onvoldoende supervisie echter kunnen leiden tot onvoldoende therapietrouw. Met name in de initiële behandelfase, waarin specifieke doelen bereikt moeten worden, is het belangrijk om patiënten met hoge frequentie te begeleiden. Bij het optimaliseren van fysieke activiteit zou gestart moeten worden met twee keer per week supervisie om therapietrouw te bevorderen. Voor het bevorderen van fysieke capaciteit dient drie keer per week getraind te worden om de optimale trainingsprikkel te bereiken (ACSM 2009). Hierbij heeft het de voorkeur om, met name in de eerste weken, onder volledige of bijna volledige supervisie te trainen. Een belangrijke reden dat trainingssessies in de eerste periode onder (vrijwel) volledige supervisie plaats dienen te vinden, is dat het voor patiënten zelf zeer moeilijk in te schatten is wat de optimale intensiteit van de training moet zijn en hoe zij de training moeten opbouwen. Een te lage intensiteit leidt tot te weinig trainingsresultaat, terwijl trainen op een te hoge intensiteit het risico op adverse events verhoogt. Een frequentie van twee tot drie keer per week wordt veelal aangehouden in trainingsprogramma’s in wetenschappelijke studies die de effectiviteit van trainingsprogramma’s aantonen (McCarthy 2015).
Een te korte duur van therapie kan er enerzijds toe leiden dat de training onvoldoende effect heeft en anderzijds leiden tot een te snelle terugval van het bereikte effect. Op basis van inspanningsfysiologische principes, principes vanuit de gedragsverandering en studies naar het effect van fysieke training bij patiënten met COPD wordt een periode van 8 tot 12 weken veelal aangehouden voor de initiële behandelfase, waarin gewerkt wordt aan het bereiken van doelstellingen (ACSM 2009; McCarthy 2015). Voldoende aandacht voor het behoud van fysieke activiteit is belangrijk, omdat veel patiënten door te weinig supervisie terug kunnen vallen in het oude patroon van inactiviteit (Mantoani 2016, 2017). Ook bij het bevorderen van fysieke capaciteit is een periode van nabehandeling nodig om ervoor te zorgen dat de patiënt op een juiste manier blijft trainen en hiermee de bereikte fysieke capaciteit op peil houdt (Jenkins 2018). Deze periode van nabehandeling is tevens geschikt voor het begeleiden van de patiënt naar het reguliere beweeg- en sportaanbod.
Kwaliteit gewenste effecten De geïdentificeerde literatuur geeft onvoldoende antwoord op de gestelde uitgangsvragen omtrent optimale duur en frequentie van de supervisie.
Balans tussen gewenste en ongewenste effecten Niet van toepassing.
Waarde aan gewenste effecten Patiënten met COPD en een milde, matige of hoge symptoomlast zijn fysiek dermate beperkt dat een interventie hierop naar verwachting gewenst is (GOLD 2020).
Variatie in waarde aan gewenste effecten Tussen patiënten met COPD zitten grote verschillen. Patiënten met een lage symptoomlast zullen naar verwachting minder waarde hechten aan de te verwachtte, kleine gezondheidswinst. Patiënten met een hoge symptoomlast zullen echter zeer veel waarde hechten aan alleen al stabilisatie van het fysiek functioneren van dat moment.
Benodigde middelen (kosten) Een hoge frequentie en langere tijdsduur van de supervisie leidt vanzelfsprekend tot hogere directe zorgkosten dan bij minder frequente of minder lang gesuperviseerde therapie.
Variatie in benodigde middelen (kosten) De meest kwetsbare patiënten zullen naar verwachting veel directe zorgkosten maken, doordat een onderhoudsbehandeling nodig is om achteruitgang in het fysiek functioneren zoveel als mogelijk is te beperken en/of de symptoomlast te verminderen (Jenkins 2018).
Kosteneffectiviteit Verschillen in kosteneffectiviteit tussen langdurende en kortdurende, en hoogfrequente en laagfrequentie supervisie zijn niet aangetoond in wetenschappelijke studies. Meer supervisie in de initiële behandelfase zal echter leiden tot een effectievere opbouw van de fysieke activiteit en fysieke capaciteit, waarmee het risico op ziekenhuisopname door een longaanval zal afnemen. De indirecte kosten ten gevolge van een longaanval zullen naar verwachting gaan toenemen bij een te geringe trainingsduur of een te lage trainingsfrequentie.
Aanvaardbaarheid Tot op heden zijn veel patiënten met COPD eraan gewend om langdurig, gesuperviseerd door een therapeut, te bewegen. De inschatting is echter dat veel patiënten (met uitzondering van de meest kwetsbare groep en patiënten die een interdisciplinair longrevalidatieprogramma doorlopen hebben) na de initiële behandelperiode een transitie kunnen en moeten maken richting het reguliere beweeg- en/of sportaanbod, waarbij de supervisie van de therapeut afgebouwd wordt. Deze verandering zal voor veel patiënten en therapeuten als nieuw ervaren worden, maar zal uiteindelijk bijdragen aan meer doelmatige zorg.
Haalbaarheid Op basis van de beschikbare literatuur en de eerder genoemde overwegingen is het niet mogelijk een optimale duur en frequentie vast te stellen. Het is wel mogelijk om een inschatting te maken van het benodigde aantal sessies per profiel, uitgaande van een intensieve behandelfase en een afbouwfase. Een therapeut kan gemotiveerd afwijken van dit aantal als dit voor het bereiken of behouden van de doelstelling nodig is.
Conclusie Op basis van de literatuur en bovenstaande overwegingen doet de werkgroep geen aanbeveling over de optimale duur en frequentie van supervisie. Wel doet de werkgroep per profiel een aanbeveling voor het maximale aantal sessies dat in principe nodig is om behandeldoelstellingen te behalen en te behouden (Spruit 2020). De initiële behandelfase is gericht op het verbeteren van fysiek functioneren aan de hand van de aangrijpingspunten. De afbouwfase is gericht op behoud van het bereikte effect en bevorderen van zelfmanagement, zodat het mogelijk wordt om het bereikte effect te behouden zonder supervisie van de therapeut. Hierbij dient aangetekend te worden dat het behoud van fysiek functioneren zonder supervisie niet voor iedere patiënt met COPD mogelijk is. Op grond hierdoor wordt aanbevolen de meest kwetsbare groep patiënten en patiënten die een interdisciplinair longrevalidatieprogramma doorlopen hebben een onderhoudsbehandeling aan te bieden. Hierbij wordt een behandelfrequentie van één keer per week aanbevolen, tenzij dit voor het behoud van het fysiek functioneren onvoldoende blijkt te zijn.
- ACSM. American College of Sports Medicine position stand. Exercise and physical activity for older adults. Med Sci Sports Exerc. 2009;41(7):1510-30.
- Beauchamp MK, Janaudis-Ferreira T, Goldstein RS, Brooks D. Optimal duration of pulmonary rehabilitation for individuals with chronic obstructive pulmonary disease – a systematic review. Chron Respir Dis. 2011;8(2):129-40.
- Berry MJ, Rejeski WJ, Adair NE, Ettinger WH Jr, Zaccaro DJ, Sevick MA. A randomized, controlled trial comparing long-term and short-term exercise in patients with chronic obstructive pulmonary disease. J Cardiopulm Rehabil. 2003;23(1):60-8.
- Foy CG, Rejeski WJ, Berry MJ, Zaccaro D, Woodard CM. Gender moderates the effects of exercise therapy on health-related quality of life among COPD patients. Chest. 2001;119(1):70-6.
- GOLD. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. Global Initiative for Chronic Obstructive Lung Disease (GOLD); 2020.
- Green RH, Singh SJ, Williams J, Morgan MD. A randomised controlled trial of four weeks versus seven weeks of pulmonary rehabilitation in chronic obstructive pulmonary disease. Thorax. 2001;56(2):143-5.
- Hibbard JH, Mahoney ER, Stockard J, Tusler M. Development and testing of a short form of the patient activation measure. Health Serv Res. 2005;40(6 Pt 1):1918-30.
- Jenkins AR, Gowler H, Curtis F, Holden NS, Bridle C, Jones AW. Efficacy of supervised maintenance exercise following pulmonary rehabilitation on health care use: a systematic review and meta-analysis. Int J Chron Obstruct Pulmon Dis. 2018;13:257-3.
- KNGF. Bekostiging COPD. Amersfoort: Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF); 2019. Beschikbaar via https://www.kngf.nl. Geraadpleegd op 29 november 2019.
- Liddell F, Webber J. Pulmonary rehabilitation for chronic obstructive pulmonary disease: a pilot study evaluating a once-weekly versus twice-weekly supervised programme. Physiotherapy. 2010;96(1):68-74.
- Mantoani LC, Rubio N, McKinstry B, MacNee W, Rabinovich RA. Interventions to modify physical activity in patients with COPD: a systematic review. Eur Respir J. 2016;48(1):69-81.
- Mantoani LC, Dell’Era S, MacNee W, Rabinovich RA. Physical activity in patients with COPD: the impact of comorbidities. Expert Rev Respir Med. 2017;11(9):685-98.
- McCarthy B, Casey D, Devane D, Murphy K, Murphy E, Lacasse Y. Pulmonary rehabilitation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2015;(2):CD003793.
- Nivel. Minder zelfmanagementvaardigheden, dus meer zorggebruik? Utrecht: Nivel; 2013.
- O’Neill B, McKevitt A, Rafferty S, Bradley JM, Johnston D, Bradbury I, et al. A comparison of twice- versus once-weekly supervision during pulmonary rehabilitation in chronic obstructive pulmonary disease. Arch Phys Med Rehabil. 2007;88(2):167-72.
- Pitta F, Troosters T, Probst VS, Langer D, Decramer M, Gosselink R. Are patients with COPD more active after pulmonary rehabilitation? Chest. 2008 Aug;134(2):273-280.
- Sewell L, Singh SJ, Williams JE, Collier R, Morgan MD. How long should outpatient pulmonary rehabilitation be? A randomised controlled trial of 4 weeks versus 7 weeks. Thorax. 2006;61(9):767-71.
- Spruit MA, van ’t Hul A, Vreeken HL, Beekman E, Post MHT, Meerhoff GA, et al. Profiling of patients with COPD for adequate referral to exercise-based care: the Dutch model. Sports Med. 2020 Apr 24. doi: 10.1007/ s40279-020-01286-9.
- Swerts PM, Kretzers LM, Terpstra-Lindeman E, Verstappen FT, Wouters EF. Exercise reconditioning in the rehabilitation of patients with chronic obstructive pulmonary disease: a short- and long-term analysis. Arch Phys Med Rehabil. 1990;71(8):570-3.
- ZiN. Rapport Gesuperviseerde oefentherapie bij COPD. Diemen: Zorginstituut Nederland (ZiN); 2018.
C.5.2 Oefentherapie in groepsverband
Bied bij voorkeur oefentherapie aan in groepsverband waarbij intensieve begeleiding op maat gegeven kan worden. Alleen wanneer dit om praktische redenen niet mogelijk is (bijvoorbeeld als de patiënt aan huis behandeld moet worden), vindt de begeleiding individueel plaats.
Maak op basis van patiëntfactoren (symptoomlast, patiëntkenmerken), therapeutfactoren (vaardigheden) en organisatiefactoren (faciliteiten) een inschatting van de optimale therapeut- patiëntratio, maar houd een maximum van zes patiënten per therapeut aan.
Onderbouwing
Uitgangsvraag
Wanneer en bij wie kies je voor groepstraining en wanneer kies je voor individuele training en waar moet de groepstraining aan voldoen (bijv. groepsgrootte)?
Aanleiding
Oefentherapie voor COPD wordt veelal in groepsvorm aangeboden. Alvorens specifieke adviezen over de therapievorm te kunnen geven, moet duidelijk zijn of er tussen beide trainingsvormen verschil is in effect op klinische uitkomstmaten.
Literatuur
Er zijn geen specifieke studies waarin groepstherapie is vergeleken met individuele therapie op klinische uitkomstmaten bij patiënten met COPD. Dergelijke studies zijn wel uitgevoerd voor de therapeutische setting binnen andere patiëntpopulaties.
Een systematische review naar het effect op klinische uitkomstmaten bij urine-incontinentie en bij lage rugpijn laat dezelfde resultaten zien voor groepsfysiotherapie als voor individuele therapie met gelijke fysiotherapeutische inhoud (Robertson 2014). Een gerandomiseerde gecontroleerde trial naar de behandelvorm voor fysiotherapie bij knieartrose laat ook geen verschil in resultaten zien (Allen 2016). Voor longrevalidatie bij patiënten met COPD is aangetoond dat een veelzijdige benadering van zelfmanagementvaardigheden en gedrag zowel in een groep als op basis van individuele therapie kan worden gefaciliteerd (Lacasse 2006).
Het verschil tussen groepsbenadering en individuele benadering is ook onderzocht in vakgebieden buiten de fysio- en oefentherapie, voornamelijk in de geestelijke gezondheidszorg. Zoals een review waarbij cognitieve gedragstherapie in een groep werd vergeleken met individuele cognitieve gedragstherapie. In deze review werd geen verschil in effect op klinische uitkomstmaten gevonden, maar ook geen verschil in uitval en follow-up (Pozza 2017).
Soms worden van groepstherapie ten opzichte van individuele therapie bijkomende voordelen gerapporteerd. Zo kunnen patiënten die in het verleden longrevalidatie als positief hebben ervaren en die bereid zijn hun positieve ervaringen te delen, een sterk vormend effect hebben op andere patiënten met COPD (Lorig 1993).
Uit een andere studie bleek dat groepstherapie patiënten ondersteunt, omdat ervaringen worden gedeeld, leerervaringen versterkt, het zelfbeeld van patiënten verandert en passiviteit wordt ontmoedigd (ATS/ERS 2013). In enkele studies binnen en buiten het vakgebied van fysio- of oefentherapie is de uitval lager bij de groepstherapie in vergelijking met individuele therapie of is de follow-up na deelname aan groepstherapie beter na beëindiging van de interventie, wat erop kan duiden dat kenmerken van groepstherapie leiden tot een lager uitvalpercentage (Doussoulin 2018; Minniti 2007). Bewegen in groepsverband kan de sociale steun vergroten (KNGF 2014).
Het is niet mogelijk om de conclusies uit de hiervoor beschreven studies te generaliseren naar andere populaties waarin revalidatie wordt aangeboden (Robertson 2014), waaronder COPD. Om te beoordelen of een patiënt beter in een groep of individueel kan trainen en of juist beter voorlichting en educatie kan krijgen, spelen andere aspecten een belangrijke rol.
Belangrijk zijn het kennisniveau van de patiënt (over de invloed van negatief denken, inactiviteit, benaderingen van symptoommanagement en barrières voor therapietrouw) en hoe een patiënt de groep ervaart (individueel comfort) kunnen belangrijke factoren zijn voor het optimaliseren van de voorlichting en het succesvol laten verlopen van het oefenprogramma (Lee 2014; Graves 2010).
Ook de inhoud en de vorm van de supervisie spelen een rol. Het is ook mogelijk om in een groep te trainen met een individueel afgestemd programma en onder intensieve professionele begeleiding (LAN 2016). Het toepassen van andere methoden van support, zoals voortdurend peersupport in groepsvorm na afloop van longrevalidatie, zijn weinig bestudeerd (Spruit 2013). Kwalitatief onderzoek toont echter aan dat patiënten na afloop van longrevalidatie wel waarde hechten aan dergelijke groepsactiviteiten met patiënten die dezelfde behoeften en ervaringen hebben (Rodgers 2007).
Er is geen bewijs voor de optimale groepsgrootte (McCarthy 2015). Vaak trainen patiënten in kleine groepen (LAN 2016). De ‘American Association of Cardiovascular and Pulmonary Rehabilitation’ beveelt een ratio aan van vier patiënten per therapeut (AACVPR 2011) en de ‘British Thoracic Society’ beveelt een ratio aan van acht patiënten per therapeut (British Thoracic Society 2001).
Overwegingen
Hoewel groepstherapie voor longrevalidatie de voorkeur heeft, is individuele behandeling ook mogelijk (LAN 2016) in geval van noodzakelijke behandeling aan huis of indien de patiënt specifieke behandeldoelen heeft die niet in een groep behaald kunnen worden. Er kan ook gekozen worden voor een combinatie van groepstherapie enerzijds en individueel advies, voorlichting of specifieke oefeningen anderzijds. De individuele behandeling kan dan wel onderdeel uitmaken van de behandeling in groepsverband. De voordelen van groepstherapie in de praktijk zijn het plezier dat de patiënt ervaart tijdens de training, maar ook de ondersteuning vanuit het lotgenotencontact, bijvoorbeeld door ervaringen te delen. Een nadeel kan zijn dat patiënten grote groepen als ‘te druk’ kunnen ervaren.
De therapeut bepaalt de optimale ratio op basis van patiëntfactoren (symptoomlast, patiëntkarakteristieken), therapeutfactoren (vaardigheden) en organisatiefactoren (faciliteiten). De werkgroep is van mening dat zes patiënten per therapeut het maximaal haalbare is om voldoende individuele begeleiding te kunnen bieden. Drie of vier patiënten per therapeut kan in de praktijk soms realistischer zijn, afhankelijk van de hiervoor beschreven factoren. Voorlichtingen educatie kan in grotere groepen worden gegeven (zie C.1 ‘Voorlichting en educatie’).
Voor het beantwoorden van de uitgangsvraag is in overleg met de werkgroep en de klankbordgroep besloten geen systematisch literatuuronderzoek uit te voeren. De literatuur over dit onderwerp is op niet-systematische wijze vergaard.
- AACVPR. Guidelines for pulmonary rehabilitation programs. 4th Edition. Chicago, IL: American Association of Cardiovascular and Pulmonary Rehabilitation (AACVPR); 2011.
- Allen KD, Bongiorni D, Bosworth HB, Coffman CJ, Datta SK, Edelman D, et al. Group versus individual physical therapy for veterans with knee osteoarthritis: randomized clinical trial. Phys Ther. 2016;96(5):597-608.
- ATS/ERS. An official American Thoracic Society/European Respiratory Society statement: key concepts and advances in pulmonary rehabilitation. American Thoracic Society/European Respiratory Society (ATS/ERS). Am J Respir Crit Care Med. 2013;188(8):e13-64.
- British Thoracic Society Standards of Care Subcommittee on Pulmonary Rehabilitation. Pulmonary rehabilitation. Thorax 2001;56:827-34.
- Doussoulin A, Rivas C, Rivas R, Saiz J. Effects of modified constraint-induced movement therapy in the recovery of upper extremity function affected by a stroke: a single-blind randomized parallel trial-comparing group versus individual intervention. Int J Rehabil Res. 2018;41(1):35-40.
- Graves J, Sandrey V, Graves T, Smith DL. Effectiveness of a group opt-in session on uptake and graduation rates for pulmonary rehabilitation. Chron Respir Dis. 2010;7(3):159-64.
- Lacasse Y, Goldstein R, Lasserson TJ, Martin S. Pulmonary rehabilitation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2006;4:CD003793.
- Lorig K, Holman H. Arthritis self-management studies: a twelve-year review. Health Educ Q 1993;20:17-28. McCarthy B, Casey D, Devane D, Murphy K, Murphy E, Lacasse Y. Pulmonary rehabilitation for chronic obstruc-
- tive pulmonary disease. Cochrane Database Syst Rev. 2015;(2):CD003793.
- Minniti A, Bissoli L, Di Francesco V, Fantin F, Mandragona R, Olivieri M, et al. Individual versus group therapy for obesity: comparison of dropout rate and treatment outcome. Eat Weight Disord. 2007;12(4):161-7.
- Pozza A, Dèttore D. Drop-out and efficacy of group versus individual cognitive behavioural therapy: What works best for obsessive-compulsive disorder? A systematic review and meta-analysis of direct comparisons. Psychiatry Res. 2017;258:24-36.
- Robertson B, Harding KE. Outcomes with individual versus group physical therapy for treating urinary incontinence and low back pain: a systematic review and meta-analysis of randomized controlled trials. Arch Phys Med Rehabil. 2014;95(11):2187-98.
- Rodgers S, Dyas J, Molyneux AW, Ward MJ, Revill SM. Evaluation of the information needs of patients with chronic obstructive pulmonary disease following pulmonary rehabilitation: a focus group study. Chron Respir Dis 2007;4:195-203.
C.6 Therapeutisch handelen bij subgroepen
Deze module betreft:
- Therapeutisch handelen bij comorbiditeit (module C.6.1)
- Therapeutisch handelen bij een longaanval (module C.6.2)
- Therapeutisch handelen in de palliatieve fase (module C.6.3)
C.6.1 Therapeutisch handelen bij comorbiditeit
Monitor indien nodig specifieke parameters extra intensief en wees gedurende de behandelepisode alert op het signaleren van onbekende/nieuwe comorbiditeit, verslechtering van bestaande comorbiditeit en/of rode vlaggen met betrekking tot de comorbiditeit tijdens het diagnostisch én therapeutisch proces.
Wees tijdens het trainen alert op symptomen die gerelateerd zijn aan cardiovasculair risico, zoals plotselinge pijn op de borst. Zie B.4.1 ‘Rode vlaggen’.
Overweeg oefeningen aan te passen indien klachten aan het houdings- en bewegingsapparaat de training belemmeren. Er kan gekozen worden voor gewrichtsontlastende training om toch op de optimale intensiteit te kunnen trainen, of voor specifieke oefeningen om de klachten aan het houdings- en bewegingsapparaat af te laten nemen.
Wees bij symptomen van angst en depressie alert op uitval gedurende de behandelepisode. Zie B.4.2 ‘Doorverwijzing naar andere zorgverleners’. Overleg indien nodig met de verwijzer.
Wees alert op (een verhoogd risico op) ondervoeding en/of sarcopenie. Zie B.4.2 ‘Doorverwijzing naar andere zorgverleners’. Overleg indien nodig met de verwijzer.
Voor het aanpassen van oefentherapie zijn behalve kennis en vaardigheden met betrekking tot COPD ook kennis en vaardigheden vereist met betrekking tot de comorbiditeit. Hierbij geldt de algemene stelregel ‘onbekwaam is onbevoegd’. Indien bij de behandelend therapeut de benodigde kennis van en vaardigheden ten aanzien van de aanwezige comorbiditeit onvoldoende aanwezig zijn, verwijst de therapeut de patiënt door naar een therapeut die hierover wel beschikt.
Onderbouwing
Uitgangsvraag
Hoe wordt het therapeutisch handelen vormgegeven indien er sprake is van een veelvoorkomende comorbiditeit (en daaraan gerelateerde medicatie) die het fysiek functioneren van een patiënt met COPD beïnvloedt?
De beantwoording van deze uitgangsvraag is gebaseerd op de aanbevelingen ten aanzien van regulier therapeutisch handelen (C.1 t/m C.5). De aanbevelingen in deze module zijn aanvullend.
Aanleiding
Naar de invloed van comorbiditeit op de effecten van de therapie bij patiënten met COPD is tot op heden weinig wetenschappelijk onderzoek gedaan. In de meeste wetenschappelijke studies is nooit actief gescreend op mogelijke aanwezigheid van comorbiditeit of zijn patiënten met COPD met gekende comorbiditeit uitgesloten van deelname aan wetenschappelijke studies (McCarthy 2015).
Als uitgangspunt wordt gehanteerd dat aanbevelingen op het gebied van therapeutisch handelen gevolgd kunnen worden, ook bij patiënten met COPD plus comorbiditeit, tenzij er een specifieke aanleiding is om de aanbeveling niet te volgen. Wél kan comorbiditeit aanleiding zijn om specifieke parameters intensief te monitoren of om therapeutische interventies aan te passen. Voor het aanpassen van oefentherapeutische interventies dient de therapeut te beschikken over voldoende kennis en vaardigheden met betrekking tot COPD én de betreffende comorbiditeit. Hierbij geldt de algemene stelregel ‘onbekwaam is onbevoegd’. Als de behandelend therapeut die kennis en vaardigheden niet heeft, dient de therapeut de patiënt door te verwijzen naar een therapeut die daar wel over beschikt.
Aangezien het niet mogelijk is om alle vormen van comorbiditeit te benoemen, beperkt deze richtlijn zich tot de meest voorkomende comorbiditeit (zie B.7.1 ‘Diagnostisch handelen bij comorbiditeit’), namelijk cardiovasculaire aandoeningen, aandoeningen van het houdings- en bewegingsapparaat, symptomen van angst en depressie en abnormale lichaamssamenstelling.
Aandachtspunten bij comorbiditeit
Cardiovasculaire aandoeningen
- De therapeut dient tijdens oefentherapie extra alert te zijn op symptomen van cardiovasculair risico, zoals pijn op de borst (Beekman 2013; Neder 2018). Zie B.4.1 ‘Rode Vlaggen’.
- Bij gebruik van bètablokkers verloopt de hartfrequentie afwijkend (Beekman 2013; Horowitz 1996; Neder 2018; ZiNL 2019).
Aandoeningen van het houdings- en bewegingsapparaat
- De therapeut dient alert te zijn op pijnklachten aan het houdings- en bewegingsapparaat tijdens fysieke training en beoordeelt of deze pijn de fysieke activiteiten belemmeren.
- Om het functioneel inspanningsvermogen voldoende intensief te trainen of fysieke activiteit te vergroten, kan gekozen worden voor minder gewrichtsbelastende oefenvormen en activiteiten, zoals fietsen en/of hydrotherapie, in plaats van lopen.
- Het aanbieden van specifieke oefeningen kan overwogen worden om klachten aan het houdings- en bewegingsapparaat tegen te gaan, indien deze klachten de fysieke training of het bevorderen van fysieke activiteit belemmeren.
Symptomen van angst en depressie
- Het risico op tussentijdse uitval is vergroot bij patiënten met symptomen van angst en depressie; hier dient men alert op te zijn (Garrod 2006; Harrison 2012; Trappenburg 2005). Gesuperviseerde oefentherapie kan echter een positief effect hebben op symptomen van angst en depressie, met name bij patiënten met verhoogde angst en/of depressie bij aanvang van de behandeling (Harrison 2012).
- Symptomen van angst en depressie dienen bespreekbaar gemaakt te worden, waarbij begrip getoond wordt naar de patiënt.
- Het is belangrijk de reden van de angst te begrijpen en om zo aangrijpingspunten voor de behandeling vast te stellen. Bij angst die is gerelateerd aan de longaandoening, zoals angst voor kortademigheid of bewegingsangst door kortademigheid, kan er ingestoken worden op educatie, vertrouwen geven en ervaring laten opdoen door te oefenen in een veilige omgeving.
- Indien de symptomen van angst of depressie de behandeling belemmeren, of wanneer de therapeut onvoldoende invloed op de klachten heeft, wordt contact opgenomen met de verwijzer. Mogelijk is er indicatie voor doorverwijzing naar een psycholoog.
Abnormale lichaamssamenstelling
- Indien er sprake is van (een verhoogd risico op) ondervoeding en/of sarcopenie is er mogelijk indicatie voor doorverwijzing naar een diëtist (zie B.4.2 ‘Doorverwijzen naar andere zorgverleners’). In dat geval dient er contact opgenomen te worden met de verwijzer.
- Bij patiënten met obesitas dient men alert te zijn op mogelijk hieraan gerelateerde pijnklachten aan de onderste extremiteiten. De therapie kan waar nodig aangepast worden zoals hiervoor beschreven (‘Aandoeningen van het houdings- en bewegingsapparaat’).
Aandachtspunten in het algemeen
- De therapeut dient alert te zijn op het signaleren van onbekende en mogelijk nieuwe vormen van comorbiditeit, verslechtering van bestaande comorbiditeit en/of rode vlaggen met betrekking tot comorbiditeit.
- De oefeningen dienen aangepast te worden indien klachten naar aanleiding van comorbiditeit de training belemmeren.
Voor het beantwoorden van de uitgangsvraag is in overleg met de werkgroep en de klankbordgroep besloten geen systematisch literatuuronderzoek uit te voeren. De literatuur over dit onderwerp is op niet-systematische wijze vergaard.
- Beekman E, Mesters I, de Rooij M, de Vries N, Werkman M, Hulzebos E, et al. Therapeutic consequences for physical therapy of comorbidity highly prevalent in COPD: a multi-case study. J Aller Ther. 2013;S2(004).
- Garrod R, Marshall J, Barley E, Jones PW. Predictors of success and failure in pulmonary rehabilitation. Eur Respir J. 2006;27(4):788-94.
- Harrison SL, Greening NJ, Williams JE, Morgan MD, Steiner MC, Singh SJ. Have we underestimated the efficacy of pulmonary rehabilitation in improving mood? Respir Med. 2012;106(6):838-44.
- Horowitz MB, Littenberg B, Mahler DA. Dyspnea ratings for prescribing exercise intensity in patients with COPD. Chest. 1996 May;109(5):1169-75.
- McCarthy B, Casey D, Devane D, Murphy K, Murphy E, Lacasse Y. Pulmonary rehabilitation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2015 Feb 23;(2):CD003793.
- Neder JA, Rocha A, Alencar MCN, Arbex F, Berton DC, Oliveira MF, et al. Current challenges in managing comorbid heart failure and COPD. Expert Rev Cardiovasc Ther. 2018;16(9):653-73.
- NVD. Artsenwijzer diëtetiek: Longziekten. Houten: Nederlandse Vereniging van Diëtisten (NVD); 2016.
- Trappenburg JC, Troosters T, Spruit MA, Vandebrouck N, Decramer M, Gosselink R. Psychosocial conditions do not affect short-term outcome of multidisciplinary rehabilitation in chronic obstructive pulmonary disease. Arch Phys Med Rehabil. 2005 Sep;86(9):1788-92.
- ZiN. Farmacotherapeutisch kompas. Zorginstituut Nederland (ZiN). Beschikbaar via: https://www.farmacotherapeutischkompas.nl/. Geraadpleegd op 22 augustus 2019.
C.6.2 Therapeutisch handelen bij een longaanval
De patiënt dient bij een longaanval zo snel mogelijk geactiveerd of gemobiliseerd te worden als de klinische status dit toelaat.
Als blijkt dat de patiënt rond een longaanval met de gebruikelijke oefentherapie vanwege kortademigheid en/of vermoeidheid onvoldoende intensief belast kan worden om doelen op het gebied van fysieke capaciteit te bereiken, worden strategieën toegepast die minder aanspraak doen op de ventilatie en gaswisseling van de patiënt, zoals spierkrachttraining of NMES.
Wees alert op sputumretentie en pas technieken voor mucusklaring toe indien nodig.
Wees alert op het feit dat na een ziekenhuisopname vanwege een longaanval de patiënt gescreend dient te worden voor interdisciplinaire longrevalidatie.
Wees bij een longaanval alert op een afname van fysieke capaciteit en fysieke activiteit en pas zo nodig interventies toe om fysieke capaciteit en fysieke activiteit te optimaliseren.
Onderbouwing
Uitgangsvraag
Hoe wordt het therapeutisch proces bij patiënten met COPD bij een longaanval vormgegeven?
De beantwoording van deze uitgangsvraag is gebaseerd op de aanbevelingen ten aanzien van regulier therapeutisch handelen (C.1 t/m C.5). De aanbevelingen in deze module zijn aanvullend.
Aanleiding
Het is belangrijk om bij een longaanval – als de klinische status dit toelaat – direct te starten met de therapie, deze te hervatten of voort te zetten, of de patiënt opgenomen is geweest in het ziekenhuis of niet (Puhan 2016). De therapie dient afgestemd te worden op de inspanningstolerantie van de patiënt, waarbij het belangrijk is dat de patiënt niet overbelast, maar ook niet onderbelast wordt. Symptomen waarop men alert dient te zijn en de therapie op af dient te stemmen staan beschreven in B.7.2 ‘Diagnostisch handelen rond een longaanval’.
Longaanval met ziekenhuisopname
Doel van de therapeutische behandeling in het ziekenhuis is de patiënt zo spoedig mogelijk ADL-zelfstandig te laten zijn, te werken aan functionaliteit en de randvoorwaarden te scheppen die nodig zijn om naar huis te gaan en daar zelfstandig en veilig te kunnen functioneren (indien nodig en afhankelijk van de status praesens voor opname). Te denken valt aan zelfstandige transfer, lopen (met of zonder) hulpmiddel en traplopen.
De meest voorkomende therapeutische behandeldoelstellingen in het ziekenhuis zijn:
- verminderen van de kortademigheid;
- vroegtijdige mobilisatie;
- verbeteren van de mucusklaring;
- verbeteren van het vertrouwen om activiteiten te kunnen uitvoeren.
Bij het therapeutisch proces tijdens een ziekenhuisopname is het belangrijk dat de therapeut aandacht heeft voor het volgende:
- Kortademigheid en sputumevacuatie. Hiervoor kunnen ademhalingstechnieken en technieken voor mucusklaring ingezet worden (zie C.4.2 ‘Ademhalingstechnieken’ en C.4.5 ‘Mucusklaring’).
- Mobilisatie wordt bij voorkeur zo spoedig mogelijk opgestart, al dan niet met een hulpmiddel en zuurstofsuppletie. Als blijkt dat de patiënt tijdens een longaanval met de gebruikelijke oefentherapie op basis van symptoomlast onvoldoende intensief belast kan worden om doelen op het gebied van fysieke capaciteit te bereiken, worden strategieën toegepast die minder aanspraak doen op de ventilatie en gaswisseling van de patiënt, zoals krachttraining of NMES.
- Na langdurige inactiviteit kan worden gestart met (geleid) actieve beweegvormen/spierkrachtoefeningen, eventueel ondersteund met neuromusculaire elektrostimulatie (NMES; C.3.5 ‘Neuromusculaire elektrostimulatie’).
- De verhouding tussen belasting en belastbaarheid. Deze aspecten worden besproken met de patiënt indien zich op dit vlak problemen voordoen.
- Om training en voedingsintake op elkaar af te stemmen kan worden samengewerkt met de diëtist.
- Na een ziekenhuisopname vanwege een longaanval wordt, zodra de patiënt medisch stabiel is, in multidisciplinair verband overwogen of de patiënt verwezen moet worden voor interdisciplinaire longrevalidatie (screening) of zorg in de eerste lijn.
- Wanneer een patiënt wordt ontslagen, is het belangrijk dat voor de fysio-/oefentherapeutische nazorg een overdracht (naar longrevalidatie of eerstelijns therapie) is opgesteld waarin de (beïnvloedbare) aandachtspunten benoemd worden.
- De therapie dient zich te richten op het behouden van de fysieke capaciteit, maar ook op het optimaliseren van fysieke activiteit. Het is belangrijk om factoren te herkennen die fysieke activiteit belemmeren en deze met de patiënt te bespreken. Daarnaast kan inzicht in belemmerende factoren en het perspectief van de patiënt ingezet worden om sommige belemmerende factoren na een ziekenhuisopname tegen te gaan (Thorpe 2014). De therapeut kan de patiënt stimuleren om weer rustig te starten met bewegen en naar buiten gaan.
Belemmerende factoren voor het oppakken van activiteiten uit het dagelijks leven kunnen zijn: hogere leeftijd, de behoefte aan hersteltijd na de longaanval en de afwezigheid van zuurstoftherapie na ziekenhuisontslag, terwijl de patiënt het gevoel heeft deze ondersteuning wel nodig te hebben (Thorpe 2014). Zie verder C.2 ‘Optimaliseren van fysieke activiteit’.
Longaanval zonder ziekenhuisopname
Bij voorkeur wordt de therapie bij een longaanval niet onderbroken, en indien de therapie wel onderbroken wordt, dient deze zo snel mogelijk te worden hervat zodra de klinische status dit toelaat (Puhan 2016).
De volgende aandachtspunten zijn voor de therapeut in de eerstelijnszorg van belang bij het therapeutisch proces rond een longaanval:
- Mobilisatie wordt bij voorkeur zo spoedig mogelijk gestart. Als blijkt dat de patiënt tijdens een longaanval met de gebruikelijke oefentherapie op basis van symptoomlast onvoldoende intensief belast kan worden om doelen op het gebied van fysieke capaciteit te bereiken, worden strategieën toegepast die minder aanspraak doen op de ventilatie en gaswisseling van de patiënt.
- Kortademigheid en problemen met sputumevacuatie. Hiervoor kunnen ademhalingstechnieken en technieken voor mucusklaring ingezet worden. Zie C.4.2 ‘Ademhalingstechnieken’ en C.4.5 ‘Mucusklaring’.
- Een afname in de fysieke activiteit. Zo nodig kunnen interventies ingezet worden om de fysieke activiteit te optimaliseren. Zie C.2 ‘Optimaliseren van fysieke activiteit’.
- Ongewenste gewichtsafname en andere rode vlaggen. Zie B.4.1 ‘Rode vlaggen’.
Voor het beantwoorden van de uitgangsvraag is in overleg met de werkgroep en de klankbordgroep besloten geen systematisch literatuuronderzoek uit te voeren. De literatuur over dit onderwerp is op niet-systematische wijze vergaard.
- Puhan MA, Gimeno-Santos E, Cates CJ, Troosters T. Pulmonary rehabilitation following exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2016;12:CD005305.
- Thorpe O, Kumar S, Johnston K. Barriers to and enablers of physical activity in patients with COPD following a hospital admission: a qualitative study. Int J Chron Obstruct Pulmon Dis. 2014;9:115-28.
C.7 Evaluatie en afsluiting therapeutisch proces
De evaluatie en afsluiting vinden plaats volgens de vigerende ‘KNGF-richtlijn Dossiervoering’ of de ‘VvOCM-richtlijn Verslaglegging’.
Bij elk therapeut-patiëntcontact worden de relevante behandelgegevens geregistreerd volgens de SOAP-systematiek (subjectief, objectief, analyse en plan).
Evalueer na 12 weken en na afsluiting van de therapie de behandeldoelen, bij voorkeur aan de hand van meetinstrumenten zoals beschreven in B.3.1 ‘Aanbevolen en optionele meetinstrumenten’.
Bij afsluiting van het therapeutisch proces wordt de patiënt geadviseerd over het waar mogelijk zelfstandig in stand houden van behaalde doelstellingen in de onderhoudsfase.
Daarbij kan de therapeut de patiënt onder andere tips geven over het handhaven van fysieke capaciteit en fysieke activiteit in het dagelijks leven.
Evalueer na het afsluiten van de behandelepisode twee tot drie keer per jaar de symptoomlast, fysieke activiteit en fysieke capaciteit.
Overweeg om op basis van de profielindeling opnieuw de behandeling te starten indien er sprake is van een klinisch relevante terugval in:
- symptoomlast (van geen naar mild/matig of van mild/matig naar hoog) en/of
- fysieke activiteit (een afname van 1500 stappen per dag of meer) en/of
- fysieke capaciteit (een afname in de 6 minuten wandelafstand van 45 meter of meer)
Indien er tussentijds sprake is van een longaanval wordt de behandeling direct hervat. De therapie wordt voortijdig gestopt als:
- de hulpvraag van de patiënt is opgelost, doordat therapeutische behandeldoel(en) zijn be- reikt en/of
- er bij tussenevaluaties geen of onvoldoende therapeutisch effect bereikt is zonder duidelijke verklaring en/of
- de patiënt in staat is om de behandeling te continueren via reguliere beweeg- en/of sport- activiteiten en/of
- de patiënt, ongeacht de symptoomlast en ongeacht de mate van fysieke capaciteit of fysieke activiteit, op geen enkele wijze gemotiveerd kan worden om therapietrouw te zijn/blijven en/of
- er sprake is van rode vlaggen of contra-indicaties voor oefentherapie
Licht de verwijzer in over de reden van het vroegtijdig stoppen van de therapie.
Onderbouwing
Uitgangsvragen
- Na hoeveel tijd worden de behandeldoelen geëvalueerd?
- Welke stopcriteria worden gehanteerd voor het beëindigen van de behandelepisode?
Aanleiding
De periode waarin de initiële therapie wordt aangeboden, is afhankelijk van de start- en stopcriteria. Na afsluiting van de initiële therapie is er een periode van nazorg waarin ondersteuning wordt gegeven of minimaal de gezondheidstoestand van de patiënt wordt gemonitord. De startcriteria zijn beschreven in B.5 ‘Patiëntenprofielen’. In deze module wordt beschreven wanneer de behandeldoelen geëvalueerd worden en wanneer de behandeling gestopt kan worden. Zie voor informatie aan de verwijzer A.3.4 ‘Informatie-uitwisseling met de verwijzer’.
1 Na hoeveel tijd worden de behandeldoelen geëvalueerd?
Literatuur en overwegingen
In de vigerende ‘KNGF-richtlijn Dossiervoering’ en ‘VvOCM richtlijn Verslaglegging’ is opgenomen op welke wijze evaluatie en afsluiting plaats dienen te vinden (KNGF 2019; VvOCM 2018). Het is daarnaast gebruikelijk om bij elk therapeut-patiëntcontact de relevante behandelgegevens te registreren volgens de SOAP (subjectief, objectief, analyse en plan) systematiek. Na twaalf weken initiële behandeling wordt aanbevolen een tussenevaluatie te doen.
De Zorgstandaard COPD beschrijft dat het beoordelen van de gezondheidstoestand bij intake plaats dient te vinden en daarna in principe jaarlijks (LAN 2016). Hierbij wordt aangegeven dat de frequentie van monitoring maatwerk vereist. Mogelijk is het dus relevant om de gezondheidstoestand van de patiënt vaker te evalueren. Het wordt daarom aanbevolen om na afsluiting van de therapie, of indien er sprake is van onderhoudsbehandeling, eenmaal per vier tot zes maanden relevante parameters te evalueren (in relatie tot de behandeldoelen), zodat de therapie tijdig hervat of geïntensiveerd kan worden indien de gezondheidstoestand van de patiënt verslechtert. Als er sprake is van een klinisch-relevante terugval in symptoomlast (van geen naar mild/ matig of van mild/matig naar hoog), fysieke activiteit (een afname van 1500 stappen per dag of meer) en/of fysieke capaciteit (een afname in 6-min wandelafstand van 45 meter of meer), wordt overwogen om op basis van de profielindeling opnieuw de behandeling te starten. Ook bij een longaanval (met of zonder ziekenhuisopname) is het zinvol de relevante parameters en behandeldoelen opnieuw vast te stellen.
2 Welke stopcriteria worden gehanteerd voor het beëindigen van de behandelepisode?
In de literatuur worden geen stopcriteria gevonden die van toepassing zijn op de praktijk. De door de werkgroep opgestelde stopcriteria passen bij de context van de patiënt en sluiten aan op de doelen van de therapie.
De volgende stopcriteria zijn geformuleerd:
- De hulpvraag van de patiënt is opgelost doordat therapeutische behandeldoel(en) zijn bereikt (Lakerveld- Heyl 2007). De hulpvraag kan tijdens de therapie veranderen.
- De patiënt is in staat om training te continueren via reguliere beweeg- en/of sportactiviteiten (bijv. wandelen (met de hond), tuinieren, fietsen (e-bike) of yoga) of door aan te sluiten bij regionale of landelijke initiatieven (bijv. in de reguliere sportsector, plaatselijke georganiseerde wandelgroepen, de Nationale COPD Challenge). Verschillende vormen van bewegen zijn goed voor het stabiel houden van de fysieke capaciteit (Longfonds 2019).
- De patiënt kan, ongeacht de symptoomlast en ongeacht de mate van fysieke capaciteit of activiteit, op geen enkele wijze gemotiveerd worden om therapietrouw te zijn of te blijven (met name met betrekking tot fysiek trainen en/of fysiek actief worden buiten de therapie).
- Er is sprake van een rode vlag of contra-indicatie voor oefentherapie (zie B.4.1 ‘Rode Vlaggen’ en B.4.2 ‘Doorverwijzing naar andere zorgverleners’).
Uiteraard kunnen er naast de genoemde redenen nog andere redenen zijn waarom de therapie gestopt moet worden zoals: persoonlijke redenen, redenen vanuit de sociale context van de patiënt en financiële redenen. Indien de therapie vroegtijdig stopt, neemt de therapeut contact op met de behandelend arts.
Voor het beantwoorden van de uitgangsvragen is in overleg met de werkgroep en de klankbordgroep besloten geen systematisch literatuuronderzoek uit te voeren. De literatuur over dit onderwerp is op niet-systematische wijze vergaard.
- KNGF. Richtlijn Fysiotherapeutische dossiervoering 2019. Amersfoort: Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF); 2019.
- Lakerveld-Heyl K, Boomsma LJ, Geijer RMM, Gosselink R, Muris JWM, Vermeeren MAP, et al. Landelijke Eerstelijns Samenwerkings Afspraak COPD. Huisarts Wet 2007;50(8):S21-7.
- LAN. Zorgstandaard COPD. Amersfoort: Long Alliantie Nederland (LAN); 2016.
- Longfonds. COPD en bewegen. Beschikbaar via: https://www.longfonds.nl/. Geraadpleegd op 9 juli 2019. VvOCM. Richtlijn Verslaglegging. Utrecht: Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM); 2018.

