Diagnostisch proces
B.1 Persoonsgerichte zorg
Deze module betreft:
- B.1.1 Persoonsgerichte zorg
- B.1.2. Samen beslissen
Onderbouwing
Aanleiding
De Nederlandse zorg verandert snel. Het ministerie van Volksgezondheid, Welzijn en Sport (VWS) heeft in 2018 het rapport ‘De juiste zorg op de juiste plek’ gepubliceerd om de Nederlandse zorg toekomstbestendiger te maken. In dit rapport wordt het functioneren van mensen als vertrekpunt genomen, waarbij de term ‘functioneren’ betrekking heeft op het lichamelijk, psychisch en sociaal functioneren. Hierbij ligt het eigenaarschap voor het functioneren primair bij de mensen zelf, waarbij de omgeving, alsmede zorgverleners kunnen helpen (Taskforce Zorg op de juiste plek 2018).
Termen als ‘persoonsgerichte zorg’, ‘samen beslissen’ en ‘zorg op maat’ sluiten aan bij deze centrale positie van de patiënt in de gezondheidszorg. Ook ‘zelfmanagement’, ‘eigen regie’ en ‘patiëntempowerment’ worden veelvuldig in deze context gebruikt. De termen kennen een lange historie in beleids- en onderzoeksrapporten (Ouwens 2012).
Ook in de huidige gezondheidszorg speelt samen beslissen een prominente rol. Zo wordt deze term in zowel het ’Bestuurlijk akkoord medisch-specialistische zorg 2019-2022’ als de ‘Bestuurlijke afspraken paramedische zorg 2019-2022’ benoemd (Ministerie van Volksgezondheid Welzijn en Sport 2018; Ministerie van Volksgezondheid Welzijn en Sport 2019). Ook is er in 2021 gestart met een grootscheepse campagne vanuit de overheid en de Patiëntenfederatie Nederland ‘Samen Beslissen’ (Patiëntenfederatie Nederland 2021).
Om de juiste zorg op de juiste plek te kunnen geven aan patiënten met coronairlijden of chronisch hartfalen is het van belang om deze termen te kunnen interpreteren. Ouwens (2012) voerde een literatuuronderzoek uit naar de begripsbepaling van deze termen en de onderlinge samenhang van de concepten, welke in deze module wordt beschreven (Ouwens 2012). Hiertoe is de volgende uitgangsvraag geformuleerd.
Uitgangsvraag
Hoe worden de begrippen ‘persoonsgerichte zorg’, ‘samen beslissen’ en ‘zorg op maat’ in het klinisch redeneren binnen het beweegprogramma in het diagnostisch, therapeutisch en afsluitend proces vormgegeven bij patiënten met coronairlijden of chronisch hartfalen?
Rationale van de aanbevelingen
In overleg met de werkgroep is besloten om geen systematische zoekactie uit te voeren, maar de informatie die nodig is voor het beantwoorden van deze uitgangsvraag op niet-systematische wijze te vergaren en narratief uit te werken met behulp van de kennis en klinische expertise van de werkgroep.
Persoonsgerichte zorg en samen beslissen in de hartrevalidatie
Bij het therapeutisch handelen staat de patiënt met diens specifieke hulpvraag in de eigen leefomgeving centraal. Samen met de patiënt bepaalt de therapeut de behandeldoelen die passen bij de zorgvraag, mogelijkheden en vaardigheden van de patiënt en gezondheidsvaardigheden (Koninklijk Nederlands Genootschap Fysiotherapie 2021; Vereniging van Oefentherapeuten Cesar en Mensendieck 2019). Dit alles geldt ook voor het therapeutisch handelen binnen de hartrevalidatie.
Het aantal patiënten met coronairlijden of chronisch hartfalen dat start met fase II-hartrevalidatie is suboptimaal (Conijn 2022; van Engen-Verheul 2013), evenals het aantal patiënten dat de hartrevalidatie volhoudt en voltooit. Van de aangemelde patiënten voltooit, in specifieke subpopulaties, 80% de hartrevalidatie (Sunamura 2017; Vonk 2021). Een belangrijke oplossing bij het starten, volhouden en voltooien van fase II-hartrevalidatie wordt gezien in het aanbieden van persoonsgerichte zorg (zie C.2 ‘Volhouden en voltooien van de hartrevalidatie’) (Gevaert 2020).
Klinisch redeneren
Het kunnen aanbieden van persoonsgerichte zorg vraagt van de therapeut dat hij middels klinisch redeneren en voortdurend in samenspraak met de patiënt beslist welke behandeling bij de patiënt past en deze behandeling ook evalueert. Dit is zowel van belang tijdens het diagnostisch proces (anamnese, lichamelijk onderzoek en opstellen van behandelplan), het therapeutisch proces als tijdens het afsluitend proces.
Een strategie die hierbij handvatten kan geven, is de i3-strategie.
De i3-strategie
Deze strategie bestaat uit: 1) inventarisatie van de comorbiditeit; 2)inventarisatie van de (contra-)indicaties en restricties; 3) inventarisatie van de mogelijke aanpassingen op de behandeldoelen en 4) de synthese (Dekker 2016).
Deze stappen heeft de werkgroep uitgewerkt voor de behandeling van patiënten met coronairlijden of chronisch hartfalen.
Stap 1. Inventarisatie van nevenpathologie en risicofactoren
Bij deze stap wordt een inventarisatie gemaakt van de nevenpathologie, en de risicofactoren van de patiënt.
Deze betreffen bij deze patiëntengroep met name CVA, perifeer arterieel vaatlijden, hypertensie, kleplijden, ritme- en geleidingsstoornissen, diabetes mellitus, obesitas, cachexie, cognitieve stoornissen, kanker, psychische of slaap gerelateerde ademhalingsstoornissen (McDonagh 2021; Nederlands Huisartsen Genootschap 2021, 2022).
Stap 2. Inventarisatie van de (contra-)indicaties en restricties
Bij deze stap inventariseert de therapeut de belangrijkste (contra-)indicaties en restricties van de patiënt. Zie voor de belangrijkste B.7 ‘Indicatiestelling’.
Stap 3. Inventarisatie van de mogelijke aanpassingen van de behandeldoelen
Bij deze stap maakt de therapeut een inventarisatie van de mogelijke aanpassingen van de behandeldoelen. Zie voor de behandeldoelen B.5 ‘Lichamelijk onderzoek en behandelplan’.
Stap 4. Synthese
Het is van belang om alle informatie uit de voorgaande stappen te integreren met de zorgvraag, voorkeuren of mogelijkheden van de patiënt, en dit alles in samenspraak met de patiënt. Zie voor het vaststellen van de behandeldoelen B.5 ‘Lichamelijk onderzoek en behandelplan‘. De behandeldoelen vormen steeds het uitgangspunt van de synthese. Er zal ook een keuze moeten worden gemaakt over de wijze waarop de gekozen behandeldoelen bereikt worden. Zie voor de aanbevelingen die betrekking hebben op interventies die het volhouden en voltooien van hartrevalidatie bevorderen C.2 ‘Volhouden en voltooien van de hartrevalidatie’.
Er is geen verantwoording bij deze module.
- Conijn D, de Lind van Wijngaarden RAF, Vermeulen HM, Vliet Vlieland TPM, Meesters JJL. Referral to and enrolment in cardiac rehabilitation after open-heart surgery in the Netherlands. Neth Heart J. 2022;30(4):227-36.
- Dekker J, de Rooij M, van der Leeden M. Exercise and comorbidity: the i3-S strategy for developing comorbidity-related adaptations to exercise therapy. Disabil Rehabil. 2016;38(9):905-9.
- Elwyn G, Frosch D, Thomson R, Joseph-Williams N, Lloyd A, Kinnersley P, Cording E, Tomson D, Dodd C, Rollnick S, Edwards A, Barry M. Shared decision making: a model for clinical practice. J Gen Intern Med. 2012;27(10):1361-7.
- Engel GL. The need for a new medical model: a challenge for biomedicine. Science. 1977;196(4286):129-36.
- Federatie Medisch Specialisten. Visiedocument: Samen beslissen. Utrecht: Federatie Medisch Specialisten (FMS); 2019. Beschikbaar via https://demedischspecialist.nl/
- Gevaert AB, Adams V, Bahls M, Bowen TS, Cornelissen V, Dörr M, Hansen D, Kemps HM, Leeson P, Van Craenenbroeck EM, Kränkel N. Towards a personalised approach in exercise-based cardiovascular rehabilitation: How can translational research help? A ‘call to action’ from the section on secondary prevention and cardiac rehabilitation of the European Association of Preventive Cardiology. Eur J Prev Cardiol. 2020;27(13):1369-85.
- Kantar. Samen beslissen. Doelgroepenonderzoek onder zorgverleners en zorggebruikers. Den Haag: Ministerie van Volksgezondheid, Welzijn en Sport (VWS); 2020. Beschikbaar via https://open.overheid.nl/
- Koninklijk Nederlands Genootschap Fysiotherapie. De Fysiotherapeut. Amersfoort: Koninklijk Nederlands Genootschap Fysiotherapie (KNGF). Beschikbaar via https://defysiotherapeut.com/
- Koninklijk Nederlands Genootschap Fysiotherapie, Mutsaers JHAM, Ruitenbeek TH, Schmitt MA, Veenhof C, Driehuis F. KNGF Beroepsprofiel Fysiotherapeut. Over het vakgebied en rollen en competenties van de fysiotherapeut. Amersfoort: Koninklijk Nederlands Genootschap Fysiotherapie (KNGF); 2021. Beschikbaar via https://www.kngf.nl/article/vak-en-kwaliteit/beroepscode/beroepsprofiel-fysiotherapeut
- Koninklijk Nederlands Genootschap voor Fysiotherapie, Mutubuki EN, van Doormaal MCM, Conijn D, Toonders S, Ostelo RWJG. KNGF-richtlijn Zelfmanagement. Amersfoort: Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF), Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM); 2022. Beschikbaar via https://www.kngf.nl/kennisplatform/richtlijnen/zelfmanagement
- McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, Burri H, Butler J, Čelutkienė J, Chioncel O, Cleland JGF, Coats AJS, Crespo-Leiro MG, Farmakis D, Gilard M, Heymans S, Hoes AW, Jaarsma T, Jankowska EA, Lainscak M, Lam CSP, Lyon AR, McMurray JJV, Mebazaa A, Mindham R, Muneretto C, Francesco Piepoli M, Price S, Rosano GMC, Ruschitzka F, Kathrine Skibelund A. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-726.
- Ministerie van Volksgezondheid, Welzijn en Sport. Bestuurlijk akkoord medisch-specialistische zorg 2019 t/m 2022. Den Haag: Ministerie van Volksgezondheid, Welzijn en Sport (VWS); 2018.Beschikbaar via https://www.tweedekamer.nl/kamerstukken/brieven_regering/detail?id=2018Z10368&did=2018D31922
- Ministerie van Volksgezondheid Welzijn en Sport. Bestuurlijke afspraken paramedische zorg 2019-2022. Ministerie van Volksgezondheid, Welzijn en Sport (VWS); 2019. Beschikbaar via https://www.zonmw.nl/nl/onderzoek-resultaten/kwaliteit-van-zorg/programmas/programma-detail/paramedische-zorg-2019-2022/
- Nederlands Huisartsen Genootschap, Auwerda A, Bouma M, Bruins Slot M, Cohen M, Damman P, de Roy van Zuiijderwijn F, Greving J, Rutten F, van Casteren B, Wichers I, Willemsen R, Woudstra P. NHG-standaard acuut coronair syndroom (M80). Utrecht: Nederlands Huisartsen Genootschap (NHG); 2022. Beschikbaar via https://richtlijnen.nhg.org/
- Nederlands Huisartsen Genootschap, de Boer R, Dieleman-Bij de Vaate A, Isfordink L, Lambermon H, Oud M, Rutten F, Schaafstra A, Strijbis A, Valk M, van de Pol A, van den Donk M, Wiersma T. NHG-standaard Hartfalen (M51). Nederlands Huisartsen Genootschap (NHG), Cluster Richtlijnontwikkeling en Wetenschap; 2021. Beschikbaar via https://richtlijnen.nhg.org/
- Nederlandse Federatie van Kanker patiënten organisaties. Samen beslissen. Een handreiking voor patiëntbelangenbehartigers. Nederlandse Federatie van Kanker patiënten organisaties; 2018. Beschikbaar via https://nfk.nl/
- Nederlandse Huisartsen Genootschap. Dossier persoonsgerichte zorg. Utrecht: Nederlandse Huisartsen Genootschap (NHG); 2021. Beschikbaar via https://www.nhg.org/actueel/dossiers/dossier-persoonsgerichte-zorg-0
- Ouwens M, van der Burg S, Faber M, van der Weijden T. Shared decision making & zelfmanagement. Literatuuronderzoek naar begripsbepaling. Nijmegen: Scientific Institute for Quality of Healthcare (IQ healthcare); 2012. Beschikbaar via https://www.raadrvs.nl/documenten/publicaties/2013/06/20/achtergrondstudie-shared-decisionmaking-en-zelfmanagement
- Patiëntenfederatie Nederland. Samen beslissen met behulp van Consultkaarten. Patiëntenfederatie Nederland (PFN). Beschikbaar via https://consultkaart.nl/
- Patiëntenfederatie Nederland. Samen beslissen. Patiëntenfederatie Nederland (PFN); 2021. Beschikbaar via https://begineengoedgesprek.nl/
- Stiggelbout AM, Pieterse AH, De Haes JC. Shared decision making: Concepts, evidence, and practice. Patient Educ Couns. 2015;98(10):1172-9.
- Sunamura M, ter Hoeve N, Geleijnse ML, Steenaard RV, van den Berg-Emons HJG, Boersma H, van Domburg RT. Cardiac rehabilitation in patients who underwent primary percutaneous coronary intervention for acute myocardial infarction: determinants of programme participation and completion. Neth Heart J. 2017;25(11):618-28.
- Taskforce Zorg op de juiste plek. De juiste zorgt op de juiste plek. Wie durft? Den Haag: Ministerie van Volksgezondheid, Welzijn en Sport. Taskforce Zorg op de juiste plek; 2018. Beschikbaar via https://www.dejuistezorgopdejuisteplek.nl/over-ons/
- van Engen-Verheul M, de Vries H, Kemps H, Kraaijenhagen R, de Keizer N, Peek N. Cardiac rehabilitation uptake and its determinants in the Netherlands. Eur J Prev Cardiol. 2013;20(2):349-56.
- Vereniging van Oefentherapeuten Cesar en Mensendieck, Post MHT, Buis G. Beroepsprofiel Oefentherapeut. Utrecht: Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM); Utrecht/Amersfoort: 2019. Beschikbaar via https://vvocm.nl/Kwaliteit/Richtlijnen-en-protocollen.
- Vonk T, Nuijten MAH, Maessen MFH, Meindersma EP, Koornstra-Wortel HJJ, Waskowsky MM, Snoek JA, Eijsvogels TMH, Hopman MTE. Identifying reasons for nonattendance and noncompletion of cardiac rehabilitation: insights from Germany and the Netherlands. J Cardiopulm Rehabil Prev. 2021;41(3):153-8.
B.1.1 Persoonsgerichte zorg
Aanbevelingen
Zet persoonsgerichte zorg in binnen het beweegprogramma van fase II-hartrevalidatie bij patiënten met coronairlijden of chronisch hartfalen om het opstarten, voltooien en volhouden te bevorderen.
Neem hierbij het volgende in overweging:
- Indicatiestelling (inclusief een intakegesprek, de screening, het vaststellen van doelen voor de hartrevalidatie) en de formulering van het fysio- of oefentherapeutisch behandelplan worden vastgesteld en gestart door een multidisciplinair hartrevalidatieteam in een hartrevalidatiecentrum/ziekenhuis in de tweede of derde lijn.
- Bij het opstellen van het behandelplan wordt uitgegaan van:
- de zorgvraag, individuele kenmerken, mogelijkheden, wensen, behoeften, leerstrategie en context van de patiënt;
- de (relatieve) contra-indicaties en de comorbiditeit van de patiënt (zie B.7 ‘Indicatiestelling’);
- de complexiteit van het ziektebeeld;
- de hartrevalidatiedoelen die door het multidisciplinaire revalidatieteam samen met de patiënt zijn gekozen (zie B.5 ‘Lichamelijk onderzoek en behandelplan’).
- Indicatiestelling en formulering van het behandelplan vinden plaats op verwijzing en onder de eindverantwoordelijkheid van de cardioloog*.
- Gedurende het gehele hartrevalidatieprogramma beoordeelt de therapeut met de patiënt of het ingezette beweegprogramma nog voldoende op de patiënt is afgestemd. Overleg met het multidisciplinair hartrevalidatieteam of aanpassing van het hartrevalidatieprogramma noodzakelijk is. Zie hiervoor ook C.7 ‘Evaluatie, stopcriteria en afsluiting van de behandeling’.
Betrek de patiënt met coronairlijden of chronisch hartfalen actief bij de besluitvorming rond hun diagnostiek, behandeling, begeleiding en nazorg om samen de best passende behandeling te kiezen tijdens het beweegprogramma van de fase II-hartrevalidatie en overweeg daarbij het i3s-model te gebruiken.
* De cardioloog is eindverantwoordelijk voor de hartrevalidatie, maar kan er voor kiezen om bepaalde taken over te dragen aan de hartrevalidatiecoördinator.
Onderbouwing
B.1.1 Persoonsgerichte zorg
‘Persoonsgerichte zorg’ wordt verondersteld een synoniem te zijn van ‘patiëntgerichte zorg’ en ‘zorg op maat’, en staat in de internationale wetenschappelijke literatuur bekend als personalized, tailored of patient centered care. Deze termen vinden hun oorsprong in de psychologie of psychotherapie, maar hebben zich uitgebreid naar de (para)medische zorg.
Ouwens (2012) gebruikt patiëntgerichte zorg als overkoepelende term, en beschouwt ‘gezamenlijke besluitvorming’, ‘zelfmanagement’ en ‘patiëntempowerment’ (of ‘zelfmanagementondersteuning’) als onderdelen daarvan. Hij voert soms de zorgverlener als actor op, soms de patiënt en soms allebei. De betekenis van persoonsgerichte zorg is multi-interpretabel en zal waarschijnlijk blijven veranderen in de tijd.
In deze richtlijn ‘Hartrevalidatie bij coronairlijden en chronisch hartfalen’ wordt persoonsgerichte zorg als volgt omschreven: Persoonsgerichte zorg is een manier om zorg op maat aan te bieden aan mensen met een zorgvraag.
De volgende aspecten zijn onderdeel van persoonsgerichte zorg:
- zorg waarbij de hele mens centraal staat en niet diens ziekte of beperking: een van de grondhoudingen van de fysio- en oefentherapeut is om alle aspecten van het biopsychosociaal model hierbij te betrekken (Engel 1977);
- zorg die afgestemd is op individuele kenmerken, mogelijkheden, wensen, behoeften, leerstrategie en context van de patiënt;
- zorg die gebaseerd is op het samen beslissen. Hierbij wordt geëvalueerd welke zorg nodig en bij de persoon passend is, met als uitgangspunt dat de therapeut en de patiënt samen tot een besluit over de diagnostiek, behandeling, begeleiding en nazorg van de patiënt nadenken en tot besluitvorming komen;
- zorg met continuïteit, zodat het mogelijk is om een vertrouwensrelatie op te bouwen.’
(Nederlandse Huisartsen Genootschap 2021)
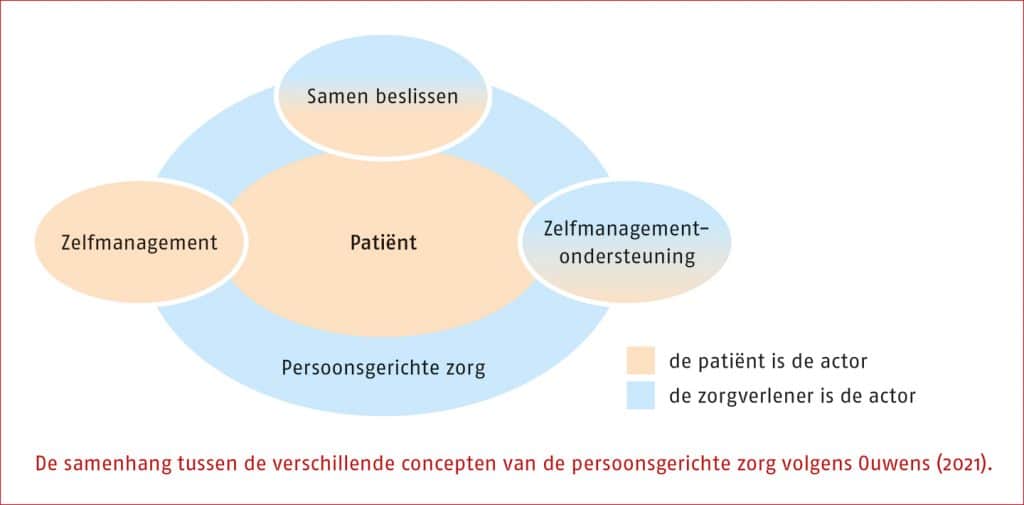
De begrippen ‘zelfmanagement’ en ‘zelfmanagementondersteuning’ zijn beschreven en toegelicht in de ‘KNGF-richtlijn Zelfmanagement’ (Koninklijk Nederlands Genootschap voor Fysiotherapie 2022).
Er is geen verantwoording bij deze module.
- Conijn D, de Lind van Wijngaarden RAF, Vermeulen HM, Vliet Vlieland TPM, Meesters JJL. Referral to and enrolment in cardiac rehabilitation after open-heart surgery in the Netherlands. Neth Heart J. 2022;30(4):227-36.
- Dekker J, de Rooij M, van der Leeden M. Exercise and comorbidity: the i3-S strategy for developing comorbidity-related adaptations to exercise therapy. Disabil Rehabil. 2016;38(9):905-9.
- Elwyn G, Frosch D, Thomson R, Joseph-Williams N, Lloyd A, Kinnersley P, Cording E, Tomson D, Dodd C, Rollnick S, Edwards A, Barry M. Shared decision making: a model for clinical practice. J Gen Intern Med. 2012;27(10):1361-7.
- Engel GL. The need for a new medical model: a challenge for biomedicine. Science. 1977;196(4286):129-36.
- Federatie Medisch Specialisten. Visiedocument: Samen beslissen. Utrecht: Federatie Medisch Specialisten (FMS); 2019. Beschikbaar via https://demedischspecialist.nl/
- Gevaert AB, Adams V, Bahls M, Bowen TS, Cornelissen V, Dörr M, Hansen D, Kemps HM, Leeson P, Van Craenenbroeck EM, Kränkel N. Towards a personalised approach in exercise-based cardiovascular rehabilitation: How can translational research help? A ‘call to action’ from the section on secondary prevention and cardiac rehabilitation of the European Association of Preventive Cardiology. Eur J Prev Cardiol. 2020;27(13):1369-85.
- Kantar. Samen beslissen. Doelgroepenonderzoek onder zorgverleners en zorggebruikers. Den Haag: Ministerie van Volksgezondheid, Welzijn en Sport (VWS); 2020. Beschikbaar via https://open.overheid.nl/
- Koninklijk Nederlands Genootschap Fysiotherapie. De Fysiotherapeut. Amersfoort: Koninklijk Nederlands Genootschap Fysiotherapie (KNGF). Beschikbaar via https://defysiotherapeut.com/
- Koninklijk Nederlands Genootschap Fysiotherapie, Mutsaers JHAM, Ruitenbeek TH, Schmitt MA, Veenhof C, Driehuis F. KNGF Beroepsprofiel Fysiotherapeut. Over het vakgebied en rollen en competenties van de fysiotherapeut. Amersfoort: Koninklijk Nederlands Genootschap Fysiotherapie (KNGF); 2021. Beschikbaar via https://www.kngf.nl/article/vak-en-kwaliteit/beroepscode/beroepsprofiel-fysiotherapeut
- Koninklijk Nederlands Genootschap voor Fysiotherapie, Mutubuki EN, van Doormaal MCM, Conijn D, Toonders S, Ostelo RWJG. KNGF-richtlijn Zelfmanagement. Amersfoort: Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF), Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM); 2022. Beschikbaar via https://www.kngf.nl/kennisplatform/richtlijnen/zelfmanagement
- McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, Burri H, Butler J, Čelutkienė J, Chioncel O, Cleland JGF, Coats AJS, Crespo-Leiro MG, Farmakis D, Gilard M, Heymans S, Hoes AW, Jaarsma T, Jankowska EA, Lainscak M, Lam CSP, Lyon AR, McMurray JJV, Mebazaa A, Mindham R, Muneretto C, Francesco Piepoli M, Price S, Rosano GMC, Ruschitzka F, Kathrine Skibelund A. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-726.
- Ministerie van Volksgezondheid, Welzijn en Sport. Bestuurlijk akkoord medisch-specialistische zorg 2019 t/m 2022. Den Haag: Ministerie van Volksgezondheid, Welzijn en Sport (VWS); 2018.Beschikbaar via https://www.tweedekamer.nl/kamerstukken/brieven_regering/detail?id=2018Z10368&did=2018D31922
- Ministerie van Volksgezondheid Welzijn en Sport. Bestuurlijke afspraken paramedische zorg 2019-2022. Ministerie van Volksgezondheid, Welzijn en Sport (VWS); 2019. Beschikbaar via https://www.zonmw.nl/nl/onderzoek-resultaten/kwaliteit-van-zorg/programmas/programma-detail/paramedische-zorg-2019-2022/
- Nederlands Huisartsen Genootschap, Auwerda A, Bouma M, Bruins Slot M, Cohen M, Damman P, de Roy van Zuiijderwijn F, Greving J, Rutten F, van Casteren B, Wichers I, Willemsen R, Woudstra P. NHG-standaard acuut coronair syndroom (M80). Utrecht: Nederlands Huisartsen Genootschap (NHG); 2022. Beschikbaar via https://richtlijnen.nhg.org/
- Nederlands Huisartsen Genootschap, de Boer R, Dieleman-Bij de Vaate A, Isfordink L, Lambermon H, Oud M, Rutten F, Schaafstra A, Strijbis A, Valk M, van de Pol A, van den Donk M, Wiersma T. NHG-standaard Hartfalen (M51). Nederlands Huisartsen Genootschap (NHG), Cluster Richtlijnontwikkeling en Wetenschap; 2021. Beschikbaar via https://richtlijnen.nhg.org/
- Nederlandse Federatie van Kanker patiënten organisaties. Samen beslissen. Een handreiking voor patiëntbelangenbehartigers. Nederlandse Federatie van Kanker patiënten organisaties; 2018. Beschikbaar via https://nfk.nl/
- Nederlandse Huisartsen Genootschap. Dossier persoonsgerichte zorg. Utrecht: Nederlandse Huisartsen Genootschap (NHG); 2021. Beschikbaar via https://www.nhg.org/actueel/dossiers/dossier-persoonsgerichte-zorg-0
- Ouwens M, van der Burg S, Faber M, van der Weijden T. Shared decision making & zelfmanagement. Literatuuronderzoek naar begripsbepaling. Nijmegen: Scientific Institute for Quality of Healthcare (IQ healthcare); 2012. Beschikbaar via https://www.raadrvs.nl/documenten/publicaties/2013/06/20/achtergrondstudie-shared-decisionmaking-en-zelfmanagement
- Patiëntenfederatie Nederland. Samen beslissen met behulp van Consultkaarten. Patiëntenfederatie Nederland (PFN). Beschikbaar via https://consultkaart.nl/
- Patiëntenfederatie Nederland. Samen beslissen. Patiëntenfederatie Nederland (PFN); 2021. Beschikbaar via https://begineengoedgesprek.nl/
- Stiggelbout AM, Pieterse AH, De Haes JC. Shared decision making: Concepts, evidence, and practice. Patient Educ Couns. 2015;98(10):1172-9.
- Sunamura M, ter Hoeve N, Geleijnse ML, Steenaard RV, van den Berg-Emons HJG, Boersma H, van Domburg RT. Cardiac rehabilitation in patients who underwent primary percutaneous coronary intervention for acute myocardial infarction: determinants of programme participation and completion. Neth Heart J. 2017;25(11):618-28.
- Taskforce Zorg op de juiste plek. De juiste zorgt op de juiste plek. Wie durft? Den Haag: Ministerie van Volksgezondheid, Welzijn en Sport. Taskforce Zorg op de juiste plek; 2018. Beschikbaar via https://www.dejuistezorgopdejuisteplek.nl/over-ons/
- van Engen-Verheul M, de Vries H, Kemps H, Kraaijenhagen R, de Keizer N, Peek N. Cardiac rehabilitation uptake and its determinants in the Netherlands. Eur J Prev Cardiol. 2013;20(2):349-56.
- Vereniging van Oefentherapeuten Cesar en Mensendieck, Post MHT, Buis G. Beroepsprofiel Oefentherapeut. Utrecht: Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM); Utrecht/Amersfoort: 2019. Beschikbaar via https://vvocm.nl/Kwaliteit/Richtlijnen-en-protocollen.
- Vonk T, Nuijten MAH, Maessen MFH, Meindersma EP, Koornstra-Wortel HJJ, Waskowsky MM, Snoek JA, Eijsvogels TMH, Hopman MTE. Identifying reasons for nonattendance and noncompletion of cardiac rehabilitation: insights from Germany and the Netherlands. J Cardiopulm Rehabil Prev. 2021;41(3):153-8.
B.1.2 Samen beslissen
Aanbevelingen
Overweeg het model ‘Samen Beslissen’ en het model ‘3 goede vragen’ in te zetten.
Het eerste model is geschreven vanuit zorgverlenersperspectief en het tweede vanuit patiëntenperspectief.
Het model ‘Samen beslissen’
In dit model betrekt de therapeut de patiënt actief bij de besluitvorming rond diagnostiek, behandeling, begeleiding en nazorg en kiest samen met de patiënt de best passende behandeling. Daarbij doorloopt de therapeut de volgende stappen:
Stap 1: Keuze
Aangeven dat de patiënt meer dan één optie heeft en dat hij daar een stem in heeft.
Stap 2: Opties
Bespreken van de verschillende opties met de patiënt, met aandacht voor:
- voor- en nadelen en risico’s van de opties;
- verwachte uitkomsten van de opties;
- de mogelijke invloed van de opties op de persoonlijke situatie van de patiënt.
Stap 3: Voorkeur
Bespreken van de voorkeuren, behoeften en omstandigheden van de patiënt, waarbij de therapeut de patiënt ondersteunt in het proces. Samen wordt er gekeken welke behandeling het beste past.
Stap 4: Besluit
Het bespreken van het maken van een besluit. Het samen komen tot een beslissing over het te volgen beleid.
Succesvolle toepassing van ‘Samen beslissen’ vraagt van de therapeut de volgende competenties:
- bewustwording bij de therapeut;
- tijd voor het nemen van de beslissing.
De therapeut:
- onderkent dat ‘samen beslissen’ leidt tot hogere kwaliteit van zorg;
- begeleidt het proces van ‘samen beslissen’;
- beschikt over gesprekstechnieken en vaardigheden om het proces van ‘samen beslissen’ te faciliteren;
- houdt rekening met de context van de patiënt;
- ondersteunt de patiënt en moedigt de patiënt actief aan om te participeren in het proces van ‘samen beslissen’ (‘empowerment’);
- draagt zorg voor begrijpelijke kennisoverdracht en informatie-uitwisseling, en maakt gebruik van tools die ‘samen beslissen’ ondersteunen;
- is een betrouwbare en professionele gesprekspartner;
- onderkent het belang van samenwerking en communicatie met andere zorgprofessionals en (sociale) factoren uit het netwerk van de patiënt en weet wanneer deze te betrekken.
Model ‘3 goede vragen’
Hierbij ondersteunt de therapeut de patiënt bij het overwegen van de volgende vragen:
Vraag 1 Wat zijn mijn mogelijkheden?
Vraag 2 Wat zijn de voordelen en nadelen van die mogelijkheden?
Vraag 3 Wat betekent dat in mijn situatie?
Ter ondersteuning kan de therapeut het volgende aanreiken aan de patiënt:
- “Geef aan als u iets niet helemaal begrijpt.”
- “Geef aan als u ergens over twijfelt.”
- “Neem uw vragen de volgende keer mee op papier en schrijf de antwoorden gerust op. U kunt dan thuis de antwoorden nog even rustig nalezen.”
- “Nu we ons gesprek afsluiten, wilt u ons gesprek eens in uw eigen woorden samenvatten? Zo kunnen we samen nagaan of u alles begrepen heeft.”
* De cardioloog is eindverantwoordelijk voor de hartrevalidatie, maar kan er voor kiezen om bepaalde taken over te dragen aan de hartrevalidatiecoördinator.
Onderbouwing
‘Samen beslissen’ (Stiggelbout 2015) gaat uit van de gedachte dat patiënten en therapeuten verschillende, maar even belangrijke expertise in te brengen hebben bij het nemen van medische beslissingen. Samen beslissen gebeurt in één of meer gesprekken. Daarin bespreken patiënt en therapeut alle mogelijkheden en wat deze betekenen voor iemands leven. Samen beslissen betekent voor de therapeut dat hij beter kan inspelen op de behoeften en voorkeuren van de patiënt. Voor de patiënt betekent samen beslissen dat hij kan kiezen voor wat het beste aansluit bij de eigen situatie en persoonlijke voorkeuren. Het model ‘Samen beslissen’ is opgenomen in de richtlijnen van de Federatie Medisch Specialisten (2019) en Patiëntenfederatie Nederland (2021).
‘Shared decision making’ en ‘gedeelde of gezamenlijke besluitvorming’ zijn allemaal termen die staan voor het samen beslissen. Doordat bij samen beslissen zowel patiënt als therapeut actor zijn, ontstaat tweerichtingsverkeer. Dit is tegengesteld aan paternalistische of geïnformeerde besluitvorming, waarbij de patiënt alleen wordt geïnformeerd. Ook de betekenis van samen beslissen is multi-interpretabel en zal gedurende de tijd veranderen (Ouwens 2012).
In deze richtlijn ‘Hartrevalidatie bij coronairlijden en chronisch hartfalen’ wordt samen beslissen als volgt omschreven:
Bij het samen beslissen worden patiënten actief betrokken bij de besluitvorming rond hun diagnostiek, behandeling, begeleiding en nazorg om samen de best passende behandeling te kiezen. Hiervoor is het belangrijk dat de patiënten goed geïnformeerd worden door de therapeut.
Samen beslissen gaat uit van de gedachte dat patiënten en therapeuten verschillende, maar even belangrijke expertise in te brengen hebben bij het maken van medische beslissingen. Samen beslissen gebeurt in één of meer gesprekken. Daarin bespreken patiënten en therapeuten samen alle mogelijkheden en wat deze betekenen voor iemands leven. Samen beslissen betekent voor therapeuten dat ze beter kunnen inspelen op de behoeften en voorkeuren van de patiënt. Voor de patiënt betekent samen beslissen dat er een keuze wordt gemaakt die het beste aansluit bij de eigen situatie en diens persoonlijke voorkeuren (Federatie Medisch Specialisten 2019; Patiëntenfederatie Nederland 2021).
Samen beslissen kan er voor zorgen dat patiënten beter geïnformeerd zijn, tevredener zijn over het besluit, dat hun therapietrouw groter is, dat ze minder keuzestress ervaren en dat zij andere keuzes maken. Voor de zorgverleners geeft het samen beslissen meer arbeidsvreugde (Nederlandse Federatie van Kankerpatiëntenorganisaties 2018). Zorgverleners hebben de indruk dat zij al veel (46%) met de patiënt samen beslissen. Toch geeft slechts 37% van de patiënten in een onderzoek van Kantar (2020) aan dat ze samen met hun zorgverlener beslissingen nemen. Ook geeft 11 tot 15% van de patiënten aan dat ze het moeilijk vinden om actief mee te doen met het gesprek met de therapeut en geeft 30% aan dat zij de gesprekken met de therapeut niet voorbereiden. Er is dus een mismatch tussen de ervaren mate van samen beslissen tussen patiënten en zorgverleners (Kantar 2020).
Er zijn diverse modellen die het uitvoeren van samen beslissen ondersteunen. In de Nederlandse gezondheidszorg worden vooral de modellen van Elwyn (2012) en Stiggelbout (2015) en de ‘3 goede vragen’ gebruikt (Patiëntenfederatie Nederland 2021). Het model van Stiggelbout (2015) is geschreven vanuit zorgverlenersperspectief en is gebaseerd op dat van Elwyn (2015). Het model van de ‘3 goede vragen’ is geschreven vanuit patiëntenperspectief.
Er zijn diverse andere hulpmiddelen die het uitvoeren van samen beslissen kunnen ondersteunen. Zo zijn er keuzeondersteunende hulpmiddelen (keuzehulp) en is er patiënteninformatie beschikbaar. Ook kunnen de patiënt en therapeut de gemaakte afspraken (over terugkoppeling en controle) vastleggen, bij voorkeur in een individueel zorgplan. Het is echter van belang dat deze hulpmiddelen als ondersteuning worden ingezet en niet het goede gesprek tussen patiënt en therapeut vervangen (Koninklijk Nederlands Genootschap Fysiotherapie ; Patiëntenfederatie Nederland).
Er is geen verantwoording bij deze module.
- Conijn D, de Lind van Wijngaarden RAF, Vermeulen HM, Vliet Vlieland TPM, Meesters JJL. Referral to and enrolment in cardiac rehabilitation after open-heart surgery in the Netherlands. Neth Heart J. 2022;30(4):227-36.
- Dekker J, de Rooij M, van der Leeden M. Exercise and comorbidity: the i3-S strategy for developing comorbidity-related adaptations to exercise therapy. Disabil Rehabil. 2016;38(9):905-9.
- Elwyn G, Frosch D, Thomson R, Joseph-Williams N, Lloyd A, Kinnersley P, Cording E, Tomson D, Dodd C, Rollnick S, Edwards A, Barry M. Shared decision making: a model for clinical practice. J Gen Intern Med. 2012;27(10):1361-7.
- Engel GL. The need for a new medical model: a challenge for biomedicine. Science. 1977;196(4286):129-36.
- Federatie Medisch Specialisten. Visiedocument: Samen beslissen. Utrecht: Federatie Medisch Specialisten (FMS); 2019. Beschikbaar via https://demedischspecialist.nl/
- Gevaert AB, Adams V, Bahls M, Bowen TS, Cornelissen V, Dörr M, Hansen D, Kemps HM, Leeson P, Van Craenenbroeck EM, Kränkel N. Towards a personalised approach in exercise-based cardiovascular rehabilitation: How can translational research help? A ‘call to action’ from the section on secondary prevention and cardiac rehabilitation of the European Association of Preventive Cardiology. Eur J Prev Cardiol. 2020;27(13):1369-85.
- Kantar. Samen beslissen. Doelgroepenonderzoek onder zorgverleners en zorggebruikers. Den Haag: Ministerie van Volksgezondheid, Welzijn en Sport (VWS); 2020. Beschikbaar via https://open.overheid.nl/
- Koninklijk Nederlands Genootschap Fysiotherapie. De Fysiotherapeut. Amersfoort: Koninklijk Nederlands Genootschap Fysiotherapie (KNGF). Beschikbaar via https://defysiotherapeut.com/
- Koninklijk Nederlands Genootschap Fysiotherapie, Mutsaers JHAM, Ruitenbeek TH, Schmitt MA, Veenhof C, Driehuis F. KNGF Beroepsprofiel Fysiotherapeut. Over het vakgebied en rollen en competenties van de fysiotherapeut. Amersfoort: Koninklijk Nederlands Genootschap Fysiotherapie (KNGF); 2021. Beschikbaar via https://www.kngf.nl/article/vak-en-kwaliteit/beroepscode/beroepsprofiel-fysiotherapeut
- Koninklijk Nederlands Genootschap voor Fysiotherapie, Mutubuki EN, van Doormaal MCM, Conijn D, Toonders S, Ostelo RWJG. KNGF-richtlijn Zelfmanagement. Amersfoort: Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF), Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM); 2022. Beschikbaar via https://www.kngf.nl/kennisplatform/richtlijnen/zelfmanagement
- McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, Burri H, Butler J, Čelutkienė J, Chioncel O, Cleland JGF, Coats AJS, Crespo-Leiro MG, Farmakis D, Gilard M, Heymans S, Hoes AW, Jaarsma T, Jankowska EA, Lainscak M, Lam CSP, Lyon AR, McMurray JJV, Mebazaa A, Mindham R, Muneretto C, Francesco Piepoli M, Price S, Rosano GMC, Ruschitzka F, Kathrine Skibelund A. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-726.
- Ministerie van Volksgezondheid, Welzijn en Sport. Bestuurlijk akkoord medisch-specialistische zorg 2019 t/m 2022. Den Haag: Ministerie van Volksgezondheid, Welzijn en Sport (VWS); 2018.Beschikbaar via https://www.tweedekamer.nl/kamerstukken/brieven_regering/detail?id=2018Z10368&did=2018D31922
- Ministerie van Volksgezondheid Welzijn en Sport. Bestuurlijke afspraken paramedische zorg 2019-2022. Ministerie van Volksgezondheid, Welzijn en Sport (VWS); 2019. Beschikbaar via https://www.zonmw.nl/nl/onderzoek-resultaten/kwaliteit-van-zorg/programmas/programma-detail/paramedische-zorg-2019-2022/
- Nederlands Huisartsen Genootschap, Auwerda A, Bouma M, Bruins Slot M, Cohen M, Damman P, de Roy van Zuiijderwijn F, Greving J, Rutten F, van Casteren B, Wichers I, Willemsen R, Woudstra P. NHG-standaard acuut coronair syndroom (M80). Utrecht: Nederlands Huisartsen Genootschap (NHG); 2022. Beschikbaar via https://richtlijnen.nhg.org/
- Nederlands Huisartsen Genootschap, de Boer R, Dieleman-Bij de Vaate A, Isfordink L, Lambermon H, Oud M, Rutten F, Schaafstra A, Strijbis A, Valk M, van de Pol A, van den Donk M, Wiersma T. NHG-standaard Hartfalen (M51). Nederlands Huisartsen Genootschap (NHG), Cluster Richtlijnontwikkeling en Wetenschap; 2021. Beschikbaar via https://richtlijnen.nhg.org/
- Nederlandse Federatie van Kanker patiënten organisaties. Samen beslissen. Een handreiking voor patiëntbelangenbehartigers. Nederlandse Federatie van Kanker patiënten organisaties; 2018. Beschikbaar via https://nfk.nl/
- Nederlandse Huisartsen Genootschap. Dossier persoonsgerichte zorg. Utrecht: Nederlandse Huisartsen Genootschap (NHG); 2021. Beschikbaar via https://www.nhg.org/actueel/dossiers/dossier-persoonsgerichte-zorg-0
- Ouwens M, van der Burg S, Faber M, van der Weijden T. Shared decision making & zelfmanagement. Literatuuronderzoek naar begripsbepaling. Nijmegen: Scientific Institute for Quality of Healthcare (IQ healthcare); 2012. Beschikbaar via https://www.raadrvs.nl/documenten/publicaties/2013/06/20/achtergrondstudie-shared-decisionmaking-en-zelfmanagement
- Patiëntenfederatie Nederland. Samen beslissen met behulp van Consultkaarten. Patiëntenfederatie Nederland (PFN). Beschikbaar via https://consultkaart.nl/
- Patiëntenfederatie Nederland. Samen beslissen. Patiëntenfederatie Nederland (PFN); 2021. Beschikbaar via https://begineengoedgesprek.nl/
- Stiggelbout AM, Pieterse AH, De Haes JC. Shared decision making: Concepts, evidence, and practice. Patient Educ Couns. 2015;98(10):1172-9.
- Sunamura M, ter Hoeve N, Geleijnse ML, Steenaard RV, van den Berg-Emons HJG, Boersma H, van Domburg RT. Cardiac rehabilitation in patients who underwent primary percutaneous coronary intervention for acute myocardial infarction: determinants of programme participation and completion. Neth Heart J. 2017;25(11):618-28.
- Taskforce Zorg op de juiste plek. De juiste zorgt op de juiste plek. Wie durft? Den Haag: Ministerie van Volksgezondheid, Welzijn en Sport. Taskforce Zorg op de juiste plek; 2018. Beschikbaar via https://www.dejuistezorgopdejuisteplek.nl/over-ons/
- van Engen-Verheul M, de Vries H, Kemps H, Kraaijenhagen R, de Keizer N, Peek N. Cardiac rehabilitation uptake and its determinants in the Netherlands. Eur J Prev Cardiol. 2013;20(2):349-56.
- Vereniging van Oefentherapeuten Cesar en Mensendieck, Post MHT, Buis G. Beroepsprofiel Oefentherapeut. Utrecht: Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM); Utrecht/Amersfoort: 2019. Beschikbaar via https://vvocm.nl/Kwaliteit/Richtlijnen-en-protocollen.
- Vonk T, Nuijten MAH, Maessen MFH, Meindersma EP, Koornstra-Wortel HJJ, Waskowsky MM, Snoek JA, Eijsvogels TMH, Hopman MTE. Identifying reasons for nonattendance and noncompletion of cardiac rehabilitation: insights from Germany and the Netherlands. J Cardiopulm Rehabil Prev. 2021;41(3):153-8.
B.2 Belemmerende en bevorderende factoren
Aanbevelingen
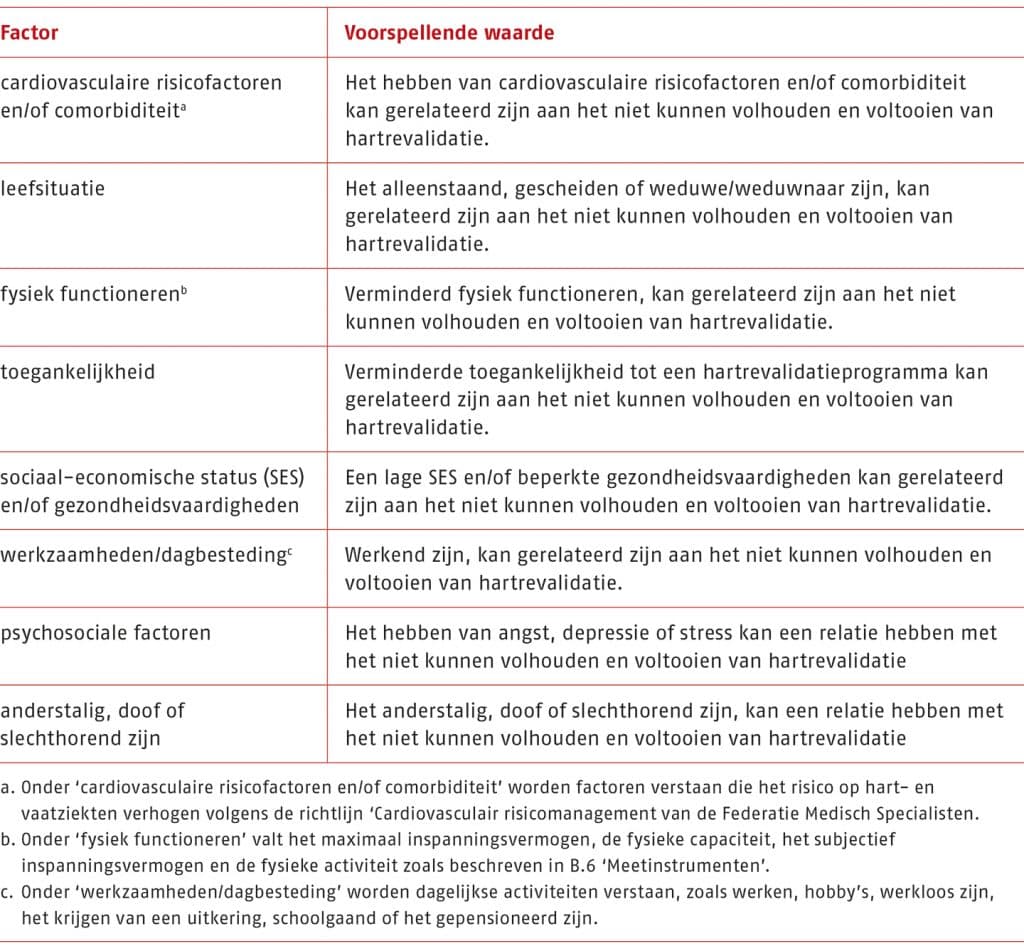
Het is van belang om te beschikken over kennis van de factoren die mogelijk het volhouden en voltooien van fase II-hartrevalidatie bij patiënten met coronairlijden of chronisch hartfalen belemmeren.
De wijze waarop genoemde factoren in kaart worden gebracht, is beschreven in B.4 ‘Anamnese’, B.5 ‘Lichamelijk onderzoek en behandelplan’ en in B.6 ‘Meetinstrumenten’.
De wijze waarop het beweegprogramma van fase II-hartrevalidatie op de beschreven factoren wordt afgestemd staat in C.2 ‘Volhouden en voltooien van de hartrevalidatie’.
Onderbouwing
Aanleiding
Het aantal patiënten met coronairlijden of chronisch hartfalen dat fase II-hartrevalidatie start, volhoudt en voltooit, is in Nederland suboptimaal (Sunamura 2017; Vonk 2021; Conijn 2022; Van Engen-Verheul 2013). De praktijkvariatie in de uitvoer van de hartrevalidatie kan daar een van de oorzaken van zijn. Aansluiten bij de behoeftes van de patiënt kan de therapietrouw en het percentage patiënten dat fase II-hartrevalidatie voltooit, verhogen. Daarvoor is het cruciaal om factoren te identificeren die therapietrouw (volhouden) en het voltooien van fase II-hartrevalidatie bevorderen of belemmeren.
Uitgangsvraag
Welke belemmerende en bevorderende factoren beïnvloeden therapietrouw (volhouden) en het voltooien van fase II-hartrevalidatie en zijn ten minste in kaart gebracht bij patiënten met coronairlijden of chronisch hartfalen?
Conclusies op basis van de literatuur
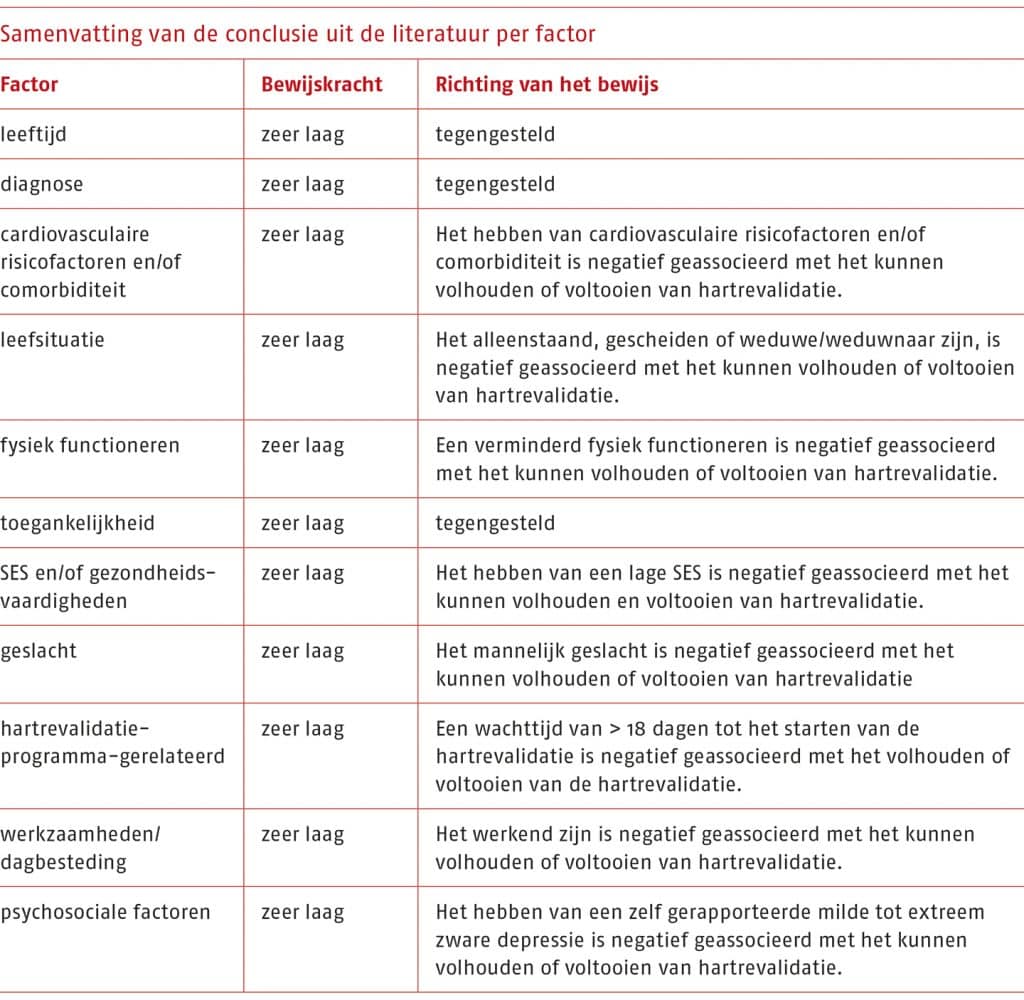
Op basis van de zoekactie zijn zeven cohortstudies geïdentificeerd die belemmerende en bevorderende factoren voor het volhouden en voltooien van fase II-hartrevalidatie beschrijven. In deze prognostische studies zijn meerdere belemmerende en bevorderende factoren geïdentificeerd. Als gevolg van de gevonden heterogeniteit van de prognostische factoren en cruciale uitkomsten, was een meta-analyse niet gerechtvaardigd en is er een narratieve synthese uitgevoerd.
Hiertoe zijn de prognostische factoren gecategoriseerd, wat resulteerde in de volgende relevante factoren: leeftijd, diagnose, cardiovasculair risicofactoren en/of comorbiditeit, leefsituatie, fysiek functioneren, toegankelijkheid, SES en/of gezondheidsvaardigheden, geslacht, aan het hartrevalidatieprogramma-gerelateerde factoren, werkzaamheden/dagbesteding en tot slot psychosociale factoren. In de volgende tabel is de bewijskracht van deze factoren samengevat.
Rationale van de aanbevelingen
De werkgroep heeft ervoor gekozen geen algemene aanbeveling te formuleren ten aanzien van de prognostische factoren. Zo’n aanbeveling zou een actie vragen van de therapeut en gezien de beperkte wetenschappelijke onderbouwing van deze factoren vindt de werkgroep dit niet op z’n plaats.
Er is daarom gekozen voor het formuleren van aanbevelingen voor de anamnese, het lichamelijk onderzoek en het behandelplan, de meetinstrumenten en de interventies ter bevordering van het volhouden en voltooien van de hartrevalidatie.
De werkgroep heeft echter wel per factor een weging gemaakt van de relatie tussen die geïdentificeerde factoren en het volhouden of voltooien van de hartrevalidatie. De factor ‘anderstalig, doof of slechthorend zijn’ is in het evidence to decision toegevoegd en niet in de literatuur gevonden.
Literatuur
Om de uitgangsvraag te beantwoorden, is een systematisch literatuuronderzoek verricht naar de volgende onderzoeksvraag:
- Welke belemmerende en bevorderende factoren spelen een belangrijke rol bij het beïnvloeden van therapietrouw (volhouden) en het voltooien van fase II-hartrevalidatie bij patiënten met coronairlijden of chronisch hartfalen?
Relevante uitkomstmaten
De werkgroep beschouwt het volhouden en voltooien van fase II-hartrevalidatie voor de besluitvorming als cruciale uitkomstmaten.
Per uitkomstmaat:
- Volhouden van fase II-hartrevalidatie: De werkgroep definieert therapietrouw (volhouden) als het volgen van ≥ 75% van het beweegprogramma van fase II-hartrevalidatie.
- Volhouden en voltooien van fase II-hartrevalidatie: De werkgroep definieert een odds ratio (OR) ≠ 1 (de waarde 1 zit niet in het betrouwbaarheidsinterval) als een belangrijk effect (klinisch-relevant verschil).
Systematisch literatuuronderzoek
Op 22 juni 2022 en 24 juni 2022 is door een informatiespecialist mevrouw H.W.J. Deurenberg een systematische zoekactie uitgevoerd in MEDLINE, Embase, CINAHL. Een screening op titel en abstract en bij potentiële inclusie op basis van volledige artikelen is geblindeerd uitgevoerd door twee onderzoekers (DC en RA). Een aanvullende search is vervolgens uitgevoerd om literatuur toe te voegen, waarbij het studiedesign onbekend is (zie bijlage B.2-1 (opent in nieuw tabblad) voor de zoekverantwoording). De systematische zoekactie leverde 1012 unieke treffers op. Na screening van de titel en het abstract op de inclusiecriteria zijn 963 artikelen geëxcludeerd. De inclusiecriteria staan in de volgende tabel.

Om een uitspraak te kunnen doen over welke factoren van invloed zijn op de gehele populatie is het van belang dat de factoren gecorrigeerd worden voor elkaar. Hierbij is de pragmatische keuze gemaakt om cohorten met ≥ 500 patiënten te includeren en eveneens alleen studies waarin multivariate analyses zijn uitgevoerd. Ook studies waarin enkel subpopulaties (bijv. vrouwen) beschreven zijn, zijn op basis van de generaliseerbaarheid geëxcludeerd. Er zijn 49 full-tekstartikelen gescreend en na bereiken van consensus tussen DC en RA zijn uiteindelijk zeven studies geïncludeerd (Brouwers 2021; Gaalema 2017; González-Salvado 2021; Nakayama 2020; Rao 2021; Sunamura 2017; Wittmer 2012). Zie bijlage B.2-2 (opent in nieuw tabblad) voor het stroomdiagram van het inclusieproces.
De artikelen die op basis van de volledige tekst zijn geëxcludeerd en de reden van exclusie zijn weergegeven in bijlage B.2-3 (opent in nieuw tabblad) (Armstrong 2015; Bostrom 2020; Colbert 2015; De Jong 2012; De Melo Ghisi 2013; Farah 2019; Frechette 2019; Gaalema 2015; Gardiner 2018; Gobeil 2021; Goldstein 2022; Grace 2015; Grace 2021; Heald 2022; Hwang 2022; Keteyian 2022; Laddu 2018; Lee 2013; Lemstra 2013; Martin 2012, 2013; Marzolini 2015; McDonall 2013; Mikkelsen 2014; Minges 2017; Nakanishi 2022; Olsen 2018; Parashar 2012; Pardaens 2017; Park 2017; Poh 2015; Redfern 2014; Ritchey 2020; Rubin 2019; Sanchez-Delgado 2016; Tang 2022; Turk-Adawi 2013; Vonk 2021; Wallert 2019; Weeger 2017; Wu 2022; Zullo 2017).
Karakteristieken van de geïncludeerde studies
De kenmerken van de geïncludeerde studies zijn weergegeven in bijlage B.2-4 en B.2-5. (opent in nieuw tabblad) In totaal zijn in de zeven studies 23.596 patiënten (gem. leeftijd 57-71 jaar, 15-50% vrouw) geïncludeerd met de diagnose coronairlijden of chronisch hartfalen. De populatie bestond uit de volgende subdiagnoses: patiënten met een acuut coronair syndroom (ACS), een ziekte van de aorta, een bypass- of omleidingsoperatie (CABG), chronisch hartfalen, coronaire re-vascularisatie, chirurgische of percutane behandeling, gedocumenteerde kransslagaderziekte zonder re-vascularisatie, klepvervanging of -reparatie, een myocardinfarct zonder ST-elevatie (NSTEMI), risicofactorenmodificatie, een acuut myocardinfarct (AMI), stabiele angina pectoris (SAP) of een myocardinfarct met ST-elevatie (STEMI).
Individuele studiekwaliteit (RoB)
Het risico op vertekening van de individuele studies (RoB) is door DC en RA gescoord met behulp van de QUIPS-tool (Hayden 2006, 2013). Het oordeel op de verschillende items is onderling besproken door DC en RA waarna consensus is bereikt. Een overzicht van de beoordeling van de studiekwaliteit per studie is weergegeven in bijlage B.2-6. (opent in nieuw tabblad)
Effectiviteit en bewijskracht van de prognostische factoren
Een overzichtstabel van de effectiviteit en bewijskracht van studies per factor is weergegeven in bijlage B.2-7. (opent in nieuw tabblad)
Op grond van de gevonden heterogeniteit van de prognostische factoren en cruciale uitkomsten was een meta-analyse niet gerechtvaardigd en is een narratieve synthese uitgevoerd. Hiertoe zijn de prognostische factoren als volgt gecategoriseerd.
Leeftijd
Deze factor is als continue, dichotome en categoriale maat geïncludeerd.
In vijf studies blijkt uit de multivariate analyse dat leeftijd klinisch-significant geassocieerd is met het volhouden en voltooien van hartrevalidatie (Brouwers 2021; Gaalema 2017; González-Salvado 2021; Nakayama 2020; Rao 2021).
De richting van de associaties tussen de studies verschilt, evenals de gevonden effect size:
- In de multicenter studie van González-Salvado (2021) is bij multivariate analyse leeftijd slechts op één locatie (Bern) significant geassocieerd met het volhouden of voltooien van de hartrevalidatie, terwijl dit niet het geval is op andere locaties (Kopenhagen, Zwolle en Santiago).
- In twee studies komt leeftijd als niet-significant geassocieerd uit de univariate analyse, op grond waarvan deze factor niet is opgenomen in het multivariate model (Sunamura 2017; Wittmer 2012).
- In twee studies is een hogere leeftijd klinisch relevant geassocieerd met het niet volhouden of voltooien van de hartrevalidatie (OR 0,9-1,05) (Brouwers 2021; González-Salvado 2021).
- In drie studies is een hogere leeftijd klinisch relevant geassocieerd met het volhouden of voltooien van de hartrevalidatie (OR 0,57-1,58) (Gaalema 2017; Nakayama 2020; Rao 2021).
De bewijskracht is met drie niveaus verlaagd van hoog naar zeer laag gezien: 1) de inconsistentie in zowel de factor als de uitkomstmaat, 2) de heterogeniteit van de beschreven populaties en interventies en 3) de tegengestelde effecten van de factoren op de uitkomstmaten.
Diagnose
Onder deze factor vallen bijvoorbeeld: CABG, percutane coronaire interventie (PCI), STEMI, NSTEMI of diagnosegroepen (al dan niet chirurgisch). De factor is dichotoom en categoriaal geïncludeerd.
In drie studies blijkt uit de multivariate analyse dat de diagnose significant geassocieerd is met het volhouden en voltooien van hartrevalidatie (Gaalema 2017; González-Salvado 2021; Nakayama 2020).
De richting van de associaties tussen de studies verschilt, evenals de gevonden effect size:
- In de multicenter studie van González-Salvado (2021) varieert het hebben van ACS als significante factor in de multivariate analyses per locatie. ACS is in twee locaties (Zwolle en Santiago) wel opgenomen in het model, maar niet significant gebleken, maar in het model van locatie Bern wel.
- In drie studies is de factor opgenomen in het multivariate model, maar is deze niet-significant geassocieerd met het volhouden en voltooien van hartrevalidatie (Brouwers 2021; Nakayama 2020; Rao 2021).
- In twee studies komt de factor diagnose als niet-significant geassocieerd uit de univariate analyse, op grond waarvan deze factor niet is opgenomen in het multivariate model (Sunamura 2017; Wittmer 2012).
- Een CABG is klinisch relevant geassocieerd met het volhouden of voltooien van de hartrevalidatie (OR 2,6-94) ten opzichte van het niet volhouden of voltooien van de hartrevalidatie met een klinisch-relevante associatie (OR 1,24) (González-Salvado 2021; Nakayama 2020).
- In twee studies is een PCI klinisch relevant geassocieerd met het volhouden en voltooien van de hartrevalidatie (OR 0,69-3,6) (González-Salvado 2021; Nakayama 2020).
- Ook de overige studies geven tegengestelde richtingen aan. Zo wordt beschreven dat het hebben van ACS, chronisch hartfalen (CHF) en een aorta-aneurysma klinisch relevant geassocieerd zijn met het volhouden of voltooien van hartrevalidatie (OR 0,58-3,9); met een (klinisch-)relevante associatie (OR 0,58-3,9), daar tegenover zijn een niet-chirurgische diagnose, valvulopathie en een klepoperatie geassocieerd met het niet volhouden of voltooien van hartrevalidatie met een kleine tot matige (klinisch)-relevante associatie (OR- range 0,11-1,54).
De bewijskracht is met drie niveaus verlaagd van hoog tot zeer laag gezien: 1) de inconsistentie in zowel de factor als de uitkomstmaat, 2) de heterogeniteit van de beschreven populaties en interventies en 3) de tegengestelde effecten van de factoren op de uitkomstmaten.
Cardiovasculaire risicofactoren en/of comorbiditeit
Onder deze factor vallen bijvoorbeeld: roken (historie), body mass index (BMI), gerelateerde voorgeschiedenis of aanverwante diagnoses, diabetes mellitus of inactiviteit/ beweeggedrag. Dit betreft de factoren die het risico op hart- en vaatziekten verhogen volgens de richtlijn ‘Cardiovasculair risicomanagement’ (CVRM) van de Federatie Medisch Specialisten (2019). De factor is continue, dichotoom en categoriaal geïncludeerd.
In zes studies blijkt uit de multivariate analyse cardiovasculaire risicofactoren en/of comorbiditeit significant geassocieerd met het volhouden en voltooien van hartrevalidatie (Gaalema 2017; González-Salvado 2021; Nakayama 2020; Rao 2021; Sunamura 2017; Wittmer 2012).
De richting van de associaties die studies vinden, verschilt, evenals de gevonden effect size:
- In vijf studies is de factor bij multivariate analyse niet-significant geassocieerd (body mass index (BMI), ‘chronic obstructive pulmonary disease’ (COPD), ‘cardiovascuclar disease’ (CVD) of ‘coronary arterial disease’ (CAD) in de voorgeschiedenis, hypercholesterolemie, eerder doorgemaakte PCI) met het volhouden en voltooien van hartrevalidatie (Brouwers 2021; Gaalema 2017; González-Salvado 2021; Rao 2021; Sunamura 2017).
- In vier studies blijkt bij univariate analyse de factor (hypercholesterolemie, hypertensie, roken, positieve familiegeschiedenis, BMI, eerder doorgemaakt CABG) niet-significant geassocieerd met het volhouden en voltooien van hartrevalidatie, op grond waarvan deze factor niet is opgenomen in het multivariate model (Brouwers 2021; Rao 2021; Sunamura 2017; Wittmer 2012).
- Roken wordt geassocieerd met het niet volhouden of voltooien van hartrevalidatie met een klinisch-relevante associatie (OR 0,00-2,40) (Gaalema 2017; Rao 2021; Sunamura 2017; Wittmer 2012).
- Een hogere BMI wordt geassocieerd met het niet volhouden of voltooien van hartrevalidatie met een klinisch-relevante associatie (OR 1,03-1,60) (Rao 2021; Wittmer 2012).
- Diabetes wordt geassocieerd met het niet volhouden of voltooien van hartrevalidatie met een klinisch-relevante associatie (OR 0,59-1,63) (Rao 2021; Sunamura 2017; Wittmer 2012).
- Het hebben van ≥ 3 vormen van comorbiditeit, een albuminewaarde ≤ 3,8 g/dl, PAD, ACS, een eerder doorgemaakt myocardinfarct (MI) en sedentair gedrag worden geassocieerd met het niet volhouden of voltooien van hartrevalidatie met een klinisch-relevante associatie (OR 0,02-11,13) (Gaalema 2017; González-Salvado 2021; Nakayama 2020; Rao 2021; Sunamura 2017).
- Het hebben van (een) cardiovasculaire risicofactor(en) is negatief geassocieerd met het kunnen volhouden of voltooien van de hartrevalidatie met een klinisch-relevante associatie in zes studies (OR 0,00-11,13) (Gaalema 2017; González-Salvado 2021; Nakayama 2020; Rao 2021; Sunamura 2017; Wittmer 2012).
De bewijskracht is met drie niveaus verlaagd van hoog tot zeer laag gezien: 1) het risico op vertekening van de resultaten door bias, 2) de inconsistentie in zowel de factor als de uitkomstmaat en 3) heterogeniteit van de beschreven populaties en interventies.
Leefsituatie
Onder deze factor vallen alle dichotome en categoriale variabelen, zoals het al dan gehuwd/ongehuwd/verloofd zijn, gescheiden of uit elkaar zijn, en alleenstaand of weduwe/weduwnaar zijn.
In twee studies blijkt uit de multivariate analyse dat leefsituatie significant geassocieerd is met het volhouden en voltooien van hartrevalidatie (Rao 2021; Wittmer 2012).
De richting van de associaties die studies vinden, verschilt, evenals de gevonden effect size:
- In de multicenter studie van González-Salvado (2021) is leefsituatie slechts op één locatie (van de vijf locaties) in het model opgenomen, en daar is deze factor niet-significant geassocieerd bij multivariate analyse.
- In maar één studie komt leefsituatie als niet-significant geassocieerd uit de univariate analyse, op grond waarvan deze factor niet is opgenomen in het multivariate model (Brouwers 2021).
- In de overige studies is de factor niet als variabele opgenomen.
- In twee studies is het alleenstaand/gescheiden of weduwe zijn klinisch relevant geassocieerd met het niet volhouden of voltooien van de hartrevalidatie (OR 1,99-2,01) (Rao 2021; Wittmer 2012).
De bewijskracht is met drie niveaus verlaagd van hoog tot zeer laag gezien: 1) de inconsistentie in de factor en 2) de heterogeniteit van de beschreven populaties en interventies.
Fysiek functioneren
Onder deze factor vallen: fysiek functioneren in vragenlijsten, het inspanningsvermogen (uitgedrukt in wattage en eventueel in relatie tot het gestelde doel bij een inspanningstest), het maximaal vermogen en de geschatte MET’s. Onder het fysiek functioneren valt het maximaal inspanningsvermogen, de fysieke capaciteit, het subjectief inspanningsvermogen en de fysieke activiteit zoals beschreven in B.6 ‘Meetinstrumenten’. De factor is geïncludeerd als continue variabele.
In twee studies blijkt uit de multivariate analyse dat fysiek functioneren significant geassocieerd is met het volhouden en voltooien van hartrevalidatie uit het multivariate model gekomen (Brouwers 2021; Wittmer 2012).
De richting van de associaties die studies vinden, verschilt, evenals de gevonden effect size:
- In twee studies is de factor niet-significant geassocieerd (fysiek functioneren op de MOS-SF-36 en geschatte MET’s) op het volhouden en voltooien van hartrevalidatie uit het multivariate model gekomen (Gaalema 2017; Rao 2021).
- In maar één studie komt fysiek functioneren, uitgedrukt in MET’s, als niet-significant geassocieerd uit de univariate analyse, op grond waarvan deze factor niet is opgenomen in het multivariate model (Rao 2021).
- In de overige studies is de factor niet als variabele opgenomen.
- In twee studies wordt een hoger fysiek functioneren (maximale belasting of wattage van het inspanningsdoel) klinisch relevant geassocieerd met het volhouden of voltooien van de hartrevalidatie met een (klinisch) relevante associatie (OR 0,81-0,99) (Brouwers 2021; Wittmer 2012).
De bewijskracht is met 3 niveaus verlaagd van hoog tot zeer laag gezien: 1) de inconsistentie in zowel de factor als de uitkomstmaat en 2) de heterogeniteit van de beschreven populaties.
Toegankelijkheid
Onder deze factor vallen: de afstand tot het revalidatiecentrum en stedelijk wonen. De factor is continue, dichotoom en categoriaal geïncludeerd.
In twee studies blijkt uit de multivariate analyse dat toegankelijkheid significant geassocieerd is met het volhouden en voltooien van hartrevalidatie (González-Salvado 2021; Nakayama 2020).
De richting van de associaties die studies vinden, verschilt, evenals de gevonden effect size:
- In maar één studie is de factor als niet-significant geassocieerde factor op het volhouden en voltooien van hartrevalidatie uit het multivariate model gekomen (Brouwers 2021).
- In de overige studies is de factor niet als variabele opgenomen.
- In maar één studie is een afstand > 20 km klinisch relevant geassocieerd met het niet volhouden of voltooien van de hartrevalidatie (OR 1,85-3,55) (Nakayama 2020).
- In deze studie wordt het stedelijk wonen geassocieerd met niet volhouden of voltooien van de hartrevalidatie met een klinisch relevante associatie (OR 0,2) (González-Salvado 2021).
De bewijskracht is met drie niveaus verlaagd van hoog tot zeer laag gezien: 1) de inconsistentie in zowel de factor als de uitkomstmaat en 2) de heterogeniteit van de beschreven interventies
SES en/of gezondheidsvaardigheden
Het betreft een continue, dichotoom en categoriaal geïncludeerde factor.
In één studie blijkt uit de multivariate analyse dat er een significante associatie is tussen de SES en/of gezondheidsvaardigheden en het volhouden en voltooien van hartrevalidatie (Gaalema 2017).
De volgende uitkomsten zijn gerapporteerd:
- In drie studies de factor meegenomen in de multivariate analyse en niet-significant geassocieerd gebleken (Rao 2021; Sunamura 2017; Wittmer 2012).
- In maar één studie is een lage SES klinisch relevant geassocieerd met het niet volhouden of voltooien van de hartrevalidatie (OR 0,02) (Gaalema 2017).
De bewijskracht is met drie niveaus verlaagd van hoog naar zeer laag, aangezien slechts één studie de factor in kaart brengt en er in deze studie bovendien een onbekend risico op vertekening van de resultaten in de RoB aanwezig is.
Geslacht
Deze factor is dichotoom in analyses opgenomen (man/vrouw).
In één studie blijkt uit de multivariate analyse dat geslacht significant geassocieerd is met het volhouden en voltooien van hartrevalidatie (Nakayama 2020).
De volgende uitkomsten zijn gerapporteerd:
- In de studie van Brouwers is geslacht bij multivariate analyse niet significant geassocieerd met het volhouden en voltooien van hartrevalidatie (Brouwers 2021).
- In vier andere studies kwam de factor als niet-significant geassocieerd uit de univariate analyse, op grond waarvan deze niet is opgenomen in het multivariate model (Gaalema 2017; Rao 2021; Sunamura 2017; Wittmer 2012).
- In de overige studies is de factor niet als variabele opgenomen.
- In maar één studie is het mannelijk geslacht klinisch relevant geassocieerd met het niet volhouden of voltooien van de hartrevalidatie (OR-1,48) (Nakayama 2020).
De bewijskracht is met drie niveaus verlaagd van hoog naar zeer laag, aangezien slechts één studie de factor in kaart brengt en er in deze studie bovendien een onbekend risico op vertekening van de resultaten in de RoB aanwezig is.
Hartrevalidatieprogramma-gerelateerd
Onder deze factor vallen: wachttijd tot het starten van het revalideren en eerdere deelname aan hartrevalidatie. De factor is continue en categoriaal geïncludeerd.
In één studie blijkt uit de multivariate analyse dat de wachttijd tot het starten van het revalideren en eerdere deelname aan hartrevalidatie significant geassocieerd is met het volhouden en voltooien van hartrevalidatie (Rao 2021).
De volgende uitkomsten zijn gerapporteerd:
- In maar één studie komt de factor, uitgedrukt in het aantal dagen wachten tot de start van de hartrevalidatie of eerdere deelname aan hartrevalidatie, als niet-significant geassocieerd uit de univariate analyse, op grond waarvan deze factor niet is opgenomen in het multivariate (Brouwers 2021).
- In de overige studies is de factor niet als variabele opgenomen.
- In maar één studie is een wachttijd van > 18 dagen tot het starten van de hartrevalidatie klinisch relevant geassocieerd met het niet volhouden of voltooien van de hartrevalidatie (OR 1,32-1,72) (Rao 2021).
De bewijskracht is met drie niveaus verlaagd van hoog naar zeer laag, aangezien er slechts één studie de factor in kaart brengt en er in deze studie bovendien een onbekend risico op vertekening van de resultaten in de RoB aanwezig is.
Werkzaamheden/dagbesteding
Onder deze factor vallen alle variabelen die met de werkzaamheden/dagbesteding van de mens zijn gerelateerd, zoals: werken, werkloos zijn, het krijgen van een uitkering, schoolgaand of gepensioneerd zijn. De factor is dichotoom of categoriaal geïncludeerd.
In één studie blijkt uit de multivariate analyse dat werkzaamheden of dagbesteding significant geassocieerd is met het volhouden en voltooien van hartrevalidatie (González-Salvado 2021).
De volgende uitkomsten zijn gerapporteerd:
- In twee studies zijn werkzaamheden/dagbesteding meegenomen in de multivariate analyse, maar blijkt deze factor niet-significant geassocieerd met het volhouden en voltooien van hartrevalidatie (Rao 2021; Wittmer 2012).
- In maar één studie is deze factor als niet-significant geassocieerde factor uit de univariate analyse gekomen, op grond waarvan deze niet is opgenomen in het multivariate model (Brouwers 2021).
- In de overige studies is de factor niet als variabele opgenomen.
- In maar één studie is werken geassocieerd met het niet volhouden of voltooien van de hartrevalidatie met een klinisch-relevante associatie (OR-0,2) (González-Salvado 2021).
De bewijskracht is met drie niveaus verlaagd van hoog naar zeer laag aangezien er slechts één studie de factor in kaart brengt en er deze studie bovendien een onbekend risico op vertekening van de resultaten in de RoB aanwezig is.
Psychosociale factoren
Onder deze factor vallen: alle variabelen die met de psychosociale status van de mens zijn gerelateerd, zoals het hebben van angst, depressie of stress (en afgeleide scores) en de mentale, sociale gezondheid. De factor is dichotoom of categoriaal geïncludeerd.
In één studie is psychosociale factoren als significant geassocieerde factor op het volhouden en voltooien van hartrevalidatie uit het multivariate model gekomen (Rao 2021).
De volgende uitkomsten zijn gerapporteerd:
- In een studie blijkt uit het multivariate model dat zelf gerapporteerde angst en stress of de gerelateerde sub-schalen (gescoord op de MOS SF-36) niet-significant geassocieerd zijn met het volhouden en voltooien van hartrevalidatie (Rao 2021).
- In twee studies kwam de factor (GAD-score, depressiescore) als niet-significant geassocieerde factor uit de univariate analyse, waardoor deze niet is opgenomen in het multivariate model (Brouwers 2021; Gaalema 2017).
- In de overige studies is de factor niet als variabele opgenomen.
- In maar één studie wordt het hebben van een zelf gerapporteerde milde tot extreem zware depressie geassocieerd met het niet volhouden of voltooien van de hartrevalidatie met een (klinisch-)relevante associatie (OR-1,33) (Rao 2021).
De bewijskracht is met 3 niveaus verlaagd van hoog naar zeer laag, aangezien er slechts één studie de factor in kaart brengt, waarbij er een onbekend risico op vertekening van de resultaten in de RoB aanwezig is.
Cardiaal gerelateerd
Onder de factor ‘Cardiaal gerelateerd’ vallen: alle variabelen die met de cardiale status van de mens zijn gerelateerd, zoals cardiaal gerelateerde bloedwaardes, ejectiefractie, bloeddruk en hartritme. De factor is continue, dichotoom of categoriaal geïncludeerd.
De volgende uitkomsten zijn gerapporteerd:
- In twee studies kwam de factor (uitgedrukt in rust diastolische, rusthartslag of atriumfibrilleren) niet als significant geassocieerde factor uit de multivariate analyse (González-Salvado 2021; Rao 2021).
- In twee studies kwam de factor (systolische bloeddruk, ejectiefractie en LVEF ≤ 40%) als niet-significant geassocieerde factor uit de univariate analyse, waardoor deze niet is opgenomen in het multivariate model (Rao 2021; Wittmer 2012).In de overige studies is de factor niet als variabele opgenomen.
De bewijskracht en de RoB zijn daarom niet beschreven.
Kwaliteit van leven
Onder de factor ‘Kwaliteit van leven’ vallen: alle variabelen die met de kwaliteit van leven van de mens zijn gerelateerd, zoals specifieke meetinstrumenten (MOS-SF-36, PLC). De factor is categoriaal geïncludeerd.
De volgende uitkomsten zijn gerapporteerd:
- In twee studies kwam de factor (op de MOS-SF-36 en PLC-schaal) niet als significant geassocieerde factor uit de multivariate analyse (Rao 2021; Wittmer 2012).
- In maar één studie kwam leven de factor als niet-significant geassocieerde factor uit de univariate analyse, waardoor deze niet is opgenomen in het multivariate model (Brouwers 2021).
De bewijskracht en de RoB zijn daarom niet beschreven.
Medicatie
Onder de factor ‘Medicatie’ vallen: alle variabelen die met de cardiale medicatie zijn gerelateerd.
- In maar één studie is de associatie tussen medicatie en het volhouden en voltooien van hartrevalidatie bekeken. Antiaritmische medicatie kwam hierbij als significante factor uit de univariate analyse, echter ook de bètablokkers en nitraten zijn in de multivariate analyse meegenomen. Geen enkele medicatiesoort blijkt significant geassocieerd uit de multivariate analyse (Rao 2021).
De bewijskracht en de RoB zijn daarom niet beschreven.
Overige factoren
In de studies zijn geen andere factoren of gerelateerde onderwerpen beschreven.
Criteria voor het formuleren van de aanbevelingen
Van bewijs naar aanbeveling
Er zijn internationaal erkende criteria gehanteerd voor het beoordelen van het bewijs dat ten grondslag ligt aan de aanbevelingen. Deze criteria, evenals de overige overwegingen die de werkgroep formuleerde, bepalen de sterkte van de aanbeveling.
Effecten (gewenste en ongewenste)
Als gevolg van de gevonden heterogeniteit van de prognostische factoren en cruciale uitkomsten, is een meta-analyse niet gerechtvaardigd en is er een narratieve synthese uitgevoerd. Hierdoor is het niet mogelijk om de effectsize met een absoluut getal aan te duiden, maar enkel een range van de effectsizes van de geïncludeerde studies te bepalen. De interpretatie van deze range en het geven van een richting van het bewijs is hierdoor beperkt. De werkgroep heeft factoren (of subgroepen van de factor) waarvan de richting en de relevantie overeenkwam, zoveel mogelijk geclusterd om een uitspraak te kunnen doen over de effecten van de prognostische factor.
Kwaliteit van bewijs
Als gevolg van de gevonden heterogeniteit van de prognostische factoren, de cruciale uitkomsten en het niet kunnen vergelijken van de populaties en interventies, is een groot aantal geïncludeerde studies ten minste twee niveaus afgewaardeerd en uitgekomen op een zeer lage bewijskracht.
Als bewijs is gebaseerd op slechts één studie is de kwaliteit van de bewijskracht per definitie zeer laag op grond van ‘selection of measurement bias’.
Waarden en voorkeuren van patiënten
De werkgroep is van mening dat de patiënten waarde hechten aan het in kaart brengen van zijn waarden en voorkeuren en dat daar weinig variatie in zit tussen patiënten. Deze worden immers al tijdens het diagnostisch proces in kaart gebracht. Het in kaart brengen van de waarden en voorkeuren die het volhouden of voltooien van de hartrevalidatie kunnen voorspellen, vergt hierdoor geen additionele inspanning van de patiënt. Dit sluit aan op het onderzoek van de Harteraad (2022), die onderzocht waarom mensen met hartfalen niet deelnemen of aanhaken aan een hartrevalidatieprogramma.
Balans gewenste en ongewenste effecten
Cardiovasculaire risicofactoren en/of comorbiditeit. Ondanks de zeer lage bewijskracht van studies waarin het hebben van cardiovasculaire risicofactoren en/of comorbiditeit negatief geassocieerd is met het kunnen volhouden of voltooien van hartrevalidatie, oordeelt de werkgroep dat het in kaart brengen van de factor ‘cardiovasculaire risicofactoren en/of comorbiditeit’ van belang is om te kunnen voorspellen of de patiënt de hartrevalidatie kan volhouden en voltooien.
De werkgroep heeft hiervoor de volgende motivatie:
- De klinische ervaring vanuit de werkgroep leert dat patiënten met meerdere cardiale risicofactoren en/of comorbiditeit (zoals diabetes mellitus, COPD, perifeer arterieel vaatlijden (PAV)), in de praktijk in mindere mate in staat zijn om de hartrevalidatie vol te houden en te voltooien.
Leefsituatie. Ondanks de zeer lage bewijskracht van de studies waarin het alleenstaand, gescheiden of weduwe/weduwnaar zijn negatief geassocieerd is met het kunnen volhouden of voltooien van hartrevalidatie, oordeelt de werkgroep dat het in kaart brengen van de factor ‘leefsituatie’ van belang is om te kunnen voorspellen of de patiënt de hartrevalidatie kan volhouden en voltooien.
De werkgroep heeft hiervoor de volgende motivatie:
- De klinische ervaring van de werkgroep leert dat alleenstaande patiënten in de praktijk in mindere mate in staat zijn om het hartprogramma vol te houden en te voltooien dan niet-alleenstaande. Een verklaring zou kunnen zijn dat alleenstaande patiënten minder sociale ondersteuning ervaren in het volhouden of voltooien van de hartrevalidatie dan niet-alleenstaanden, wat ondersteund wordt door de studie van Wittmer (2012). Een andere verklaring zou kunnen zijn dat alleenstaande patiënten minder vaak beschikken over vervoer en daarmee in dit opzicht afhankelijk zijn van hun sociale netwerk. Deze verklaringen worden verder uitgewerkt bij de factor ‘toegankelijkheid’ en ‘psychosociale factoren’.
Fysiek functioneren. Ondanks de zeer lage bewijskracht van studies waarin een verminderd fysiek functioneren negatief geassocieerd is met het kunnen volhouden of voltooien van hartrevalidatie, oordeelt de werkgroep dat het in kaart brengen van de factor ‘fysiek functioneren’ van belang is om te kunnen voorspellen of de patiënt de hartrevalidatie kan volhouden en voltooien.
De werkgroep heeft hiervoor de volgende motivatie:
- Het in kaart brengen van het fysiek functioneren is een onderdeel van het diagnostisch proces, evenals het samen met de patiënt vaststellen van de fysio- of oefentherapeutische doelstellingen. Als er verandering optreedt in de motivatie van de patiënt gedurende het behandelproces kan het ondersteunend zijn om op dat moment de doelstellingen nogmaals met de patiënt door te nemen en te bespreken wat de ontwikkelingen in fysiek functioneren zijn.
Toegankelijkheid. De factor ‘toegankelijkheid’ is zowel positief als negatief geassocieerd met het kunnen volhouden en voltooien van de hartrevalidatie. Ondanks de zeer lage bewijskracht van deze studies, oordeelt de werkgroep dat het in kaart brengen van de factor ‘toegankelijkheid’ van belang is om te kunnen voorspellen of de patiënt de hartrevalidatie kan volhouden en voltooien.
De werkgroep heeft hiervoor de volgende motivatie:
- De klinische ervaring van de werkgroep leert dat patiënten die op een grotere afstand van het hartcentrum wonen, eerder geneigd zijn om te stoppen met de hartrevalidatie dan patiënten die dicht bij het hartcentrum wonen.
- De werkgroep geeft aan dat het niet kunnen beschikken over een vervoersmiddel om de afstand tot het hartcentrum te overbruggen of de weg naar het hartcentrum niet kunnen vinden een belemmerende rol spelen.
SES en/of gezondheidsvaardigheden. Hoewel slechts één studie een klinisch relevante associatie beschrijft, waarbij het hebben van een lage economische status (SES) negatief geassocieerd is met het kunnen volhouden of voltooien van hartrevalidatie, oordeelt de werkgroep dat het in kaart brengen van de factor ‘SES en/of gezondheidsvaardigheden’ van belang is om te kunnen voorspellen of de patiënt de hartrevalidatie kan volhouden en voltooien.
De werkgroep heeft hiervoor de volgende motivatie:
- De klinische ervaring van de werkgroep leert dat patiënten met een lage SES of beperkte gezondheidsvaardigheden eerder geneigd zijn om te stoppen met de hartrevalidatie. Deze ervaring wordt ondersteund door de literatuur (Gaalema 2017).
Werkzaamheden/dagbesteding. Hoewel slechts één studie het hebben van werk negatief geassocieerd is met het kunnen volhouden of voltooien van hartrevalidatie, oordeelt de werkgroep dat het in kaart brengen van de factor ‘werkzaamheden/dagbesteding’ van belang is om te kunnen voorspellen of de patiënt de hartrevalidatie kan volhouden en voltooien.
De werkgroep heeft hiervoor de volgende motivatie:
- De klinische ervaring van de werkgroep leert dat patiënten die werkend zijn, eerder geneigd zijn om te stoppen met de hartrevalidatie als ze tijdens het hartprogramma het werk hervatten. Hierbij is een belangrijke beperking dat hartcentra doorgaans alleen tijdens kantooruren geopend zijn. Patiënten die snel re-integreren op hun werk, zijn hierdoor belemmerd in het uitvoeren van de hartrevalidatieprogramma’s. Deze ervaring wordt ondersteund door de literatuur (Gaalema 2017).
Psychosociale factoren. Hoewel slechts één studie een relevante associatie beschrijft, waarbij het hebben van een zelfgerapporteerde mild tot extreem zware depressie negatief geassocieerd is met het kunnen volhouden en voltooien van hartrevalidatie, oordeelt de werkgroep dat het in kaart brengen van de factor ‘psychosociale factoren’ van belang is om te kunnen voorspellen of de patiënt de hartrevalidatie kan volhouden en voltooien.
De werkgroep heeft hiervoor de volgende motivatie:
- De klinische ervaring van de werkgroep leert dat patiënten bij wie (complexere) psychosociale problematiek speelt, eerder geneigd zijn om te stoppen met de hartrevalidatie. Dit wordt ondersteund door een systematische review naar de associatie van depressie en het voltooien van hartrevalidatie (Edwards 2019).
- De ESC-Clinical Practice Guidelines onderschrijft dat psychosociale stress, depressie en angst negatief geassocieerd zijn met het volhouden van de hartrevalidatie en dat het voor patiënten met psychosociale stress, depressie en angst moeilijk is om positieve veranderingen in hun levensstijl toe te passen of zich aan een therapeutisch regime te houden (Knuuti 2020).
Sociaal-economische overwegingen en kosteneffectiviteit
De werkgroep oordeelt dat de benodigde middelen of kosten voor het in kaart brengen van de factoren die het volhouden en volooien van de hartrevalidatie voorspellen verwaarloosbaar zijn. Dit komt omdat de geïdentificeerde factoren vanuit de geïncludeerde studies in de huidige praktijk al tijdens het diagnostisch proces in kaart worden gebracht. Het in kaart brengen van de factoren vergt hierdoor geen additionele middelen of kosten ten opzichte van de huidige praktijk. Aanvullend oordeelt de werkgroep dat als de instroom in de hartrevalidatie en het voltooien van de hartrevalidatie door de patiënt de (toekomstige) ziektelast vermindert, deze verminderde ziektelast zich direct vertaalt in voordelen voor de samenleving en de economie (De Gruyter 2016; Frederix 2018).
Gezondheidsgelijkheid
De werkgroep verwacht dat het in kaart brengen van factoren die voorspellen of de patiënt de hartrevalidatie kan volhouden en voltooien, geen impact heeft op gezondheidsgelijkheid. De geïdentificeerde factoren vanuit de geïncludeerde studies worden in de huidige praktijk al tijdens het diagnostisch proces in kaart gebracht. Op basis van klinische expertise oordeelt de werkgroep het al dan niet volhouden of voltooien van de hartrevalidatie geen invloed heeft op de gezondheidsgelijkheid.
Aanvaardbaarheid
De werkgroep verwacht dat het in kaart brengen van de factoren die voorspellen of de patiënt de hartrevalidatie kan volhouden en voltooien door alle belangrijkste stakeholders zal worden geaccepteerd. Dit komt omdat deze factoren vanuit de geïncludeerde studies in de huidige praktijk al tijdens het diagnostisch proces in kaart worden gebracht. Er is geen additionele inspanning voor nodig, wat in kaart brengen haalbaar maakt.
Haalbaarheid
De werkgroep oordeelt dat het realistisch is om het in kaart brengen van de factoren die voorspellen of de patiënt de hartrevalidatie kan volhouden en voltooien. Dit komt omdat de geïdentificeerde factoren vanuit de geïncludeerde studies in de huidige praktijk al tijdens het diagnostisch proces in kaart worden gebracht. Er is geen additionele inspanning voor nodig, wat in kaart brengen haalbaar maakt.
Overige overwegingen
Leeftijd en geslacht. De werkgroep is van mening dat de factoren leeftijd en geslacht niet in kaart hoeven te worden gebracht, omdat deze factoren niet belang zijn om te kunnen voorspellen of de patiënt de hartrevalidatie kan volhouden. Wel is bekend dat vrouwen en ouderen minder vaak instromen in hartrevalidatie. Dit wordt ondersteund door studies die zijn uitgevoerd in de Nederlandse situatie, waarbij het vrouwelijk geslacht en oudere leeftijd voorspellend zijn voor een verminderde instroom (Brouwers 2021; Conijn 2022; González-Salvado 2021; Sunamura 2017; Van Engen-Verheul 2013; Vonk 2021). De werkgroep is echter van mening dat deze subpopulaties, als zij eenmaal zijn gestart met de hartrevalidatie, hiervoor goed gemotiveerd zijn.
Diagnose. De werkgroep is van mening dat de factor ‘diagnose’ niet in kaart hoeft te worden gebracht, omdat deze factor niet belang is om te kunnen voorspellen of de patiënt de hartrevalidatie kan volhouden of voltooien. De werkgroep geeft aan dat de factor diagnose met name van belang is bij het instromen in de hartrevalidatie.
Hartrevalidatieprogramma-gerelateerd. De werkgroep is van mening dat de factor ‘hartrevalidatieprogramma-gerelateerd’ niet in kaart hoeft te worden gebracht, omdat deze factor niet van belang is om te kunnen voorspellen of de patiënt de hartrevalidatie kan volhouden of voltooien. De werkgroep geeft aan dat de factor Hartrevalidatieprogramma met name van belang is bij het instromen in de hartrevalidatie.
Cognitieve vaardigheid. De werkgroep is van mening dat de factor ‘cognitieve vaardigheid’ niet in kaart hoeft te worden gebracht. Cognitieve vaardigheid is in de geïncludeerde studies niet geanalyseerd, waardoor er vanuit de literatuur geen conclusie aan deze mening verbonden kan worden. Wel wordt het in kaart brengen van cognitieve factoren beschreven in de Europese richtlijn voor postreanimatiezorg (Nolan 2021). De werkgroep is echter van mening dat het in kaart brengen van de cognitieve status niet primair door de fysio- of oefentherapeut zou moeten worden gedaan. Wel is het van belang om gedurende het beweegprogramma van fase II-hartrevalidatie rekening te houden met de cognitieve status van de patiënt.
Anderstalig, doof of slechthorend zijn. De werkgroep is van mening dat het anderstalig, doof of slechthorend zijn van de patiënt een relatie kan hebben met niet kunnen volhouden en voltooien van de hartrevalidatie. Deze factor is echter niet in de literatuur geïdentificeerd, maar op basis van de klinische expertise van de werkgroepleden toegevoegd.
Aandachtspunten voor implementatie
Zie hiervoor de beschrijving bij ‘Haalbaarheid’.
Kennislacunes
Uit het systematische literatuuronderzoek kwam naar voren dat er een grote heterogeniteit is in de manier waarop prognostische factoren worden gedefinieerd en dat geldt ook de voor de begrippen ‘volhouden’ en ‘voltooien’ van de hartrevalidatie. Dit laatste is overigens al eerder in de literatuur gesignaleerd (Brouwers 2021; Sunamura 2017). Een ander punt is dat hartrevalidatieprogramma’s tussen de verschillende landen niet met elkaar te vergelijken zijn. Het is daarom van belang om belemmerende en bevorderende factoren in kaart te brengen die specifiek zijn gericht op de Nederlandse situatie.
Op grond hiervan oordeelt de werkgroep dat de volgende onderzoeksvraag belangrijk is:
- Welke belemmerende en bevorderende factoren, gerelateerd aan het beweegprogramma van fase II-hartrevalidatie, spelen een belangrijke rol bij het beïnvloeden van therapietrouw (volhouden) en het voltooien van fase II-hartrevalidatie bij patiënten met coronairlijden of chronisch hartfalen in Nederland?
- Armstrong MJ, Sigal RJ, Arena R, Hauer TL, Austford LD, Aggarwal S, Stone JA, Martin BJ. Cardiac rehabilitation completion is associated with reduced mortality in patients with diabetes and coronary artery disease. Diabetologia. 2015;58(4):691-8.
- Bostrom J, Searcy R, Walia A, Rzucidlo J, Banco D, Quien M, Sweeney G, Pierre A, Tang Y, Mola A, Xia Y, Whiteson J, Dodson JA. Early Termination of Cardiac Rehabilitation Is More Common With Heart Failure With Reduced Ejection Fraction Than With Ischemic Heart Disease. J Cardiopulm Rehab Prev. 2020;40(3):E26-E30.
- Brouwers RWM, Houben VJG, Kraal JJ, Spee RF, Kemps HMC. Predictors of cardiac rehabilitation referral, enrolment and completion after acute myocardial infarction: an exploratory study. Neth Heart J. 2021;29(3):151-7.
- Colbert JD, Martin BJ, Haykowsky MJ, Hauer TL, Austford LD, Arena RA, Knudtson ML, Meldrum DA, Aggarwal SG, Stone JA. Cardiac rehabilitation referral, attendance and mortality in women. Eur J Prev Cardiol. 2015;22(8):979-86.
- Conijn D, de Lind van Wijngaarden RAF, Vermeulen HM, Vliet Vlieland TPM, Meesters JJL. Referral to and enrolment in cardiac rehabilitation after open-heart surgery in the Netherlands. Neth Heart J. 2022;30(4):227-36.
- De Gruyter E, Ford G, Stavreski B. Economic and social Impact of increasing uptake of cardiac rehabilitation services – A cost benefit analysis. Heart Lung Circ. 2016;25(2):175-83.
- de Jong A. Cardiac rehabilitation: underutilized care offering substantial benefits. ACSM’s Health & Fitness Journal 2012;16(2):31-3.
- de Melo Ghisi GL, Dos Santos RZ, Aranha EE, Nunes AD, Oh P, Benetti M, Grace SL. Perceptions of barriers to cardiac rehabilitation use in Brazil. Vascular Health & Risk Management. 2013;9:485-91.
- Edwards BL, Sydeman SJ. Depression iIs associated with reduced outpatient cardiac rehabilitation completion rates: a systematic literature review and meta-analysis. J Cardiopulm Rehabil Prev. 2019;39(6):365-72.
- Farah M, Abdallah M, Szalai H, Berry R, Lagu T, Lindenauer PK, Pack QR. Association Between Patient Cost Sharing and Cardiac Rehabilitation Adherence. Mayo Clinic Proceedings. 2019;94(12):2390-8.
- Federatie Medisch Specialisten. Cardiovasculair risicomanagement (CVRM). Utrecht: Federatie Medisch Specialisten (FMS); 2019. Beschikbaar via https://richtlijnendatabase.nl/
- Frechette KM, Conley SM, Tang A, Welch TD. Cardiac rehabilitation in a rural setting: optimization of referral and participation rates. J Cardiopulm Rehabil Prev. 2019;39:E4-E7.
- Frederix I, Vandijck D, Hens N, De Sutter J, Dendale P. Economic and social impact of increased cardiac rehabilitation uptake and cardiac telerehabilitation in Belgium – a cost-benefit analysis. Acta Cardiol. 2018;73(3):222-9.
- Gaalema D, Cutler A, Higgins ST, Savage P, Ades P. Smoking and cardiac rehabilitation program completion. Drug and Alcohol Dependence. 2015;156:e76.
- Gaalema DE, Savage PD, Rengo JL, Cutler AY, Elliott RJ, Priest JS, Higgins ST, Ades PA. Patient characteristics predictive of cardiac rehabilitation adherence. J Cardiopul Rehabil Prev. 2017;37(2):103-10.
- Gardiner F, Nwose E, Regan E, French P, Bwititi Ph, Crockett J, Wang L. Outpatient cardiac rehabilitation: Patient perceived benefits and reasons for non-attendance. Collegian. 2018;25(5):479-85.
- Gobeil K, White K, Bhat A, Szalai H, Lagu TC, Pack QR. Cardiac rehabilitation in Takotsubo cardiomyopathy: Predictors of utilization and effects of exercise training. Heart Lung. 2021;50(2):230-4.
- Goldstein DW, Hajduk AM, Song X, Tsang S, Geda M, Dodson JA, Forman DE, Krumholz H, Chaudhry SI. Factors associated with cardiac rehabilitation participation in older adults after myocardial infarction: the SILVER-AMI study. J Cardiopulm Rehabilit Prev. 2022;42(2):109-14.
- González-Salvado V, Pena-Gil C, Lado-Baleato O, Cadarso-Suarez C, Prada-Ramallal G, Prescott E, Wilhelm M, Eser P, Iliou MC, Zeymer U, Ardissino D, Bruins W, van der Velde AE, van’t Hof AWJ, de Kluiver EP, Kolkman EK, Prins L, Gonzalez Juanatey JR. Offering, participation and adherence to cardiac rehabilitation programmes in the elderly: a European comparison based on the EU-CaRE multicentre observational study. Eur J Prev Cardiol. 2021;28(5):558-68.
- Grace SL, Oh PI, Marzolini S, Colella T, Tan Y, Alter DA. Observing temporal trends in cardiac rehabilitation from 1996 to 2010 in Ontario: Characteristics of referred patients, programme participation and mortality rates. BMJ Open. 2015;5(11):e009523.
- Grace SL, Prior PL, Mamataz T, Hartley T, Oh P, Suskin N. Cardiac rehabilitation component attendance and impact of intervening clinical events, as well as disease severity and risk factor burden. J Cardiopulm Rehabi Prev. 2021;41(1):40-5.
- Harteraad. Hartrevalidatie: waarom mensen met hartfalen niet deelnemen of afhaken. Harteraad onderzoek 2022. Hartfalen en hartrevalidatie. Den Haag: Harteraad, Hartstichting; 2022. Beschikbaar via https://harteraad.nl/
- Hayden JA, Côté P, Bombardier C. Evaluation of the quality of prognosis studies in systematic reviews. Ann Intern Med. 2006;144(6):427-37.
- Hayden JA, van der Windt DA, Cartwright JL, Côté P, Bombardier C. Assessing bias in studies of prognostic factors. Ann Intern Med. 2013;158(4):280-6.
- Heald FA, Marzolini S, Colella TJF, Oh P, Nijhawan R, Grace SL. Profile of women choosing mixed-sex, women-only, and home-based cardiac rehabilitation models and impact on utilization. Women Health. 2022;62(2):98-107.
- Hwang R, Peters R, Harmer E, Boyde M, Morris NR. Insight into a real-world experience with completion of cardiac rehabilitation. International Journal of Cardiology 2022;360:5-6.
- Keteyian SJ, Jackson SL, Chang A, Brawner CA, Wall HK, Forman DE, Sukul D, Ritchey MD, Sperling LS. Tracking cardiac rehabilitation utilization in medicare beneficiaries: 2017 update. J Cardiopulm Rehabil Prev. 2022;42(4):235-45.
- Knuuti J, Wijns W, Saraste A, Capodanno D, Barbato E, Funck-Brentano C, Prescott E, Storey RF, Deaton C, Cuisset T, Agewall S, Dickstein K, Edvardsen T, Escaned J, Gersh BJ, Svitil P, Gilard M, Hasdai D, Hatala R, Mahfoud F, Masip J, Muneretto C, Valgimigli M, Achenbach S, Bax JJ. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41(3):407-77.
- Laddu D, Ozemek C, Lamb B, Hauer T, Aggarwal S, Stone JA, Arena R, Martin BJ. Factors associated with cardiorespiratory fitness at completion of cardiac rehabilitation: identification of specific patient features requiring attention. Can J Cardiol. 2018;34(7):925-32.
- Lee JY, Kang SJ, Cho YR, Park GM, Ahn JM, Kim WJ, Park DW, Lee SW, Kim YH, Lee CW, Park SW, Park SJ. Factors influencing a patient’s decision to participation or completion of cardiac rehabilitation. Am J Cardiol. 2013;1:69B.
- Lemstra ME, Alsabbagh W, Rajakumar RJ, Rogers MR, Blackburn D. Neighbourhood income and cardiac rehabilitation access as determinants of nonattendance and noncompletion. Can J Cardiol. 2013;29(12):1599-603.
- Martin BJ, Hauer T, Arena R, Austford LD, Galbraith PD, Lewin AM, Knudtson ML, Ghali WA, Stone JA, Aggarwal SG. Cardiac rehabilitation attendance and outcomes in coronary artery disease patients. Circulation. 2012;126(6):677-87.
- Martin BJ, Hauer T, Austford LD, Knudtson ML, Arena R, Meldrum DA, Aggarwal S, Stone JA. Cardiac rehabilitation: Characteristics of those who drop out after initiating a program. Circulation 2013;128 Suppl 22.
- Marzolini S, Blanchard C, Alter DA, Grace SL, Oh PI. Delays in referral and enrolment are associated with mitigated benefits of cardiac rehabilitation after coronary artery bypass surgery. Circ Cardiovasc Qual Outcomes. 2015;8(6):608-20.
- McDonall J, Botti M, Redley B, Wood B. Patient participation in a cardiac rehabilitation program. J Cardiopulm Rehabil Prev. 2013;33(3):185-8.
- Mikkelsen T, Korsgaard Thomsen K, Tchijevitch O. Non-attendance and drop-out in cardiac rehabilitation among patients with ischaemic heart disease. Dan Med J. 2014;61(10):A4919.
- Minges KE, Strait KM, Owen N, Dunstan DW, Camhi SM, Lichtman J, Geda M, Dreyer RP, Bueno H, Beltrame JF, Curtis JP, Krumholz HM. Gender differences in physical activity following acute myocardial infarction in adults: A prospective, observational study. Eur J Prev Cardiol. 2017;24(2):192-203.
- Nakanishi M, Miura H, Irie Y, Nakao K, Fujino M, Otsuka F, Aoki T, Yanase M, Goto Y, Noguchi T. Association of adherence to a 3 month cardiac rehabilitation with long-term clinical outcomes in heart failure patients. ESC Heart Failure. 2022;9:1424-35.
- Nakayama A, Nagayama M, Morita H, Kawahara T, Komuro I, Isobe M. The use of geographical analysis in assessing the impact of patients’ home addresses on their participation in outpatient cardiac rehabilitation: a prospective cohort study. EHPM. 2020;25(1):76.
- Nolan JP, Sandroni C, Böttiger BW, Cariou A, Cronberg T, Friberg H, Genbrugge C, Haywood K, Lilja G, Moulaert VRM, Nikolaou N, Olasveengen TM, Skrifvars MB, Taccone F, Soar J. European Resuscitation Council and European Society of Intensive Care Medicine guidelines 2021: post-resuscitation care. Intensive Care Med. 2021;47(4):369-421.
- Olsen SJ, Schirmer H, Bonaa KH, Hanssen TA. Cardiac rehabilitation after percutaneous coronary intervention: Results from a nationwide survey. Eur J Cardiovasc Nurs. 2018;17(3):273-9.
- Parashar S, Spertus JA, Tang F, Bishop KL, Vaccarino V, Jackson CF, Boyden TF, Sperling L. Predictors of early and late enrollment in cardiac rehabilitation, among those referred, after acute myocardial infarction. Circulation. 2012;126:1587-95.
- Pardaens S, De Smedt D, de Bacquer D, Willems AM, Verstreken S, De Sutter J. Comorbidities and psychosocial characteristics as determinants of dropout in outpatient cardiac rehabilitation. J Cardiovasc Nurs. 2017;32(1):14-21.
- Park LG, Schopfer DW, Zhang N, Shen H, Whooley MA. Participation in cardiac rehabilitation among patients with heart failure. J Cardiac Failure. 2017;23(5):427-31.
- Poh R, Ng H-N, Loo G, Ooi L-S, Yeo T-J, Wong R, Lee C-H. Cardiac Rehabilitation After Percutaneous Coronary Intervention in a Multiethnic Asian Country: Enrollment and Barriers. Arch Phys Med Rehabil. 2015;96(9):1733-8.
- Rao A, Zecchin R, Byth K, Denniss AR, Hickman LD, DiGiacomo M, Phillips JL, Newton PJ. The role of lifestyle and cardiovascular risk factors in dropout from an Australian cardiac rehabilitation program. A longitudinal cohort study. Heart Lung Circ. 2021;30(12):1891-900.
- Redfern J, Hyun K, Chew DP, Astley C, Chow C, Aliprandi-Costa B, Howell T, Carr B, Lintern K, Ranasinghe I, Nallaiah K, Turnbull F, Ferry C, Hammett C, Ellis CJ, French J, Brieger D, Briffa T. Prescription of secondary prevention medications, lifestyle advice, and referral to rehabilitation among acute coronary syndrome inpatients: Results from a large prospective audit in Australia and New Zealand. Heart. 2014;100:1281-8.
- Revalidatiecommissie NVVC/NHS en projectgroep PAAHR. Multidisciplinaire Richtlijn Hartrevalidatie 2011. Utrecht: Nederlandse Vereniging voor Cardiologie; 2011.
- Beschikbaar via https://www.nvvc.nl/Kwaliteit/richtlijnen
- Ritchey MD, Maresh S, McNeely J, Shaffer T, Jackson SL, Keteyian SJ, Brawner CA, Whooley MA, Chang T, Stolp H, Schieb L, Wright J. Tracking cardiac rehabilitation participation and completion among Medicare beneficiaries to inform the efforts of a national initiative. Circ Cardiovasc Qual Outcomes. 2020. Jan;13(1):e005902.
- Rubin R. Although cardiac rehab saves lives, few eligible patients take part. JAMA. 2019;322(5):386-8.
- Sanchez-Delgado JC, Angarita-Fonseca A, Jacome Hortua A, Malaver-Vega Y, Schmalbach-Aponte E, Diaz-Diaz C. Barriers for the participation in cardiac rehabilitation programmes in patients undergoing percutaneous revascularisation due to a coronary disease. Revista Colombiana de Cardiologia. 2016;23:141-7.
- Sunamura M, Ter Hoeve N, Geleijnse ML, Steenaard RV, van den Berg-Emons HJG, Boersma H, van Domburg RT. Cardiac rehabilitation in patients who underwent primary percutaneous coronary intervention for acute myocardial infarction: determinants of programme participation and completion. Neth Heart J. 2017;25(11):618-28.
- Tang LH, Harrison A, Skou ST, Taylor RS, Dalal H, Doherty P. Are patient characteristics and modes of delivery associated with completion of cardiac rehabilitation? A national registry analysis. Int J Cardiol. 2022;361:7-13.
- Turk-Adawi KI, Oldridge NB, Tarima SS, Stason WB, Shepard DS. Cardiac rehabilitation patient and organizational factors: what keeps patients in programs? J Am Heart Assoc. 2013;2(5):e000418-e.
- van Engen-Verheul M, de Vries H, Kemps H, Kraaijenhagen R, de Keizer N, Peek N. Cardiac rehabilitation uptake and its determinants in the Netherlands. Eur J Prev Cardiol. 2013;20(2):349-56.
- Vonk T, Nuijten MAH, Maessen MFH, Meindersma EP, Koornstra-Wortel HJJ, Waskowsky MM, Snoek JA, Eijsvogels TMH, Hopman MTE. Identifying reasons for nonattendance and noncompletion of cardiac rehabilitation: insights from Germany and the Netherlands. J Cardiopulm Rehabil Prev. 2021;41(3):153-8.
- Wallert J, Mitchell A, Held C, Hagstrom E, Leosdottir M, Olsson EMG. Cardiac rehabilitation goal attainment after myocardial infarction with versus without diabetes: A nationwide registry study. Int J Cardiol. 2019;292:19-24.
- Weeger S, Farin E. The effect of the patient–physician relationship on health-related quality of life after cardiac rehabilitation. Disabil Rehabil. 2017;39(5):468-76.
- Wittmer M, Volpatti M, Piazzalonga S, Hoffmann A. Expectation, satisfaction, and predictors of dropout in cardiac rehabilitation. Eur J Prev Cardiol. 2012;19(5):1082-8.
- Wu LH, Wang CH, Liu MH, Hsu CC, Yuan PH, Fu TC. Factors associated with participation rate and predictive of improvement after cardiac rehabilitation in patients with heart failure. J Cardiopulm Rehabil Prev. 2023 Jan 1;43(1):49-54.
- Zullo MD, Gathright EC, Dolansky MA, Josephson RA, Cheruvu VK, Hughes JW. Influence of depression on utilization of cardiac rehabilitation postmyocardial infarction: a study of 158 991 medicare beneficiaries. J Cardiopulm Rehabil Prev. 2017;37(1):22-9.
B.3 Lage SES / beperkte gezondheidsvaardigheden
Aanbevelingen
Pas bij alle patiënten met coronairlijden of chronisch hartfalen, maar in het bijzonder bij patiënten met een lage sociaal-economische status (SES) en/of beperkte gezondheidsvaardigheden, onderstaande adviezen toe om de therapietrouw en voltooiing van het beweegprogramma van fase II-hartrevalidatie te bevorderen.
1. Communiceer begrijpelijk
Tijdens een gesprek
- Normaliseer laaggeletterdheid. Vraag bijvoorbeeld: ‘We weten dat veel mensen moeite hebben met het invullen van formulieren. Hoe is dat voor u?’
- Veronderstel geen basiskennis van het lichaam. Mensen met beperkte gezondheidsvaardigheden hebben moeite met het vinden, begrijpen en toepassen van medische informatie. Gebruik na uitleg de terugvraagmethode: ‘Ik heb een heleboel verteld. Wat gaat u thuis vertellen?’
- Laat mensen hun oefeningen voordoen. ‘Laat eens zien of ik u de oefeningen de vorige keer goed heb voorgedaan’.
- Gebruik ondersteunend voorlichtingsmateriaal dat past bij iemands taal- en digitale vaardigheden.
- Maak korte zinnen en gebruik eenvoudige woorden.
- Maak geen ‘uitstapjes’ in je verhaal: blijf bij de kern van de boodschap.
- Wees zo concreet mogelijk, vermijd jargon en beeldspraak.
- Herhaal de belangrijkste punten (en beperk die tot maximaal drie).
- Geef instructies en adviezen op papier mee.
In schriftelijke communicatie
- Gebruik filmpjes of getekend voorlichtingsmateriaal dat is getest met of bij de doelgroep.
- Gebruik woorden op A2-B1-niveau.
- Beperk de hoeveelheid informatie tot maximaal drie belangrijke punten. Verwijs eventueel voor meer informatie door naar relevante informatiebronnen.
- Een heldere opmaak en kopjes vergroten het begrip.
- Gebruik alleen materialen die getest zijn op begrijpelijkheid. En test materialen die je zelf maakt altijd op begrijpelijkheid voordat je deze in de praktijk inzet.
Bron: (Landelijk expertisecentrum Pharos)
2. Ondersteun het geloof in eigen kunnen
Maak gebruik van de aanbevelingen die geformuleerd zijn in de ‘KNGF-richtlijn Zelfmanagement’ (Koninklijk Nederlands Genootschap voor Fysiotherapie 2022).
3. Vraag naar praktische, sociaal en/of-economische barrières
Bespreek aan het begin van het hartrevalidatieprogramma met de patiënt eventuele praktische, sociale en/of economische barrières voor het opstarten en succesvol afronden van de hartrevalidatie.
Interventies op het gebied van gezondheid en leefstijl
Vraag in de anamnese bijvoorbeeld naar de volgende belemmerende factoren (zie B.4 ‘Anamnese’)
- De oefenlocatie moet vindbaar en bereikbaar zijn (adviseer bijvoorbeeld om de eerste keer met iemand samen te komen).
- De therapie moet betaalbaar zijn.
- Bespreek of er andere praktische belemmeringen zijn: bijvoorbeeld geen oppas voor de kinderen.
- Bespreek in het geval van groepstherapie vooraf individueel met de deelnemer welke voorkeuren zij hebben in samenstelling en werkvormen. Bespreek ook bij sportactiviteiten of er een voorkeur voor binnen of buiten is en wat de voorschriften voor sportkleding zijn. Houd rekening met culturele verschillen.
- Onbekendheid: een warme overdracht is belangrijk. Bekijk wie de eerste keer het contact kan leggen en/of laat een familielid, buurman/buurvrouw de eerste keer meekomen.
- Aanwezigheid van psychosociale factoren (stress, angst, depressie). De aanwezigheid hiervan kan een drempel zijn voor het ontwikkelen of volhouden van een actieve leefstijl.
Bron: (Landelijk expertisecentrum Pharos)
4. Probeer een indruk te krijgen van iemands gezondheids-, taal- en digitale vaardigheden.
5. Wees je bewust van de eigen therapeutische attitude.
Therapeutische attitude bij fase II-hartrevalidatie
- Maak persoonlijk contact.
- Maak duidelijk wat er te halen valt voor de deelnemer.
- Zorg voor een sociale en veilige sfeer in de groep.
- Zorg voor een klik tussen de begeleider en de deelnemer.
- Start niet te snel met de interventie.
- Investeer in een vertrouwensband.
- Wees empathisch.
Bron: (Landelijk expertisecentrum Pharos)
6. Overleg met het hele hartrevalidatieteam.
- Bespreek de aandachtspunten. Mogelijk is het nodig aanpassing van het hartrevalidatieprogramma (inclusief beweegprogramma) te overwegen. Zie hiervoor C.2 ‘Volhouden en voltooien van de hartrevalidatie’.
- Blijf monitoren gedurende het gehele hartrevalidatieprogramma. Zie hiervoor C.7 ‘Evaluatie, stopcriteria en afsluiting van de behandeling’.
Onderbouwing
Aanleiding
Eén op de vier Nederlanders heeft beperkte gezondheidsvaardigheden. Dat betekent dat zij moeite hebben met het vinden, begrijpen, beoordelen en gebruiken van informatie over gezondheid. Een deel van deze groep is laaggeletterd (Landelijk expertisecentrum Pharos).
In Nederland leven mensen met lage SES en/of beperkte gezondheidsvaardigheden, gemiddeld vier jaar korter, en zelfs 15 jaar in minder goed ervaren gezondheid, dan mensen met hogere beroepsopleiding (hbo) of een universitaire opleiding (Landelijk expertisecentrum Pharos).
Hart- en vaatziekten komen bij mensen met beperkte gezondheidsvaardigheden beduidend vaker voor (Landelijk expertisecentrum Pharos). Hartrevalidatie richt zich op het voorkomen van hart- en vaatziekten door het veranderen van de leefstijl en verminderen van de risicofactoren; patiënten met een lage SES zijn echter minder goed in staat de hartrevalidatie te voltooien (zie B.2 ‘Belemmerende en bevorderende factoren’).
Om de positieve effecten van hartrevalidatie toch te realiseren, is het van belang af te stemmen op de belemmerende factoren en behoeften van patiënten met een lage SES en/of beperkte gezondheidsvaardigheden.
Uitgangsvraag
Hoe bevorder je de therapietrouw en voltooiing van het beweegprogramma van fase II-hartrevalidatie bij patiënten met coronairlijden of chronisch hartfalen met een lage SES en/of beperkte gezondheidsvaardigheden?
Conclusies op basis van de literatuur
In overleg met de werkgroep is besloten om geen systematische zoekactie uit te voeren, maar de informatie die nodig is voor het beantwoorden van deze uitgangsvraag op niet-systematische wijze te vergaren en narratief uit te werken met behulp van de kennis en klinische expertise van de werkgroep.
Rationale van de aanbevelingen
Het is zeer onzeker of het inzetten van de adviezen binnen het fase II-hartrevalidatie bij patiënten met coronairlijden of chronisch hartfalen met een lage SES en/of beperkte gezondheidsvaardigheden, effect heeft. De werkgroep is echter wel van mening dat de mogelijke gunstige effecten van het inzetten van de adviezen overheersen, wat heeft geleid tot het formuleren van een conditionele aanbeveling.
Literatuur
Bij het niet-systematisch vergaren van informatie selecteerde de werkgroep het systematisch literatuuronderzoek van Gaalema (2017). Hij concludeert dat bij patiënten met een lage SES de toegepaste interventie ten aanzien van gedragsverandering minder succesvol lijkt. In Nederland is Pharos het landelijk expertisecentrum voor gezondheidsverschillen. De werkgroep heeft besloten om de adviezen van Pharos te betrekken bij het beantwoorden van de uitgangsvraag (De Been 2018; Landelijk expertisecentrum Pharos). De werkgroep is van mening dat het de verantwoordelijkheid is van de behandelaar om een interventie zo toe te passen dat de interventie zo goed mogelijk aansluit bij de behoeften en mogelijkheden van de patiënt.
Van bewijs naar aanbeveling
Van bewijs naar aanbeveling
Er zijn internationaal erkende criteria gehanteerd voor het beoordelen van het bewijs dat ten grondslag ligt aan de aanbevelingen. Deze criteria, evenals de overige overwegingen die de werkgroep formuleerde, bepalen de sterkte van de aanbeveling.
Gewenste en ongewenste effecten
Er is geen literatuur geselecteerd die antwoord geeft op de uitgangsvraag. Om die reden heeft de werkgroep geen balans opgemaakt tussen gewenste en ongewenste effecten.
Kwaliteit van bewijs
Er is geen literatuur geselecteerd die antwoord geeft op de uitgangsvraag. Om die reden heeft de werkgroep geen balans opgemaakt van de kwaliteit van bewijs.
Waarden en voorkeuren van patiënten
De werkgroep oordeelt dat de patiënten zeer grote waarde hechten aan het bevorderen van therapietrouw en voltooiing van de hartrevalidatie die specifiek is gericht op de individuele patiënt en dat daar weinig variatie in zit tussen patiënten.
Dit wordt ondersteund door het rapport ‘Kwaliteitscriteria hartrevalidatie. Geformuleerd vanuit patiëntenperspectief’, dat is opgesteld door De Hart&Vaatgroep binnen het programma ‘Kwaliteit in Zicht’. In dit rapport wordt beschreven dat patiëntgerichte zorg, afgestemd op de voorkeuren, mogelijkheden en behoeften van de individuele patiënt een belangrijk (vanuit de patiënt geformuleerd) kwaliteitscriterium is (Harteraad 2012).
Balans gewenste en ongewenste effecten
Er is geen literatuur geselecteerd voor het beantwoorden van de uitgangsvraag. Om die reden heeft de werkgroep geen balans opgemaakt van de gewenste en ongewenste effecten.
Sociaal-economische overwegingen en kosteneffectiviteit
De werkgroep oordeelt dat de middelen die nodig zijn voor de interventie verwaarloosbaar van omvang zijn. De interventie is waarschijnlijk wel kosteneffectief; er zijn echter geen specifieke studies die dit oordeel ondersteunen.
Gezondheidsgelijkheid
De werkgroep verwacht dat de interventie zal leiden tot een toename van gezondheidsgelijkheid.
Aanvaardbaarheid
De werkgroep verwacht dat de interventie door alle belangrijke stakeholders zal worden geaccepteerd.
Haalbaarheid
De implementatie van de werkzame elementen wordt door de werkgroep als ‘waarschijnlijk wel realistisch’ beoordeeld. De werkgroep geeft aan dat het inrichten van specifieke (transmurale) zorgpaden of trainingsgroepen voor subpopulaties binnen de huidige hartcentra een uitdaging is, met name voor kleinere instellingen. Zie ook C.6 ‘Telerevalidatie’ en C.4 ‘Het beweegprogramma in de eerste lijn’
Overige overwegingen
De werkgroep is van mening dat de volgende overwegingen ook van belang zijn om een beweegprogramma van fase II-hartrevalidatie vorm te geven om therapietrouw en het voltooien van het beweegprogramma te bevorderen bij patiënten met coronairlijden of chronisch hartfalen met een lage SES /beperkte gezondheidsvaardigheden.
- De werkgroep is van mening dat de studie van Nielsen (2013) een goed voorbeeld is van een hartrevalidatieprogramma waarin de werkzame elementen voor mensen met een lage sociaal-economische status (SES) zijn toegepast). Wel is de werkgroep van mening dat er meerdere manieren zijn waarop deze werkzame elementen toegepast kunnen worden binnen het beweegprogramma van fase II-hartrevalidatie.
- In deze studie leidde een uitgebreid hartrevalidatieprogramma gedurende vijf jaar met 508 patiënten (van wie 303 een lage SES hadden) tot hogere participatie (97,7 vs. 75% standaard hartrevalidatie; p < 0,0001). Dit uitgebreide hartrevalidatieprogramma bevatte de volgende elementen:
- een extra individueel verpleegkundig consult, waarin de patiënt een plan voor zijn postrevalidatiefase definieerde;
- een preventieoverleg met de huisarts na afloop van de hartrevalidatie, waartoe aan de huisarts van tevoren een patiëntenplan werd opgestuurd, zodat de huisarts de revalidatieperiode kon overnemen; voor het preventieoverleg wordt een half uur geadviseerd;
- een telefonisch contact op initiatief van de verpleegkundige met de patiënt vier maanden na ontslag, dit is twee maanden voor het einde van de hartrevalidatie, om te informeren naar de voortgang van de hartrevalidatie en hoe het gaat met de doelen die de patiënt zich had gesteld;
- borging van actiegerichte elementen en vaardigheidstraining ten aanzien van voeding, beweging, ontspanning en stoppen met roken tot 1,5 jaar na ziekenhuisopname.
- het advies om gepensioneerde patiënten niet-cardiaalspecifieke activiteiten in de lokale gemeenschapscentra te laten ondernemen;
- gebruik van motiverende gespreksvoering door de verpleegkundigen;
- aanmoediging van patiënten om doelen te definiëren en actieroutes te motiveren vanuit overeenstemmingsprincipes en niet vanuit nalevingsprincipes.
- aanbieden van vertolking aan patiënten die geen Deens spraken.
- De werkgroep is van mening dat bij het opstellen van een behandelplan voor patiënten de voorwaarden zoals beschreven in C.2 ‘Volhouden en voltooien van de hartrevalidatie’ bij het behandelplan betrokken moeten worden.
- De werkgroep is van mening dat het belangrijk is om gedurende de uitvoer het hartrevalidatieprogramma de behandeling te blijven monitoren. Zie hiervoor C.7 ‘Evaluatie, stopcriteria en afsluiting van de behandeling’.
- De werkgroep is van mening dat de therapeut een signalerende functie heeft in het identificeren van patiënten met een lage SES / beperkte gezondheidsvaardigheden om vervolgens de vermoedens in het multidisciplinair overleg te bespreken met het hartrevalidatieteam, zodat een aanpassing van het hartrevalidatieprogramma overwogen kan worden.
Aandachtspunten voor implementatie
De werkgroep geeft aan dat implementatie van de aanbevelingen die gevormd zijn in deze module geen extra aandacht vergen. Het is echter wel van belang dat de therapeut in staat is om patiënten met een lage SES en/of beperkte gezondheidsvaardigheden te herkennen. Dit vergt een zekere mate van bewustwording.
Kennislacunes
Er is geen systematische zoekactie uitgevoerd, waardoor de werkgroep onzeker is of er literatuur beschikbaar is over dit onderwerp. De werkgroep heeft echter wel de indruk dat er literatuur beschikbaar is over hoe je de therapietrouw en voltooiing van het beweegprogramma van fase II-hartrevalidatie bij patiënten met coronairlijden of chronisch hartfalen met een lage SES en/of beperkte gezondheidsvaardigheden bevordert.
- de Been M, van den Muijsenbergh M, Duijnhoven T. Gezondheid en kwaliteit van zorg voor iedereen. Wat maakt het verschil? Utrecht: Pharos; 2018.
- Gaalema DE, Elliott RJ, Morford ZH, Higgins ST, Ades PA. Effect of socioeconomic status on propensity to change risk behaviors following myocardial infarction: implications for healthy lifestyle medicine. Prog Cardiovasc Dis. 2017;60(1):159-68.
- Harteraad. Kwaliteit in Zicht. Kwaliteitscriteria hartrevalidatie. Geformuleerd vanuit patiëntenperspectief. De Hart & Vaatgroep; 2012. Beschikbaar via https://harteraad.nl
- Koninklijk Nederlands Genootschap voor Fysiotherapie, Mutubuki EN, van Doormaal MCM, Conijn D, Toonders S, Ostelo RWJG. KNGF-richtlijn Zelfmanagement. Amersfoort: Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF); 2022.
- Landelijk expertisecentrum Pharos. Beschikbaar via https://www.pharos.nl/
- Nielsen KM, Meillier LK, Larsen ML. Extended cardiac rehabilitation for socially vulnerable patients improves attendance and outcome. Dan Med J. 2013;60(3):A4591.
- Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM); 2022. Beschikbaar via https://www.kngf.nl/kennisplatform/richtlijnen/zelfmanagement
B.4 Anamnese
Aanbeveling
Vraag tijdens de anamnese relevante informatie uit, maar neem eerst kennis van de voor de desbetreffende patiënt relevante verwijsgegevens van de cardioloog*.
Relevante verwijsgegevens van de cardioloog
- (medische) diagnose;
- hartritme- en geleidingsstoornissen;
- wel/geen inwendige cardioverter defibrillator (ICD)a of pacemaker (type, instellingen);
- gegevens van de maximale of symptoomgelimiteerde inspanningstest (eventueel met ademgasanalyse). Zie B.6 ‘Meetinstrumenten’;
- relevante nevenpathologie;
- voorgeschiedenis (cardiaal/niet-cardiaal);
- medicatie (type en dosering);
- operatiegegevens, indien van toepassing;
- door de cardioloog relevant geachte cardiologische gegevens.
Voor coronairlijden
- gegevens over hemodynamische stabiliteit tijdens en na de behandeling van het event, de grootte en lokalisatie van het infarct, eventuele complicaties, de linkerventrikelejectiefractie (LVEF), eventuele restischemie en de status van (niet-behandelde) coronairvaten;
- percutane coronaire interventie (PCI): aantal en lokalisatie; wel/geen stent;
- omleidingsoperatie (CABG) (aantal bypasses bij CABG; methode bypassoperatie (sternotomiea, endocab, opcab); soorten bypass (veneuze/arteriële graft);
- klepoperatie (soort klep, lokalisatie klep, methode klepoperatiea) .
a.Zie B.7 ‘Indicatiestelling’ voor restricties en contra-indicaties ten aanzien van het bewegen.
Voor chronisch hartfalen
- gegevens over de ernst van het chronisch hartfalen (uitgedrukt in linkerventrikelejectiefractie (LVEF), New York Heart Association (NYHA)-klasse), de oorzaak van het chronisch hartfalen (zoals ischemische hartziekte, hypertensie, kleplijden, ritmeproblematiek), en de behandelingen;
- soort/type chronisch hartfalen: patiënten met een verminderde linkerventrikelfunctie (HFrEF; LVEF < 40%), patiënten een matige linkerventrikelfunctie (HFmREF; LVEF 41-49%) en patiënten met een behouden linkerventrikelfunctie (HFpEF; LVEF > 50%).
Relevante gegevens afkomstig van de maximale of symptoomgelimiteerde inspanningstest (eventueel met ademgasanalyse)
- de huidige (fysieke) belastbaarheid van de patiënt op grond van de maximale of symptoomgelimiteerde inspanningstest uitgedrukt in absolute waarde en normwaarde (VO2-max /MET’s/wattage);
- het gehanteerde protocol van de inspanningstest;
- de beoordeling door de arts van het elektrocardiogram (ECG) voor, tijdens en na de inspanning (criteria voor cardiale ischemie, ritme- en geleidingsstoornissen, met hiervan de praktische consequenties);
- de rusthartfrequentie, de bereikte maximale hartfrequentie, de voorspelde maximale hartfrequentie, de te verwachten maximale VO2-max of het wattage;
- het bloeddrukverloop in rust en het verloop tijdens inspanning en de herstelfase;
- de reden van beëindigen van de test (denk ook aan beweegangst);
- het medicatiegebruik (zoals een bètablokker, inclusief type en dosering);
- de (subjectieve) klachten van de patiënt tijdens de test (angina pectoris / dyspnoe) en bij voorkeur de Borgscore (6-20);
- spiro-ergometrie: gaswisselingsparameters, zoals de maximale zuurstofopname (VO2-max), het percentage van de voorspelde VO2-max, de O2-pols, het maximale ademminuutvolume (VE) (het teugvolume (VT) X de ademfrequentie), de ‘respiratory exchange rate’ (RER), de anaerobe of ventilatoire drempel, de VE/VCO2-ratio, de saturatie en eventuele andere relevante parameters (bijvoorbeeld de VO2-‘oxygen uptake efficiency slope’, en het al dan niet optreden van ademoscillaties);
- de ‘maximum voluntary ventilation’ (MVV) die eventueel van de gegenereerde gegevens kan worden afgeleid.
Zie B.6 ‘Meetinstrumenten’ voor verdere toelichting over de maximale of symptoomgelimiteerde inspanningstest (eventueel met ademgasanalyse )
Breng de volgende gegevens in kaart.
Algemeen
- Wat is de zorgvraag?
Inventarisatie van de gezondheidstoestand die heeft geleid tot het cardiale incident of de verslechtering van chronisch hartfalen
- Wat is de aanvang, de duur en het beloop van de klachten?
- Wat is de prognose en wat zijn de (cardiovasculaire) risicofactoren (bijv. inactieve leefstijl, roken, stress, inslaap- of doorslaapproblemen)?
Inventarisatie huidige status
- Is er comorbiditeit aanwezig (zoals diabetes mellitus, perifeer arterieel vaatlijden, chronic obstructive pulmonary disease (COPD))?
- Waaruit bestaat de huidige behandeling: medicijngebruik (type en dosering)/nevenbehandeling en in welke mate is die behandeling van invloed op het beweegprogramma?
- Wat is de leefsituatie van de patiënt (burgerlijke staat/sociale steun)?
- Wat is de sociale status (dagelijkse bezigheden, rol in gezin)?
- Zijn er problemen te verwachten met werkhervatting? Zie tevens de screeningsvragen in de ‘Multidisciplinaire richtlijn Hartrevalidatie 2024 (opent in nieuw tabblad)’.
- Hoe toegankelijk is het hartrevalidatieprogramma voor de patiënt?
- Wat is de informatiebehoefte van de patiënt?
Functies en anatomische eigenschappen
Inventarisatie functiestoornissen (aard en ernst) vóór het ontstaan van het cardiale incident of de verslechtering van het chronisch hartfalen.
- Wat waren de functiestoornissen (aard en ernst) vóór het ontstaan van het cardiale incident of de verslechtering van het chronisch hartfalen?
Inventarisatie huidige status
- Wat zijn de huidige stoornissen in functies die de patiënt als gevolg van het coronairlijden of het chronisch hartfalen ervaart?
Activiteiten
Inventarisatie beperkingen in activiteit (aard en ernst) vóór het ontstaan van het cardiale incident of de verslechtering van chronisch hartfalen
- Wat waren de beperkingen in activiteit (aard en ernst vóór het ontstaan van het cardiale incident of de verslechtering van het chronisch hartfalen?
- Wat was het activiteitenniveau van de patiënt vóór het ontstaan van de hartziekte?
- Wat is het beweeggedrag (heden, verleden en toekomst)?
Inventarisatie huidige status
- Wat zijn de huidige beperkingen in activiteit die de patiënt als gevolg van het coronairlijden of het chronisch hartfalen ervaart?
- Zijn er problemen op het gebied van seksualiteit?
- Onderdelen van de Patiënt Specifieke Goal-setting (PSK) methode zijn:
Stap 1 ‘Inventariseren’
Wat vindt u belangrijk, maar moeilijk om uit te voeren vanwege uw klachten?
Stap 2 ‘Prioriteren’
Noteer de voor u belangrijkste activiteiten uit stap 1.
Stap 3 ‘Scoren’
Hoe goed kunt u deze activiteiten uitvoeren? Omcirkel het cijfer (volg hierbij het format van de PSG).
Stap 4 ‘Doelen stellen’
- Wat wilt u bereiken met de therapie?
Participatie
Inventarisatie participatieproblemen (aard en ernst) vóór het ontstaan van het cardiale incident of de verslechtering van het chronisch hartfalen
- Wat waren de beperkingen in participatie (aard en ernst vóór het ontstaan van het cardiale incident of de verslechtering van het chronisch hartfalen?
- Was de patiënt betrokken in het arbeidsproces voor het ontstaan van de hartziekte?
Inventarisatie huidige status
- Wat zijn de huidige participatieproblemen die de patiënt als gevolg van het coronairlijden of chronisch hartfalen ervaart?
Externe factoren
Inventarisatie externe factoren vóór het ontstaan van het cardiale incident of de verslechtering van het chronisch hartfalen
- Welke eisen stelde de omgeving aan de patiënt vóór het ontstaan van de hartziekte?
Inventarisatie huidige status
- Welke fysieke belasting vergt het werk van de patiënt (indien van toepassing)?
- Zijn er externe drempels of barrières voor het ontwikkelen/onderhouden/hervatten van een actieve leefstijl?
Persoonlijke factoren
Inventarisatie persoonlijke factoren vóór het ontstaan van het cardiale incident of de verslechtering van het chronisch hartfalen
- Welke eisen stelde de patiënt aan zichzelf vóór het ontstaan van de hartziekte?
Inventarisatie huidige status
- Hoe ervaart de patiënt de hartziekte?
- Probeer een indruk te krijgen van de sociaal-economische status van de patiënt. Vraag naar het opleidingsniveau en het beroepsniveau.
- Probeer een indruk te krijgen van de gezondheidsvaardigheden van de patiënt.
- Probeer een indruk te krijgen van de cognitieve status van de patiënt.
- Wat zijn de gevolgen van de aandoening op het psychosociaal functioneren (bijv. surmenage, (bewegings)angst, paniekstoornis, stress, depressie)?
- Wat zijn de illness beliefs van de patiënt? (Wat mankeer ik? Hoe komt het? Persoonlijke gevolgen? Welke invloed kan ik zelf uitoefenen?)
- Zijn er drempels of barrières voor het ontwikkelen/onderhouden/hervatten van een actieve leefstijl (bijvoorbeeld psychosociale factoren)?
- Wat is de motivatie van de patiënt voor het volgen van het beweegprogramma; voor het ontwikkelen/onderhouden/hervatten van een actieve leefstijl?
- Probeer een indruk te krijgen van de digitale vaardigheden van de patiënt, bijvoorbeeld aan de hand van een QuickScan (Pharos. Landelijk expertisecentrum sociaaleconomische en etnische gezondheidsverschillen).
* De cardioloog is eindverantwoordelijk voor de hartrevalidatie, maar kan er voor kiezen om bepaalde taken over te dragen aan de hartrevalidatiecoördinator
Onderbouwing
Deze module is niet op basis van een geprioriteerd knelpunt in de richtlijn opgenomen. Iedere richtlijn van het Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF) bevat een module ‘Anamnese’.
Aanleiding
In het diagnostisch proces van het beweegprogramma van fase II-hartrevalidatie wordt gestart met een anamnese. In deze module wordt beschreven waar de anamnese uit bestaat bij patiënten met coronairlijden en/of chronisch hartfalen, op grond waarvan onderstaande uitgangsvraag is geformuleerd.
Uitgangsvraag
Waaruit bestaat de anamnese bij patiënten met coronairlijden en chronisch hartfalen met een indicatie voor het beweegprogramma van fase II-hartrevalidatie?
Rationale van de aanbeveling
In overleg met de werkgroep is besloten om geen systematische zoekactie uit te voeren, maar de informatie die nodig is voor het beantwoorden van deze uitgangsvraag op niet-systematische wijze te vergaren en narratief uit te werken, gebruik makend van de International Classification of Functioning, Disability and Health (ICF) met behulp van de kennis en klinische expertise van de werkgroep.
Daarnaast is er aangesloten op de ‘Multidisciplinaire richtlijn Hartrevalidatie 2024 (opent in nieuw tabblad)’. Aan de hand van deze screeningsvragen wordt gescreend door de hartrevalidatiecoördinator welk zorgaanbod geïndiceerd is. De therapeut heeft een signalerende functie op een aantal onderwerpen, waarna hij dit kan bespreken in het multidisciplinair hartrevalidatieteam (Revalidatiecommissie NVVC/NHS en projectgroep PAAHR 2011).
Er is geen verantwoording bij deze module.
- Pharos. Landelijk expertisecentrum sociaaleconomische en etnische gezondheidsverschillen. Quickscan digitale vaardigheden van je patiënten. Pharos, landelijk expertisecentrum sociaaleconomische en etnische gezondheidsverschillen. Beschikbaar via https://www.pharos.nl/kennisbank/quickscan-digitale-vaardigheden-van-uw-patienten/
- Nederlandse Vereniging voor Cardiologie. Multidisciplinaire richtlijn Hartrevalidatie 2024. Utrecht: Nederlandse Vereniging voor Cardiologie, 2024.
Beschikbaar via https://richtlijnendatabase.nl/richtlijn/hartrevalidatie/hartrevalidatie_-_startpagina.html
B.5 Lichamelijk onderzoek en behandelplan
Aanbevelingen
- Verzamel tijdens het lichamelijk onderzoek relevante informatie door middel van inspectie in rust, een functionele inspectie en het basisonderzoek.
- Stel, in samenspraak met de patiënt een persoonsgericht behandelplan op, op basis van: 1) de verwijsgegevens van de cardioloog*; 2) gegevens verstrekt door het multidisciplinair team en 3) de gegevens die voortkomen uit de eigen analyse.
Integreer daarin de volgende behandeldoelen.
Bij coronairlijden:
- leren kennen van eigen fysieke grenzen;
- leren omgaan met fysieke beperkingen;
- optimaliseren van het inspanningsvermogen;
- overwinnen van angst voor lichamelijke inspanning;
- ontwikkelen/onderhouden/hervatten van een lichamelijk actieve leefstijl;
- optimaliseren van werkhervatting (indien van toepassing).
Bij chronisch hartfalen:
Specifieke doelen
- optimaliseren van het inspanningsvermogen;
- afstemmen van de belasting in relatie tot de belastbaarheid;
- verminderen van vermoeidheid, kortademigheid en inactiviteit.
Algemene doelen
- leren kennen van eigen fysieke grenzen;
- leren omgaan met fysieke beperkingen;
- overwinnen van angst voor lichamelijke inspanning;
- het ontwikkelen/onderhouden/hervatten van een lichamelijk actieve leefstijl;
- optimaliseren van werkhervatting (indien van toepassing).
* De cardioloog is eindverantwoordelijk voor de hartrevalidatie, maar kan kan er voor kiezen om bepaalde taken over te dragen aan de hartrevalidatiecoördinator.
Onderbouwing
Deze module is niet op basis van een geprioriteerd knelpunt in de richtlijn opgenomen. Iedere richtlijn van het Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF) bevat een module ‘Lichamelijk onderzoek en behandelplan’.
Aanleiding
In het diagnostisch proces van het beweegprogramma van fase II-hartrevalidatie volgt na de anamnese, het lichamelijk onderzoek en het behandelplan. In deze module wordt beschreven waar deze uit bestaan bij patiënten met coronairlijden en chronisch hartfalen, waartoe de volgende uitgangsvragen zijn geformuleerd:
Uitgangsvragen
- Waaruit bestaat het lichamelijk onderzoek bij patiënten met een indicatie voor een beweegprogramma van fase II-hartrevalidatie?
- Hoe worden het behandelplan en de bijbehorende behandeldoelen bij patiënten met een indicatie voor een beweegprogramma van fase II-hartrevalidatie opgesteld?
Rationale van de aanbeveling
In overleg met de werkgroep is besloten om geen systematische zoekactie uit te voeren, maar de informatie die nodig is voor het beantwoorden van deze uitgangsvraag op niet-systematische wijze te vergaren en narratief uit te werken met behulp van de kennis en klinische expertise van de werkgroep.
Toelichting
Lichamelijk onderzoek
Het lichamelijk onderzoek is gericht op het in kaart brengen van de stoornissen in functies, beperkingen in activiteiten, participatieproblemen en gezondheidsproblemen, die de keuze van bewegingsactiviteiten in het beweegprogramma bepalen.
De therapeut analyseert de uitvoering van problematische activiteiten die in de anamnese naar voren zijn gekomen. Er wordt nagegaan welke domeinen essentieel zijn voor de gewenste beweegactiviteiten, en op welke wijze en op welk niveau deze domeinen kunnen worden aangesproken. Hierbij maakt de therapeut een inschatting van de mate waarin de prestatie bij een beweegactiviteit verband houdt met het domein.
Behandelplan en behandeldoelen
De therapeut verzamelt de relevante informatie door de gegevens vanuit de anamnese en het lichamelijk onderzoek te bundelen. Vervolgens brengt de therapeut het behandelplan in kaart.
De gegevens die nodig zijn voor het opstellen van het behandelplan worden deels verstrekt door het multidisciplinair team, verwijsgegevens van de cardioloog* en komen deels voort uit eigen analyse. Op basis van de informatie uit de anamnese en het lichamelijk onderzoek stelt de therapeut in samenspraak met de patiënt een persoonsgericht behandelplan op (inclusief behandeldoelen).
Bij een indicatie voor het beweegprogramma worden meerdere individuele hartrevalidatiedoelen nagestreefd. Deze doelen maken deel uit van de ‘Multidisciplinaire richtlijn hartrevalidatie 2024 (opent in nieuw tabblad) ’ (NVVC).
In de volgende tabellen worden de individuele hartrevalidatiedoelen beschreven die met een beweegprogramma kunnen worden nagestreefd.
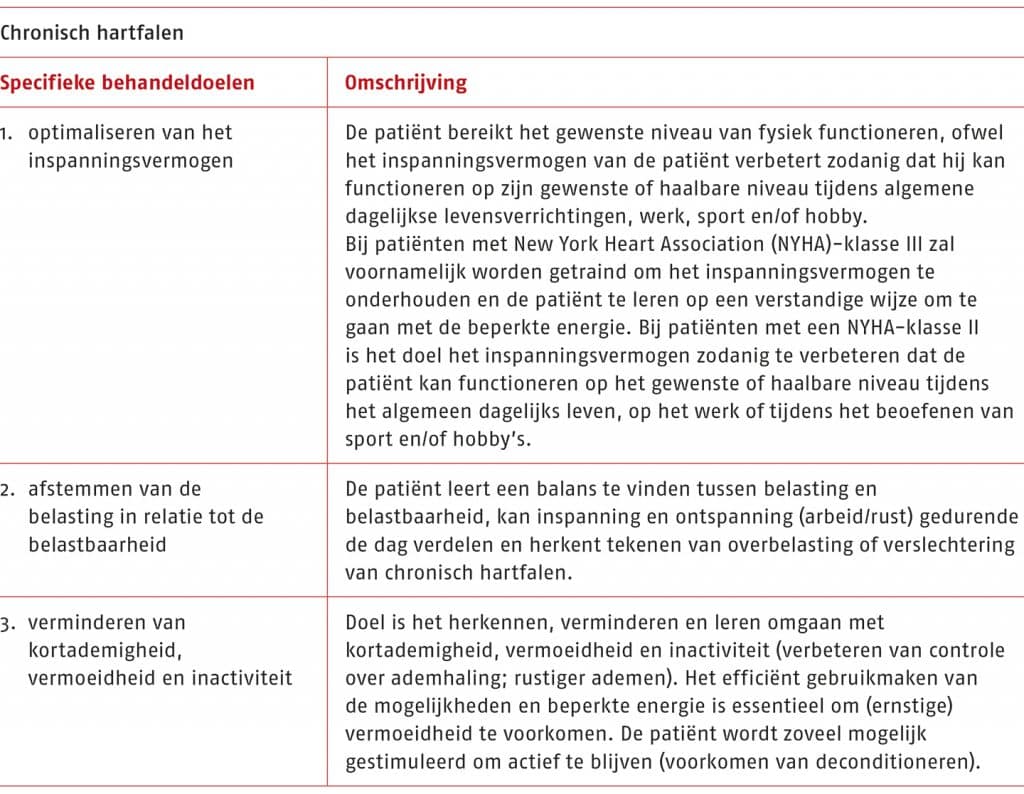
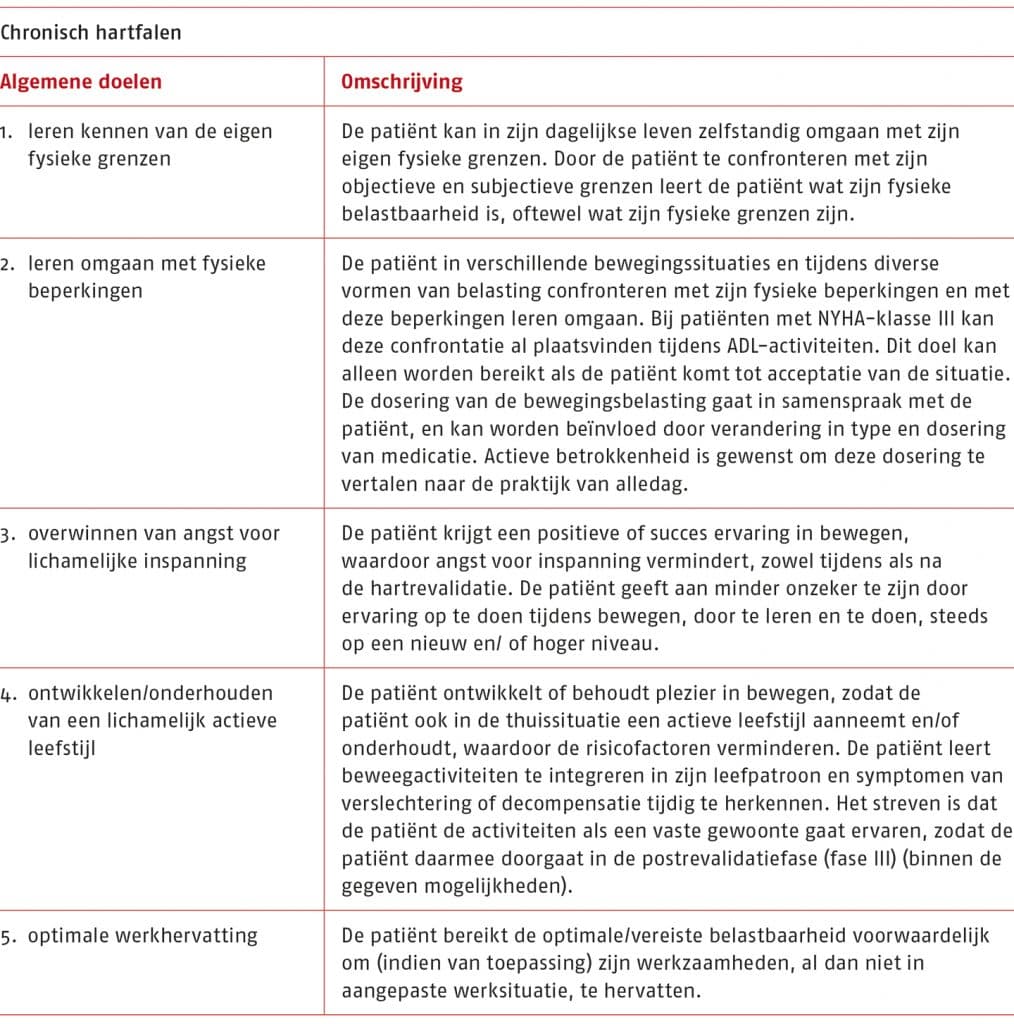
Tijdens het beweegprogramma worden (indien mogelijk) vaak ook de doelen ondersteund die andere disciplines nastreven, zoals ‘het herwinnen van het emotionele evenwicht’ en ‘op een functionele manier leren omgaan met de hartziekte’.
Bij bijna alle patiënten wordt een combinatie van doelen nagestreefd. Als ‘verbetering van het inspanningsvermogen’ niet of onvoldoende haalbaar wordt geacht, komt in ieder geval ‘het leren kennen van de eigen fysieke grenzen’ en ‘het leren omgaan met fysieke beperkingen’ in aanmerking. Bij deze doelen is zelfmanagement van groot belang.
Als het gestelde doel ‘het verbeteren van het inspanningsvermogen’ haalbaar is, worden de doelen ‘het leren kennen van de eigen fysieke grenzen’ en/of ‘het optimaliseren van het inspanningsvermogen’ nagestreefd.
Om optimalisatie van het inspanningsvermogen te kunnen nastreven, moet eerst de trainingsintensiteit worden vastgesteld. Deze stelt de therapeut bij voorkeur vast op basis van de uitkomsten van de maximale of symptoomgelimiteerde inspanningstest (eventueel met ademgasanalyse). In de ‘Multidisciplinaire richtlijn Hartrevalidatie 2024 (opent in nieuw tabblad)’ wordt beschreven op basis van welke overwegingen een maximale of symptoomgelimiteerde inspanningstest (eventueel met ademgasanalyse) wordt afgenomen (NVVC). De therapeut houdt bij het bepalen van de trainingsintensiteit ook rekening met de fysieke belemmeringen voor het vergroten van de belastbaarheid, andere (interne en externe) factoren die het natuurlijke vermogen tot aanpassing van de belastbaarheid op een negatieve manier beïnvloeden en persoonlijke trainingsdoelen.
Indien sprake is van een subjectieve vermindering van het inspanningsvermogen kan de behandeling gericht zijn op ‘het leren kennen van de eigen fysieke grenzen’, ‘het overwinnen van angst voor inspanning’ en ‘het ontwikkelen/onderhouden van een lichamelijke actieve leefstijl’. ‘Het leren kennen van de eigen fysieke grenzen’ en ‘het ontwikkelen/onderhouden van een lichamelijke actieve leefstijl’ worden veelal als eerste nagestreefd. Patiënten moeten immers hun angst voor inspanning overwinnen en hun grenzen leren kennen, voordat ze trainbaar zijn.
Een aanzet geven tot het ontwikkelen van een lichamelijk actieve leefstijl is bij vrijwel alle patiënten van belang. Al tijdens de hartrevalidatie krijgt de patiënt het advies om te starten met het zelfstandig bewegen of sporten.
Werkhervatting is een belangrijk doel bij de hartrevalidatie; al tijdens de revalidatie wordt de patiënt gestimuleerd het werk gedeeltelijk te hervatten in samenspraak met de bedrijfsarts. De therapeutische zorg is gericht het in kaart brengen van de fysieke belastbaarheid, het opheffen van eventuele (fysieke) beperkingen die werkhervatting in de weg staan en het adviseren over (mogelijke) werkaanpassingen die werkhervatting optimaliseren.
De behandeldoelen moeten bij aanvang van het behandelprogramma zo concreet mogelijk worden geformuleerd. Bijvoorbeeld het doel ‘overwinnen van angst voor inspanning’ wordt bij voorkeur gespecificeerd als ‘de patiënt fietst weer alleen op straat’ of ‘de patiënt is weer seksueel actief’.
Specifieke behandeldoelen bij chronisch hartfalen
De specifieke behandeldoelen voor patiënten met chronisch hartfalen gelden voor alle chronisch- hartfalenpatiënten. Bij het nastreven van de specifieke doelen moet rekening worden gehouden met de algemene doelen. De algemene doelen 1 en 2 moeten bijvoorbeeld leiden tot het efficiënt afstemmen van de relatie tussen belasting en belastbaarheid.
Als het subjectieve inspanningsvermogen is verminderd, is de behandeling gericht op behandeldoel 1 en/of 3. De problemen zoals aangegeven in die doelen zijn vaak het eerste aangrijpingspunt. Om trainbaar te zijn en verdere deconditionering te voorkomen, zal de patiënt bijvoorbeeld eerst zijn angst voor inspanning moeten overwinnen en zijn grenzen leren kennen.
Het verbeteren van het inspanningsvermogen is niet altijd haalbaar bij patiënten met chronisch hartfalen (vooral NYHA klasse III-IV). Uit onderzoek blijkt dat bij een substantieel deel van de hartfalenpatiënten de VO2-piek niet toeneemt door training (Kemps 2008; Wilson 1996). Het doel kan ook het verbeteren van het volhouden van (sub)maximale inspanningsvermogen zijn of het onderhouden van het huidige inspanningsvermogen om deconditioneren te voorkomen.
Een aanzet geven tot het ontwikkelen van een actieve leefstijl is altijd een belangrijk doel. De therapeut leert de patiënt tijdens de training om tekenen van overbelasting en symptomen van decompensatie te herkennen.
* De cardioloog is eindverantwoordelijk voor de hartrevalidatie, maar kan er voor kiezen om bepaalde taken over te dragen aan de hartrevalidatiecoördinator.
Er is geen verantwoording bij deze module.
- Kemps HM, Schep G, de Vries WR, Schmikli SL, Zonderland ML, Thijssen EJ, Wijn PF, Doevendans PA. Predicting effects of exercise training in patients with heart failure secondary to ischemic or idiopathic dilated cardiomyopathy. Am J Cardiol. 2008;102(8):1073-8.
- Nederlandse Vereniging voor Cardiologie. Multidisciplinaire richtlijn Hartrevalidatie 2024. Utrecht: Nederlandse Vereniging voor Cardiologie, 2024.
- Wilson JR, Groves J, Rayos G. Circulatory status and response to cardiac rehabilitation in patients with heart failure. Circulation. 1996;94(7):1567-72.
B.6 Meetinstrumenten
Aanbevelingen
- Neem de Patiënt Specifieke ‘Goal-setting’ methode (PSG) af bij alle patiënten voor het diagnosticeren, monitoren en evalueren van de therapeutische behandeling, tenzij er een patiëntspecifieke aanleiding is om dit niet te doen.
- Vraag, indien deze nog niet in bezit zijn, de uitkomsten van de maximale of symptoomgelimiteerde inspanningstest (eventueel met ademgasanalyse) op bij cardioloog*.

- Neem de optionele meetinstrumenten af als er een patiëntspecifieke aanleiding is om het domein in kaart te brengen en/of relevant is voor het bereiken van het individuele hartrevalidatiedoel(en) van de patiënt.
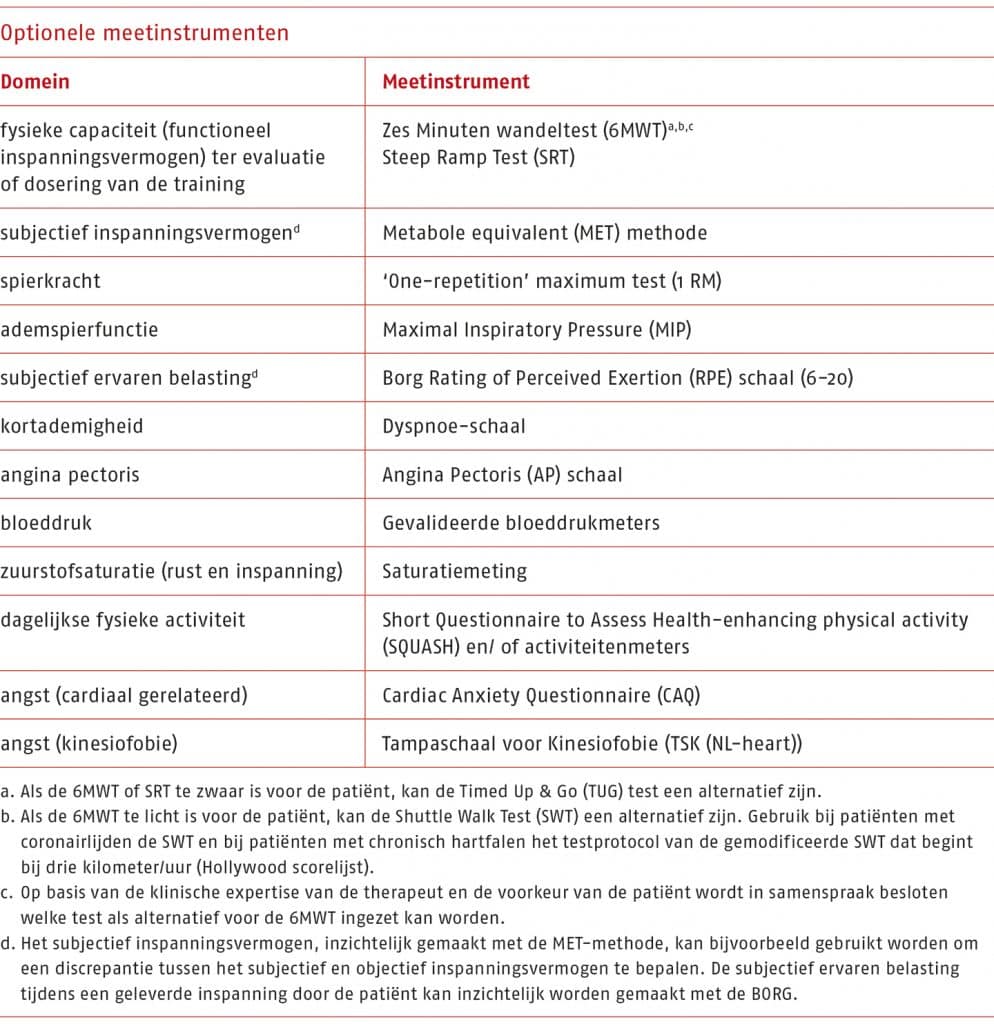
* De cardioloog is eindverantwoordelijk voor de hartrevalidatie, maar kan er voor kiezen om bepaalde taken over te dragen aan de hartrevalidatiecoördinator.
Onderbouwing
Deze module is niet op basis van een geprioriteerd knelpunt in de richtlijn opgenomen. Iedere richtlijn van het Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF) bevat een module ‘Meetinstrumenten’.
Aanleiding
In het diagnostisch proces van het beweegprogramma van fase II-hartrevalidatie wordt gestart met een anamnese en lichamelijk onderzoek. Hierbij wordt gebruikgemaakt van meetinstrumenten. In deze module wordt beschreven welke meetinstrumenten bij patiënten met coronairlijden en chronisch hartfalen worden gebruikt, op grond waarvan onderstaande uitgangsvraag is geformuleerd.
Uitgangsvraag
Welke meetinstrumenten brengen de domeinen van de ‘International Classification of Functioning Disability and Health’ (ICF) (namelijk: functies en anatomische eigenschappen, activiteiten, participatie, persoonlijke factoren) en individuele fysieke revalidatiedoelen het beste in kaart (aanbevolen en optionele meetinstrumenten) bij patiënten met coronairlijden of chronisch hartfalen?
Conclusies op basis van de literatuur
Voor het beantwoorden van de uitgangsvraag zijn op systematische wijze de vigerende Nederlandse en Europese richtlijnen binnen de hartrevalidatie geraadpleegd. Aanvullend is een niet-systematisch literatuuronderzoek verricht.
De werkgroep oordeelt dat – onderverdeeld naar ICF-domein – de volgende domeinen relevant zijn:
- functies en anatomische eigenschappen: maximaal inspanningsvermogen, fysieke capaciteit (functioneel inspanningsvermogen), subjectief inspanningsvermogen, spierkracht, ademspierfunctie, subjectief ervaren fysieke belasting, vermoeidheid, dyspnoe, angina pectoris, bloeddruk, zuurstofsaturatie;
- activiteiten en participatie: activiteiten en participatie tijdens het algemeen dagelijks leven (ADL), fysieke activiteiten;
- externe factoren: geen;
- persoonlijke factoren: angst.
Rationale van de aanbeveling
Deze vraag is beantwoord door de aanbevolen en optionele meetinstrumenten te beschrijven die tijdens het diagnostisch en therapeutisch proces ingezet kunnen worden. Hierbij is het ‘Raamwerk Klinimetrie voor evidence-based products’ gebruikt (Swinkels 2016). De informatie is op niet-systematische wijze verkregen en narratief uitgewerkt met behulp van de kennis en klinische expertise van de werkgroep.
Maximaal inspanningsvermogen
Maximale of symptoomgelimiteerde inspanningstest (eventueel met ademgasanalyse)
Op indicatie van de cardioloog wordt de maximale of symptoomgelimiteerde inspanningstest uitgevoerd, eventueel gecombineerd met ademgasanalyse (spiro-ergometrie) (Revalidatiecommissie NVVC/NHS en projectgroep PAAHR 2011). Deze test wordt afgenomen door een arts, of door een opgeleid professional onder supervisie van een arts en wordt beschouwd als gouden standaard om het maximaal inspanningsvermogen te objectiveren. De inspanningstest wordt veelal diagnostisch ingezet en idealiter gecombineerd met een test voor de evaluatie van de fysieke capaciteit (functioneel inspanningsvermogen). Zie verderop.
Uit de maximale of symptoomgelimiteerde inspanningstest volgt de maximale inspanningscapaciteit van de patiënt in maximaal inspanningsvermogen (in watt). Het inspanningsvermogen kan ook worden uitgedrukt in een percentage van het voorspelde vermogen en eventueel kan het worden omgerekend in MET’s (MET staat voor ‘metabolic equivalent of task’).
Tijdens de maximale of symptoomgelimiteerde inspanningstest worden de volgende fysiologische parameters bepaald: de bereikte maximale hartfrequentie, het bloeddrukverloop, de Borgscore (6-20) en de uitslag van het inspanningselektrocardiogram. Op indicatie van de cardioloog wordt de maximale of symptoomgelimiteerde inspanningstest gecombineerd te worden met ademgasanalyse (spiro-ergometrie).
Vanuit de ademgasanalyse kan de piek van het volume aan zuurstof (VO2-piek) worden bepaald. Daarnaast kan een specifiek submaximaal inspanningsvermogen worden ingeschat door de ventilatoire drempel te bepalen. Bovendien kan een indruk worden verkregen van de ademefficiëntie en het eventueel bestaan van ademinefficiëntie (VE/VCO2-slope, oftewel de ‘oxygen uptake efficiency slope’ en ademoscillaties) of aanwijzingen voor pathologie (chronic obstructive pulmonary disease’ (COPD)).
Ook is het mogelijk om vanuit fysiologische parameters een indruk te krijgen van de reden dat een test wordt beëindigd of afgebroken en wat de mogelijke oorzaak (pulmonaal, cardiaal of perifeer) van de inspanningsbeperking is. Ten slotte is het mogelijk om een indruk te krijgen van de angst voor bewegen..
Er zijn meerdere protocollen voor de maximale of symptoomgelimiteerde inspanningstest, die verschillen in uitvoering (lopen of fietsen), maar ook in duur, belastingsblokken, progressie van de belasting, de manier waarop de intensiteit wordt verhoogd, wattage, snelheid en percentage van de helling.
Fysieke capaciteit (functioneel inspanningsvermogen)
Voor het objectiveren van het functioneel inspanningsvermogen zijn de Zes Minuten Wandeltest (6MWT) de Shuttle Walk Test (SWT), de Steep Ramp Test (SRT) of de Timed Up & Go (TUG) test beoordeeld. Deze vier tests correleren goed met de maximale of symptoomgelimiteerde inspanningstest (eventueel met ademgasanalyse) en zijn reproduceerbaar en goed uitvoerbaar voor de patiënt en therapeut. De veiligheid van de SRT is niet op grote schaal onderzocht.
Subjectief inspanningsvermogen
Aan de hand van de MET-methode en/of de Specific Activity Scale (SAS) kan de therapeut inschatten of een discrepantie tussen feitelijk en gewenst prestatievermogen met een adequaat beweegprogramma van fase II-hartrevalidatie te ondervangen is. De MET-methode kent een goede validiteit en betrouwbaarheid. De validiteit van de SAS is niet onderzocht, wel is de betrouwbaarheid goed bij hartpatiënten. Aan de hand van het metabole equivalent wordt de patiënt geclassificeerd.
Spierkracht
Voor het inventariseren en evalueren van kracht-gerelateerde beperkingen zijn de Handheld Dynomometer (HDD) en de ‘One-repetition’ maximum test (1RM) geanalyseerd. De validiteit, inclusief de differentiatie tussen lage en hoge spierkracht van de 1RM en van een submaximale variant daarvan is lager dan die van de objectievere methoden, zoals de HHD. Er zijn normwaarden en referentieformules beschikbaar voor de HHD-meting. Er zijn geen normwaarden voor de 1RM-tests en de gemeten waarden zijn in sterke mate afhankelijk van de gebruikte apparatuur, waardoor deze tests niet diagnostisch gebruikt kunnen worden.
Ademspierfunctie
Een ‘Maximal Inspiratory Pressure’ (MIP) meting kan met een ademspierfunctiemeter betrouwbaar worden bepaald als drie herhalingen minder dan 10% van elkaar verschillen. Deze meting wordt bij patiënten met coronairlijden en een ventilatoire beperking (bijvoorbeeld na een bypassoperatie of bij ‘chronic obstructive pulmonary disease’ (COPD)) of chronisch hartfalen aanbevolen.
Subjectief maat voor geleverde inspanning
De ‘Borg Rating of Perceived Exertion’ (RPE) schaal (6-20) kan worden gebruikt om de subjectief ervaren belasting van een beweegactiviteit door de patiënt te monitoren. De Borgschaal is betrouwbaar en kan helpen bij het inschatten van bijvoorbeeld de ervaren inspanning, de belastingsgraad en de mate van vermoeidheid van de hartpatiënt.
Kortademigheid
Met de Dyspnoeschaal kan de gewaarwording van kortademigheid worden gekwantificeerd. Kortademigheid is een vaak gehoorde klacht bij patiënten met chronisch hartfalen of patiënten met als comorbiditeit COPD. Als er kortademigheid optreedt, kan deze schaal tijdens training worden ingezet. De patiënt kan in vier graden aangeven in welke mate hij de klachten ervaart. Bij iedere graad wordt een beschrijving gegeven.
Angina pectoris
De Angina Pectoris (AP) schaal is praktisch goed bruikbaar gebleken en kan worden ingezet om te monitoren of er klachten zijn die het gevolg zijn van (rest)ischemie van de hartspier.
Bloeddruk
Voor het monitoren van de bloeddruk, in rust of tijdens inspanning zijn diverse gevalideerde bloeddrukmeters in omloop. De digitale bloeddrukmeters zijn makkelijk in gebruik.
Zuurstofsaturatie
Bij patiënten met een ventilatiebeperking kan het meten van de zuurstofsaturatie (SpO2) geïndiceerd zijn, zoals patiënten met coronairlijden en COPD of patiënten met chronisch hartfalen (met COPD). De vingersaturatiemeter is betrouwbaar en handig in gebruik.
Activiteiten en participatie in ADL
Voor het meten van activiteiten en participatie in ADL zijn de Patiënt Specifieke Klachten (PSK) en de Patiënt Specifieke ‘Goal-setting’ methode (PSG) beoordeeld op hanteerbaarheid en klinimetrische kwaliteit. De PSK is eenvoudig in gebruik. Afname neemt niet veel tijd in beslag, vraagt nagenoeg geen aanvullende expertise of ervaring van de therapeut en vergt bovendien minimale inspanning van de patiënt. De PSG is de vernieuwde versie van de PSK. De PSG is vooral geschikt om samen met de patiënt revalidatiedoelen op te stellen. Voor juiste toepassing van het instrument in de praktijk is scholing noodzakelijk. Naar de validiteit, responsiviteit en reproduceerbaarheid van de Nederlandse versie van de PSK is geen onderzoek gedaan bij hartpatiënten. Bij patiënten met artrose van de heup of knie is de Engelse variant valide, betrouwbaar en responsief bevonden. Er is geen onderzoek bekend naar de klinimetrische kwaliteit van de PSG.
Fysieke activiteit
Voor het in kaart brengen van het beweeggedrag zijn de Nederlandse Norm Gezond Bewegen (NNGB) vragenlijst, de ‘International Physical Activity Questionnaire’ (IPAQ), de ‘Short Questionnaire to Assess Health-enhancing physical activity’ (SQUASH) en een ‘Assessment of Physical Activity and Energy Expenditure’ (PAEE) beoordeeld. Het objectiveren van het beweeggedrag van hartpatiënten is niet ideaal met vragenlijsten, maar lijkt het best uitvoerbaar met de SQUASH. Er is steeds meer onderzoek naar de klinimetrische kwaliteit van activiteitenmeters om PAEE in kaart te brengen, zoals applicaties op smartphones. Toch lijken de onnauwkeurigheid, beperkte klinische validiteit, een gebrek aan gestandaardiseerd regelgevend beleid en bezorgdheid over de privacy van patiënten nog steeds de wijdverbreide toepassing van slimme draagbare technologieën in de klinische praktijk te beperken. Daarentegen is gebruiksvriendelijkheid en het maatschappelijk draagvlak voor activiteitenmeters, zoals stappentellers, aanwezig, en heeft deze ontwikkeling potentie om bij te dragen aan het beweeggedrag van de hartpatiënt.
Angst (cardiaal en bewegen)
Voor het meten van angst zijn de ‘Hospital Anxiety and Depression Scale’ (HADS), de ‘Cardiac Anxiety Questionnaire’ (CAQ) en de Tampaschaal voor Kinesiofobie (TSK NL-heart) beoordeeld op hanteerbaarheid en klinimetrische kwaliteit. De HADS en TSK NL-heart hebben een goede validiteit, reproduceerbaarheid en responsiviteit en zijn goed hanteerbaar voor de patiënt en therapeut. De CAQ heeft een goede validiteit en reproduceerbaarheid, echter de afkapwaarden en responsiviteit zijn onbekend.
Literatuur
Voor het beantwoorden van de uitgangsvraag zijn op systematische wijze de vigerende Nederlandse en Europese richtlijnen binnen de hartrevalidatie geraadpleegd. De prioritering van de meetinstrumenten staat beschreven in stap 3. Daarnaast is aanvullend een niet-systematisch literatuuronderzoek uitgevoerd.
In de richtlijn wordt onderscheid gemaakt tussen (een) aanbevolen meetinstrument(en) en optionele meetinstrumenten.
De gevonden literatuur is geanalyseerd volgens de methodiek van het ‘Raamwerk Klinimetrie voor evidence-based products’ (Swinkels 2016). In dit raamwerk wordt een stappenplan beschreven waarmee in acht stappen via een iteratief proces doelgericht proces, meetinstrumenten kunnen worden geselecteerd.
Het betreft de volgende stappen:
- Stap 1 Wat wil je meten?
- Stap 2 Waarom wil je meten?
- Stap 3 Met welk soort meetinstrument wil je meten?
- Stap 4 Hoe vind je een meetinstrument?
- Stap 5 Wat is de hanteerbaarheid?
- Stap 6 Wat is de klinimetrische kwaliteit?
- Stap 7 Zijn er normwaarden beschikbaar?
- Stap 8 Hoe bereken en interpreteer je de gegevens?
Stap 1 ‘Wat wil je meten?’
In het kader van persoonsgerichte zorg dient bij de keuze van meetinstrumenten rekening te worden gehouden met het taalbegrip of de cognitie van de patiënt, maar ook met zijn fysieke belastbaarheid.
De volgende relevante domeinen zijn geformuleerd, onderverdeeld naar de ‘International Classification of Functioning Disability and Health’ (ICF):
- functies en anatomische eigenschappen: maximaal inspanningsvermogen, fysieke capaciteit (functioneel inspanningsvermogen), spierkracht, ademspierfunctie, subjectief ervaren maat voor geleverde inspanning, dyspnoe, angina pectoris, bloeddruk, zuurstofsaturatie;
- activiteiten en participatie: activiteiten en participatie tijdens het algemeen dagelijks leven (adl) en fysieke activiteiten;
- externe factoren: geen;
- persoonlijke factoren: angst.
Stap 2 ‘Waarom wil je meten?’
Alle genoemde domeinen in stap 1 kunnen met zowel een diagnostisch doel als een evaluatief doel (inclusief monitoren) gemeten worden. Hierbij staat de evaluatie van de individuele hartrevalidatiedoelen centraal. Er zijn geen domeinen die expliciet met een prognostisch doel worden gemeten. De maximale of symptoomgelimiteerde inspanningstest wordt veelal diagnostisch ingezet en idealiter gecombineerd met een test voor de evaluatie van de fysieke capaciteit (functioneel inspanningsvermogen). Op deze wijze kan de therapeut de dosering van de training instellen en het effect van de training evalueren.
Stap 3 ‘Met welk soort meetinstrument wil je meten?’
In bijlage B.6-1 (opent in nieuw tabblad) staan de meetinstrumenten uit relevante Nederlandse hartrevalidatierichtlijnen en richtlijnen en ‘position statements’ van de European Society of Cardiology (ESC). In bijlage B.6.-2 (opent in nieuw tabblad) staan meetinstrumenten per individueel revalidatiedoel, beschreven door Achttien en Vromen (2015) (Achttien 2015). Deze meetinstrumenten zijn grotendeels gebaseerd op de prioritering die is beschreven in bijlage B.6-1 (opent in nieuw tabblad). De werkgroep heeft besloten de meetinstrumenten uit deze bijlagen te analyseren, en aan te vullen met een analyse van meetinstrumenten die zijn gevonden middels een narratieve zoektocht per domein in verschillende databanken.
Uit dit aanvullend literatuuronderzoek zijn de volgende meetinstrumenten naar voren gekomen:
- de ‘Patient Specific Goal setting’ (PSG) methode;
- de Tampaschaal voor Kinesiofobie (TSK NL-heart) en de ‘Cardiac Anxiety Questionnaire’ (CAQ);
- de ‘Steep Ramp Test’ (SRT);
- de ‘Short Questionnaire to Assess Health-enhancing physical activity’ (SQUASH).
Maximaal inspanningsvermogen
Het inspanningsvermogen kan worden geobjectiveerd als maximaal en als functioneel inspanningsvermogen. Voor het objectiveren van het maximale inspanningsvermogen wordt de maximale of symptoomgelimiteerde inspanningstest (eventueel met ademgasanalyse) aanbevolen. Op indicatie van de cardioloog wordt de maximale of symptoomgelimiteerde inspanningstest uitgevoerd, eventueel gecombineerd met ademgasanalyse (spiro-ergometrie) (Revalidatiecommissie NVVC/NHS en projectgroep PAAHR 2011).
Fysieke capaciteit (functioneel inspanningsvermogen)
Voor het objectiveren van het functioneel inspanningsvermogen is een analyse uitgevoerd van de Zes Minuten Wandeltest (6MWT) (Du 2009), de (gemodificeerde) ‘Shuttle Walk Test’ (SWT) (Morales 1999), de Steep Ramp Test (SRT) (Meyer 1996), en bij ouderen (Bellet 2013) en laagbelastbare patiënten met chronisch hartfalen (Hwang 2016) de ‘Timed Up & Go’ test (TUG).
Subjectief inspanningsvermogen
Voor het inschatten van het subjectief inspanningsvermogen zijn de metabole equivalent (MET) methode (Ainsworth 2011, 1993) en/of de Specific Activity Scale (SAS) (Goldman 1981) geanalyseerd.
Spierkracht
Om de spierkracht te objectiveren, zijn de ‘Hand-Held dynamometer’ (HHD), de ‘One-repetition’ maximumtest (1RM), en de 6RM of de 10RM submaximaaltest geanalyseerd.
Ademspierfunctie
Om de ademspierfunctie bij patiënten met chronisch hartfalen te objectiveren, is de ‘Maximal Inspiratory Pressure’ (MIP) geanalyseerd.
Subjectieve maat voor geleverde inspanning
Om subjectief ervaren maat voor geleverde inspanning tijdens training te objectiveren, is de Borgschaal RPE (6-20) ‘Vermoeidheid’ geanalyseerd (Borg 1982).
Kortademigheid
Om kortademigheid in kaart te brengen is de Dyspnoe-schaal geanalyseerd (Roitman 2001).
Angina pectoris
Om cardiale (rest)ischemie in te schatten is de Angina Pectoris (AP) schaal geanalyseerd (Christensen 2006).
Bloeddruk
Om de bloeddruk te meten zijn verschillende bloeddrukmeters geanalyseerd.
Zuurstofsaturatie
Bij patiënten met een ventilatiebeperking kan het meten van de zuurstofsaturatie (SpO2) geïndiceerd zijn, zoals patiënten met coronairlijden en COPD als comorbiditeit of patiënten met chronisch hartfalen (met COPD). Door de SpO2 te bepalen kan worden besloten om de training te starten, de intensiteit gedurende de inspanning aan te passen of de inspanning te stoppen. Ook wordt de SpO2 gemeten om het herstel van de saturatie na inspanning te bepalen. De transcutane niet-invasieve meting van de SpO2 via een vinger, oorlel of het voorhoofd met een saturatiemeter is geanalyseerd (Garvey 2016).
Activiteiten en participatie in ADL
Om activiteiten en participatie in ADL te objectiveren, zijn de Patiënt Specifieke Klachten (PSK) en de (Patiënt Specifieke Goal-setting methode (PSG) geanalyseerd.
Fysieke activiteit
Om het beweeggedrag te objectiveren zijn activiteitenmeters en de volgende vragenlijsten geanalyseerd: de Nederlandse Norm Gezond Bewegen (NNGB) vragenlijst / TNO-monitor, de ‘International Physical Activity Questionnaire’ (IPAQ), de ‘Short Questionnaire to Assess Health-enhancing physical activity’ (SQUASH) en de ‘Assessment of Physical Activity and Energy Expenditure’ (PAEE).
Angst (cardiaal en bewegingsangst)
Om angst te objectiveren, zijn de ‘Hospital Anxiety and Depression Scale’ (HADS), de ‘Cardiac Anxiety Questionnaire’ (CAQ) en de Tampaschaal voor Kinesiofobie (TSK NL-heart) geanalyseerd.
Stap 4 ‘Hoe vind je een meetinstrument?’
Alle genoemde meetinstrumenten in deze richtlijn zijn beschikbaar, of kunnen beschikbaar gesteld worden, via www.meetinstrumentenzorg.nl.
Stap 5 ‘Wat is de hanteerbaarheid?’
Maximaal inspanningsvermogen
De maximale of symptoomgelimiteerde inspanningstest (eventueel met ademgasanalyse) is betrouwbaar in het bepalen van het maximaal inspanningsvermogen. Op indicatie van de cardioloog wordt de maximale of symptoomgelimiteerde inspanningstest uitgevoerd, eventueel gecombineerd met ademgasanalyse (spiro-ergometrie). De indicaties worden beschreven in de ‘Multidisciplinaire richtlijn Hartrevalidatie 2024 (opent in nieuw tabblad) ’ (NVVC).
Fysieke capaciteit (functioneel inspanningsvermogen)
De 6MWT is een simpele test die bij hartpatiënten kan worden ingezet om het submaximale inspanningsvermogen te bepalen (Du 2009; Pollentier 2010). De 6MWT is een ‘self-paced’ test en is in Nederland in de praktijk de meest gebruikte test. De test wordt als goed hanteerbaar beschouwd.
De SWT is een submaximale inspanning test die gebruikt kan worden om de functionele capaciteit of inspanningstolerantie van hartpatiënten te bepalen (Keell 1998; Morales 1999, 2000). De SWT heeft vaak de voorkeur bij patiënten die van zichzelf al een hogere loopsnelheid hebben. De gemodificeerde SWT is gevalideerd bij hartpatiënten, en vangt aan met een startloopsnelheid van 3,0 km/h (kilometer per uur). Deze startsnelheid is niet haalbaar voor alle patiënten met chronisch hartfalen. Om die reden kan ook worden gekozen voor het protocol dat start met een loopsnelheid van 1,8 km/h. De keuze van de startsnelheid ligt bij de patiënt in overleg met de therapeut (wel dient deze snelheid bij de voor- en nameting hetzelfde te zijn).
De SRT is een korte maximale inspanningstest op een geijkte fietsergometer om de aerobe capaciteit te meten. De belasting wordt tijdens deze test in een korte tijd snel opgevoerd (standaard 25 W/10 sec.) tot uitputting van de patiënt (Meyer 1996). Vanuit het testresultaat kan een schatting worden verkregen van de VO2-max (maximale zuurstofopname) en de Wmax (maximale inspanningsvermogen) zoals gemeten bij een reguliere maximale of symptoomgelimiteerde inspanningstest (eventueel met ademgasanalyse), met behulp van een regressievergelijking. Deze test kan worden gebruikt om de trainingsintensiteit te bepalen. Echter, onderzoek van voldoende kwaliteit naar de veiligheid bij hartpatiënten is niet uitgevoerd.
De TUG is praktisch en simpel uit te voeren en dient twee keer te worden herhaald (Mesquita 2016). Het meetinstrument is ADL-specifiek en kan gebruikt worden om functioneel inspanningsvermogen te meten indien andere inspanningstesten niet mogelijk zijn, bijvoorbeeld vanwege beperkte belastbaarheid bij kwetsbare ouderen (Bellet 2013) en bij patiënten met chronisch hartfalen (Hwang 2016) of bijvoorbeeld in de thuissituatie (Mesquita 2016). Ook geeft de TUG inzicht in de activiteiten ‘opstaan uit een stoel’ en ‘lopen’. De TUG wordt als goed hanteerbaar beschouwd.
Subjectief inspanningsvermogen
Aan de hand van de MET-methode (Ainsworth 2011, 1993) en/of de SAS (Goldman 1981) kan de therapeut inschatten of een discrepantie tussen feitelijk en gewenst prestatievermogen met een adequaat beweegprogramma van fase II-hartrevalidatie te ondervangen is. De SAS scoort op vier vragen over de functionele status van patiënten met cardiale aandoeningen en leidt tot een indeling in vier groepen. De vragenlijst kan in 3 minuten worden afgenomen. De MET-methode biedt de mogelijkheid om de metabole belasting van motorische activiteiten aan te geven, onafhankelijk van iemands lichaamsafmetingen. Voor een persoon staat 1 MET gelijk aan het basaalmetabolisme in rust voor die persoon. Het aantal MET’s voor een bepaalde motorische activiteit is de verhouding tussen de energiewisseling voor die activiteit en de energiewisseling in rust. Beide meetinstrumenten zijn goed te hanteren.
Spierkracht
Voor het in kaart brengen van perifere spierkracht bij patiënten met coronairlijden of chronisch hartfalen is het meten van het krachtuithoudingsvermogen van grote spiergroepen van belang. De afnameduur van de HDD is kort. In de dagelijkse praktijk is de HHD een draagbaar klein instrument, dat eenvoudig is in het gebruik voor een snelle meting. Het instrument is relatief goedkoop ten opzichte van isokinetische dynamometers die worden beschouwd als de gouden standaard, maar waarvoor speciale kennis, vaardigheid en apparatuur vereist zijn (Schrama 2014). Er wordt geen HHD-meting van de bovenste extremiteit (bijv. schouderabductie) aanbevolen; deze wordt als minder relevant beschouwd dan HDD-meting van de onderste extremiteit. De HHD wordt als voldoende hanteerbaar beschouwd.
Het maximale gewicht dat eenmalig correct kan worden verplaatst over een specifiek bewegingstraject (1RM) is een veelgebruikte maat bij het berekenen van de weerstand bij krachttraining. Aangezien een 1RM-bepaling een te grote belasting is voor hartpatiënten kan met behulp van de piramidecurve een schatting worden gemaakt van de (maximale) spierkracht zonder dat een patiënt een 1RM hoeft uit te voeren. Aan de hand van de piramidecurve kan het aantal herhalingen worden gerelateerd aan de (maximale) spierkracht. Het bepalen van het RM hangt af van de soort oefening, de uitvoeringssnelheid en de leeftijd van de patiënt.
De 1RM test heeft eveneens een korte afnameduur (Kaelin 1999). Er hoeft voor de meting geen extra apparatuur te worden aangeschaft als de therapeut al beschikt over nauwkeurig in te stellen krachtapparatuur. In tegenstelling tot de HHD kan de 1RM niet diagnostisch ingezet worden. Met behulp van de 1RM kan wel de trainingsintensiteit bepaald worden voor training op dezelfde krachtapparatuur als waarop de meting werd uitgevoerd (Morree 2006). De 1RM wordt als voldoende hanteerbaar beschouwd.
Ademspierfunctie
Voor een MIP-meting bij de chronisch-hartfalenpatiënt is de aanschaf van een ademspierfunctiemeter noodzakelijk (Basso-Vanelli 2018). Een meting is betrouwbaar als drie herhalingen minder dan 10% van elkaar verschillen. Indien een ademspierfunctiemeter al aanwezig is in het hartrevalidatiecentrum, wordt dit meetinstrument als hanteerbaar beschouwd. Tijdens de inspiratoire ademhalingstraining, die bij deze patiënten geïndiceerd kan zijn, kan het ‘threshold device’ worden gebruikt (Dall’Ago 2006; Mello 2012).
Subjectieve maat voor geleverde inspanning
De RPE-schaal is een 15-puntsschaal (6-20) die gebruikt wordt om subjectieve ervaringen tijdens fysieke belasting te beoordelen (Borg 1982). Deze subjectieve belastingsschaal kan helpen bij het inschatten van de mate van inspanning, de belastingsgraad en de vermoeidheid van de patiënt. De Borgschaal kan onder andere hartpatiënten ondersteunen bij het verantwoord bewegen. Het is een eenvoudige schaal, die zeer veel wordt gebruikt door therapeuten in Nederland. De Borgschaal wordt als goed hanteerbaar beschouwd.
Kortademigheid
De kortademigheid kan tijdens de training in kaart worden gebracht met de Dyspnoe-schaal (Roitman 2001). De patiënt kan in vier graden aangeven in welke mate hij de klachten ervaart. Bij iedere graad wordt een beschrijving gegeven. De patiënt kan van 1+ tot en met 4+ scoren. Hierbij wordt de volgende onderverdeling gehanteerd: 1) ‘mild, merkbaar voor de patiënt, maar niet voor observeerder’, 2) ‘mild, lichte problemen, merkbaar voor observeerder’, 3) ‘matige problemen, maar kan doorgaan’, en 4) ‘ernstige problemen, patiënt moet stoppen’.
Angina pectoris
De AP-schaal is praktisch goed bruikbaar (Austen 1975; Campeau 2002, 1976). Angina pectoris is een absolute, of in sommige gevallen een relatieve contra-indicatie (bij patiënten met rest-ischemische klachten) om deel te nemen aan beweegactiviteiten.
Bloeddruk
Er zijn diverse gevalideerde bloeddrukmeters. De Hartstichting publiceert op haar website een lijst met betrouwbare bloeddrukmeters (bezocht d.d. 11-1-2022). De digitaal af te lezen bloeddrukmeters zijn makkelijk in gebruik.
Zuurstofsaturatie
De transcutane SpO2 kan eenvoudig en snel in de praktijk worden gemeten aan de vinger of de oorlel. Er moet een zuurstofsaturatiemeter voor worden aangeschaft, maar de kosten daarvan zijn beperkt. De zuurstofsaturatiemeter wordt op grond hiervan als goed hanteerbaar beschouwd.
Activiteiten en participatie in ADL
De PSK wordt toegepast als meetinstrument om de functionele status van de individuele patiënt te bepalen. De patiënt selecteert de drie tot vijf belangrijkste klachten op het gebied van fysieke activiteiten. Deze activiteiten moeten relevant (belangrijk) zijn, de patiënt moet hinder ondervinden bij de uitvoering en de uitvoering moet regelmatig (wekelijks) plaatsvinden (Beurskens 1999).
De PSG is de vernieuwde versie van de PSK. De PSG kan als meetinstrument, maar tegelijkertijd als methode worden ingezet om samen met de patiënt doelen te stellen (Stevens 2013, 2017). Bij de PSG wordt meteen de PSK afgenomen, waardoor het stellen van doelen meer geïntegreerd is in het therapeutisch methodisch handelen (Stevens 2018). Benodigdheden zijn alleen de – vrij verkrijgbare – vragenlijst en een pen. Afhankelijk van de doelgroep en de tijd die het kost om activiteiten te selecteren, is de afnameduur van de PSG gemiddeld 5 tot 15 minuten (Beurskens 1999). Omdat de PSG onderdeel is van het methodisch handelen, kost afnemen ervan geen extra tijd en de PSG is daardoor zeer goed hanteerbaar (Stevens 2017).
Fysieke activiteit
De Nederlandse Norm Gezond Bewegen (NNGB) vragenlijst (Douwes 2000) en de ‘International Physical Activity Questionnaire’ (IPAQ) (Treskes 2017), de ‘Short Questionnaire to Assess Health-enhancing physical activity’ (SQUASH) (Wendel-Vos 2003) en activiteitenmeters, zoals beweegmeters, stappentellers en smartwatches, en de ‘Assessment of Physical Activity and Energy Expenditure’ (PAEE) (Hills 2014)) kunnen worden gebruikt om beweegactiviteit te scoren. De TNO monitor (NNGB) is opgenomen in de Beslisboom indicatiestelling poliklinische hartrevalidatie (Nederlandse Vereniging voor Cardiologie 2012). De IPAQ wordt gebruikt voor het inschatten van het fysieke activiteitenniveau. De vragenlijst bestaat uit 31 vragen verdeeld over vijf deelgebieden, en kost ongeveer 8 minuten om in te vullen. De SQUASH is gebaseerd op de Nederlandse Norm Gezond Bewegen. Deze vragenlijst bevat 11 items die door de respondent zelf ingevuld dienen te worden. PAEE-methoden zijn divers, waarbij de keuze afhangt van de voorkeur en de revalidatiedoelen van de patiënt.
Angst (cardiaal en bewegingsangst)
Met de HADS kan depressie en generieke angst worden gemeten in zowel een ziekenhuissetting als in de dagelijkse praktijk bij verschillende doelgroepen (Zigmond 1983). De vragenlijst bestaat uit 14 items die gelijkelijk zijn verdeeld over de subschalen ‘Angst’ (HADS-A) en ‘Depressie’ (HADS-D). De HADS detecteert de aanwezigheid van specifieke angst- of depressieve stoornissen niet adequaat en is geen medisch-diagnostisch gereedschap of een goede voorspeller van een specifieke diagnose, maar geeft wel aanwijzingen voor gegeneraliseerde symptomen van angst en depressie (Julian 2011). De HADS is gemakkelijk in het gebruik. Het is een korte vragenlijst met een invultijd van 2 tot 5 minuten. De HADS is een veel gebruikte vragenlijst voor het snel en gemakkelijk in kaart brengen van psychologische klachten en wordt als goed hanteerbaar beschouwd.
De CAQ is een betrouwbaar en valide instrument om hartangst te beoordelen bij patiënten die in het ziekenhuis zijn opgenomen met acuut coronair syndroom (Eifert 2000; Van Beek 2012). De CAQ is een zelfrapportagemaatstaf met 18 items die angst in verband met hartsymptomen beoordeelt.
De TAMPA kan worden gebruikt om kinesiofobie in kaart te brengen (Acar 2016; Kese 2022; Monticone 2015). De TSK NL-heart is specifiek ontwikkeld en gevalideerd voor de hartpopulatie (Keessen 2020). Met deze vragenlijst kan worden geïnventariseerd of het activiteitenniveau van de hartpatiënt beïnvloed wordt door vrees voor hartletsel/weefselschade met vermijdingsgedrag als gevolg. De vragenlijst bestaat uit 13 items waarbij een hogere score staat voor een hogere mate van bewegingsvrees (Keessen 2020).
Stap 6 ‘Wat is de klinimetrische kwaliteit?’
Maximaal inspanningsvermogen
De maximale of symptoomgelimiteerde inspanningstest (eventueel met ademgasanalyse) is een instrument dat geschikt is voor het meten van het maximale inspanningsvermogen en wordt hiervoor dan ook als gouden standaard beschouwd (Hansen 2015; Revalidatiecommissie NVVC/NHS en projectgroep PAAHR 2011). De test-hertestbetrouwbaarheid van de maximale of symptoomgelimiteerde inspanningstest (eventueel met ademgasanalyse) voor het meten van de VO2-max bij mensen met coronairlijden of chronisch hartfalen is goed.
Fysieke capaciteit (functioneel inspanningsvermogen)
Zowel de 6MWT (Du 2009; Pollentier 2010) als de (gemodificeerde) SWT (Keell 1998; Morales 1999, 2000) blijken geschikt voor het meten van de submaximale inspanningscapaciteit en zijn valide, betrouwbare en responsieve meetinstrumenten. De klinimetrische kwaliteit van de 6MWT en de (gemodificeerde) SWT wordt als goed beschouwd.
De SRT is valide en betrouwbaar voor het bepalen van de VO2-max en het trainingswattage. Er is een goede correlatie met de maximale of symptoomgelimiteerde inspanningstest (eventueel met ademgasanalyse) (Chura 2012; Meyer 1996; Takken 2008). Echter, deze onderzoeken hebben geen hartpatiënten geïncludeerd.
De TUG is geschikt voor het meten van de functionele belastbaarheid bij laag belastbare hartpatiënten, chronisch-hartfalenpatiënten (Hwang 2016) en oudere patiënten (Bellet 2013). Een significante correlatie is aangetoond tussen de TUG en de 6MWT (Bellet 2013). De test-hertestbetrouwbaarheid is goed.
Subjectief inspanningsvermogen
De validiteit van de SAS is niet onderzocht, wel is de betrouwbaarheid goed bij hartpatiënten (Goldman 1981; Lee 1988). Aan de hand van het metabole equivalent wordt de patiënt geclassificeerd. De MET-methode kent een goede validiteit en betrouwbaarheid (Ainsworth 1993).
Spierkracht
De validiteit, inclusief de differentiatie tussen lage en hoge spierkracht van de 1RM en van een submaximale variant daarvan is lager dan die van objectievere methoden, zoals de HHD (Schrama 2014). Uit een systematische literatuurstudie bleek de HHD valide (Stark 2011). De interbeoordelaarsbetrouwbaarheid van de HDD bij meting van de bovenste extremiteit is goed (Schrama 2014).
Het indirect bepalen van de 1RM is gevalideerd binnen de hartpatiëntenpopulatie (Barnard 1999; Ellis 2019; Reynolds 2006). De 4-6RM is betrouwbaar; 1-3RM geeft een te zware belasting, en de >7RM is minder betrouwbaar bij goed belastbare patiënten met coronairlijden. Bij laag belastbare patiënten, zoals patiënten met ernstige comorbiditeit, kan de 10RM betrouwbaar worden bepaald.
Ademspierfunctie
De MIP-meting is geschikt voor het bepalen en evalueren van de maximale inademingsspierkracht (Basso-Vanelli 2018). De meting is betrouwbaar bij patiënten wanneer meerdere metingen gedaan worden en de meting wordt uitgevoerd door een ervaren zorgprofessional. De betrouwbaarheid kan negatief beïnvloed worden wanneer er sprake is van hyperinflatie en/of een ernstige obstructie (bijvoorbeeld bij patiënten met COPD). De klinimetrische eigenschappen van de MIP-meting worden op grond hiervan als voldoende beschouwd.
Subjectieve maat voor geleverde inspanning
De Borg RPE-schaal (6-20) is valide en correleert goed met de hartfrequentie (Chen 2002; Scherr 2013). Het is niet duidelijk wat de invloed is van medicatie op de correlatie van de Borg RPE-schaal met de hartfrequentie.
Bijna alle hartpatiënten krijgen bètablokkers waardoor de correlatie met hartfrequentie niet van toepassing is, wel neemt de hartfrequentie onder bètablokkade lineair toe met de inspanning.
Kortademigheid
De Dyspneu-schaal vertoont veel overlap met de classificatie van de New York Heart Association (NYHA).
Angina pectoris
De interbeoordelaarsbetrouwbaarheid van de AP-schaal is goed en de validiteit is voldoende (Christensen 2006).
Bloeddruk
Er zijn diverse gevalideerde bloeddrukmeters met elk zijn eigen specifieke handelingsprotocol. Voor de klinimetrische eigenschappen van bloeddrukmeters wordt verwezen naar de lijst van de Hartstichting (Hartstichting website bezocht op 11-11-2022).
Zuurstofsaturatie
De nauwkeurigheid van de zuurstofsaturatiemeter is met ongeveer 4% (Amalakanti 2016) voldoende voor de detectie van een significante daling in zuurstofspanning. Hoewel er aanwijzingen zijn dat de meting bij patiënten met COPD de SpO2-waarde overschat (Amalakanti 2016), is de saturatiemeter aan de vinger geaccepteerd als een betrouwbaar instrument (Hess 2016; Nitzan 2014). De meting kan onbetrouwbaar zijn bij een abnormaal hemoglobinegehalte, tijdens beweging en bij het dragen van nagellak of als de vinger koud is (verminderde perifere doorbloeding) (Hess 2016; Nitzan 2014). Dan kan de meting elders op het lichaam herhaald worden, zoals via de oorlel of via een plaksensor op het voorhoofd. Er zijn ook praktische overwegingen bij het kiezen van een bepaalde meetlocatie. Meting via het voorhoofd lijkt dichter bij de arteriële zuurstofsaturatie (SaO2) te liggen dan via de vinger, maar beide sensoren detecteren inspanningsgerelateerde desaturatie (Wilson 2013). De klinimetrische kwaliteit van de saturatiemeter wordt als voldoende beschouwd.
Activiteiten en participatie in ADL en fysieke activiteit
De methodologische kwaliteit van de PSK is goed bevonden, maar werd vooral onderzocht bij andere doelgroepen dan hartpatiënten (Berghmans 2015; Hall 2011; Rollman 2010). De validiteit en responsiviteit van de vragenlijst zijn voldoende (Beurskens 1999). De betrouwbaarheid wisselt, afhankelijk van de gekozen activiteit (Nijkrake 2009). Wanneer bij de vragenlijst de ‘Visual Analogue Scale’ (VAS) wordt gebruikt in plaats van de ‘Numeric Rating Scale’ (NRS) is de betrouwbaarheid van de PSK voldoende (Rollman 2010). Op basis van de klinimetrische eigenschappen van de PSK, wordt ook de klinimetrische kwaliteit van de PSG als voldoende beschouwd.
Fysieke activiteit
De klinimetrische kwaliteit van vragenlijsten (TNO-monitor, IPAQ) is te beperkt om inzicht in beweeggedrag van patiënten te krijgen. Het invullen van vragenlijsten of dagboekjes leidt tot overschatting van de meeste activiteiten, terwijl laagintensieve activiteiten erdoor worden onderschat (Ainsworth 2011; Helmerhorst 2012). De SQUASH daarentegen lijkt valide en betrouwbaar voor het objectiveren van beweeggedrag (Campbell 2016; Makabe 2015; Sorensen 2018; Wagenmakers 2008; Wendel-Vos 2003).
Er is nog te weinig onderzoek gedaan naar de klinimetrische kwaliteit van applicaties op smartphones, zoals activiteitenmeters, die de PAEE inzichtelijk kunnen maken (Johnston 2021). Uit onderzoeken waarin dit soort applicaties zijn bestudeerd, blijkt dat de validiteit van dergelijke applicaties bij hartpatiënten, maar ook bij andere patiëntengroepen, wisselend is (Larsen 2022). Er wordt steeds meer onderzoek gedaan naar activiteitenmeters, en steeds meer activiteitenmeters worden valide en betrouwbaar bevonden (Case 2015; Patel 2020). Toch werd recentelijk geconcludeerd door Bayoumy et al (2020) dat de nauwkeurigheid, klinische validiteit, een gebrek aan gestandaardiseerd regelgevend beleid en bezorgdheid over de privacy van patiënten nog steeds de wijdverbreide toepassing van slimme draagbare technologieën in de klinische praktijk beperkt (Bayoumy 2021).
Angst
Zowel de interne consistentie van de subschalen, als de test-hertestbetrouwbaarheid van de HADS is hoog (Bjelland 2002; Christensen 2020; Hunt-Shanks 2010; Roberts 2001). In vergelijking met andere veel gebruikte (maar langere) vragenlijsten voor het in kaart brengen van depressieve gevoelens en angst is de validiteit van de HADS goed tot zeer goed (Bjelland 2002; Julian 2011). Het discriminerend vermogen van de HADS is matig tot hoog en vergelijkbaar met die van andere screeningsvragenlijsten (Bjelland 2002; Brennan 2010). De klinimetrische kwaliteit van de HADS wordt hiermee als goed beoordeeld. De CAQ (Eifert 2000; Van Beek 2012) en de TSK NL-heart (Keessen 2020) zijn gevalideerd bij hartpatiënten. De TSK NL-heart is betrouwbaar in te zetten, heeft voldoende responsiviteit en kan verandering in de tijd detecteren (Ter Hoeve 2022). Bovendien is tussen de TSK NL-heart, de CAQ en de HADS er een sterk positieve correlatie gevonden (Keessen 2020). De klinimetrische eigenschappen van zowel de CAQ als de TSK NL-heart worden als voldoende beschouwd.
Stap 7 en 8 ‘Zijn er normwaarden beschikbaar en hoe bereken en interpreteer je de gegevens?’
Voor de normwaarden en de interpretatie van optionele meetinstrumenten wordt verwezen naar www.meetinstrumentenzorg.nl.
Maximaal inspanningsvermogen
Voor de maximale of symptoomgelimiteerde inspanningstest (eventueel met ademgasanalyse) zijn normwaarden beschikbaar (Hansen 2015).
Fysieke capaciteit (functioneel inspanningsvermogen)
Er zijn normwaarden beschikbaar voor de 6MWT (Beekman 2014; Mylius 2016) en verschillende uitvoeringen van de SWT (Lima 2019; Neves 2015). Ten aanzien van de 6MWT is het belangrijk dat de normwaarden worden gebruikt die horen bij de manier waarop de test is afgenomen, zoals parcourslengte en de manier van aanmoedigen, en dat de normwaarden passen bij het land of de regio waar de geteste persoon vandaan komt (Mylius 2016). Voor zowel de SRT (Meyer 1996) als de TUG (Podsiadlo 1991) zijn normgegevens beschikbaar. Echter de normwaarden van de SRT zijn niet specifiek voor de hartpatiënt.
Subjectief inspanningsvermogen
Zowel de MET-methode als de SAS (Lee 1988) worden uitgedrukt als metabolische equivalenten. Aan de hand van het metabolische equivalent wordt de patiënt geclassificeerd, wat kan worden afgezet tegen de uitkomst op de maximale of symptoomgelimiteerde inspanningstest (eventueel met ademgasanalyse).
Spierkracht
Er zijn normwaarden en referentieformules beschikbaar voor de HHD-meting.(Andrews 1996; Bohannon 1997; McKay 2017; Van der Ploeg 1991). Er zijn geen normwaarden voor de 1RM-tests en de gemeten waarden zijn in sterke mate afhankelijk van de gebruikte apparatuur, waardoor deze tests niet diagnostisch gebruikt kunnen worden.
Ademspierfunctie
Van de MIP zijn normwaarden beschikbaar voor het vaststellen van een verminderde ademspierfunctie bij patiënten (Laveneziana 2019; Rodrigues 2017).
Subjectief maat voor geleverde inspanning
Hoe hoger de patiënt op de schaal scoort, des te zwaarder is de lichamelijke inspanning die hij ervaart (Borg 1982).
Kortademigheid
Hoe hoger de patiënt op de schaal scoort, des te kortademiger de patiënt is tijdens de training (Roitman 2001).
Angina pectoris
Hoe hoger de patiënt scoort, des te meer angina pectoris hij ervaart tijdens beweegactiviteiten (Austen 1975; Campeau 2002, 1976).
Bloeddruk
In de ‘Multidisciplinaire richtlijn cardiovasculair risicomanagement (CVRM) (opent in nieuw tabblad)’ staan normwaarden voor de bloeddruk (Federatie Medisch Specialisten 2019). De bloeddruk kan afhankelijk zijn van het type en dosering van de bloeddrukverlager en de getraindheid van de hartpatiënt, en beïnvloed worden door bijvoorbeeld emotionele stress.
Zuurstofsaturatie
Ten aanzien van de zuurstofsaturatie zijn aanbevelingen geformuleerd voor de situatie waarin de training (tijdelijk) onderbroken moet worden vanwege desaturatie bij patiënten met COPD .
Activiteiten en participatie in ADL
Er zijn normgegevens beschikbaar voor de klinisch-relevante verbetering op de PSK en PSG (Beurskens 1999; Stevens 2017).
Fysieke activiteit
Het totale beweegvolume is gerelateerd aan een reductie van (cardiale) mortaliteit. In de WHO-richtlijn bewegen wordt aanbevolen dat hartpatiënten ten minste 150 tot 300 minuten per week matig tot intensief bewegen (World Health Organisation 2020). Veel onderzoek richt zich op het tellen van stappen. Er is consensus dat er bij 7500 tot 10.000 stappen per dag kan worden gesproken van een actieve gezonde leefstijl (Del Pozo Cruz 2022; Hancock 2012; Lee 2019; Tudor-Locke 2004, 2009). Bij patiënten met hart- en vaatziekten is een levenslange actieve leefstijl geassocieerd met een 50% lagere kans op vroegtijdige sterfte in vergelijking met inactiviteit. De gezondheidswinst was iets lager bij patiënten die eerst inactief waren maar later actief werden (45% reductie) evenals bij patiënten die eerst actief waren maar later inactief werden (20% reductie) (Gonzalez-Jaramillo 2022). Een andere overzichtsstudie laat zien dat vanaf 3000 stappen per dag het risico op cardiale mortaliteit gradueel afneemt, en dat de maximale risicoreductie wordt bereikt bij 10.000 stappen per dag (Paluch 2022). Hoewel voor het behalen van gezondheidswinst een bescheiden toename van stappen per dag al relevant is (Jayedi 2022), beweegt een gezond persoon gemiddeld slechts 5500 tot 6000 stappen per dag en mensen met een chronische aandoening zelfs maar 3500 tot 5500 stappen per dag (Lee 2019; Tudor-Locke 2004, 2009). In een recentelijk Nederlands onderzoek is gekeken naar het aantal stappen van ruim 110.000 mensen (Stens 2023). Zij concludeerden dat er vanaf zo’n 2500 stappen gezondheidsvoordelen te meten zijn. En elke 500 stappen extra zorgen voor een vermindering van de kans op vroegtijdig overlijden of hart- en vaatziekten van 8%. De kans op hart- en vaatziekten is al maximaal verkleind bij 7126 stappen en bij overlijden 8763 stappen. Om de kans op andere ziektebeelden (zoals het voorkomen van ontstekingen) te voorkomen is het nodig nog extra stappen bovenop de 7126 stappen te maken. Het advies is daarom om 8800 stappen te hanteren. Daarnaast is het advies om deze rustig op te bouwen met 500 stappen.
Angst (cardiaal en bewegingsangst)
Er zijn normgegevens beschikbaar van de HADS en TSK NL-heart, maar niet van de CAQ (Eifert 2000; Keessen 2020; Snaith 2003; Van Beek 2012; Zigmond 1983).
Van bewijs naar aanbeveling
De werkgroep heeft in deze module enkel ‘overige overwegingen’ opgesteld.
Overige overwegingen
De werkgroep is van mening dat het belangrijk is om de optionele meetinstrumenten te richten op de hulpvraag van de patiënt en het monitoren van de behandeling.
De werkgroep is van mening dat er idealiter een combinatie van vragenlijsten geselecteerd wordt voor het in kaart brengen van de domeinen en adviseert op basis van de uitkomsten van de vragenlijsten een aanvullende (bewegings)analyse of functietests uit te voeren.
De werkgroep is van mening dat een manuele bloeddrukbepaling dient te worden aangeraden bij patiënten met een abnormaal ritme (zoals bijvoorbeeld atriumfibrilleren), aangezien digitale bloeddrukmeters onvoldoende betrouwbaar zijn.
Als optioneel meetinstrument voor de fysieke capaciteit (functioneel inspanningsvermogen) selecteert de werkgroep de 6MWT of de SRT. Als de 6MWT of de SRT te zwaar is voor de patiënt, kan de TUG een alternatief zijn. Als de 6MWT te licht is voor de patiënt, kan de SWT een alternatief zijn. De therapeut schat de belastbaarheid in op basis van zijn klinische expertise en houdt hierbij rekening met de voorkeur van de patiënt.
Als optioneel meetinstrument voor het subjectief inspanningsvermogen selecteert de werkgroep de MET-methode. De SAS wordt door de werkgroep als een te globaal meetinstrument ervaren en daardoor afgeraden.
Als optioneel meetinstrument voor de spierkracht selecteert de werkgroep de 1RM-methode. Deze methode wordt het meeste toegepast in de klinische praktijk. Het bepalen van het RM hangt af van de soort oefening, de uitvoeringssnelheid van de test en de leeftijd van de patiënt. Een directe 1RM-bepaling wordt afgeraden, omdat deze bepaling een te zware belasting is voor de patiënt. De werkgroep adviseert het 4-6RM te bepalen bij goed belastbare patiënten met coronairlijden. Bij laag belastbare patiënten, zoals patiënten met ernstige comorbiditeit, adviseert de werkgroep een 10RM te gebruiken omwille van de veiligheid. De inschatting van de belastbaarheid vindt plaats op basis van klinische expertise.
Als aanbevolen meetinstrument voor activiteiten en participatie in ADL selecteert de werkgroep de PSG. De werkgroep is van mening dat de additionele goalsetting bijdraagt aan de motivatie van de patiënt van het voortzetten van de hartrevalidatie. De werkgroep is zich bewust dat voor het gebruik van de PSG aanvullende scholing nodig is, maar geeft desondanks de voorkeur aan de PSG.
Als optioneel meetinstrument voor fysieke activiteit selecteert de werkgroep de SQUASH als vragenlijst en geeft de aanbeveling om ook activiteitmeters, zoals beweegmeters, stappentellers en smartwatches in te zetten. De werkgroep geeft aan dat het inzetten van vragenlijsten vaak complex is, waardoor de betrouwbaarheid hierdoor afneemt. De SQUASH lijkt het meest klinisch toepasbaar. Ondanks de beperkte wetenschappelijke onderbouwing van activiteitenmeters, welke wel toeneemt in de tijd, ziet de werkgroep maatschappelijk draagvlak en gebruiksvriendelijkheid van deze technologie en heeft daarmee potentie om het beweeggedrag te stimuleren (zie ook de KNGF-richtlijn ‘Zorg op afstand’) .
De werkgroep oordeelt dat het een sterke voorkeur heeft om een maximale of symptoomgelimiteerde inspanningstest uit te voeren om persoonsgericht zorg te waarborgen voor het:
- bepalen van het maximaal inspanningsvermogen;
- bepalen van de bloeddruk en hartslagfrequentierespons voor de hartrevalidatie;
- bepalen van de trainingsintensiteit voor de harrevalidatie;
- bepalen van de respons van de hartrevalidatie (aanvangs- en evaluatiemeting).
Het afnemen van een test, gericht op de fysieke activiteit (functioneel inspanningsvermogen), zoals de 6MWT of SRT heeft als doel dat de therapeut zelf in staat is om de training te kunnen doseren of de effecten van de training te kunnen evalueren.
In de ‘Multidisciplinaire richtlijn Hartrevalidatie 2024 (opent in nieuw tabblad) ’ worden deze indicaties verder beschreven (NVVC).
Als optioneel meetinstrument voor angst selecteert de werkgroep de TSK (NL-heart) en CAQ. De werkgroep geeft aan dat de HADS alleen generieke angst meet, terwijl de subcategorieën (cardiale angst en bewegingsangst) met name voor fysio- en oefentherapeuten van belang zijn om in kaart te brengen. In de huidige praktijk wordt daarnaast de generieke angst veelal al multidisciplinair uitgevraagd d.m.v. de HADS of een ander meetinstrument. Hierdoor gaat de voorkeur uit naar de TSK (NL-heart) en CAQ.
Voor deze module zijn de primaire domeinen geselecteerd door de werkgroep. Echter de werkgroep oordeelt dat de fysio- of oefentherapeut ook werkzaam kan zijn op andere domeinen, zoals depressie. De werkgroep geeft aan dat een belangrijke interventie bij het verminderen van een depressie het bewegen is.
Ook is de signalerende functie, zie A.3 ‘Organisatie van Zorg’ van de fysio- of oefentherapeut is van belang voor het signaleren van bijvoorbeeld psychosociale, arbeidsgerelateerde of cognitieve klachten.
- Acar S, Savci S, Keskinoglu P, Akdeniz B, Ozpelit E, Ozcan Kahraman B, Karadibak D, Sevinc C. Tampa Scale of Kinesiophobia for Heart Turkish Version Study: cross-cultural adaptation, exploratory factor analysis, and reliability. J Pain Res. 2016;9:445-51.
- Achttien RJ, Vromen T, Staal JB, Peek N, Spee RF, Niemeijer VM, Kemps HM, multidisciplinary expert p. Development of evidence-based clinical algorithms for prescription of exercise-based cardiac rehabilitation. Neth Heart J. 2015;23(12):563-75.
- Ainsworth B, Haskell W, Herrmann S, et al. The compendium of physical activities tracking guide. Tempe AZ, VS: Arizona State University, Healthy Lifestyles Research Center, College of Nursing & Health Innovation; 2011.
- Ainsworth BE, Haskell WL, Leon AS, Jacobs DR, Jr., Montoye HJ, Sallis JF, Paffenbarger RS, Jr. Compendium of physical activities: classification of energy costs of human physical activities. Med Sci Sports Exerc. 1993;25(1):71-80.
- Amalakanti S, Pentakota MR. Pulse oximetry overestimates oxygen saturation in COPD. Respir Care. 2016;61(4):423-7.
- Andrews AW, Thomas MW, Bohannon RW. Normative values for isometric muscle force measurements obtained with hand-held dynamometers. Phys Ther. 1996;76(3):248-59.
- Austen WG, Edwards JE, Frye RL, Gensini GG, Gott VL, Griffith LS, McGoon DC, Murphy ML, Roe BB. A reporting system on patients evaluated for coronary artery disease. Report of the Ad Hoc Committee for Grading of Coronary Artery Disease, Council on Cardiovascular Surgery, American Heart Association. Circulation. 1975;51(4 Suppl):5-40.
- Barnard KL, Adams KJ, Swank AM, Mann E, Denny DM. Injuries and muscle soreness during the one repetition maximum assessment in a cardiac rehabilitation population. J Cardiopulm Rehabil. 1999;19(1):52-8.
- Basso-Vanelli RP, Di Lorenzo VAP, Ramalho M, Labadessa IG, Regueiro EMG, Jamami M, Costa D. Reproducibility of inspiratory muscle endurance testing using PowerBreathe for COPD patients. Physiother Res Int. 2018;23(1).
- Bayoumy K, Gaber M, Elshafeey A, Mhaimeed O, Dineen EH, Marvel FA, Martin SS, Muse ED, Turakhia MP, Tarakji KG, Elshazly MB. Smart wearable devices in cardiovascular care: where we are and how to move forward. Nat Rev Cardiol. 2021;18(8):581-99.
- Beekman E, Mesters I, Gosselink R, Klaassen MP, Hendriks EJ, Van Schayck OC, de Bie RA. The first reference equations for the 6-minute walk distance over a 10 m course. Thorax. 2014;69(9):867-8.
- Bellet RN, Francis RL, Jacob JS, Healy KM, Bartlett HJ, Adams L, Morris NR. Timed up and go tests in cardiac rehabilitation: reliability and comparison with the 6-Minute Walk Test. J Cardiopulm Rehabil Prev. 2013;33(2):99-105.
- Berghmans DD, Lenssen AF, van Rhijn LW, de Bie RA. The patient-specific functional scale: its reliability and responsiveness in patients undergoing a total knee arthroplasty. J Orthop Sports Phys Ther. 2015;45(7):550-6.
- Beurskens AJ, de Vet HC, Köke AJ, Lindeman E, van der Heijden GJ, Regtop W, Knipschild PG. A patient-specific approach for measuring functional status in low back pain. J Manipulative Physiol Ther. 1999;22(3):144-8.
- Bjelland I, Dahl AA, Haug TT, Neckelmann D. The validity of the Hospital Anxiety and Depression Scale. An updated literature review. J Psychosom Res. 2002;52(2):69-77.
- Bohannon RW. Reference values for extremity muscle strength obtained by hand-held dynamometry from adults aged 20 to 79 years. Arch Phys Med Rehabil. 1997;78(1):26-32.
- Borg GA. Psychophysical bases of perceived exertion. Med Sci Sports Exerc. 1982;14(5):377-81.
- Brennan C, Worrall-Davies A, McMillan D, Gilbody S, House A. The Hospital Anxiety and Depression Scale: a diagnostic meta-analysis of case-finding ability. J Psychosom Res. 2010;69(4):371-8.
- Campbell N, Gaston A, Gray C, Rush E, Maddison R, Prapavessis H. The short questionnaire to assess health-enhancing (SQUASH) physical activity in adolescents: a validation using doubly labeled water. J Phys Act Health. 2016;13(2):154-8.
- Campeau L. The Canadian Cardiovascular Society grading of angina pectoris revisited 30 years later. Can J Cardiol. 2002;18(4):371-9.
- Campeau L. Letter: Grading of angina pectoris. Circulation. 1976;54(3):522-3.
- Case MA, Burwick HA, Volpp KG, Patel MS. Accuracy of smartphone applications and wearable devices for tracking physical activity data. JAMA. 2015;313(6):625-6.
- Chen MJ, Fan X, Moe ST. Criterion-related validity of the Borg ratings of perceived exertion scale in healthy individuals: a meta-analysis. J Sports Sci. 2002;20(11):873-99.
- Christensen AV, Dixon JK, Juel K, Ekholm O, Rasmussen TB, Borregaard B, Mols RE, Thrysoe L, Thorup CB, Berg SK. Psychometric properties of the Danish Hospital Anxiety and Depression Scale in patients with cardiac disease: results from the DenHeart survey. Health Qual Life Outcomes. 2020;18(1):9.
- Christensen HW, Haghfelt T, Vach W, Johansen A, Hoilund-Carlsen PF. Observer reproducibility and validity of systems for clinical classification of angina pectoris: comparison with radionuclide imaging and coronary angiography. Clin Physiol Funct Imaging. 2006;26(1):26-31.
- Chura RL, Marciniuk DD, Clemens R, Butcher SJ. Test-retest reliability and physiological responses associated with the steep ramp anaerobic test in patients with COPD. Pulm Med. 2012;2012:653831.
- Dall’Ago P, Chiappa GR, Guths H, Stein R, Ribeiro JP. Inspiratory muscle training in patients with heart failure and inspiratory muscle weakness: a randomized trial. J Am Coll Cardiol. 2006;47(4):757-63.
- Del Pozo Cruz B, Gallardo-Gomez D, Del Pozo-Cruz J, Ding D. How many steps a day to reduce the risk of all-cause mortality? A dose-response meta-analysis. J Intern Med. 2022;291(4):519-21.
- Douwes M HV. Questions on the amount of physical activity. Geneeskunde en Sport. 2000;33(1):9-16.
- Du H, Newton PJ, Salamonson Y, Carrieri-Kohlman VL, Davidson PM. A review of the six-minute walk test: its implication as a self-administered assessment tool. Eur J Cardiovasc Nurs. 2009;8(1):2-8.
- Eifert GH, Thompson RN, Zvolensky MJ, Edwards K, Frazer NL, Haddad JW, Davig J. The cardiac anxiety questionnaire: development and preliminary validity. Behav Res Ther. 2000;38(10):1039-53.
- Ellis R, Holland AE, Dodd K, Shields N. Reliability of one-repetition maximum performance in people with chronic heart failure. Disabil Rehabil. 2019;41(14):1706-10.
- Federatie Medisch Specialisten. Cardiovasculair risicomanagement (CVRM). Federatie Medisch Specialisten.; 2019. Beschikbaar via https://richtlijnendatabase.nl/
- Garvey C, Bayles MP, Hamm LF, Hill K, Holland A, Limberg TM, Spruit MA. Pulmonary rehabilitation exercise prescription in chronic obstructive pulmonary disease: review of selected guidelines: an official statement from the American association of cardiovascular and pulmonary rehabilitation. J Cardiopulm Rehabil Prev. 2016;36(2):75-83.
- Goldman L, Hashimoto B, Cook EF, Loscalzo A. Comparative reproducibility and validity of systems for assessing cardiovascular functional class: advantages of a new specific activity scale. Circulation. 1981;64(6):1227-34.
- Gonzalez-Jaramillo N, Wilhelm M, Arango-Rivas AM, Gonzalez-Jaramillo V, Mesa-Vieira C, Minder B, Franco OH, Bano A. Systematic review of physical activity trajectories and mortality in patients with coronary artery disease. J Am Coll Cardiol. 2022;79(17):1690-700.
- Hall AM, Maher CG, Latimer J, Ferreira ML, Costa LO. The patient-specific functional scale is more responsive than the Roland Morris disability questionnaire when activity limitation is low. Eur Spine J. 2011;20(1):79-86.
- Hancock C. The benefits of regular walking for health, well-being and the environment. Londen: Collaborating for Health; 2012.
- Hansen J, Rassouli F, Brutsche MH. [Cardiopulmonary exercise testing (CPET) – indication and clinical impact]. Ther Umsch. 2015;72(5):321-6.
- Hartstichting. Betrouwbare bloeddrukmeters in Nederland. Geraadpleegd op 11-11-2022. Beschikbaar via https://www.hartstichting.nl/risicofactoren/gids-bloeddruk/bloeddrukmeter-kopen/betrouwbare-bloeddrukmeters
- Helmerhorst HJ, Brage S, Warren J, Besson H, Ekelund U. A systematic review of reliability and objective criterion-related validity of physical activity questionnaires. Int J Behav Nutr Phys Act. 2012;9:103.
- Hess RMN, Galvin WF, Mishoe SC. Chapter 2 Respiratory monitoring. Respiratory care: principles and practice. Burlington, MA, VS: Jones and Bartlett Publishers; 2016.
- Hills AP, Mokhtar N, Byrne NM. Assessment of physical activity and energy expenditure: an overview of objective measures. Front Nutr. 2014;1:5.
- Hunt-Shanks T, Blanchard C, Reid R, Fortier M, Cappelli M. A psychometric evaluation of the Hospital Anxiety and Depression Scale in cardiac patients: addressing factor structure and gender invariance. Br J Health Psychol. 2010;15(Pt 1):97-114.
- Hwang R, Morris NR, Mandrusiak A, Mudge A, Suna J, Adsett J, Russell T. Timed up and go test: a reliable and valid test in patients with chronic heart failure. J Card Fail. 2016;22(8):646-50.
- Jayedi A, Gohari A, Shab-Bidar S. Daily step count and all-cause mortality: a dose-response meta-analysis of prospective cohort studies. Sports Med. 2022;52(1):89-99.
- Johnston W, Judice PB, Molina Garcia P, Muhlen JM, Lykke Skovgaard E, Stang J, Schumann M, Cheng S, Bloch W, Brond JC, Ekelund U, Grontved A, Caulfield B, Ortega FB, Sardinha LB. Recommendations for determining the validity of consumer wearable and smartphone step count: expert statement and checklist of the Interlive Network. Br J Sports Med. 2021;55(14):780-93.
- Julian LJ. Measures of anxiety: state-trait anxiety inventory (STAI), beck anxiety inventory (BAI), and hospital anxiety and depression scale-anxiety (HADS-A). Arthritis Care Res (Hoboken). 2011;63 Suppl 11:S467-72.
- Kaelin ME, Swank AM, Adams KJ, Barnard KL, Berning JM, Green A. Cardiopulmonary responses, muscle soreness, and injury during the one repetition maximum assessment in pulmonary rehabilitation patients. J Cardiopulm Rehabil. 1999;19(6):366-72.
- Keell SD, Chambers JS, Francis DP, Edwards DF, Stables RH. Shuttle-walk test to assess chronic heart failure. Lancet. 1998;352(9129):705.
- Keessen P, den Uijl I, Visser B, van den Berg-Emons H, Latour CHM, Sunamura M, Jorstad HT, Ter Riet G, Scholte Op Reimer WJM, Kraaijgenhagen RA, Ter Hoeve N. Fear of movement in patients attending cardiac rehabilitation: A validation study. J Rehabil Med. 2020;52(2):jrm00021.
- Kese B, Salci Y, Yilmaz OT. Validity and reliability of the tampa kinesiophobia-fatigue scale in patients with multiple sclerosis. Ir J Med Sci. 2022.
- Larsen RT, Wagner V, Korfitsen CB, Keller C, Juhl CB, Langberg H, Christensen J. Effectiveness of physical activity monitors in adults: systematic review and meta-analysis. BMJ. 2022;376:e068047.
- Laveneziana P, Albuquerque A, Aliverti A, Babb T, Barreiro E, Dres M, Dube BP, Fauroux B, Gea J, Guenette JA, Hudson AL, Kabitz HJ, Laghi F, Langer D, Luo YM, Neder JA, O’Donnell D, Polkey MI, Rabinovich RA, Rossi A, Series F, Similowski T, Spengler CM, Vogiatzis I, Verges S. ERS statement on respiratory muscle testing at rest and during exercise. Eur Respir J. 2019;53(6).
- Lee IM, Shiroma EJ, Kamada M, Bassett DR, Matthews CE, Buring JE. Association of step volume and intensity with all-cause mortality in older women. JAMA Intern Med. 2019;179(8):1105-12.
- Lee TH, Shammash JB, Ribeiro JP, Hartley LH, Sherwood J, Goldman L. Estimation of maximum oxygen uptake from clinical data: performance of the specific activity scale. Am Heart J. 1988;115(1 Pt 1):203-4.
- Lima LP, Leite HR, Matos MA, Neves CDC, Lage V, Silva GPD, Lopes GS, Chaves MGA, Santos JNV, Camargos ACR, Figueiredo PHS, Lacerda ACR, Mendonca VA. Cardiorespiratory fitness assessment and prediction of peak oxygen consumption by incremental shuttle walking test in healthy women. PLoS One. 2019;14(2):e0211327.
- Makabe S, Makimoto K, Kikkawa T, Uozumi H, Ohnuma M, Kawamata T. Reliability and validity of the Japanese version of the short questionnaire to assess health-enhancing physical activity (SQUASH) scale in older adults. J Phys Ther Sci. 2015;27(2):517-22.
- McKay MJ, Baldwin JN, Ferreira P, Simic M, Vanicek N, Burns J, Norms Project C. Normative reference values for strength and flexibility of 1,000 children and adults. Neurology. 2017;88(1):36-43.
- Mello PR, Guerra GM, Borile S, Rondon MU, Alves MJ, Negrao CE, Dal Lago P, Mostarda C, Irigoyen MC, Consolim-Colombo FM. Inspiratory muscle training reduces sympathetic nervous activity and improves inspiratory muscle weakness and quality of life in patients with chronic heart failure: a clinical trial. J Cardiopulm Rehabil Prev. 2012;32(5):255-61.
- Mesquita R, Wilke S, Smid DE, Janssen DJ, Franssen FM, Probst VS, Wouters EF, Muris JW, Pitta F, Spruit MA. Measurement properties of the timed up & go test in patients with COPD. Chron Respir Dis. 2016;13(4):344-52.
- Meyer K, Samek L, Schwaibold M, Westbrook S, Hajric R, Lehmann M, Essfeld D, Roskamm H. Physical responses to different modes of interval exercise in patients with chronic heart failure – application to exercise training. Eur Heart J. 1996;17(7):1040-7.
- Monticone M, Ferrante S, Ambrosini E, Rocca B, Secci C, Foti C. Development of the Tampa Scale of Kinesiophobia for Parkinson’s disease: confirmatory factor analysis, reliability, validity and sensitivity to change. Int J Rehabil Res. 2015;38(2):113-20.
- Morales FJ, Martinez A, Mendez M, Agarrado A, Ortega F, Fernandez-Guerra J, Montemayor T, Burgos J. A shuttle walk test for assessment of functional capacity in chronic heart failure. Am Heart J. 1999;138(2 Pt 1):291-8.
- Morales FJ, Montemayor T, Martinez A. Shuttle versus six-minute walk test in the prediction of outcome in chronic heart failure. Int J Cardiol. 2000;76(2-3):101-5.
- Morree JJ, Jongert T, van der Poel G. Inspanningsfysiologie, oefentherapie en training. Houten: Bohn Stafleu van Loghum; 2006.
- Mylius CF, Paap D, Takken T. Reference value for the 6-minute walk test in children and adolescents: a systematic review. Expert Rev Respir Med. 2016;10(12):1335-52.
- Nederlandse Vereniging voor Cardiologie. Beslisboom Poliklinische Indicatiestelling Hartrevalidatie 2012. Utrecht: Commissie Cardiovasculaire Preventie en Hartrevalidatie (NVVC-CCPH), Landelijk Multidisciplinair Overleg Hartrevalidatie (LMDO-H); 2012. Beschikbaar via https://www.nvvc.nl/Kwaliteit/richtlijnen
- Nederlandse Vereniging voor Cardiologie. Multidisciplinaire richtlijn Hartrevalidatie 2024. Utrecht: Nederlandse Vereniging voor Cardiologie, 2024.
Beschikbaar via https://richtlijnendatabase.nl/richtlijn/hartrevalidatie/hartrevalidatie_-_startpagina.html - Neves CD, Lacerda AC, Lage VK, Lima LP, Fonseca SF, de Avelar NC, Teixeira MM, Mendonca VA. Cardiorespiratory responses and prediction of peak oxygen uptake during the shuttle walking test in healthy sedentary adult men. PLoS One. 2015;10(2):e0117563.
- Nijkrake MJ, Keus SH, Quist-Anholts GW, Overeem S, De Roode MH, Lindeboom R, Mulleners W, Bloem BR, Munneke M. Evaluation of a Patient-Specific Index as an outcome measure for physiotherapy in Parkinson’s disease. Eur J Phys Rehabil Med. 2009;45(4):507-12.
- Nitzan M, Romem A, Koppel R. Pulse oximetry: fundamentals and technology update. Med Devices (Auckl). 2014;7:231-9.
- Paluch AE, Bajpai S, Bassett DR, Carnethon MR, Ekelund U, Evenson KR, Galuska DA, Jefferis BJ, Kraus WE, Lee IM, Matthews CE, Omura JD, Patel AV, Pieper CF, Rees-Punia E, Dallmeier D, Klenk J, Whincup PH, Dooley EE, Pettee Gabriel K, Palta P, Pompeii LA, Chernofsky A, Larson MG, Vasan RS, Spartano N, Ballin M, Nordstrom P, Nordstrom A, Anderssen SA, Hansen BH, Cochrane JA, Dwyer T, Wang J, Ferrucci L, Liu F, Schrack J, Urbanek J, Saint-Maurice PF, Yamamoto N, Yoshitake Y, Newton RL, Jr., Yang S, Shiroma EJ, Fulton JE, Steps for Health C. Daily steps and all-cause mortality: a meta-analysis of 15 international cohorts. Lancet Public Health. 2022;7(3):e219-e28.
- Patel MS, Polsky D, Kennedy EH, Small DS, Evans CN, Rareshide CAL, Volpp KG. Smartphones vs wearable devices for remotely monitoring physical activity after hospital discharge: a secondary analysis of a randomized clinical trial. JAMA Netw Open. 2020;3(2):e1920677.
- Podsiadlo D, Richardson S. The timed “up & go”: a test of basic functional mobility for frail elderly persons. J Am Geriatr Soc. 1991;39(2):142-8.
- Pollentier B, Irons SL, Benedetto CM, Dibenedetto AM, Loton D, Seyler RD, Tych M, Newton RA. Examination of the six minute walk test to determine functional capacity in people with chronic heart failure: a systematic review. Cardiopulm Phys Ther J. 2010;21(1):13-21.
- Reynolds JM, Gordon TJ, Robergs RA. Prediction of one repetition maximum strength from multiple repetition maximum testing and anthropometry. J Strength Cond Res. 2006;20(3):584-92.
- Roberts SB, Bonnici DM, Mackinnon AJ, Worcester MC. Psychometric evaluation of the Hospital Anxiety and Depression Scale (HADS) among female cardiac patients. Br J Health Psychol. 2001;6(Part 4):373-83.
- Rodrigues A, Da Silva ML, Berton DC, Cipriano G, Jr., Pitta F, O’Donnell DE, Neder JA. Maximal inspiratory pressure: does the choice of reference values actually matter? Chest. 2017;152(1):32-9.
- Roitman J, ed. ACSM’s resource manual for guidelines for exercise testing and prescription. 4e druk. Philadelphia: Lippincott Williams & Wilkins; 2001.
- Rollman A, Naeije M, Visscher CM. The reproducibility and responsiveness of a patient-specific approach: a new instrument in evaluation of treatment of temporomandibular disorders. J Orofac Pain. 2010;24(1):101-5.
- Scherr J, Wolfarth B, Christle JW, Pressler A, Wagenpfeil S, Halle M. Associations between Borg’s rating of perceived exertion and physiological measures of exercise intensity. Eur J Appl Physiol. 2013;113(1):147-55.
- Schrama PP, Stenneberg MS, Lucas C, van Trijffel E. Intraexaminer reliability of hand-held dynamometry in the upper extremity: a systematic review. Arch Phys Med Rehabil. 2014;95(12):2444-69.
- Snaith RP. The hospital anxiety and depression scale. Health Qual Life Outcomes. 2003;1:29.
- Sorensen L, Mikkelsen LR, Jacobsen JS, Tjur M, Mechlenburg I. Reliability of the Danish version of the short questionnaire to assess health-enhancing physical activity (SQUASH). Physiother Theory Pract. 2018;34(8):637-42.
- Stark T, Walker B, Phillips JK, Fejer R, Beck R. Hand-held dynamometry correlation with the gold standard isokinetic dynamometry: a systematic review. PM R. 2011;3(5):472-9.
- Stens NA, Bakker EA, Mañas A, Buffart LM, Ortega FB, Lee DC, Thompson PD, Thijssen DHJ, Eijsvogels TMH. Relationship of daily step counts to all-cause mortality and cardiovascular events. J Am Coll Cardiol. 2023;10;82(15):1483-94.
- Stevens A, Beurskens A, Koke A, van der Weijden T. The use of patient-specific measurement instruments in the process of goal-setting: a systematic review of available instruments and their feasibility. Clin Rehabil. 2013;27(11):1005-19.
- Stevens A, Koke A, van der Weijden T, Beurskens A. The development of a patient-specific method for physiotherapy goal setting: a user-centered design. Disabil Rehabil. 2018;40(17):2048-55.
- Stevens A, Koke A, van der Weijden T, Beurskens A. Ready for goal setting? Process evaluation of a patient-specific goal-setting method in physiotherapy. BMC Health Serv Res. 2017;17(1):618.
- Swinkels R, Meerhof GA, Beekman E, Beurskens AJHM. Raamwerk Klinimetrie voor evidence based products. Amersfoort: Koninklijk Genootschap voor Fysiotherapie; 2016.
- Takken T. The steep ramp test: questions about sensitivity and reliability. Arch Phys Med Rehabil. 2008;89(8):1625.
- Ter Hoeve N, Keessen P, Den Uijl I, Visser B, Kraaijenhagen RA, Sunamura M, Scholte Op Reimer WJM, Latour CHM, Jorstad HT, Van den Berg-Emons HJG. Assessing changes in fear of movement in patients attending cardiac rehabilitation: responsiveness of the TSK-NL heart questionnaire. J Rehabil Med. 2022;54:jrm00328.
- Treskes RW, van Winden LA, van Keulen N, Atsma DE, van der Velde ET, van den Akker-van Marle E, Mertens B, Schalij MJ. Using smart technology to improve outcomes in myocardial infarction patients: rationale and design of a protocol for a randomized controlled trial, the box. JMIR Res Protoc. 2017;6(9):e186.
- Tudor-Locke C, Bassett DR, Jr. How many steps/day are enough? Preliminary pedometer indices for public health. Sports Med. 2004;34(1):1-8.
- Tudor-Locke C, Hart TL, Washington TL. Expected values for pedometer-determined physical activity in older populations. Int J Behav Nutr Phys Act. 2009;6:59.
- van Beek MH, Voshaar RC, van Deelen FM, van Balkom AJ, Pop G, Speckens AE. The cardiac anxiety questionnaire: cross-validation among cardiac inpatients. Int J Psychiatry Med. 2012;43(4):349-64.
- van der Ploeg RJ, Fidler V, Oosterhuis HJ. Hand-held myometry: reference values. J Neurol Neurosurg Psychiatry. 1991;54(3):244-7.
- Wagenmakers R, van den Akker-Scheek I, Groothoff JW, Zijlstra W, Bulstra SK, Kootstra JW, Wendel-Vos GC, van Raaij JJ, Stevens M. Reliability and validity of the short questionnaire to assess health-enhancing physical activity (SQUASH) in patients after total hip arthroplasty. BMC Musculoskelet Disord. 2008;9:141.
- Wendel-Vos GC, Schuit AJ, Saris WH, Kromhout D. Reproducibility and relative validity of the short questionnaire to assess health-enhancing physical activity. J Clin Epidemiol. 2003;56(12):1163-9.
- Wilson S, Cecins N, Jenkins S, Melang M, Singh B, Hill K. Comparing finger and forehead sensors to measure oxygen saturation in people with chronic obstructive pulmonary disease. Respirology. 2013;18(7):1143-7.
- World Health Organisation. Every move counts towards better health – says WHO. World Health Organisation (WHO); 2020. Beschikbaar via: https://www.who.int/news/item/25-11-2020-every-move-counts-towards-better-health-says-who.
- Zigmond AS, Snaith RP. The hospital anxiety and depression scale. Acta Psychiatr Scand. 1983;67(6):361-70.
B.7 Indicatiestelling
Aanbevelingen
Bepaal op basis van de verwijsgegevens, de anamnese en het lichamelijk onderzoek (zie B.4 ‘Anamnese’ en B.5 ‘Lichamelijk onderzoek en behandelplan’) of er een fysio- of oefentherapeutische indicatie is voor een beweegprogramma van fase II-hartrevalidatie.
Er is een indicatie om een beweegprogramma van fase II-hartrevalidatie te starten wanneer:
- een patiënt met coronairlijden of chronisch hartfalen bij de fysio- of oefentherapeut komt met een hulpvraag die gerelateerd is aan beperkingen in dagelijkse activiteiten en/of maatschappelijke participatie op basis van het bewegend functioneren, en;
- de essentiële onderdelen, genoemd in B.1 ‘Persoonsgerichte zorg’ hierbij in overweging zijn genomen.
Onderbouwing
Deze module is niet op basis van een geprioriteerd knelpunt in de richtlijn opgenomen. Iedere richtlijn van het Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF) bevat een module ‘Indicatiestelling’.
Aanleiding
Na fase I-hartrevalidatie verwijst de behandelend cardioloog* de patiënt door voor fase II-hartrevalidatie. In deze module staan de absolute en relatieve indicaties, de contra-indicaties en de restricties bij de verwijzing beschreven, waartoe onderstaande uitgangsvraag is geformuleerd;
Uitgangsvraag
Waaruit bestaat de fysio- of oefentherapeutische indicatiestelling voor het beweegprogramma van fase II-hartrevalidatie bij patiënten met coronairlijden of chronisch hartfalen?
Rationale van de aanbeveling
In overleg met de werkgroep is besloten om geen systematische zoekactie uit te voeren, maar de informatie die nodig is voor het beantwoorden van deze uitgangsvraag op niet-systematische wijze te vergaren en narratief uit te werken met behulp van de kennis en klinische expertise van de werkgroep en om aan te sluiten bij de ‘Multidisciplinaire richtlijn hartrevalidatie 2024 (opent in nieuw tabblad) ’ (NVVC).
Screening door hartrevalidatiecoördinator
Alle patiënten met een indicatie voor hartrevalidatie komen in aanmerking voor een screening en een intakegesprek, die worden uitgevoerd door een professional uit het revalidatieteam, veelal de hartrevalidatiecoördinator. Deze intake en screening vormen de start van de fase II van de hartrevalidatie. Aan de hand van deze gegevens wordt in overleg met de patiënt bepaald welk zorgaanbod geïndiceerd is.
De uitkomst van de indicatiestelling voor interventies wordt besproken tijdens het multidisciplinair overleg (MDO), waarna de patiënt wordt verwezen naar de verschillende disciplines, waaronder het beweegprogramma, dat wordt uitgevoerd door een fysio- of oefentherapeut. Hierna volgt een discipline-specifieke intake.
Een verdere toelichting op dit proces is beschreven in de ‘Multidisciplinaire richtlijn hartrevalidatie 2024 (opent in nieuw tabblad) ’ (NVVC).
Doelen in het hartrevalidatieprogramma
Om persoonsgerichte hartrevalidatie te kunnen bieden, wordt samen met de patiënt besloten welke individuele behandeldoelen de patiënt wil bereiken en welke interventies in welke vorm gevolgd worden. Zie ook de module B.1 ‘Persoonsgerichte zorg’.
Binnen de multidisciplinaire hartrevalidatie zijn er vier typen doelen:
- fysieke doelen (zie B.4 ‘Lichamelijk onderzoek en behandelplan’);
- psychische doelen;
- sociale doelen;
- doelen met betrekking tot risicogedrag.
Een verdere toelichting op dit proces is beschreven in de ‘Multidisciplinaire richtlijn Hartrevalidatie 2024’ (opent in nieuw tabblad) ’ (NVVC).
Indicatie, contra-indicaties en restricties voor het beweegprogramma (discipline-specifieke intake)
Voordat patiënten deelnemen aan het beweegprogramma zal de fysio- of oefentherapeut een disciplinespecifieke intake uitvoeren, die bestaat uit een anamnese, een lichamelijk onderzoek en op grond daarvan het opstellen van een behandelplan. Zie B.4 ‘Anamnese’ en B.5 ‘Lichamelijk onderzoek en behandelplan’.
Er wordt naar gestreefd om samen met de patiënt een gepast behandelplan voor de patiënt te vormen. Hierbij wordt tevens in overweging genomen of de context waarbinnen het beweegprogramma van fase II-hartrevalidatie wordt uitgevoerd, past bij de essentiële onderdelen van persoonsgerichte zorg (zie B.1 ‘Persoonsgerichte zorg’.
Algemene contra-indicaties voor fysieke training zijn niet-cardiale ziekten waarbij beweging of inspanning (tijdelijk) niet mogelijk of gewenst is. Denk bijvoorbeeld aan: koorts, slecht gereguleerde diabetes mellitus, ernstige anemie, desaturatie. Daarnaast zijn er cardiale contra-indicaties.
Een verdere toelichting op deze cardiale en overige contra-indicaties is beschreven in de ‘Multidisciplinaire richtlijn hartrevalidatie 2024 (opent in nieuw tabblad) ’ (NVVC). Daarnaast is de cardioloog verantwoordelijk om de contra-indicaties en restricties over te dragen aan de behandelaren van de patiënt.
Er is geen verantwoording bij deze module.
- Nederlandse Vereniging voor Cardiologie. Multidisciplinaire richtlijn Hartrevalidatie 2024. Utrecht: Nederlandse Vereniging voor Cardiologie, 2024.
Beschikbaar via https://richtlijnendatabase.nl/richtlijn/hartrevalidatie/hartrevalidatie_-_startpagina.html

