Diagnostisch proces
B.1 Diagnose, lichamelijk onderzoek en rode vlaggen
Deze paragraaf betreft:
- Anamnese (paragraaf B.1.1)
- Lichamelijk onderzoek (paragraaf B.1.2)
- Rode vlaggen (paragraaf B.1.3)
B.1.1 Anamnese
Het doel van de anamnese is de aan lage rugpijn en LRS gerelateerde gezondheidsproblemen te inventariseren middels een vraaggesprek. Ook het opvragen van additionele verwijsgegevens behoort tot de anamnese.
Geïnventariseerd worden in ieder geval de hulpvraag, rode vlaggen (zie B.1.3 ‘Rode vlaggen’) en etiologische en prognostische factoren (zie A.2.4 ‘Etiologische en prognostische factoren’). Op basis van de vergaarde informatie voert de fysio- of oefentherapeut gericht lichamelijk onderzoek uit en wordt bepaald of er een indicatie is voor therapie. Vervolgens worden aangrijpingspunten voor de behandeling in kaart gebracht.
Overzicht van de relevante onderwerpen die aan bod kunnen komen in de anamnese
Centraal
- hulpvraag van de patiënt
Functies en anatomische eigenschappen
- duur, wijze van ontstaan en beloop van de klachten
- lokalisatie, intensiteit en aard van de pijn
- continue of intermitterende pijn
- aanwezigheid en lokalisatie van uitstraling pijn naar één of beide billen en/of benen
- invloed van rust, slaap, en (specifieke) bewegingen en houdingen op de klachten
- invloed van drukverhogende momenten, zoals hoesten, niezen en persen, op de pijn in het been
- eerdere rugklachten (duur, wijze van ontstaan, beloop, lokalisatie pijn, etc.)
- krachtverlies, sensibiliteitsstoornissen
- mictie-/defecatieklachten
Activiteiten en participatie
- mate van belemmering in het dagelijks functioneren thuis, op het werk, op school en in de vrije tijd (hobby’s en lichaamsbeweging)
- aanwezigheid van comorbiditeit en daaraan gerelateerde ervaren beperkingen in activiteiten en participatie (aangevuld met verwijsgegevens)
- balans tussen belasting en belastbaarheid
- seksuele klachten
Externe factoren
- thuissituatie (financieel, gezinssituatie, etc.)
- sociaal netwerk en ondersteuning (partner, familie, vrienden, werk)
- situatie met betrekking tot werk (wel/geen betaald werk, relatie met collega’s, financiële compensatie, tevredenheid met werk, zekerheden voor het behouden van de baan, sociale ondersteuning op het werk, mogelijkheden om werkzaamheden zelf in te vullen, fysieke en mentale belasting tijdens werk).
Persoonlijke factoren
- algehele malaise, onverklaard gewichtsverlies, koorts, nachtzweten
- algemene gezondheidstoestand (roken, body mass index (BMI), hanteren beweegnorm, etc.)
- medische voorgeschiedenis en huidige status: maligniteit in de voorgeschiedenis, (positieve) therapieën, specialisten, beeldvormend onderzoek, medische diagnoses, operaties, medicatie, letselsschadeprocedure, etc.
- mate van psychologische en psychosociale stress, pijngerelateerde bewegingsangst, depressieve gevoelens of klachten en catastroferen
- ideeën en verwachtingen over het ontstaan en voortbestaan van de klachten
- zorgen, specifieke vragen en verwachting ten aanzien van de therapie
- mate van bereidheid/motivatie/beheersingsstrategieën (zelfeffectiviteit, coping).
Onderbouwing
Aanleiding
De afgelopen jaren hebben zich in de praktijk en op basis van de literatuur ontwikkelingen voorgedaan op grond waarvan herziening gewenst was van de aanbevelingen omtrent de anamnese zoals beschreven in de KNGF-richtlijn uit 2013 (KNGF 2013).
Uitgangsvraag
Welke informatie wordt tijdens de anamnese bij een patiënt met lage rugpijn verzameld?
Methode
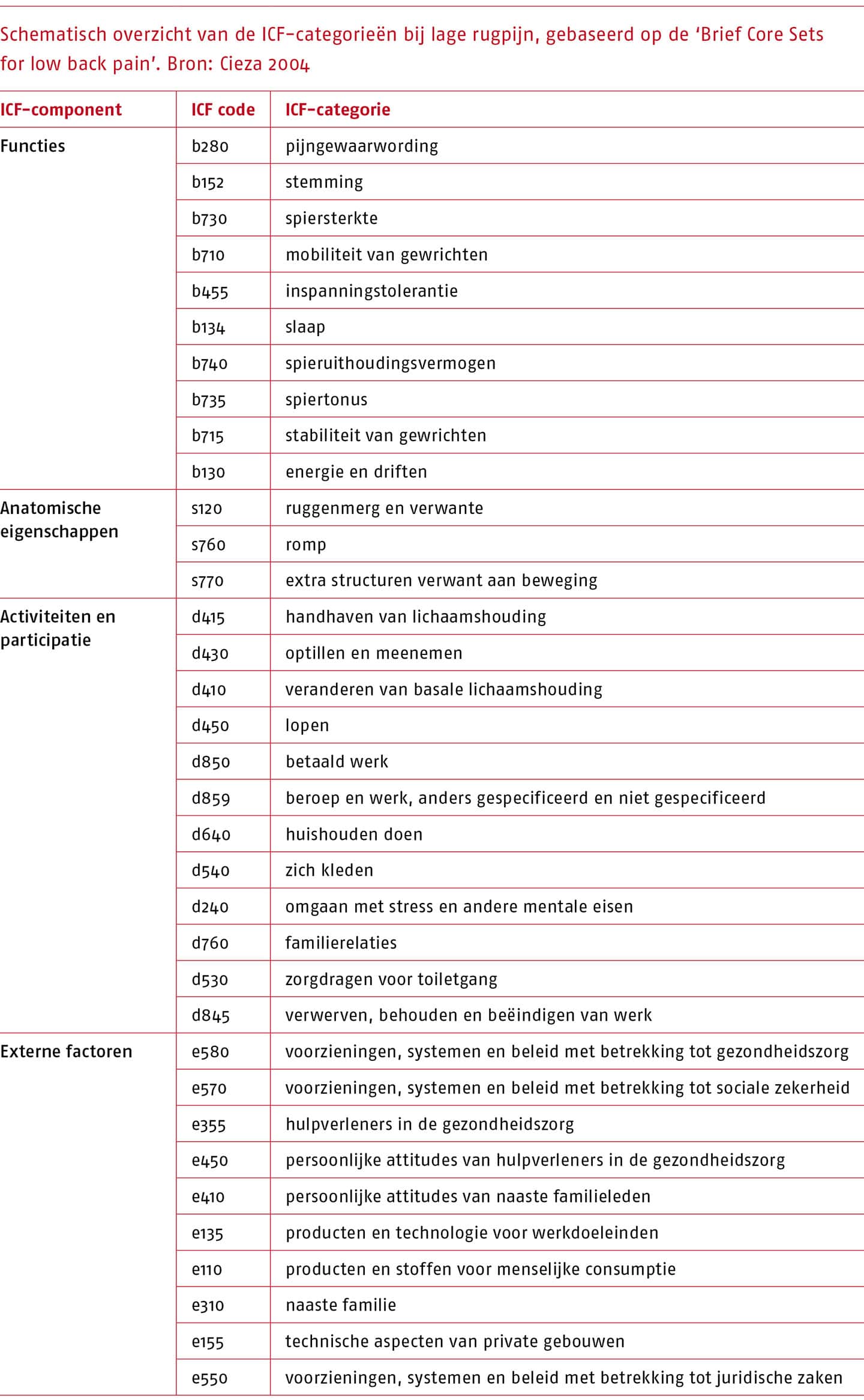
Bij de uitwerking van deze uitgangsvraag is in overleg met de werkgroep gebruikgemaakt van de verkorte ICF Core Set voor lage rugpijn (Oorspr. ‘Brief Core Sets for low back pain’ (Cieza 2004)).
De aanbevelingen zijn tot stand gekomen met gebruik van de genoemde literatuur (evidentie) en klinische expertise, patiëntvoorkeuren en voorkeuren en waarden van de leden van de werkgroep en klankbordgroep (overwegingen). Samen bepalen zij de richting, sterkte en formulering van de aanbeveling.
Conclusies op basis van de literatuur
Welke relevante informatie moet worden uitgevraagd tijdens de anamnese is geïnventariseerd aan de hand van de ‘International Classification of Functioning, Disability and Health’ (ICF) (Heerkens 2002).
Voor lage rugpijn is een verkorte ICF ‘core set’ ontwikkeld middels een literatuuronderzoek en een formeel besluitvormings- en consensusproces van internationale experts met verschillende achtergronden (Cieza 2004). Deze verkorte ‘ICF Core Set’ bevat voor mensen met lage rugpijn de meest relevante aspecten van het gezondheidsprobleem, geordend naar de domeinen ‘functies en anatomische eigenschappen’, ‘activiteiten’, ‘participatie’, ‘externe factoren’ en ‘persoonlijke factoren’. De ‘core set’ vormt de basis voor de anamnese bij patiënten met lage rugpijn.
De ICF-categorieën zijn opgenomen in de volgende tabel.
Conclusies op basis van de overwegingen
De items uit de ‘ICF core set’ zijn door de werkgroep gescreend op de toepasbaarheid voor de anamnese en aangevuld met informatie die nodig is om rode vlaggen en risicofactoren te identificeren voor het ontstaan van lage rugpijn en voor aanhoudende klachten. In aanvulling op de ‘core set’ acht de werkgroep het tevens van belang tijdens de anamnese te vragen naar comorbiditeit.
Om te beoordelen of er sprake is van bekkenbodemproblematiek kan de therapeut vragen naar mictie-, defecatie- en seksuele klachten. Bekkenproblematiek komt zowel bij mannen als vrouwen voor. Denk hierbij aan ongewenst verlies van urine of ontlasting, obstipatie, pijnklachten en/of ongemak tijdens vrijen, bekkenpijn en/of klachten tijdens of na een zwangerschap en een zwaar of moe gevoel van onderen. Hierbij kan de therapeut eventueel gebruikmaken van de ‘Vragenlijst bekkenbodemdisfuncties’ (Hanemaaijer-Slottje 2019); er zijn echter nog geen klinimetrische eigenschappen bekend van deze vragenlijst.
De ‘Numeric rating scale’ (NRPS) wordt aanbevolen voor het meten van functies en anatomische eigenschappen, de Patiënt Specifieke Klachten (PSK) en de ‘Quebec Back Pain Disability Scale’ (QBPDS) voor het meten van activiteiten en voor het meten van participatie opnieuw PSK (zie B.3 ‘Meetinstrumenten’).
- Cieza A, Stucki G, Weigl M, Disler P, Jackel W, van der Linden S, Kostanjsek N, de Bie R. ICF Core Sets for low back pain. J Rehabil Med. 2004(44 Suppl):69-74.
- Hanemaaijer-Slottje R, Moossdorff-Steinhauser H. Een gemiste bron van lage rugpijn. FysioPraxis. 2019;28(2):22-4.
- Heerkens YF, Hirs WM, de Kleijn-de Vrankrijker M, van Ravenberg CD, Ten Napel H. Nederlandse vertaling van de ‘International Classification of Functioning, Disability and Health’. Bilthoven: Nederlands WHO-FIC Collaborating Centre. Rijksinstituut voor Volkgsgezondheid en Milieu (RIVM); 2002. Beschikbaar via: https://apps.who.int/iris/bitstream/handle/10665/42407/903133913X-dut.pdf;jsessionid=1946BBFC2D0CD5BD97CF56117669B00C?sequence=117. Geraadpleegd op 15 december 2019.
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF). KNGF-richtlijn Lage rugpijn. Amersfoort: KNGF; 2013.
B.1.2 Lichamelijk onderzoek
Het doel van het lichamelijk onderzoek is om, in aansluiting op de anamnese, het aan lage rugpijn gerelateerde gezondheidsprobleem nader te onderzoeken.
Het lichamelijk onderzoek bestaat uit een inspectie en een bewegingsonderzoek. Indien vanuit de anamnese een ernstige aandoening wordt vermoed, kan indien dit relevant is, de patiënt hierop specifiek worden onderzocht. Een overzicht van relevante aspecten die aan bod kunnen komen in het lichamelijk onderzoek, staat in het volgende overzicht.
Overzicht van relevante aspecten die aan bod kunnen komen in het lichamelijk onderzoek zijn:
Inspectie
- beoordelen van het beweeggedrag
- bepalen van de lokalisatie van de klachten, zoals pijn en verminderde sensoriek
- beoordelen van de algemene statiek (stand van de wervelkolom, bekken en benen) en van de lumbale wervelkolom in het bijzonder
- inspecteren van de huid (zwelling, kleur, littekens, haargroei, vlekken, zweetsecretie)
- beoordelen van spieren of spiergroepen (symmetrie, contouren, omvang)
- beoordelen van het ademhalingspatroon
- onderzoek van de spiertonus en de triggerpoints
- onderzoek van de huid (verschuifbaarheid en oppakbaarheid)
Bewegingsonderzoek
- functioneel bewegingsonderzoek:
- beoordelen van de uitvoering en de kwaliteit van bewegen tijdens activiteiten waarbij klachten worden aangegeven
- beoordelen van het (trap)lopen, bukken, transfers, aan- en uitkleden en andere voor de patiënt relevante ADL-activiteiten
- beoordelen van het gebruik van hulpmiddelen
- actief bewegingsonderzoek van de lumbale wervelkolom en het bekken:
- beoordelen van de functie van de lumbale wervelkolom en het bekken, de spieren, de fascie en het zenuwstelsel op onder andere: mobiliteit, rekbaarheid, rekgevoeligheid, contractiegevoeligheid
- beoordelen van de spierkracht
- beoordelen van de neuromotorische controle (bijv. vloeiende of afwijkende/aberrante bewegingen), stabiliteit en evenwicht
- onderzoek naar pijnprovocerende en -reducerende houdingen en bewegingen
- passief bewegingsonderzoek van de lumbale wervelkolom en het bekken:
- beoordelen van de functie van de lumbale wervelkolom en het bekken, spieren, fascie, en zenuwstelsel op onder andere: mobiliteit, rekbaarheid, rekgevoeligheid, bewegingsweerstand en eindgevoel
- onderzoek van de biomechanisch en fysiologisch gerelateerde gewrichten van de lumbale werverkolom en het bekken, namelijk de thoracale wervelkolom, en de heupen
Lumbosacraal radiculair syndroom (LRS)
Als op basis van de anamnese een vermoeden bestaat op een LRS, voert de therapeut een neurologisch onderzoek uit. De tests binnen dit onderzoek staan in het volgende overzicht.
Aanbevelingen
Voer bij de patiënt met een vermoeden op een LRS, bijvoorbeeld bij symptomen onder de knie, een neurologisch onderzoek uit.
Wees bij de patiënt met een LRS alert op spoedindicaties, in de vorm van kenmerken van een ernstig neurologisch probleem (zie B.1.3 ‘Rode vlaggen’).
Verwijs de patiënt met een LRS en ernstige motorische uitval (MRC-score ≤ 3 uit 5), en/of ernstige pijn (NPRS ≥ 8) naar de huisarts. Controleer de overige patiënten met LRS na twee tot vier dagen en handel volgens de aanbevelingen in deze richtlijn.
Verwijs de patiënt met een LRS naar de huisarts wanneer er twijfel over bestaat of de medicatie voldoende hoog gedoseerd is.
Onderbouwing
Aanleiding
De afgelopen jaren hebben zich in de praktijk en op basis van de literatuur ontwikkelingen voorgedaan op grond waarvan herziening gewenst was van de aanbevelingen omtrent het lichamelijk onderzoek zoals beschreven in de KNGF-richtlijn uit 2013 (KNGF 2013).
Uitgangsvraag
Welke informatie wordt tijdens het lichamelijk onderzoek bij een patiënt met lage rugpijn verzameld?
Methode
Voor de beantwoording van de uitgangsvraag is in overleg met de werkgroep gebruikgemaakt van literatuur die is geïdentificeerd op basis van een systematische zoekactie naar evidence-based richtlijnen en systematische literatuuronderzoeken. Deze zoekactie is aangevuld met informatie uit nationale richtlijnen voor lage rugpijn.
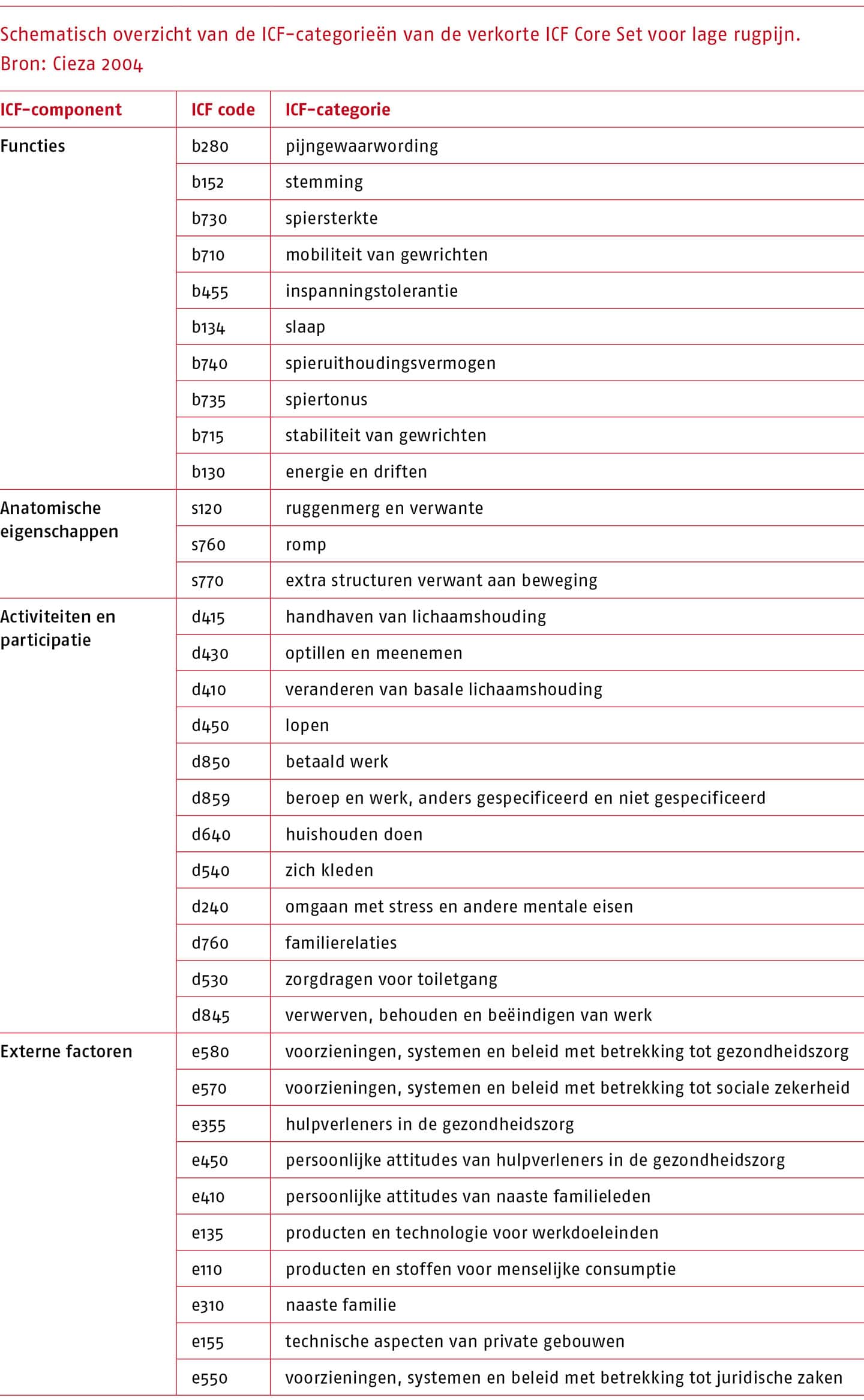
Bij de uitwerking van deze uitgangsvraag is in overleg met de werkgroep gebruikgemaakt van de verkorte ICF Core Set voor lage rugpijn (Oorspr. ‘Brief Core Sets for low back pain’ (Cieza 2004)).
De aanbevelingen zijn tot stand gekomen conform de ‘KNGF Richtlijnenmethodiek 2019’ (Driehuis 2019).
Conclusies op basis van de literatuur
Het aanbod aan klinische tests voor lichamelijk onderzoek van de lage rug is ruim en gevarieerd. Voor veel klinische tests zijn de klinimetrische aspecten als interbeoordelaarsbetrouwbaarheid, betekenisvaliditeit (inhouds- én constructvaliditeit) en prognostische waarde gering of onvoldoende aangetoond of niet onderzocht (Alqarni 2011; Cook 2011; Denteneer 2017; Hartvigsen 2015).
Het lichamelijk onderzoek van de lage rug in voorliggende richtlijn is primair gebaseerd op de onderzoekscategorieën van de ‘International Classification of Functioning, Disability and Health’ (ICF) (Delitto 2012; Heerkens 2002).
Voor lage rugpijn is een verkorte ICF ‘core set’ ontwikkeld middels een literatuuronderzoek en een formeel besluitvormings- en consensusproces van internationale experts met verschillende achtergronden (Cieza 2004). Deze verkorte ‘ICF Core Set’ bevat voor mensen met lage rugpijn de meest relevante aspecten van het gezondheidsprobleem. De ICF-categorieën zijn opgenomen in de volgende tabel.

Conclusies op basis van de overwegingen
De items uit de ICF Core Set zijn door de werkgroep gescreend op de toepasbaarheid voor het lichamelijk onderzoek en aangevuld met relevante informatie, bijvoorbeeld ten behoeve van de identificatie van rode vlaggen.
Een belangrijke doelstelling van het lichamelijk onderzoek is het evalueren en uitsluiten van onderliggende, ernstige aandoeningen. Indien vanuit de anamnese een ernstige aandoening wordt vermoed, of bij twijfel (‘niet-pluis’gevoel), wordt de patiënt hierop specifiek onderzocht tenzij dit niet relevant is. Bij een ‘niet-pluis’gevoel (zoals een combinatie van alarmsymptomen vanuit anamnese en/of lichamelijk onderzoek of lage rugklachten in combinatie met een negatief bewegingsonderzoek), is er mogelijk geen indicatie voor fysio- of oefentherapie en wordt de patiënt geadviseerd contact op te nemen met de (huis)arts (zie B.1.3 ‘Rode vlaggen’).
Voor veel klinische tests zijn de klinimetrische eigenschappen en wetenschappelijke onderbouwing (zeer) beperkt. Het is hierdoor onmogelijk om één enkel specifiek klinisch onderzoek aan te bevelen. Daarom beveelt de werkgroep een lichamelijk onderzoek aan dat zich richt op verschillende functies en activiteiten om, in combinatie met de bevindingen uit de anamnese, te komen tot een initiële hypothese en een behandelstrategie.
Lumbosacraal radiculair syndroom (LRS)
Bij het vermoeden van een LRS wordt een neurologisch onderzoek uitgevoerd. Dit onderzoek bestaat minimaal uit een onderzoek van de pijndistributie, de vinger-vloerafstand bij vooroverbuigen (positief bij een afstand > 25 cm) (Vroomen 2002), de test van Lasègue (passieve ‘Straight Leg Raise’ [SLR]), de gekruiste test van Lasègue of de omgekeerde test van Lasègue en onderzoek van de spierkracht, de sensibiliteit en de peesreflexen. Bij positieve bevindingen dient te worden geëvalueerd of de testresultaten in lijn zijn met het verzorgingsgebied van de spinale zenuwen. Hierbij moet men zich wel realiseren dat niet alle patiënten met radiculaire pijn een pijnpatroon hebben volgens de bekende dermatogene pijnpatronen. Een mogelijke uitzondering is het S1-syndroom, waarbij de pijn meestal het S1-dermatoom volgt (sensitiviteit 0,65 en specificiteit 0,80) (Murphy 2009). Ook is bekend dat sensibiliteitsstoornissen bij neuropathische pijn zeer divers kunnen zijn; denk aan hyperesthesie, hypo-esthesie, hyperalgesie, hypoalgesie, allodynie, paresthesie, dysesthesie, ‘aftersensations’, etc. (Nijs 2015).
Geen van de tests uit het neurologisch onderzoek is voldoende sensitief en specifiek voor het vaststellen van de oorzaak van radiculaire pijn, zoals een discushernia (Al Nezari 2013; Scaia 2012; van der Windt 2010). De resultaten uit het lichamelijk onderzoek dienen daarom altijd gecombineerd te worden met de anamnestische gegevens. Radiculaire pijn zonder motorische uitval sluit de diagnose niet uit, maar de aanwezigheid van passende symptomatologie maakt de diagnose wel veel zekerder. Ook is in zeldzame gevallen motorische uitval mogelijk zonder pijn.
Symptomen onder de knie zijn suggestief voor een LRS, omdat het L5-syndroom (45%) en het S1-syndroom (45%) de meest voorkomende LRS-syndromen zijn.
Functionele Capaciteit Evaluatie
Om een indruk te krijgen van het (weer) kunnen uitvoeren van (arbeidsgerelateerde) activiteiten kunnen testprotocollen toegepast worden die bekend staan onder de verzamelnaam Functionele Capaciteit Evaluatie (FCE). FCE’s worden vooral gebruikt voor de evaluatie van re-integratiemogelijkheden. In de richtlijn voor bedrijfsartsen en verzekeringsartsen wordt een FCE aanbevolen als mogelijk aanvullend meetinstrument (Luites 2021). FCE’s bevatten vele tests, maar er zijn ook protocollen die beduidend korter zijn en met enige training toepasbaar zijn in de eerste lijn (Reneman 2018).
In de afgelopen jaren is in de wetenschappelijke literatuur veel aandacht besteed aan FCE’s en de klinimetrische eigenschappen ervan. Instrumenten zoals dynamische rompmetingen, de Zes Minuten Wandeltest, de ‘Baltimore Therapeutic Equipment (BTE) work simulator’ en de ‘performance based tiltest’, lijken een voorspellende waarde te hebben voor toekomstig werkgerelateerd functioneren, zoals snellere werkhervatting, verminderde uitval na initiële werkhervatting en beter functioneren op het werk (De Baets 2018; Hegmann 2019).
- Al Nezari NH, Schneiders AG, Hendrick PA. Neurological examination of the peripheral nervous system to diagnose lumbar spinal disc herniation with suspected radiculopathy: a systematic review and meta-analysis. Spine. 2013;13(6):657-74.
- Alqarni AM, Schneiders AG, Hendrick PA. Clinical tests to diagnose lumbar segmental instability: a systematic review. J Orthop Sports Phys Ther. 2011;41(3):130-40.
- Cieza A, Stucki G, Weigl M, Disler P, Jackel W, van der Linden S, Kostanjsek N, de Bie R. ICF Core Sets for low back pain. J Rehabil Med. 2004(44 Suppl):69-74.
- Cook C, Hegedus E. Diagnostic utility of clinical tests for spinal dysfunction. Man Ther. 2011;16(1):21-5.
- De Baets S, Calders P, Schalley N, Vermeulen K, Vertriest S, Van Peteghem L, Coussens M, Malfait F, Vanderstraeten G, Van Hove G, van de Velde D. Updating the evidence on functional capacity evaluation methods: a systematic review. J Occup Rehabil. 2018;28(3):418-28.
- Delitto A, George SZ, van Dillen L, Whitman JM, Sowa G, Shekelle P, Denninger TR, Godges JJ, Orthopaedic Section of the American Physical Therapy A. Low back pain. J Orthop Sports Phys Ther. 2012;42(4):A1-57.
- Denteneer L, Stassijns G, De Hertogh W, Truijen S, Van Daele U. Inter- and intrarater reliability of clinical tests associated with functional lumbar segmental instability and motor control impairment in patients with low back pain: a systematic review. Arch Phys Med Rehabil. 2017;98(1):151-64 e6.
- Hartvigsen L, Kongsted A, Hestbaek L. Clinical examination findings as prognostic factors in low back pain: a systematic review of the literature. Chiropr Man Therap. 2015;23:13.
- Heerkens YF, Hirs WM, de Kleijn-de Vrankrijker M, van Ravenberg CD, Ten Napel H. Nederlandse vertaling van de ‘International Classification of Functioning, Disability and Health’. Bilthoven: Nederlands WHO-FIC Collaborating Centre. Rijksinstituut voor Volkgsgezondheid en Milieu (RIVM); 2002. Beschikbaar via: https://apps.who.int/iris/bitstream/handle/10665/42407/903133913X-dut.pdf; jsessionid=1946BBFC2D0CD5BD97CF56117669B00C?sequence=117. Geraadpleegd op 13 januari 2020.
- Hegmann KT, Travis R, Belcourt RM, Donelson R, Eskay-Auerbach M, Galper J, Haldeman S, Hooper PD, Lessenger JE, Mayer T, Mueller KL, Murphy DR, Tellin WG, Thiese MS, Weiss MS. Diagnostic tests for low back disorders. J Occup Environ Med. 2019;61(4):e155-e68.
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF). KNGF-richtlijn lage rugpijn. Amersfoort: KNGF; 2013.
- Luites JWH, Kuijer PPFM, Hulshof CTJ, Kok R, Langendam M, Oosterhuis T, Hoving JL. Richtlijn lage rugpijn en lumbosacraal radiculair syndroom (concept). Utrecht: Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde (NVAB); 2020. Beschikbaar via: https://nvab-online.nl/richtlijnen/richtlijnen-NVAB. Geraadpleegd op 13 januari 2020.
- Murphy DR, Hurwitz EL, Gerrard JK, Clary R. Pain patterns and descriptions in patients with radicular pain: does the pain necessarily follow a specific dermatome? Chiropr Osteopat. 2009;17:9.
- Nijs J, Apeldoorn A, Hallegraeff H, Clark J, Smeets R, Malfliet A, Girbes EL, De Kooning M, Ickmans K. Low back pain: guidelines for the clinical classification of predominant neuropathic, nociceptive, or central sensitization pin. Pain Physician. 2015;18(3):E333-46.
- Reneman MF. Functionele Capaciteiten Evaluatie; belastbaarheid voor werk meten. Fysiopraxis. 2018;17(3):12-3.
- Scaia V, Baxter D, Cook C. The pain provocation-based straight leg raise test for diagnosis of lumbar disc herniation, lumbar radiculopathy, and/or sciatica: a systematic review of clinical utility. J Back Musculoskelet Rehabil. 2012;25(4):215-23.
- van der Windt DA, Simons E, Riphagen, II, Ammendolia C, Verhagen AP, Laslett M, Deville W, Deyo RA, Bouter LM, de Vet HC, Aertgeerts B. Physical examination for lumbar radiculopathy due to disc herniation in patients with low-back pain. The Cochrane database of systematic reviews. 2010(2):CD007431.
- Vroomen PC, de Krom MC, Wilmink JT, Kester AD, Knottnerus JA. Diagnostic value of history and physical examination in patients suspected of lumbosacral nerve root compression. J Neurol Neurosurg Psychiatry. 2002;72(5):630-4.
B.1.3 Rode vlaggen
Het is belangrijk alert te zijn op kenmerken die kunnen wijzen op een onderliggende, zeldzame, ernstige pathologie, zoals kanker, een infectie, een trauma, een inflammatoire aandoening, of op ernstige neurologische problemen, zoals het cauda-equinasyndroom. Een enkel kenmerk hoeft niet direct op ernstige pathologie te wijzen; een combinatie van meerdere kenmerken vergroot de waarschijnlijkheid dat de klachten door een specifieke aandoening worden veroorzaakt (zie de volgende tabel).

Aanbevelingen
Beoordeel of er kenmerken zijn die kunnen wijzen op een onderliggende, zeldzame, ernstige pathologie, zoals weergegeven in de tabel.
Neem bij een vermoeden op ernstige pathologie of bij twijfel (‘niet-pluisgevoel’) altijd contact op met de huisarts of verwijzer.
Onderbouwing
Aanleiding
De afgelopen jaren hebben zich in de praktijk en op basis van de literatuur ontwikkelingen voorgedaan op grond waarvan herziening gewenst was van de aanbevelingen omtrent rode vlaggen zoals beschreven in de KNGF-richtlijn uit 2013 (KNGF 2013).
Uitgangsvraag
Wanneer is terugverwijzen van patiënten met lage rugpijn naar de huisarts op basis van alarmsymptomen nodig?
Methode
Voor de beantwoording van de uitgangsvraag is in overleg met de werkgroep gebruikgemaakt van literatuur die is geïdentificeerd op basis van een systematische zoekactie naar evidence-based richtlijnen en systematische literatuuronderzoeken. Deze zoekactie is aangevuld met informatie uit nationale richtlijnen voor lage rugpijn.
De aanbevelingen zijn tot stand gekomen conform de ‘KNGF Richtlijnenmethodiek 2019’ (Driehuis 2019). Ze sluiten in belangrijke mate aan bij de aanbevelingen van het Britse ‘National Institute for Health and Care Excellence’ (NICE) (De Campos 2017) en de richtlijn van het ‘Belgian Health Care Knowledge Centre’ (KCE) (Van Wambeke 2017).
Conclusies op basis van de literatuur
Alarmsymptomen zijn tekenen of signalen die alleen, of in combinatie, worden gebruikt om patiënten te screenen op de mogelijke aanwezigheid van een ernstige, specifieke oorzaak (rode vlag) van de lage rugpijn. De ernstige onderliggende pathologie waarop deze alarmsymptomen kunnen duiden, zijn aandoeningen zoals een (osteoporotische) wervelfractuur, een maligniteit, een ontsteking zoals bij axiale spondylartritis (axiale SpA), intra-abdominale problematiek zoals appendicitis en cystitis, of ernstige vormen van kanaalstenose en spondylolisthesis.
Ondanks de importantie van het screenen op alarmsymptomen en rode vlaggen blijkt de diagnostische accuratesse van de meeste alarmsymptomen beperkt (Cook 2018; Downie 2014; Enthoven 2016; Henschke 2009; Premkumar 2018; Tsiang 2019; Underwood 2009, 2013). De meeste patiënten (80-90%) met lage rugpijn hebben minimaal één alarmsymptoom, terwijl de kans dat een patiënt met lage rugpijn met spoed verwezen en behandeld moet worden klein is (Henschke 2009). Galliker analyseerde 22 studies (n = 41.320) waarbij patiënten verwezen waren naar de Spoedeisende Hulp (SEH) (Galliker 2020). Het bleek dat bij 0,7 tot 7,4% van de patiënten sprake was van serieuze pathologie. De kans op een foutpositieve score van rode vlaggen is hoog en de kans op een onnodige verwijzing groot (Grunau 2018; Henschke 2009; Premkumar 2018). Er zijn aanwijzingen dat de diagnostische accuratesse enigszins toeneemt indien verschillende alarmsymptomen voorkomen volgens specifieke clusters, maar hiervoor is weinig bewijs en de klinische relevantie van alarmsymptomen blijft beperkt (Downie 2014; Enthoven 2016; Premkumar 2018).
Conclusies op basis van de overwegingen
De werkgroep acht het van belang patiënten met lage rugpijn op alarmsymptomen en rode vlaggen te screenen om daarmee de kans op het missen van ernstige pathologie te verkleinen. Patiënten bij wie een vermoeden bestaat dat de klachten een specifieke oorzaak hebben, of bij twijfel, worden verwezen naar de huisarts.
Aangezien formele klinische ‘prediction rules’ ontbreken, dienen bij de inschatting van de relevantie van alarmsymptomen altijd de individuele kenmerken van de patiënt (zoals leeftijd, geslacht, ziektegeschiedenis, comorbiditeit, alcoholgebruik etc.) te worden betrokken.
Indien de patiënt zich zonder tussenkomst van een arts (Direct Toegankelijkheid Fysiotherapie; DTF) gemeld heeft bij de fysio- of oefentherapeut is terugverwijzing naar de huisarts laagdrempeliger dan wanneer de patiënt op verwijzing van de huisarts of specialist op consult bij de fysio- of oefentherapeut komt. Indien de patiënt is doorverwezen door een arts dient de therapeut zich er wel van te verzekeren dat de alarmsymptomen bekend zijn bij de arts.
Literatuur
In de eerste lijn is de prevalentie van alarmsymptomen bij patienten met lage rugpijn hoog, maar de prevalentie van ernstige specifieke aandoeningen (rode vlaggen) laag. In een Australisch onderzoek werden 1172 patiënten met acute lage rugpijn (< 2 weken) in de eerste lijn een jaar lang gevolgd (Henschke 2009). De meeste patiënten (80,4%) bleken minimaal één alarmsymptoom te hebben, terwijl de prevalentie van ernstige pathologie laag was (0,9%; fractuur n = 8, infectie n = 2, cauda-equinasyndroom n = 1).
In de tweede en derde lijn is de prevalentie van specifieke aandoeningen hoger, maar ook hier blijkt de diagnostische waarde van de meeste alarmsymptomen beperkt. In een Amerikaans onderzoek vond retrospectieve analyse plaats van de gegevens van 9940 patiënten met lage rugpijn (met of zonder beenpijn) die werden behandeld in een specialistisch multidisciplinaire spine clinic (Premkumar 2018). De meeste patiënten (92,6%) hadden minimaal één alarmsymptoom. In totaal werd 8,3% van de patiënten gediagnosticeerd met een ernstige pathologie (fractuur 5,6%, maligniteit 1,6%, infectie 1,2% en cauda-equinasyndroom 0,4%). De auteurs concludeerden dat de afwezigheid van alarmsymptomen in het algemeen niet de mogelijke aanwezigheid van een ernstige pathologie verminderde. Zo bleken de meeste patiënten met een spinale maligniteit (64%) geen enkele alarmsymptoom te hebben zoals een voorgeschiedenis van kanker, onverklaarbaar gewichtsverlies, nachtelijke pijn of een leeftijd boven de 50 of 70 jaar.
In een retrospectieve studie onderzocht Tsjang (2019) in de derde lijn (n = 500) de diagnostische waarde van alarmsymptomen op het kunnen aantonen van fracturen, maligniteit, infecties en het cauda-equinasyndroom. De sensitiviteit en specificiteit bleken laag voor bijna alle alarmsymptomen. Het alarmsymptoom met de hoogste accuratesse voor de diagnose maligniteit was een voorgeschiedenis van kanker (sensitiviteit 0,75 [95%-BI 0,53 tot 0,90], specificiteit 0,79 [95%-BI 0,75 tot 0,82]). Een fractuur werd het beste voorspeld door de aanwezigheid van minimaal een van de volgende alarmsymptomen: osteoporose, gebruik van steroïden en trauma (sensitiviteit 0,59 [95%-BI 0,44 tot 0,72], specificiteit 0,65 [95%-BI 0,60 tot 0,69]).
Recent heeft Finucane (2020) een raamwerk gepubliceerd waarbij een synthese is gemaakt van bestaande evidentie en internationale expert consensus. Het raamwerk richt zich op het cauda-equinasyndroom, fracturen, maligniteit en infecties en biedt voor de clinicus handvatten voor onderzoek en behandeling. In een overzicht van de incidentie en puntprevalentie van de vier aandoeningen worden de volgende gegevens vermeld. De puntprevalentie voor het cauda-equinasyndroom als oorzaak van lage rugpijn wordt geschat op 0,04% in de eerste lijn en 0,4% in de derde lijn. Het syndroom treedt bij ongeveer 2% van de patienten met een lumbale discusherniatie op als complicatie. De incidentie na een lumbale operatie wordt geschat tussen de 0,08 en 0,2%. De puntprevalentie van osteoporotische fracturen als oorzaak van lage rugpijn varieert van 0,7 tot 4,5% in de eerste lijn tot 6,5% op de Spoedeisende Hulp (SEH). Evenals metastasen komen osteoporotische fracturen voornamelijk voor in de thoracale wervelkolom (70%) en in mindere mate in de lumbale (20%) en cervicale wervelkolom (10%). De puntprevalentie van een traumatische fractuur als oorzaak van lage rugpijn wordt in de eerste lijn geschat op < 1%. De puntprevalentie van maligniteiten als oorzaak van lage rugpijn varieert van 0,0-0,7% in de eerste lijn, is 0,1% bij op de SEH en 1,6% in de derde lijn. De puntprevalentie van infecties als oorzaak van lage rugpijn wordt geschat op 0,01% in de eerste lijn en 1,2% in de derde lijn.
Internationale richtlijnen
In internationale richtlijnen is geen consensus over de alarmsymptomen waarop patiënten met lage rugpijn minimaal gescreend dienen te worden, noch over de vraag bij welke combinaties van symptomen specialistisch onderzoek gerechtvaardigd is. Verhagen (2016) vond in 16 richtlijnen 46 verschillende alarmsymptomen die zouden kunnen duiden op een maligniteit, fractuur, cauda-equinasyndroom of infectie. Parreira (2019) vond in 78 richtlijnen 12 verschillende alarmsymptomen voor de mogelijke aanwezigheid van fracturen. Beide onderzoeksgroepen concludeerden dat er nauwelijks sprake is van consensus en dat de meeste aanbevelingen niet gebaseerd zijn op wetenschappelijk bewijs, noch worden ondersteund door klinisch-relevante data.
Overwegingen
De werkgroep acht het van belang patiënten met lage rugpijn op alarmsymptomen en rode vlaggen te screenen om daarmee de kans op het missen van ernstige pathologie te verkleinen. Bij het inschatten van de relevantie van de alarmsymptomen betrekt de therapeut altijd gegevens uit de anamnese en het lichamelijk onderzoek.
De werkgroep concludeert dat de aanwezigheid van een enkele alarmsymptoom niet direct op een specifieke oorzaak hoeft te wijzen, en dat er aanwijzingen zijn dat specifieke combinaties van verschillende alarmsymptomen de waarschijnlijkheid op een specifieke aandoening vergroot.
- Cook CE, George SZ, Reiman MP. Red flag screening for low back pain: nothing to see here, move along: a narrative review. Br J Sports Med. 2018;52(8):493-6.
- de Campos TF. Low back pain and sciatica in over 16s: assessment and management NICE Guideline [NG59]. J Physiother. 2017;63(2):120.
- Downie A, Williams CM, Henschke N, Hancock MJ, Ostelo RW, de Vet HC, Macaskill P, Irwig L, van Tulder MW, Koes BW, Maher CG. Red flags to screen for malignancy and fracture in patients with low back pain. Br J Sports Med. 2014;48(20):1518.
- Enthoven WT, Geuze J, Scheele J, Bierma-Zeinstra SM, Bueving HJ, Bohnen AM, Peul WC, van Tulder MW, Berger MY, Koes BW, Luijsterburg PA. Prevalence and ‘Red Flags’ Regarding Specified Causes of Back Pain in Older Adults Presenting in General Practice. Phys Ther. 2016;96(3):305-12.
- Finucane LM, Downie A, Mercer C, Greenhalgh SM, Boissonnault WG, Pool-Goudzwaard AL, Beneciuk JM, Leech RL, Selfe J. International Framework for Red Flags for Potential Serious Spinal Pathologies. J Orthop Sports Phys Ther. 2020;50(7):350-72.
- Galliker G, Scherer DE, Trippolini MA, Rasmussen-Barr E, LoMartire R, Wertli MM. Low back pain in the emergency department: prevalence of serious spinal pathologies and diagnostic accuracy of red flags. Am J Med. 2020;133(1):60-72 e14.
- Grunau GL, Darlow B, Flynn T, O’Sullivan K, O’Sullivan PB, Forster BB. Red flags or red herrings? Redefining the role of red flags in low back pain to reduce overimaging. Br J Sports Med. 2018;52(8):488-9.
- Henschke N, Maher CG, Refshauge KM, Herbert RD, Cumming RG, Bleasel J, York J, Das A, McAuley JH. Prevalence of and screening for serious spinal pathology in patients presenting to primary care settings with acute low back pain. Arthritis Rheum. 2009;60(10):3072-80.
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF). KNGF-richtlijnenmethodiek 2019. Ontwikkeling en implementatie van KNGF-richtlijnen. Versie 2. Amersfoort: Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF); 2019. Beschikbaar via: https://www.kngf.nl/binaries/content/assets/kennisplatform/onbeveiligd/klinimetrie/kngf-richtlijnenmethodiek-2019. Geraadpleegd op 13 januari 2020.
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF). KNGF-richtlijn Lage rugpijn. Amersfoort: KNGF; 2013. Beschikbaar via: https://www.kngf.nl/kennisplatform/richtlijnen/lage-rugpijn. Geraadpleegd op 13 januari 2020.
- Parreira PCS, Maher CG, Traeger AC, Hancock MJ, Downie A, Koes BW, Ferreira ML. Evaluation of guideline-endorsed red flags to screen for fracture in patients presenting with low back pain. Br J Sports Med. 2019;53(10):648-54.
- Premkumar A, Godfrey W, Gottschalk MB, Boden SD. Red flags for low back pain are not always really red: a prospective evaluation of the clinical utility of commonly used screening questions for low back pain. J Bone Joint Surg Am. 2018;100(5):368-74.
- Tsiang JT, Kinzy TG, Thompson N, Tanenbaum JE, Thakore NL, Khalaf T, Katzan IL. Sensitivity and specificity of patient-entered red flags for lower back pain. Spine. 2019;19(2):293-300.
- Underwood M, Buchbinder R. Red flags for back pain. BMJ. 2013;347:f7432.
- Underwood M. Diagnosing acute nonspecific low back pain: time to lower the red flags? Arthritis Rheum. 2009;60(10):2855-7.
- Van Wambeke P, Desomer A, Ailliet L, Berquin A, Demoulin C, Depreitere B, Dewachter J, Dolphens M, Forget P, Fraselle V, Hans G, Hoste D, Mahieu G, Michielsen J, Nielens H, Orban T, Parlevliet T, Simons E, Tobbackx Y, Van Schaeybroeck P, Van Zundert J, Vanderstraeten J, Vlaeyen J, Jonckheer P. Low back pain and radicular pain: assessment and management. Brussel: Belgian Health Care Knowledge Centre (KCE); 2017. Beschikbaar via: https://biblio.ugent.be/publication/8520932/file/8520933. Geraadpleegd op 13 januari 2020.
- Verhagen AP, Downie A, Popal N, Maher C, Koes BW. Red flags presented in current low back pain guidelines: a review. Eur Spine J. 2016;25(9):2788-802.
B.2 Indicatiestelling en behandelprofielen
Bepaal op basis van de anamnese en het lichamelijk onderzoek of er een indicatie is voor fysio- of oefentherapie.
Er is een indicatie om fysio- of oefentherapie te starten wanneer:
- een patiënt met lage rugpijn bij de fysio- of oefentherapeut komt met een hulpvraag die gerelateerd is aan beperkingen in dagelijkse activiteiten en/of maatschappelijke participatie op basis van het bewegend functioneren, en
- de therapeut geen aanleiding ziet om (terug) te verwijzen naar de huisarts of de verwijzend specialist (zie B.1.3 ‘Rode vlaggen’).
Als de indicatie voor fysio- of oefentherapie is vastgesteld, wordt de patiënt ingedeeld in een behandelprofiel op basis van het risico op aanhoudende klachten.
Aanbevelingen
Evalueer het risico op aanhoudende klachten bij het eerste contact met de patiënt door te beoordelen of er prognostische factoren voor aanhoudende klachten bij lage rugpijn aanwezig zijn:
- aan rugpijn gerelateerde factoren:
- eerdere episoden van lage rugpijn, hoge mate van beperkingen in activiteiten, pijn in het been, hoge intensiteit van de pijn;
- patiëntgerelateerde factoren:
- slechte algemene gezondheidstoestand of kwaliteit van leven;
- psychosociale factoren:
- psychologische en psychosociale stress [d.i. stress zonder de aanwezigheid van een specifieke psychologische psychiatrische diagnoses];
- pijngerelateerde bewegingsangst, depressieve gevoelens of klachten, passieve copingstijl, negatieve verwachtingen over herstel of catastroferen;
- werkgerelateerde factoren:
- hoge fysieke belasting tijdens werk, slechte relaties met collega’s, verminderde tevredenheid met werk.
Vanuit de anamnese en het lichamelijk onderzoek kunnen ook andere (al dan niet aan rugpijn gerelateerde) prognostische factoren naar voren komen. Denk aan herstelbelemmerende (zoals pijn elders in het lichaam en verminderde belastbaarheid als gevolg van comorbiditeit) of juist herstelbevorderende prognostische factoren (zoals het voldoen aan de beweegnorm en een gezonde leefstijl).
Maak op basis van je evaluatie van het risico op aanhoudende klachten een keuze voor behandelprofiel 1, 2 of 3.

Overweeg op basis van de behandelprofielen eenvoudiger en minder intensieve ondersteuning te bieden aan mensen die waarschijnlijk snel zullen herstellen, en meer complexe en intensievere ondersteuning te bieden aan mensen met een hoger risico op aanhoudende klachten.
Lumbosacraal radiculair syndroom (LRS)
Omdat bij een LRS vaak sprake is van een hoge mate van beperkingen in activiteiten, pijn in het been en hoge intensiteit van de pijn, hebben deze patiënten een grotere kans om ingedeeld te worden in profiel 3.
Herhaling van de evaluatie van het risico op aanhoudende klachten
Herhaal de evaluatie van het risico op aanhoudende klachten bij onvoldoende vermindering van de klachten .
Voer de herevaluatie ten minste uit bij:
- profiel 1 na drie weken;
- profiel 2 na drie en na zes weken;
- profiel 3 na zes weken en na 12 weken.
Herevaluatie bij profiel 1 en 2
- Overweeg bij onvoldoende vermindering van de klachten op basis van de herevaluatie het behandelprofiel (of de behandeling) aan te passen.
- Verwijs bij onvoldoende vermindering van de klachten de patiënt naar de huisarts indien de herevaluatie geen nieuwe inzichten oplevert en je niet verwacht dat een aanpassing van het behandelprofiel (of van de behandeling) afdoende is. [Of er sprake is van (on)voldoende vermindering van de klachten wordt beoordeeld door de patiënt, in overleg met de therapeut en kan eventueel worden ondersteund door meetinstrumenten (zie B.3 ‘Meetinstrumenten’)].
Herevaluatie bij profiel 3
- Neem contact op met de huisarts bij onvoldoende vermindering van de klachtena na zes weken.
- Verwijs de patiënt naar de huisarts bij onvoldoende vermindering van de klachten na 12 weken, en overleg over de volgende fase van de stapsgewijze benadering: de multidisciplinaire diagnostiek en behandeling in de eerste lijn in nauwe samenwerking met de tweede lijn (zie A.3 ‘Organisatie van zorg’).
Verwijs de patiënt met een LRS naar de huisarts bij een totale klachtenduur van zes tot acht weken bij onvoldoende afname van de pijn en/of uitvalsverschijnselen.
Onderbouwing
Aanleiding
De afgelopen jaren hebben zich in de praktijk en op basis van de literatuur ontwikkelingen voorgedaan op grond waarvan herziening gewenst was van de aanbevelingen omtrent de behandelprofielen zoals beschreven in de KNGF richtlijn uit 2013 (KNGF 2013).
Uitgangsvragen
1. Wat zijn de criteria om fysio- of oefentherapie te starten bij patiënten met lage rugpijn?
2. Hoe kunnen patiënten met lage rugpijn het best worden ingedeeld in behandelprofielen?
Methode
Voor de beantwoording van de uitgangsvragen is in overleg met de werkgroep gebruikgemaakt van literatuur die is geïdentificeerd op basis van een systematische zoekactie naar evidence-based richtlijnen en systematische literatuuronderzoeken. Deze zoekactie is aangevuld met informatie uit nationale richtlijnen voor lage rugpijn.
De resultaten zijn op narratieve wijze geanalyseerd en descriptief verwerkt.
De aanbevelingen zijn tot stand gekomen conform de ‘KNGF Richtlijnenmethodiek 2019’ (Driehuis 2019).
Conclusies op basis van de literatuur
Uitgangsvraag 1: Indicatie voor fysio- of oefentherapie
Wanneer een patiënt met lage rugpijn bij de fysio- of oefentherapeut komt met een hulpvraag die gerelateerd is aan beperkingen in dagelijkse activiteiten en/of maatschappelijke participatie op basis van het bewegend functioneren, en de therapeut geen aanleiding ziet om (terug) te verwijzen naar de huisarts (zie B.1.3 ‘Rode vlaggen’), bestaat er een indicatie voor fysio- of oefentherapie (Mutsaers 2021; Post 2019).
Uitgangsvraag 2: Indeling in behandelprofielen
In de richtlijn van het Britse ‘National Institute for Health and Care Excellence’ (NICE) voor patiënten met lage rugpijn wordt aanbevolen risicostratificatie (bijvoorbeeld met de ‘STarT Back Screening Tool’; SBST) te overwegen bij het eerste contact met de zorgverlener en op basis van de risicostratificatie eenvoudiger en minder intensieve ondersteuning te bieden aan mensen die waarschijnlijk snel zullen herstellen, en meer complexe en intensievere ondersteuning aan mensen met een hoger risico op aanhoudende klachten (De Campos 2017). De richtlijn van het Belgische Kenniscentrum voor Gezondheidszorg (‘Belgian Health Care Knowledge Centre’; KCE) heeft de aanbeveling van het NICE overgenomen en voegt daarnaast een lijst met gele, oranje, zwarte en blauwe vlaggen toe aan de evaluatie van het risico op aanhoudende klachten (Van Wambeke 2017). Daarentegen beveelt de Deense richtlijn op basis van consensus in de werkgroep aan niet routinematig één specifieke behandeling aan te bieden aan een subgroep van patiënten met vergelijkbare prognostische factoren, omdat de effectiviteit hiervan onbekend is (Stochkendahl 2018). De leidraad voor de behandeling van patiënten met aspecifieke lage rugpijn door de huisarts is een stappenplan dat bestaat uit voorlichting en advies, opbouw van activiteiten, oefentherapie, gedragsmatige behandeling en multidisciplinaire revalidatie (NHG-Werkgroep Standaard Aspecifieke lage rugpijn 2017).
Conclusies op basis van de overwegingen
Indeling in behandelprofielen
De werkgroep is van mening dat het risico op aanhoudende lage rugklachten een belangrijke rol kan spelen bij de indeling in behandelprofielen. De evaluatie van het risico op aanhoudende lage rugklachten kan waardevolle informatie bieden voor het vroegtijdig opstarten van de juiste behandelstrategie. De werkgroep is dan ook van mening dat patiënten met lage rugpijn het best ingedeeld kunnen worden in behandelprofielen op basis van de belangrijkste prognostische factoren voor aanhoudende lage rugklachten.
De werkgroep heeft drie behandelprofielen ontwikkeld op basis van de bevindingen in de literatuur en klinische expertise over patiënten met lage rugpijn. Op grond van de evaluatie van het risico op aanhoudende klachten maakt de behandelaar een keuze uit een van de drie behandelprofielen. De werkgroep erkent dat de indeling in behandelprofielen, toegepast op basis van de individuele inschatting van de fysio- en oefentherapeut, verdere ontwikkeling behoeft.
Aantal behandelsessies
Bij patiënten in behandelprofiel 1 is het van belang dat het accent van de behandeling ligt op voorlichting, advies en instructies voor zelfstandig uit te voeren oefeningen. Omdat er bij behandelprofiel 1 een laag risico is op aanhoudende klachten, dient het aantal behandelsessies bij patiënten met dit profiel zoveel mogelijk beperkt te blijven tot maximaal drie sessies. Hierbij dient de therapeut bij het geven van voorlichting en adviezen wel oog te blijven houden voor de diversiteit in klachtenbeloop en de capaciteit van de patiënt. Ten aanzien van patiënten met behandelprofiel 2 en 3 zijn geen behandelranges geformuleerd, omdat de klachten gevarieerder kunnen verlopen dan bij behandelprofiel 1 en de inschatting van de patiënt en de therapeut bepalend is voor het beëindigen van de behandeling. De werkgroep acht het bij profiel 2 en 3 van belang dat de therapeut bij onvoldoende vermindering van de klachten een herevaluatie van het risico op aanhoudende klachten uitvoert en de stopcriteria te allen tijde in acht neemt.
Herevaluatie van het risico op aanhoudende lage rugklachten
Bij onvoldoende vermindering van de klachten bij profiel 1 en 2 beveelt de werkgroep aan na drie weken een herevaluatie van het risico op aanhoudende lage rugklachten uit te voeren en het behandelprofiel of de behandeling aan te passen op basis van de bevindingen, of contact op te nemen met de huisarts. De herevaluatie geeft de therapeut de kans om prognostische factoren die bij aanvang van de behandeling niet goed in kaart gebracht konden worden alsnog in beeld te brengen (bijvoorbeeld psychosociale factoren). Daarnaast kan een afwijkend beloop van de lage rugpijn een signaal zijn voor een heroverweging van het behandelprofiel en de congruerende behandelstrategie.
Bij onvoldoende vermindering van de klachten bij profiel 2 en 3 beveelt de werkgroep aan na zes weken contact op te nemen met de huisarts om gezamenlijk het verdere beleid te bepalen. In overleg met de huisarts kan worden besloten de patiënt nog enige tijd verder te begeleiden, maar ook kan een specifieke verwijzing worden overwogen naar bijvoorbeeld een psychosomatische fysio- of oefentherapeut, een psycholoog, bedrijfsarts of medisch specialist (zie ook A.3 ‘Organisatie van zorg’).
Of er sprake is van onvoldoende vermindering van de klachten wordt bepaald door de patiënt in overleg met de therapeut. Eventueel kunnen meetinstrumenten gebruikt worden ter ondersteuning. De werkgroep is van mening dat de testuitslagen op basis van de meetinstrumenten hierin nooit leidend mogen zijn.
Bij patiënten met een LRS zonder rode vlaggen met een klachtenduur van meer dan zes weken en onvoldoende afname van de pijn en/of uitvalsverschijnselen verwijst de fysio- of oefentherapeut de patiënt (terug) naar de huisarts. De huisarts bespreekt met de patiënt of de conservatieve behandeling voortgezet wordt, of dat verwijzing naar een neuroloog gewenst is ter beoordeling van de indicatie ‘operatieve behandeling’ (Schaafstra 2015).
Literatuur
Een recent literatuuronderzoek over de belangrijkste aanbevelingen in richtlijnen voor de eerstelijnszorg beschrijft twee manieren om richting te geven aan de behandeling: ‘stepped-care’ en ‘stratified-care’ (Almeida 2018). Linton (2018) voegt daar nog een derde manier aan toe: ‘matched-care’ en geven een overzicht van de aannames die aan de drie modellen ten grondslag liggen en de voordelen en de beperkingen ervan.
Hierna volgt een korte beschrijving van de drie modellen.
Bij de stepped-care benadering wordt begonnen met de eenvoudigste en minst intensieve behandeling en wordt overgegaan op meer complexe en intensievere behandelopties wanneer de eenvoudige behandelingen niet succesvol zijn. De belangrijkste aannames zijn dat lage rugpijn niet wordt beïnvloedt door bestaande psychosociale factoren en dat een afwachtend beleid kosteneffectief is. Als belangrijkste beperkingen worden genoemd dat het stepped-care model de complexiteit van de klachten negeert en voor vertraging kan zorgen in het toekennen van de juiste behandeling van patiënten met een verhoogd risico op aanhoudende klachten. De stepped-care benadering gaat uit van een gunstig natuurlijke beloop van de rugpijn, waarbij patiënten met kortdurende klachten (acute lage rugpijn; < 6 weken) sneller zouden herstellen dan patiënten met langer durende klachten (subacute lage rugpijn; 6-12 weken of chronische lage rugpijn; > 12 weken).
Bij de stratified-care benadering, waarbij patiënten worden gegroepeerd op basis van vastgestelde risicofactoren, met een congruente intensiteit van de interventie. De stratified-care benadering is bedoeld om een intensievere behandeling te bieden aan patiënten die het nodig hebben, terwijl patiënten met een laag risico over het algemeen herstellen met minimale begeleiding. De belangrijkste aanname is dat risicofactoren geïdentificeerd kunnen worden, dat risicofactoren relatief stabiel zijn en dat een groter aantal risicofactoren gepaard gaat met een verhoogd risico op aanhoudende klachten. De belangrijkste beperking van stratified-care is dat de behandeling na risicostratificatie niet altijd aansluit op het individuele risicoprofiel van de patiënt.
Bij de matched-care benadering wordt de behandeling eveneens gebaseerd op risicofactoren, maar anders dan bij een gestratificeerde benadering, waarbij de behandelmodules min of meer gelijkvormig zijn, wordt de behandeling aangepast aan het risicoprofiel van de individuele patiënt. De aannames voor matched-care komen grotendeels overeen met die bij stratified-care, met de toevoeging dat er specifieke behandelingen zijn voor risicofactoren en dat gerichte behandeling de efficiëntie van de behandeling vergroot. De belangrijkste beperking van matched-care is dat de identificatie van risico’s voor het vormen van profielen nog in ontwikkeling is. Daarnaast is het matched-care model ingewikkelder om te implementeren dan de andere twee modellen.
Er is nog niets bekend over de (kosten)effectiviteit op basis waarvan het ene model verkozen zou moeten worden boven het andere.
De richtlijn van het ‘National Institute for Health and Care Excellence’ (NICE) en de KCE-richtlijnen hanteren een stratified-care benadering en de NHG-Standaard Aspecifieke lagerugpijn een stepped-care benadering (NHG-Werkgroep Standaard Aspecifieke lagerugpijn 2017).
Overwegingen
De werkgroep erkent de behoefte aan een indeling in behandelprofielen om de praktiserend fysio- en oefentherapeut handvatten te bieden bij het richting geven van de therapie en de klinische besluitvorming te vergemakkelijken. De werkgroep is van mening dat hierbij het risico op aanhoudende lage rugklachten een belangrijke rol kan spelen. Bij iemand met kortdurende klachten kan sprake zijn van een verhoogd risico op aanhoudende klachten, waarvoor direct een intensievere behandeling geïndiceerd is. Evaluatie van het risico op aanhoudende lage rugklachten kan waardevolle informatie bieden om vroegtijdig de juiste behandelstrategie op te starten. De werkgroep is zich ervan bewust dat er nog veel onduidelijkheid bestaat over de mate waarin prognostische factoren het risico op aanhoudende lage rugklachten kunnen voorspellen en wat de waarde is voor de individuele patiënt. De werkgroep acht het echter aannemelijk dat, indien een factor dominant aanwezig is, of als er sprake is van een combinatie van factoren, dit de kans op herstel belemmert. De werkgroep is dan ook van mening dat patiënten met lage rugpijn het best ingedeeld kunnen worden in behandelprofielen op basis van een evaluatie van het risico op aanhoudende klachten met gebruik van de belangrijkste prognostische factoren voor aanhoudende lage rugklachten.
De werkgroep vindt het in kaart brengen van het individuele risicoprofiel van de patiënt van belang, omdat de klinische besluitvorming hierop aangepast kan worden.
De werkgroep spreekt over een laag risico op aanhoudende klachten indien er geen dominant aanwezige prognostische factoren voor vertraagd herstel zijn, over een middelmatig risico op aanhoudende lage rugklachten indien er enkele niet dominant aanwezige prognostische factoren voor vertraagd herstel zijn en over een hoog risico op aanhoudende lage rugklachten als er dominant aanwezige prognostische factoren voor vertraagd herstel zijn.
Psychosociale prognostische factoren spelen een belangrijke rol bij de indeling in behandelprofielen. Indien psychosociale prognostische factoren naar de beoordeling van de therapeut dominant aanwezig zijn en een onderhoudende en negatieve invloed hebben op het bewegend functioneren, wordt de patiënt ingedeeld in behandelprofiel 3. In die gevallen wordt gedragsgeoriënteerde behandeling overwogen (zie C.3 ‘Gedragsgeoriënteerde behandeling’).
De werkgroep is van mening dat de indeling in behandelprofielen, die in de huidige vorm berust op de individuele inschatting van de fysio- en oefentherapeut, verdere ontwikkeling behoeft. De differentiatie tussen de behandelprofielen in haar huidige vorm dient explicieter geoperationaliseerd te worden om individuele variatie in classificatie tussen therapeuten te minimaliseren. Teneinde dit vorm te geven, heeft de werkgroep kennislacunes geformuleerd waar wetenschappelijk onderzoek zich op kan richten. Deze kennislacunes worden gepubliceerd bij de richtlijn.
Beloop en de duur van lage rugpijn
Binnen deze richtlijn is ervoor gekozen het risico op aanhoudende klachten bij lage rugpijn leidend te laten zijn bij de indeling in behandelprofielen. Het beloop van de lage rugpijn heeft daarmee geen rol meer bij het bepalen van het behandelprofiel bij aanvang van de behandeling. Het bepalen van het behandelprofiel op basis van het beloop heeft zijn beperking, omdat pas na enige tijd vast te stellen is of er sprake is van een afwijkend beloop, waardoor in de beginfase na het ontstaan van de klachten een afwachten beleid gevoerd zou moeten worden. Ook is er enig bewijs dat er geen klinisch relevante verschillen zijn in mate van herstel op pijn, fysiek functioneren, kwaliteit van leven, angst en depressie voor patiënten met lage rugpijn met een verschillende klachtenduur op baseline (Jess 2018).
We spreken van een afwijkend beloop en een vertraagd herstel als er gedurende drie weken geen duidelijk toename in activiteiten en afname in participatieproblemen is geweest (KNGF 2013). Het afwachtende beleid druist in tegen het theoretische construct van de huidige richtlijn, waarbij de nadruk ligt op het identificeren van risicofactoren voor vertraagd herstel. Een afwachtend beleid kan voor vertraging zorgen bij het inzetten van de juiste behandeling voor diegenen met een verhoogd risico op aanhoudende klachten. Daarentegen erkent de werkgroep dat een afwijkend beloop van de rugklachten wel een signaal is om de indeling in het behandelprofiel en de behandeling die daarbij hoort, gedurende het behandeltraject te heroverwegen. Een afwijkend beloop van de klachten is binnen de huidige richtlijn daarom aangewezen als een indicatie voor een herevaluatie van het risico op aanhoudende klachten. Op basis van de herevaluatie kan de behandelstrategie aangepast worden.
Een andere indeling die vaak wordt gehanteerd, is de indeling op basis van de duur van de klachten: acute lage rugpijn (< 6 weken), subacute lage rugpijn (6-12 weken) en chronische lage rugpijn (> 12 weken). Het bepalen van het behandelprofiel op basis van de duur van de klachten heeft eveneens haar beperking, omdat deze indeling geen rekening houdt met de grote variatie in symptomen en pijntrajecten die worden gerapporteerd door mensen met lage rugpijn, en niet goed discrimineert tussen chronische pijn en recidiverende lage rugpijn. De traditionele indeling op basis van de duur van de klachten werd dan ook aangevochten door de vaststelling dat lage rugpijn vaak een langdurige aandoening is met een variabel verloop (Dunn 2013; Hartvigsen 2018; Kongsted 2016); sommige patiënten herstellen en bij sommige patiënten is er sprake van aanhoudende ernstige lage rugpijn (Kongsted 2016). De duur van de klachten is binnen deze richtlijn niet aangewezen als belangrijke prognostische factor. Er is conflicterend bewijs voor de duur van de klachten als prognostische factor voor aanhoudende klachten bij lage rugpijn (zie A.2.4 ‘Etiologische en prognostische factoren’).
Een langere duur van de rugpijn is in een van de twee systematische literatuuronderzoeken geassocieerd met een slechtere uitkomst (Hayden 2009). Deze bevinding betekent overigens niet dat een klachtenduur van meer dan 12 weken hetzelfde is als ‘kortdurende lage rugpijn die langer duurt’. Ten opzichte van kortdurende lage rugpijn is bij chronische pijn de kans groter dat de ervaren pijn de resultante is van een complex samenspel tussen fysieke, psychologische en sociale factoren. Zo kan chronische pijn duurzame wijzigingen aanbrengen in het pijnsysteem, waaronder maladaptieve neuroplastische veranderingen in het somatosensorische systeem (bijvoorbeeld hyperactiviteit van het nociceptieve systeem) en het pijngeheugen (pijn houdt aan terwijl de oorzaak verdwenen is) (Jonckheer 2017).
De werkgroep is van mening dat de duur van de klachten een belangrijk patiëntkenmerk is dat tijdens de anamnese in kaart gebracht wordt.
- Almeida M, Saragiotto B, Richards B, Maher CG. Primary care management of non-specific low back pain: key messages from recent clinical guidelines. Med J Aust. 2018;208(6):272-5.
- de Campos TF. Low back pain and sciatica in over 16s: assessment and management NICE Guideline [NG59]. J Physiother. 2017;63(2):120.
- Dunn KM, Hestbaek L, Cassidy JD. Low back pain across the life course. Best Pract Res Clin Rheumatol. 2013;27(5):591-600.
- Hartvigsen J, Hancock MJ, Kongsted A, Louw Q, Ferreira ML, Genevay S, Hoy D, Karppinen J, Pransky G, Sieper J, Smeets RJ, Underwood M, Lancet Low Back Pain Series Working G. What low back pain is and why we need to pay attention. Lancet (London, England). 2018;391(10137):2356-67.
- Hayden JA, Chou R, Hogg-Johnson S, Bombardier C. Systematic reviews of low back pain prognosis had variable methods and results: guidance for future prognosis reviews. J Clin Epidemiol. 2009;62(8):781-96 e1.
- Jonckheer P, Desomer A, Depreitere B, Berquin A, Bruneau M, Christiaens W, Coeckelberghs E, Demoulin C, Duquenne P, Forget P, Fraselle V, Godderis L, Hans G, Hoste D, Kohn L, Mairiaux P, Munting E, Nielens H, Orban T, Parlevliet T, Pirotte B, van Boxem K, van Lerbeirghe J, van Schaeybroeck P, van Wambeke P, van Zundert J, Vanderstraeten J, Vanhaecht K, Verhulst D. Lage rugpijn en radiculaire pijn: Kernelementen van een zorgpad. Brussel: Belgian Health Care Knowledge Centre (KCE); 2017. Beschikbaar via: https://kce.fgov.be/sites/default/files/atoms/files/KCE_295A_lage_rugpijn_en_radiculaire_pijn_zorgpad_Synthese_0.pdf.
- Kongsted A, Kent P, Axen I, Downie AS, Dunn KM. What have we learned from ten years of trajectory research in low back pain? BMC Musculoskelet Disord. 2016;17:220.
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF). Beroepsprofiel fysiotherapeut. Amersfoort: KNGF; 2021. Beschikbaar via: https://www.kngf.nl/article/vak-en-kwaliteit/beroepscode/beroepsprofiel-fysiotherapeut.
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF). KNGF-richtlijn Lage rugpijn. Amersfoort: KNGF; 2013.
- Linton SJ, Nicholas M, Shaw W. Why wait to address high-risk cases of acute low back pain? A comparison of stepped, stratified, and matched care. Pain. 2018;159(12):2437-41.
- NHG-Werkgroep Standaard Aspecifieke Lagerugpijn. NHG-standaard aspecifieke lagerugpijn (tweede herziening). Huisarts Wet. 2017;60(2):78-84.
- Schaafstra A, Spinnewijn W, Bons S, Borg M, Koes B, Ostelo R, Spijker-Huiges A, Burgers J, Bouma M, Verburg A. NHG-standaard lumbosacraal radiculair syndroom (Tweede herziening). Huisarts Wet. 2015;58(6):308-20.
- Stochkendahl MJ, Kjaer P, Hartvigsen J, Kongsted A, Aaboe J, Andersen M, Andersen MO, Fournier G, Hojgaard B, Jensen MB, Jensen LD, Karbo T, Kirkeskov L, Melbye M, Morsel-Carlsen L, Nordsteen J, Palsson TS, Rasti Z, Silbye PF, Steiness MZ, Tarp S, Vaagholt M. National clinical guidelines for non-surgical treatment of patients with recent onset low back pain or lumbar radiculopathy. Eur Spine J. 2018;27(1):60-75.
- Van Wambeke P, Desomer A, Ailliet L, Berquin A, Demoulin C, Depreitere B, Dewachter J, Dolphens M, Forget P, Fraselle V, Hans G, Hoste D, Mahieu G, Michielsen J, Nielens H, Orban T, Parlevliet T, Simons E, Tobbackx Y, Van Schaeybroeck P, Van Zundert J, Vanderstraeten J, Vlaeyen J, Jonckheer P. Low back pain and radicular pain: assessment and management. Brussel: Belgian Health Care Knowledge Centre (KCE); 2017. Beschikbaar via: https://biblio.ugent.be/publication/8520932/file/8520933. Geraadpleegd op 27 juni 2019.
- Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM). Beroepsprofiel Oefentherapeut. Utrecht: VvOCM; 2019. Beschikbaar via: https://vvocm.nl/Oefentherapeut/Beroep/Beroepscode-Beroepsprofiel. Geraadpleegd op 27 juni 2019.
B.2.1 Classificatiesystemen
Overweeg de ‘StarT Back Screening Tool’ (SBST) te gebruiken om de evaluatie van het risico op aanhoudende klachten mee te ondersteunen (zie B.2 ‘Indicatiestelling en behandelprofielen’). Baseer de evaluatie van dit risico nooit uitslúitend op de SBST.
Onderbouwing
Aanleiding
In recente wetenschappelijke literatuur zijn verschillende instrumenten beschreven die gebruikt kunnen worden om de beste behandeling voor een patiënt vast te stellen, ook wel ‘classificatiesystemen’ genoemd. Een systematisch literatuuronderzoek identificeerde er 28: 16 diagnostische, 7 prognostische en 5 ‘treatment-based’ classificatiesystemen (Fairbank 2011). Dergelijke systemen zouden als fundament kunnen dienen voor de indeling van patiënten in behandelprofielen.
Binnen de module van deze richtlijn is alleen gezocht naar classificatiesystemen die richting geven aan de behandeling van patiënten met lage rugpijn, waarbij geen enkel klachtenbeeld wordt uitgesloten.
Er zijn vier treatment-based classificatiesystemen gevonden voor de behandeling van de patiëntengroep waarop deze richtlijn is gericht, waarvan de effectiviteit daadwerkelijk is onderzocht. Bij nadere bestudering van de ‘Mechanische Diagnose en Therapie’ volgens McKenzie bleek dat niet alle patiënten met lage rugpijn ermee te classificeren zijn en ook voorziet de methode niet in een systematische analyse van psychosociale herstelbelemmerende factoren. Daarmee viel dit classificatiesysteem af.
De andere classificatiesystemen waren:
- het ‘Treatment-based Classification System’ van Delitto (TCS);
- de Cognitief Functionele Therapie van O’Sullivan (‘Classification Based Cognitive Functional Therapy’; CB-CFT) en
- de ‘Subgroup for Targeted Treatment (STarT) Back Screening Tool’ (SBST).
Om na te gaan met welk classificatiesysteem patiënten met lage rugpijn het beste konden worden ingedeeld in behandelprofielen in de dagelijkse praktijk van de fysio- en oefentherapeut zijn de volgende uitgangsvragen geformuleerd.
Uitgangsvraag
Worden de volgende classificatiesystemen met daaraan gekoppelde gerichte behandeling aanbevolen voor de indeling in behandelprofielen in de praktijk van de fysio- en oefentherapeut?
- Het ‘Treatment-based Classification System’ volgens Delitto (TCS)
- De Cognitief Functionele Therapie volgens O’Sullivan (‘Classification Based Cognitive Functional Therapy’; CB-CFT)
- Behandeling op basis van de ‘STarT Back Screening Tool’ (SBST).
Methode
Om na te gaan wat het effect was van de behandeling van patiënten die waren ingedeeld volgens een van de geselecteerde profielen is een systematisch literatuuronderzoek uitgevoerd en zijn overwegingen in kaart gebracht met behulp van het ‘GRADE Evidence-to-decision framework’ (Alonso-Coello 2016a, Alonso-Coello 2016b).
Conclusies op basis van de literatuur
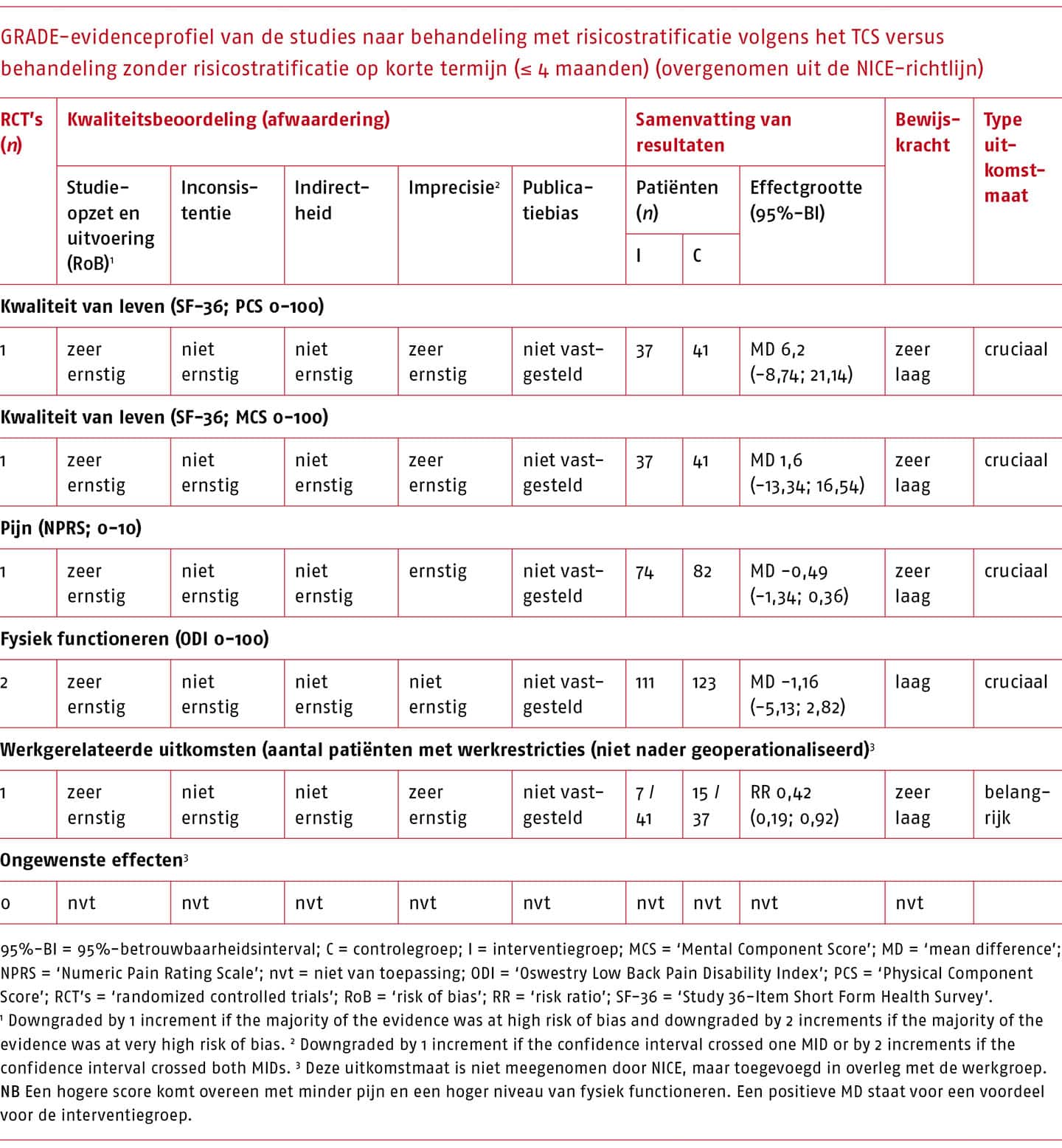
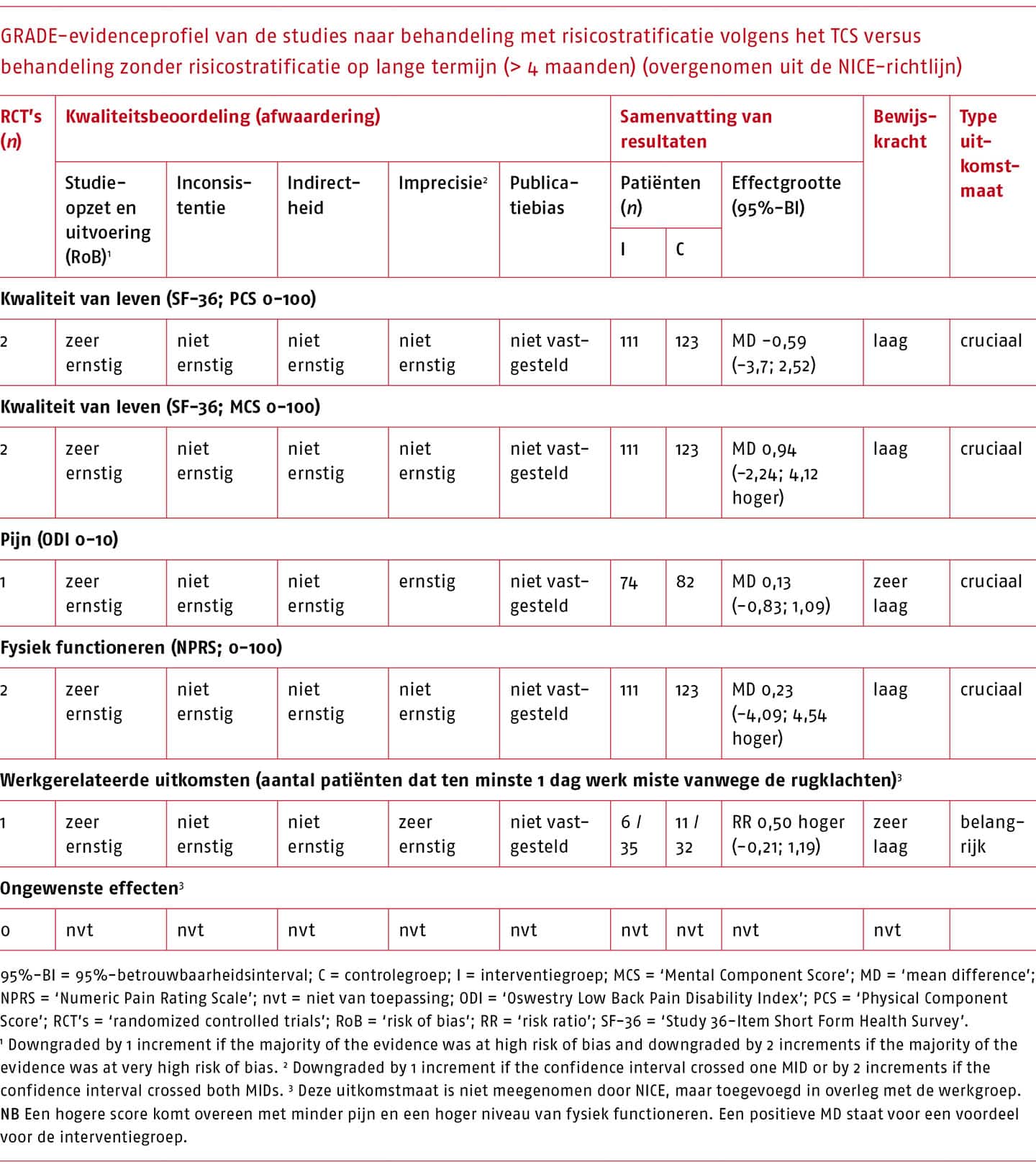
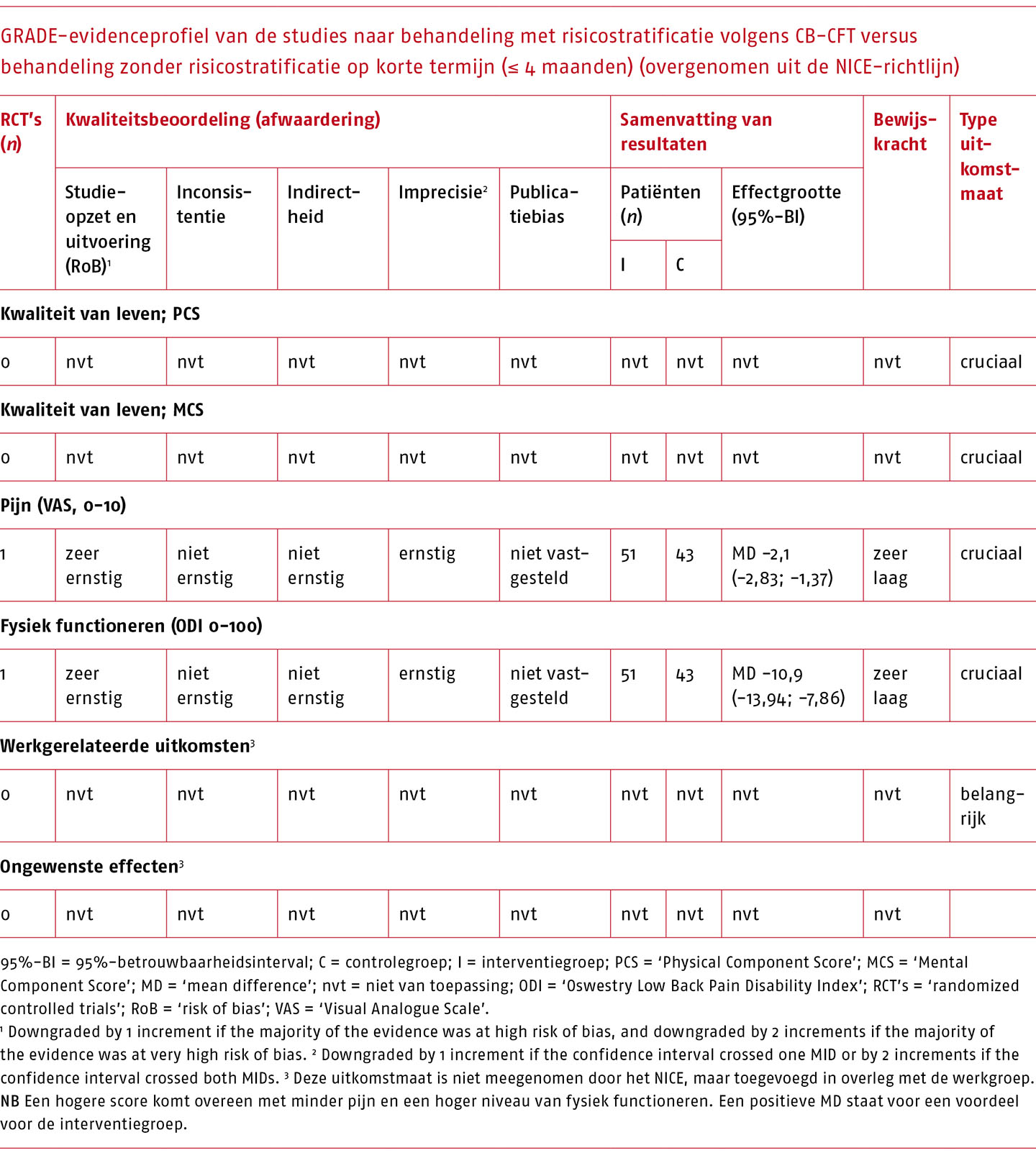
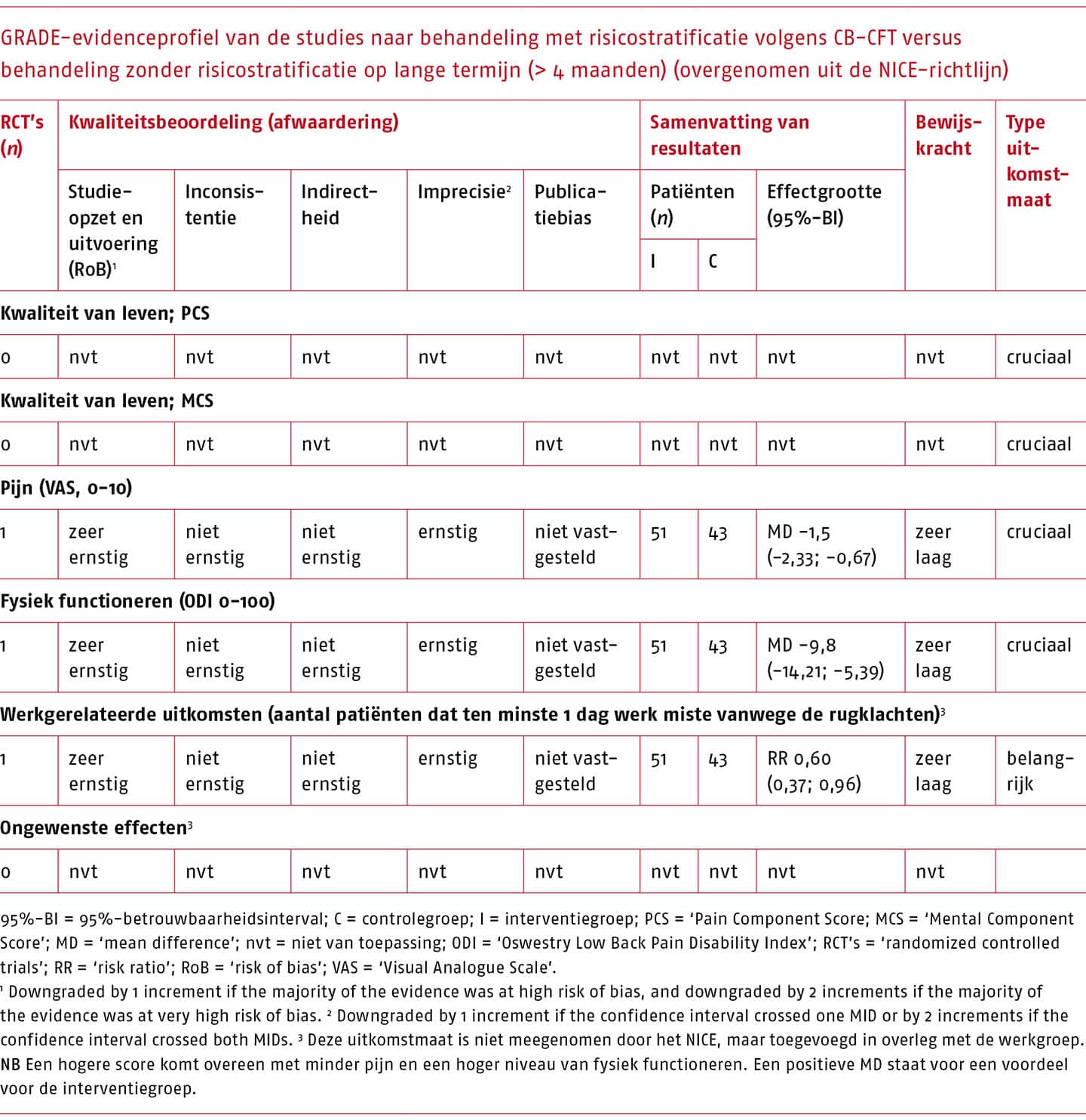
Voor de behandeling na classificatie volgens Delitto zijn zeer kleine (niet klinisch-relevante) effecten gevonden op de cruciale uitkomstmaten, met een zeer lage bewijskracht.
Voor de behandeling na classificatie volgens O’Sullivan zijn klinisch-relevante effecten gevonden op enkele cruciale uitkomstmaten, met een zeer lage bewijskracht.
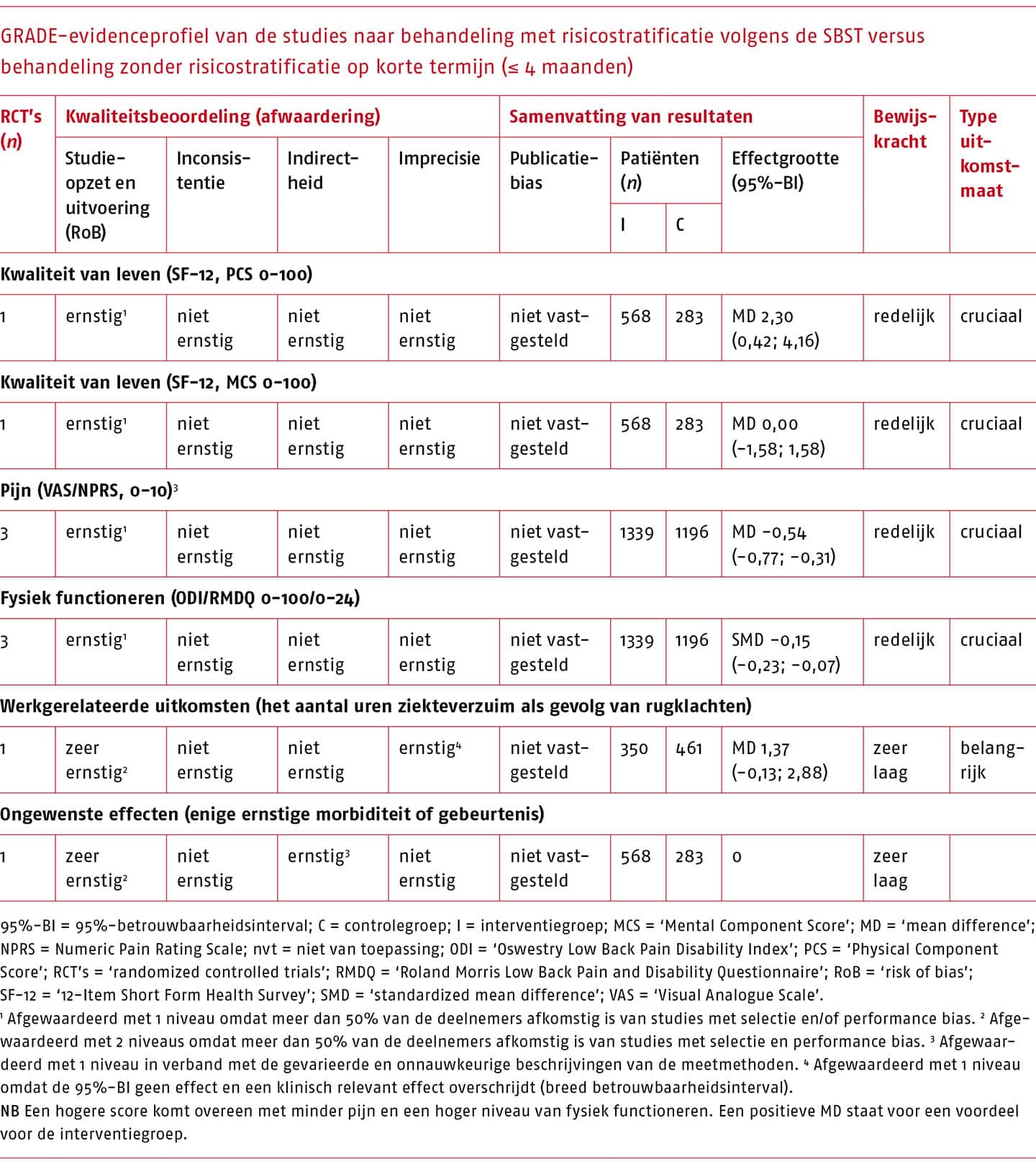
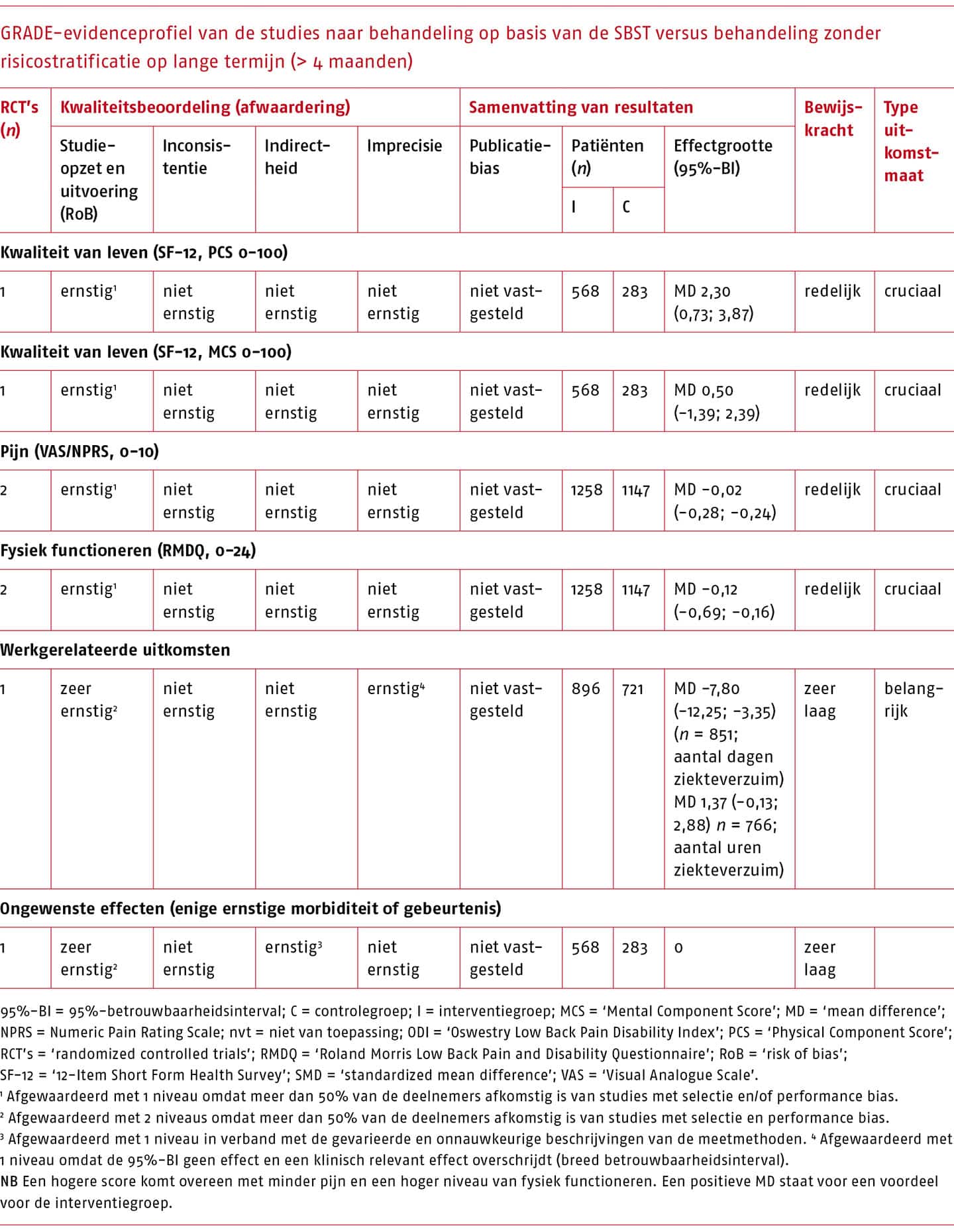
Voor de behandeling na classificatie volgens de STarT Back Screening Tool’ (SBST) zijn kleine (niet klinisch-relevante) effecten gevonden op de cruciale uitkomstmaten, met een matige bewijskracht.
Conclusies op basis van de overwegingen
Op grond van bovenstaande raadt de werkgroep een indeling in behandelprofielen op basis van het TCS of het CB-CFT vooralsnog af, gezien het gebrek aan wetenschappelijke onderbouwing van de classificatiesystemen, onzekerheden omtrent de psychometrische eigenschappen van de systemen en beperkingen in de implementeerbaarheid ervan.
De werkgroep is van mening dat gebruik van de SBST mogelijk van waarde kan zijn voor de praktiserend fysio- of oefentherapeut, omdat de tool eenvoudig is in gebruik en duidelijk richting en structuur geeft aan de therapie, en daarmee de klinische besluitvorming kan vergemakkelijken. Echter, de effecten van de behandeling van de patiënten die met dit instrument zijn geclassificeerd op kwaliteit van leven, pijn en fysiek functioneren zijn klein. Tevens is de kosteneffectiviteit van behandeling volgens de SBST in de Nederlandse setting nog onbekend. De werkgroep is daarom van mening dat het niet wenselijk is om het risico op aanhoudende klachten uitsluitend te baseren op de SBST, gezien de beperkte wetenschappelijke onderbouwing en omdat belangrijke prognostische factoren (bijvoorbeeld werkgerelateerde factoren) gemist kunnen worden. Een conditionele aanbeveling voor de SBST is daarmee gerechtvaardigd.
Literatuur
Om de uitgangsvraag te kunnen beantwoorden, is er een systematische literatuuranalyse verricht naar de volgende onderzoeksvragen (PICO):
‘Treatment-based Classification System’ (TCS)
1. Wat zijn de gewenste en ongewenste effecten (O) van het TCS (I) versus geen gestratificeerde behandeling (C) bij patiënten met lage rugpijn met of zonder uitstraling, zonder belangrijke alarmsymptomen (P)?
Cognitief Functionele Therapie (‘Classification Based Cognitive Functional Therapy’; CB-CFT)
2. Wat zijn de gewenste en ongewenste effecten (O) van CB-CFT (I) versus geen gestratificeerde behandeling (C) bij patiënten met lage rugpijn met of zonder uitstraling, zonder belangrijke alarmsymptomen (P)?
Behandeling op basis van classificatie middels de ‘STarT Back Screening Tool’ (SBST)
3. Wat zijn de gewenste en ongewenste effecten (O) van therapie volgens de SBST (I) versus geen gestratificeerde behandeling (C) bij patiënten met lage rugpijn met of zonder uitstraling, zonder belangrijke alarmsymptomen (P)?
Op basis van de literatuur selecteerde de werkgroep als cruciale uitkomstmaten ‘kwaliteit van leven’, ‘pijn’, ‘fysiek functioneren’ en als belangrijke uitkomstmaat ‘werkhervatting’ (Chiarotto 2015; ICHOM Working Group Members for Low Back Pain 2017; Verburg 2019)
Ongewenste effecten zijn alle nadelige effecten die mogelijk gerelateerd zijn aan de interventie (bijvoorbeeld een toename van de pijn en/of beperkingen in fysiek functioneren, of pijn en/of beperkingen in fysiek functioneren van andere aard dan waar men in eerste instantie voor kwam, optredend direct na de interventie).
Zoekactie
Het literatuuronderzoek is hiërarchisch uitgevoerd; in eerste instantie is gezocht naar bestaande evidence-based richtlijnen. Middels een oriënterende search naar evidence-based richtlijnen in PubMed op 2 mei 2019, is de richtlijn van het ‘National Institute for Health and Care Excellence’ (NICE) geïdentificeerd. Deze heeft een hoge methodologische kwaliteit en hanteert een overeenkomstige uitgangsvraag (De Campos 2017): “What is the clinical and cost effectiveness of stratifying management of non-specific low back pain or sciatica according to outcome of a risk assessment tool/questionnaire?”
Voor de beantwoording van deze vraag heeft het NICE gezocht in MEDLINE, Embase en de Cochrane Library tot 15 december 2015, waarna zes studies zijn geïncludeerd (Apeldoorn 2012b, Beneciuk 2015; Foster 2014; Fritz 2003; Hill 2011; Vibe Fersum 2013). Deze studies zijn door ons getoetst aan de selectiecriteria die door ons van te voren waren geformuleerd in het kader van onze drie onderzoeksvragen. Zie de volgende tabel.

Eén door het NICE geïncludeerde studie betrof een observationeel cohort en is zodoende geëxcludeerd (Foster 2014).
Op 8 mei 2019 is door een informatiespecialist (drs. J.W. Schoones, Leids Universitair Medisch Centrum) een systematische zoekactie uitgevoerd in PubMed, MEDLINE, Embase, Emcare, Web of Science en de Cochrane Library ter actualisatie van de NICE-richtlijn (zie bijlage B.2.1-6 (opent in nieuw tabblad) voor de zoekverantwoording). De zoekactie leverde 268 unieke treffers op. Na screening van de titel en het abstract op de inclusiecriteria zijn 253 artikelen geëxcludeerd. Van 14 artikelen is het volledige artikel gescreend; uiteindelijk leverde de zoekactie één extra studie op (Cherkin 2018). Het totale aantal studies in deze literatuuranalyse komt daarmee op zes (Apeldoorn 2012b; Beneciuk 2015; Cherkin 2018; Fritz 2003; Hill 2011; Vibe Fersum 2013). Zie bijlage B.2.1-1 (opent in nieuw tabblad) voor het stroomdiagram van het inclusieproces. De artikelen die op basis van de volledige tekst zijn geëxcludeerd en de reden van exclusie zijn weergegeven in bijlage B.2.1-2 (opent in nieuw tabblad) (Balasubramaniam 2016; Barone 2018; Bello 2017, 2018; Beneciuk 2015; Cherkin 2016; Morso 2018; Murphy 2016; Ng 2015; O’Keeffe 2015; Riis 2016; Vibe Fersum 2019; Whitehurst 2015).
Karakteristieken van geïncludeerde studies
De kenmerken van de geïncludeerde studies zijn weergegeven in bijlage B.2.1-3 (opent in nieuw tabblad). De zes ingesloten studies includeerden in totaal 2991 patiënten met lage rugpijn. De gemiddelde leeftijd van de patiënten varieerde tussen 37 en 50 jaar en het aandeel vrouwen van 38 tot 64%. De duur van de klachten varieerde van 1 dag tot meer dan 5 jaar en het percentage patiënten met uitstraling naar de benen varieerde van 18 tot 63% (2 studies rapporteerden geen gegevens over het percentage patiënten met uitstraling naar de benen).
Twee studies (Apeldoorn 2012b; Fritz 2003) beschreven de effectiviteit van gestratificeerde behandeling op basis van het TCS van Hicks en Delitto (1995). In de studie van Fritz omvatte de interventie mobilisatie, manipulatietechnieken, actieve range-of-motion-oefeningen, krachttraining van de romp en mechanische tractie (behandelperiode niet gespecificeerd), en in de studie van Apeldoorn lumbale manipulatie, stabilisatieoefeningen of richtingspecifieke oefeningen gedurende ten minste vier weken.
Eén studie (Vibe Fersum 2013) beschreef de effectiviteit van gestratificeerde behandeling op basis van de CB-CFT van O’Sullivan (2005). De CB-CFT berust op het biopsychosociale model en heeft een cognitieve component, een component met oefeningen die gericht zijn op functionele integratie van activiteiten in het dagelijks leven, en een fysiek activiteitenprogramma dat is gericht op ‘movement classification’.
Drie studies (Beneciuk 2015; Cherkin 2018; Hill 2011) beschreven de effectiviteit van gestratificeerde behandeling op basis van de SBST van Hill (2008) in vergelijking met behandeling zonder risicostratificatie. De SBST-groep kreeg bovendien een aanvullende behandeling: de laag-risicogroep kreeg advies en pijnmedicatie, de medium-risicogroep reguliere evidence-based fysiotherapie en de hoog-risicogroep kreeg psychosociale therapie.
Individuele studiekwaliteit (RoB)
De opzet en uitvoering van de individuele studies (‘risk of bias’, RoB) is door NS gescoord met behulp van de ‘Cochrane Risk-of-Bias tool’ (Higgins 2011a). Het oordeel op de verschillende items is besproken met AA en RO, waarna consensus is bereikt. Een overzicht van de beoordeling van de studiekwaliteit (RoB) per studie is weergegeven in bijlage B.2.1-4 (opent in nieuw tabblad).
Effectiviteit en bewijskracht van het TCS versus geen risicostratificatie per uitkomstmaat
Het effect van behandeling op basis van het TCS is in twee studies vergeleken met behandeling zonder risicostratificatie (Apeldoorn 2012b, Fritz 2003). Een overzicht van de resultaten op korte en lange termijn die gepoold konden worden, is weergegeven in de volgende tabellen.
Effectiviteit en bewijskracht van CB-CFT versus behandeling zonder risicostratificatie
Het effect van CB-CFT vergeleken met behandeling zonder risicostratificatie is beschreven in één studie (Vibe Fersum 2013). Een overzicht van de resultaten op korte en lange termijn die gepoold konden worden, is weergegeven in de volgende tabellen.
Effectiviteit en bewijskracht van SBST versus behandeling zonder risicostratificatie
Het effect van stratificatie met SBST vergeleken met de gebruikelijke zorg (behandeling zonder risicostratificatie) is beschreven in drie studies (Beneciuk 2015; Cherkin 2018; Hill 2011).
Een overzicht van de resultaten op korte en lange termijn die gepoold konden worden, is weergegeven in de volgende tabellen.
Overwegingen
Voor de beantwoording van de uitgangsvraag worden in het proces van literatuur naar aanbeveling behalve de literatuur ook andere overwegingen meegenomen. Samen bepalen zij de richting en sterkte van de aanbeveling. De beoordeling van overwegingen en de toelichting worden per classificatiesysteem weergegeven in bijlage B.2.1-5 (opent in nieuw tabblad).
- Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schunemann HJ, Group GW. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016a;353:i2089.
- Alonso-Coello P, Schunemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD, Group GW. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016b;353:i2016.
- Alrwaily M, Timko M, Schneider M, Stevans J, Bise C, Hariharan K, Delitto A. Treatment-based classification system for low back pain: revision and update. Phys Ther. 2016;96(7):1057-66.
- Apeldoorn AT, Bosmans JE, Ostelo RW, de Vet HC, van Tulder MW. Cost-effectiveness of a classification-based system for sub-acute and chronic low back pain. Eur Spine J. 2012a;21(7):1290-300.
- Apeldoorn AT, Kamper SJ. Commentary: The assessment of the quality of reliabilitystudies. Phys Ther Rev. 2014;19(5).
- Apeldoorn AT, Ostelo RW, van Helvoirt H, Fritz JM, Knol DL, van Tulder MW, de Vet HC. A randomized controlled trial on the effectiveness of a classification-based system for subacute and chronic low back pain. Spine. 2012b;37(16):1347-56.
- Balasubramaniam A, Bharathi M. Effect of motor control exercises on psychological variables in chronic low back pain in computer professionals. Int J Pharma Bio Sci. 2016;7(4):B490-B4.
- Barone GB, Hergenroeder AL, Perdomo SJ, Kowalsky RJ, Delitto A, Jakicic JM. Reducing sedentary behaviour to decrease chronic low back pain: the stand back randomised trial. Occup Environ Med. 2018;75(5):321-7.
- Belache FTC, Souza CP, Fernandez J, Castro J, Ferreira PDS, Rosa ERS, Araujo NCG, Reis FJJ, Almeida RS, Nogueira LAC, Correia LCL, Meziat-Filho N. Trial Protocol: Cognitive functional therapy compared with combined manual therapy and motor control exercise for people with non-specific chronic low back pain: protocol for a randomised, controlled trial. J Physiother. 2018;64(3):192.
- Bello B. Effectiveness of STaRT Approach in Reducing Functional Disability and Pain in Individuals with Chronic Non-specific Low Back Pain. Nigeria: Pan African Clinical Trials Registry; 2017. Beschikbaar via: https://pactr.samrc.ac.za/TrialDisplay.aspx?TrialID=1976. Geraadpleegd op 27 juni 2019.
- Bello B, Bichi MS. Comparative effects of Stratified Back care approaches in individuals with nonspecific low back pain. Physiotherapy (India). 2018;12(2):63-72.
- Beneciuk JM, Fritz JM, George SZ. The STarT Back Screening Tool for prediction of 6-month clinical outcomes: relevance of change patterns in outpatient physical therapy settings. J Orthop Sports Phys Ther. 2014;44(9):656-64.
- Beneciuk JM, George SZ. Pragmatic Implementation of a Stratified Primary Care Model for Low Back Pain Management in Outpatient Physical Therapy Settings: Two-Phase, Sequential Preliminary Study. Phys Ther. 2015;95(8):1120-34.
- Bier JD, Ostelo R, van Hooff ML, Koes BW, Verhagen AP. Validity and Reproducibility of the STarT Back Tool (Dutch Version) in Patients With Low Back Pain in Primary Care Settings. Phys Ther. 2017;97(5):561-70.
- Bier JD, Sandee-Geurts JJW, Ostelo R, Koes BW, Verhagen AP. Can Primary Care for Back and/or Neck Pain in the Netherlands Benefit From Stratification for Risk Groups According to the STarT Back Tool Classification? Arch Phys Med Rehabil. 2018;99(1):65-71.
- Brennan GP, Fritz JM, Hunter SJ, Thackeray A, Delitto A, Erhard RE. Identifying subgroups of patients with acute/subacute ‘nonspecific’ low back pain: results of a randomized clinical trial. Spine. 2006;31(6):623-31.
- Cherkin D, Balderson B, Brewer G, Cook A, Estlin KT, Evers SC, Foster NE, Hill JC, Hawkes R, Hsu C, Jensen M, LaPorte AM, Levine MD, Piekara D, Rock P, Sherman K, Sowden G, Wellman R, Yeoman J. Evaluation of a risk-stratification strategy to improve primary care for low back pain: the MATCH cluster randomized trial protocol. BMC Musculoskelet Disord. 2016;17(1):361.
- Cherkin D, Balderson B, Wellman R, Hsu C, Sherman KJ, Evers SC, Hawkes R, Cook A, Levine MD, Piekara D, Rock P, Estlin KT, Brewer G, Jensen M, LaPorte AM, Yeoman J, Sowden G, Hill JC, Foster NE. Effect of low back pain risk-stratification strategy on patient outcomes and care processes: the MATCH randomized trial in primary care. J Gen Intern Med. 2018;33(8):1324-36.
- Chiarotto A, Deyo RA, Terwee CB, Boers M, Buchbinder R, Corbin TP, Costa LO, Foster NE, Grotle M, Koes BW, Kovacs FM, Lin CW, Maher CG, Pearson AM, Peul WC, Schoene ML, Turk DC, van Tulder MW, Ostelo RW. Core outcome domains for clinical trials in non-specific low back pain. Eur Spine J. 2015;24(6):1127-42.
- de Campos TF. Low back pain and sciatica in over 16s: assessment and management NICE Guideline [NG59]. J Physiother. 2017;63(2):120.
- Delitto A, Erhard RE, Bowling RW. A treatment-based classification approach to low back syndrome: identifying and staging patients for conservative treatment. Phys Ther. 1995;75(6):470-85; discussion 85-9.
- Engers A, Jellema P, Wensing M, van der Windt DA, Grol R, van Tulder MW. Individual patient education for low back pain. The Cochrane database of systematic reviews. 2008(1):CD004057.
- Fairbank J, Gwilym SE, France JC, Daffner SD, Dettori J, Hermsmeyer J, Andersson G. The role of classification of chronic low back pain. Spine. 2011;36(21 Suppl):S19-42.
- Flavell CA, Gordon S, Marshman L, Watt K. Inter-raterreliability of classification systems in chronic low back painpopulations. Phys Ther Rev. 2014;19(3):204-12.
- Foster NE, Mullis R, Hill JC, Lewis M, Whitehurst DG, Doyle C, Konstantinou K, Main C, Somerville S, Sowden G, Wathall S, Young J, Hay EM, team IMBS. Effect of stratified care for low back pain in family practice (IMPaCT Back): a prospective population-based sequential comparison. Ann Fam Med. 2014;12(2):102-11.
- Fritz JM, Delitto A, Erhard RE. Comparison of classification-based physical therapy with therapy based on clinical practice guidelines for patients with acute low back pain: a randomized clinical trial. Spine. 2003;28(13):1363-71; discussion 72.
- Higgins JPT, Green S. Cochrane Handbook for Systematic Reviews of Interventions. The Cochrane Collaboration; 2011a [updated March 2011]. Version 5.1.0. Beschikbaar via: www.cochrane-handbook.org. Geraadpleegd op 27 juni 2019.
- Higgins JPT, Green S. Cochrane handbook for systematic reviews of interventions version 5.1.0 [updated March 2011]. The Cochrane Collaboration, 2011. Beschikbaar via www.cochrane-handbook.org 2011b.
- Hill JC, Dunn KM, Lewis M, Mullis R, Main CJ, Foster NE, Hay EM. A primary care back pain screening tool: identifying patient subgroups for initial treatment. Arthritis Rheum. 2008;59(5):632-41.
- Hill JC, Whitehurst DG, Lewis M, Bryan S, Dunn KM, Foster NE, Konstantinou K, Main CJ, Mason E, Somerville S, Sowden G, Vohora K, Hay EM. Comparison of stratified primary care management for low back pain with current best practice (STarT Back): a randomised controlled trial. Lancet (London, England). 2011;378(9802):1560-71.
- ICHOM Working Group Members for Low Back Pain. The ICHOM standard set for low back pain. Boston, United States of America: International Consortium For Health Outcomes Measurements; 2017 [updated August 24th, 2017]. Version 2.0.3. Beschikbaar via: https://www.ichom.org/portfolio/low-back-pain/. Geraadpleegd op 27 juni 2019.
- Kent P, O’Sullivan P, Smith AD, Haines T, Campbell A, McGregor AH, Hartvigsen J, O’Sullivan K, Vickery A, Caneiro JP, Schutze R, Laird RA, Attwell S, Hancock M. RESTORE-Cognitive functional therapy with or without movement sensor biofeedback versus usual care for chronic, disabling low back pain: study protocol for a randomised controlled trial. BMJ Open. 2019;9(8):e031133.
- Morso L, Kongsted A, Hestbaek L, Kent P. The prognostic ability of the STarT Back Tool was affected by episode duration. Eur Spine J. 2016;25(3):936-44.
- Morso L, Schiottz-Christensen B, Sondergaard J, Andersen NV, Pedersen F, Olsen KR, Jensen MS, Hill J, Christiansen DH. The effectiveness of a stratified care model for non-specific low back pain in Danish primary care compared to current practice: study protocol of a randomised controlled trial. Trials. 2018;19(1):315.
- Murphy SE, Blake C, Power CK, Fullen BM. Comparison of a stratified group intervention (STarT Back) with usual group care in patients with low back pain: a nonrandomized controlled trial. Spine. 2016;41(8):645-52.
- Ng L, Caneiro JP, Campbell A, Smith A, Burnett A, O’Sullivan P. Cognitive functional approach to manage low back pain in male adolescent rowers: a randomised controlled trial. Br J Sports Med. 2015;49(17):1125-31.
- O’Keeffe M, O’Sullivan P, Purtill H, Bargary N, O’Sullivan K. Cognitive functional therapy compared with a group-based exercise and education intervention for chronic low back pain: a multicentre randomised controlled trial (RCT). Br J Sports Med. 2019.
- O’Keeffe M, Purtill H, Kennedy N, O’Sullivan P, Dankaerts W, Tighe A, Allworthy L, Dolan L, Bargary N, O’Sullivan K. Individualised cognitive functional therapy compared with a combined exercise and pain education class for patients with non-specific chronic low back pain: study protocol for a multicentre randomised controlled trial. BMJ Open. 2015;5(6):e007156.
- O’Sullivan P. Diagnosis and classification of chronic low back pain disorders: maladaptive movement and motor control impairments as underlying mechanism. Man Ther. 2005;10(4):242-55.
- O’Sullivan PB, Caneiro JP, O’Keeffe M, Smith A, Dankaerts W, Fersum K, O’Sullivan K. Cognitive functional therapy: an integrated behavioral approach for the targeted management of disabling low back pain. Phys Ther. 2018;98(5):408-23.
- Ostelo RW, Deyo RA, Stratford P, Waddell G, Croft P, Von Korff M, Bouter LM, de Vet HC. Interpreting change scores for pain and functional status in low back pain: towards international consensus regarding minimal important change. Spine. 2008;33(1):90-4.
- Riis A, Jensen CE, Bro F, Maindal HT, Petersen KD, Bendtsen MD, Jensen MB. A multifaceted implementation strategy versus passive implementation of low back pain guidelines in general practice: a cluster randomised controlled trial. Implement Sci. 2016;11(1):143.
- Schaafstra A, Spinnewijn W, Bons S, Borg M, Koes B, Ostelo R, Spijker-Huiges A, Burgers J, Bouma M, Verburg A. NHG-standaard lumbosacraal radiculair syndroom (teede herziening). Huisarts Wet. 2015;58(6):308-20.
- Verburg AC, van Dulmen SA, Kiers H, Nijhuis-van der Sanden MWG, van der Wees PJ. Development of a standard set of outcome measures for non-specific low back pain in Dutch primary care physiotherapy practices: a Delphi study. Eur Spine J. 2019.
- Vibe Fersum K, O’Sullivan P, Skouen JS, Smith A, Kvale A. Efficacy of classification-based cognitive functional therapy in patients with non-specific chronic low back pain: a randomized controlled trial. Eur J Pain. 2013;17(6):916-28.
- Vibe Fersum K, Smith A, Kvale A, Skouen JS, O’Sullivan P. Cognitive functional therapy in patients with non-specific chronic low back pain-a randomized controlled trial 3-year follow-up. Eur J Pain. 2019.
- Werneke MW, Edmond S, Young M, Grigsby D, McClenahan B, McGill T. Directional preference and functional outcomes among subjects classified at high psychosocial risk using STarT. Physiother Res Int. 2018;23(3):e1711.
- Whitehurst DG, Bryan S, Lewis M, Hay EM, Mullis R, Foster NE. Implementing stratified primary care management for low back pain: cost-utility analysis alongside a prospective, population-based, sequential comparison study. Spine. 2015;40(6):405-14.
- Whitehurst DG, Bryan S, Lewis M, Hill J, Hay EM. Exploring the cost-utility of stratified primary care management for low back pain compared with current best practice within risk-defined subgroups. Ann Rheum Dis. 2012;71(11):1796-802.
B.3 Meetinstrumenten
Aanbevolen en optionele meetinstrumenten
Neem de aanbevolen meetinstrumenten (zie de figuur) af bij alle patiënten, tenzij er een aanleiding is om dit niet te doen.
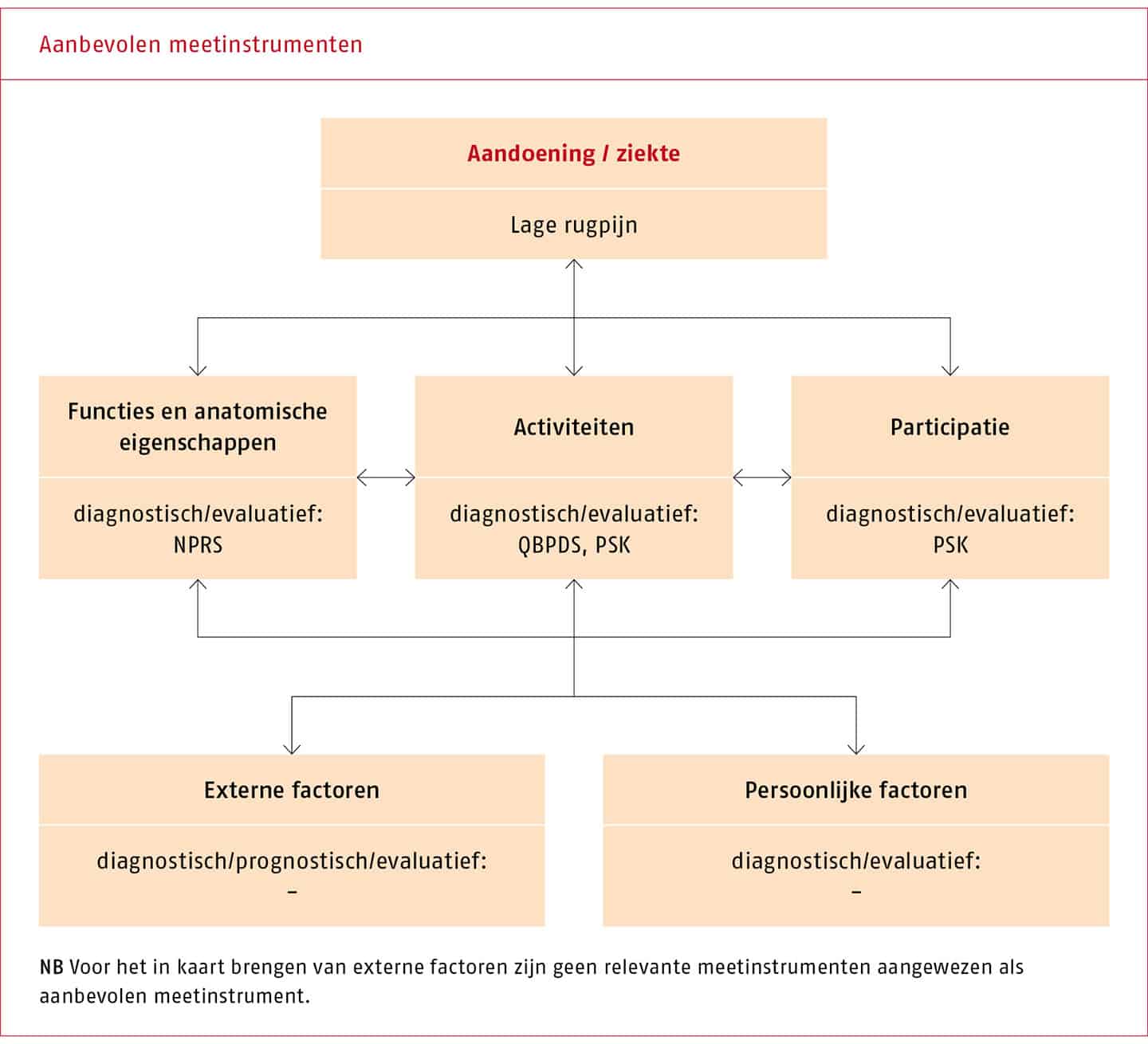
NPRS = ‘Numeric Pain Rating Scale’ (0-10, gemiddelde pijn in afgelopen 24 uur); PSK = Patiënt Specifieke Klachten;
QBPDS = ‘Quebec Back Pain Disability Scale’ (0-100).
Cursief = een performancetest of functietest, niet cursief = een vragenlijst of een observatielijst. NB Voor het in
kaart brengen van externe factoren zijn geen optionele meetinstrumenten beschreven.
De interpretatie en meetfrequentie van de aanbevolen meetinstrumenten staan in de volgende tabel.
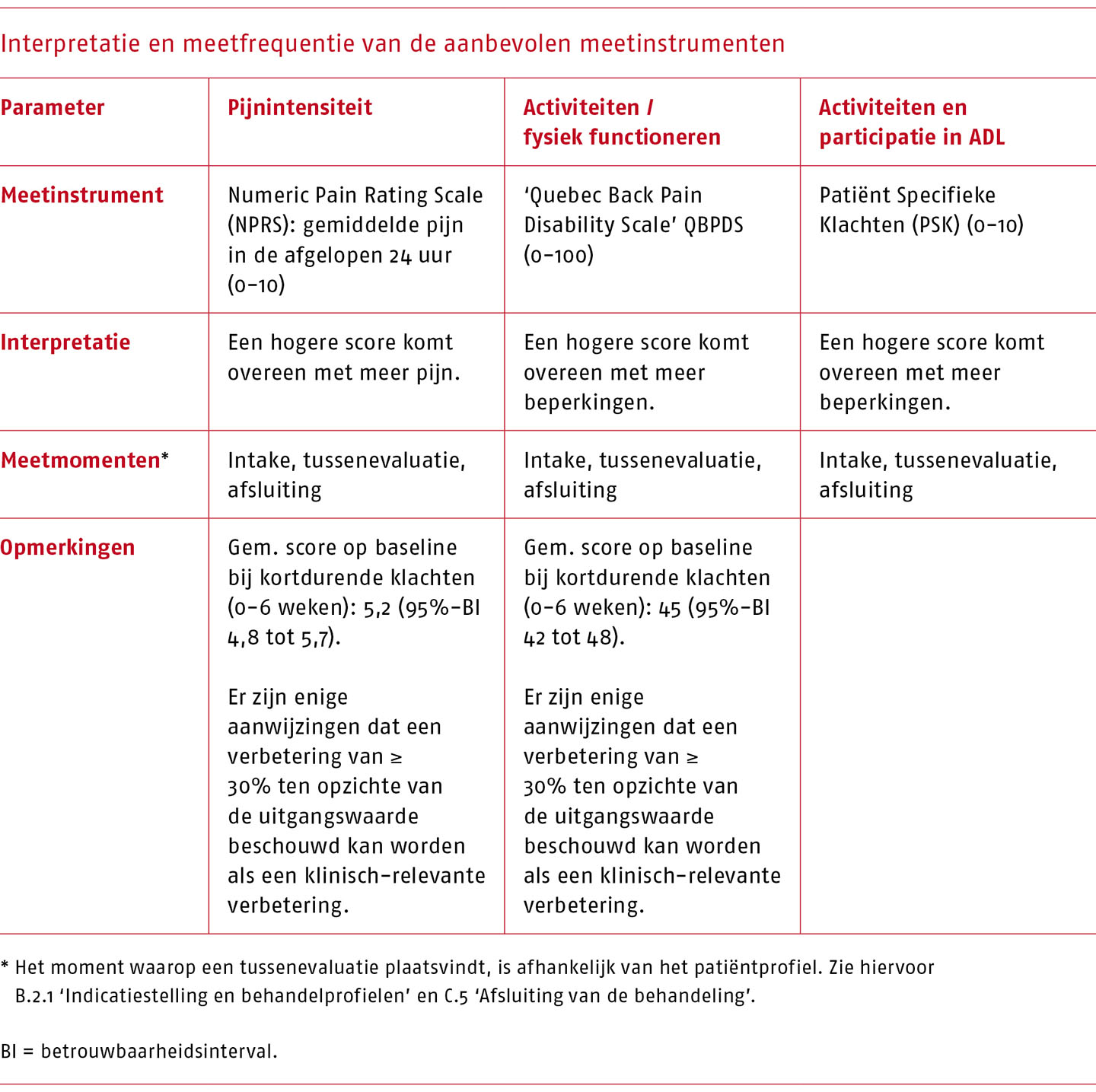
Neem de optionele meetinstrumenten enkel af wanneer er een aanleiding is om dit te doen. De optionele meetinstrumenten staan beschreven in de toelichting van deze module.
Optionele meetinstrumenten kunnen om de volgende redenen worden afgenomen:
- er is aanleiding een parameter in kaart te brengen waarvoor geen van de aanbevolen meetinstrumenten geschikt is, of
- er is aanleiding om een parameter in kaart te brengen met een ander meetinstrument dan het hiervoor aanbevolen meetinstrument.
Op basis van de uitkomsten van de vragenlijsten kan ervoor gekozen worden een aanvullende (bewegings)analyse of functietest uit te voeren (bijvoorbeeld een analyse van het looppatroon indien er bij de vragenlijst beperkingen in het lopen zijn aangegeven).
Onderbouwing
Aanleiding
De afgelopen jaren hebben zich in de praktijk en op basis van de literatuur ontwikkelingen voorgedaan op grond waarvan herziening gewenst was van de aanbevelingen omtrent de meetinstrumenten zoals beschreven in de KNGF-richtlijn uit 2013 (Staal 2013).
Uitgangsvraag
Welke meetinstrumenten brengen de ICF-domeinen en doelen het best in kaart?
Methode
Deze vraag is in overleg met werkgroep beantwoord door de aanbevolen en optionele meetinstrumenten te beschrijven die tijdens het diagnostisch proces ingezet kunnen worden. Hierbij is het ‘Raamwerk Klinimetrie voor evidence-based products’ gebruikt (Swinkels 2016). De aanbevolen meetinstrumenten zijn vermeld in de Praktijkrichtlijn en de optionele meetinstrumenten in de Toelichting.
Conclusies op basis van de literatuur
Bij de beantwoording van de uitgangsvraag is gebruikgemaakt van wetenschappelijke literatuur over de ontwikkeling van een set met kernmeetinstrumenten voor patiënten met lage rugpijn vanuit drie initiatieven (Chiarotto 2018; ICHOM Working Group Members for Low Back Pain 2017; Verburg 2019). De werkgroep heeft ervoor gekozen om bij de keuze van de aanbevolen meetinstrumenten de domeinen ‘pijn’, ‘fysiek functioneren’ en ‘activiteiten en participatie in ADL’ te prioriteren. Er was consensus in de literatuur over het gebruik van de ‘Numeric Pain Rating Scale’ (NPRS) voor het in kaart brengen van de pijnintensiteit.
Voor het meten van fysieke activiteit zijn de volgende vragenlijsten beoordeeld op de hanteerbaarheid en de klinimetrische kwaliteit: de ‘Oswestry Disablity Index’ (ODI), de ‘Roland Morris Disability Questionnaire’ (RMDQ) en de ‘Quebec Back Pain Disability Scale’ (QBPDS). De ODI, RMDQ en QBPDS zijn goed hanteerbaar voor de therapeut en de patiënt, en op basis van validiteit, reproduceerbaarheid en responsiviteit kan geen duidelijke voorkeur voor een van de drie worden uitgesproken.
Voor het meten van activiteiten en participatie in ADL zijn de Patiënt Specifieke Klachten (PSK) en de Patiënt Specifieke ‘Goal-setting’ methode (PSG) beoordeeld op de hanteerbaarheid en de klinimetrische kwaliteit. De PSK is eenvoudig in gebruik; afname neemt niet veel tijd in beslag en vraagt nagenoeg geen aanvullende expertise of ervaring van de therapeut en bovendien minimale inspanning van de patiënt. De PSG is de vernieuwde versie van de PSK. De PSG is tevens geschikt om samen met de patiënt doelen mee op te stellen. Voor juiste toepassing van het instrument in de praktijk is scholing noodzakelijk.
De PSK is voldoende responsief bevonden bij patiënten met lage rugpijn. Naar de validiteit en de reproduceerbaarheid van de Nederlandse versie van de PSK is geen onderzoek gedaan bij deze patiëntengroep. Bij patiënten met artrose van de heup of knie is de Engelse variant valide, betrouwbaar en responsief bevonden. Er is geen onderzoek bekend naar de klinimetrische kwaliteit van de PSG.
Conclusies op basis van de overwegingen
Als aanbevolen meetinstrumenten selecteert de werkgroep de NPRS voor de gemiddelde pijn in de afgelopen 24 uur, de QBPDS voor fysiek functioneren en de PSK voor activiteiten en participatie in ADL. De NPRS en de QBPDS zijn geselecteerd als aanbevolen meetinstrumenten vanwege de uniformiteit met de voorgaande richtlijn, waardoor reeds verzamelde en toekomstige gegevens vergelijkbaar blijven. Bovendien is de QBPDS een veel gebruikte vragenlijst in de dagelijkse praktijk in Nederland. Daarnaast bevordert deze keuze de implementeerbaarheid van de richtlijn.
De werkgroep selecteert de PSG als optioneel meetinstrument, omdat voor het gebruik van de PSG aanvullende scholing nodig is en de klinimetrische kwaliteit van dit instrument niet bekend is. Ook de ODI versie 2.1a en de RMDQ zijn als optionele meetinstrumenten geselecteerd.
De werkgroep is van mening dat er idealiter een combinatie van vragenlijsten en performance- of functietests geselecteerd dient te worden om de parameters in kaart te brengen. De werkgroep erkent echter dat er een gebrek is aan solide performance- en functietests om aan deze wens tegemoet te komen. De werkgroep adviseert daarom op basis van de uitkomsten van de vragenlijsten een aanvullende (bewegings)analyse of functietest uit te voeren.
De werkgroep is van mening dat de evaluatieve optionele meetinstrumenten zo veel mogelijk gericht dienen te worden op de hulpvraag van de patiënt en dat ‘meten om het meten’ niet wenselijk is.
Zie de figuur met de optionele meetinstrumenten en de parameters van die meetinstrumenten. Alle meetinstrumenten die in de richtlijn worden genoemd met bijbehorende interpretatie zijn beschikbaar via www.meetinstrumentenzorg.nl.
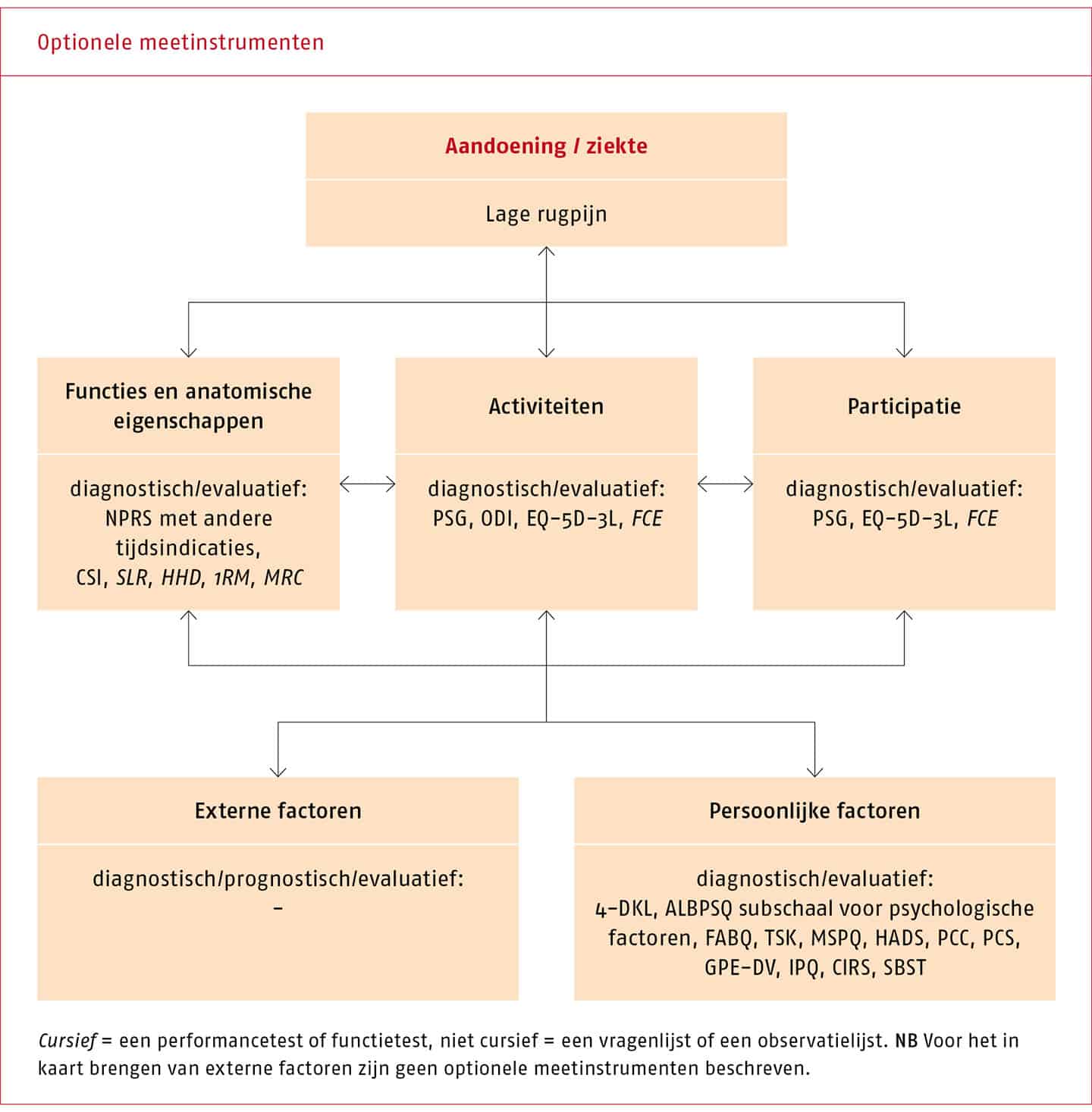
1RM = Submaximale One-Repetition maximum test; 4-DKL = Vier Dimensionale Klachtenlijst; ALBPSQ = ‘Acute
Low Back Pain Screening Questionnaire’; ALBPSQ – DLV = ‘Acute Low Back Pain Screening Questionnaire – Dutch
Language Version’; CIRS = ‘Cumulative Illness Rating Scale’; CSI = ‘Central Sensitization Inventory’;
EQ-5D-3L = ‘Euroqol-5D-3L’; FABQ = ‘Fear-avoidance beliefs questionnaire’; GPE-DV = ‘Global Perceived Effect’;
HADS = ‘Hospital Anxiety and Depression Scale’; HHD = ‘Hand-held Dynamometer’; IPQ = ‘Illness Perception
Questionnaire’; MRC = ‘Medical Research Council scale’; MSPQ = ‘Modified somatic perception questionnaire’;
NPRS = ‘Numeric Pain Rating Scale’; ODI = ‘Oswestry Disability Index’ versie 2.1a; PCC = Pijn Coping en Cognitielijst;
PCS = ‘Pain Catastrophizing Scale’; PSG = Patiënt Specifieke ‘Goal-setting’ methode; SBST = ‘StarT Back Screening
Tool’; SLR = ‘Straight Leg Raise’; TSK = Tampa Schaal voor Kinesiofobie.
Cursief = een performancetest of functietest, niet cursief = een vragenlijst of een observatielijst. NB Voor het in
kaart brengen van externe factoren zijn geen optionele meetinstrumenten beschreven.
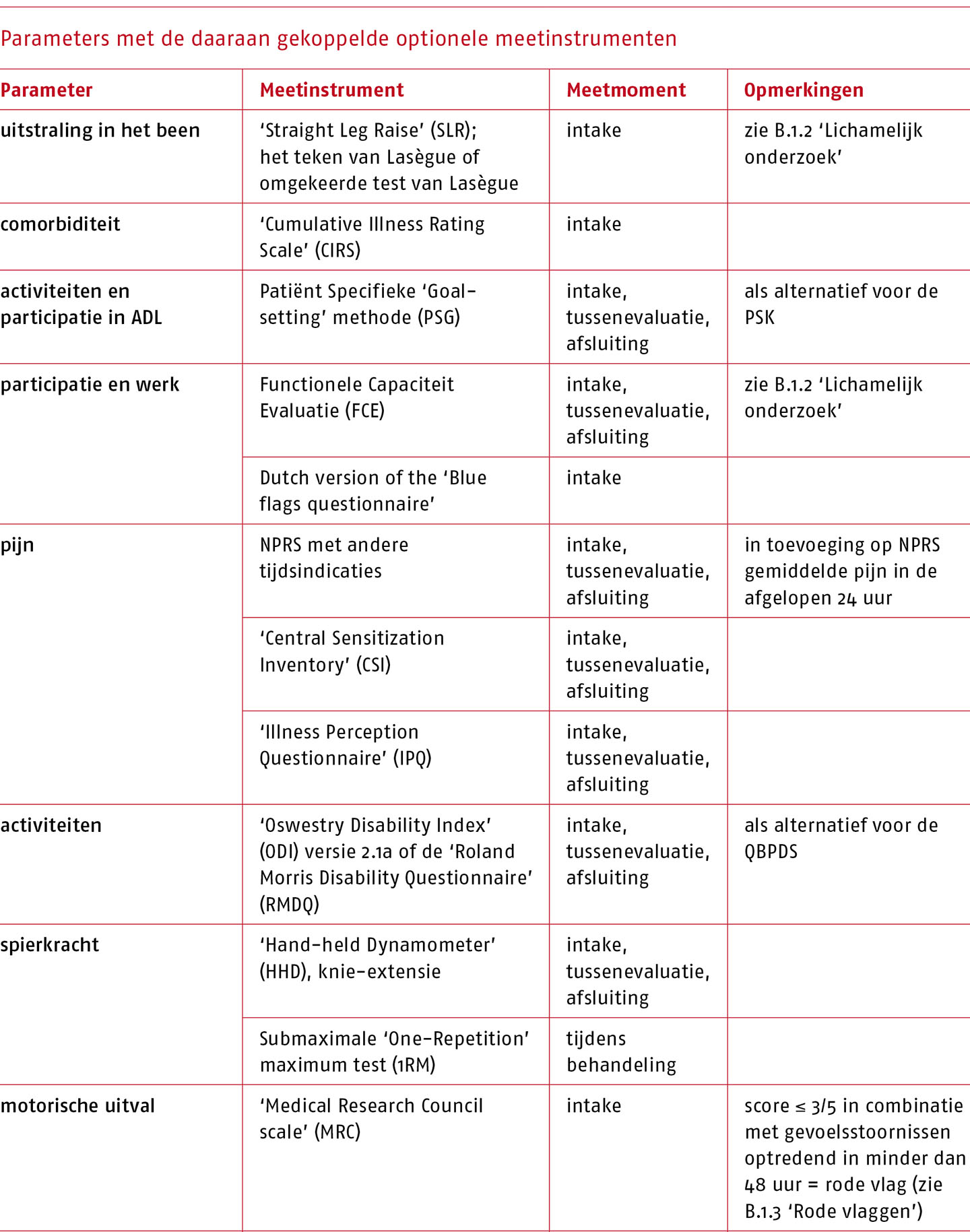
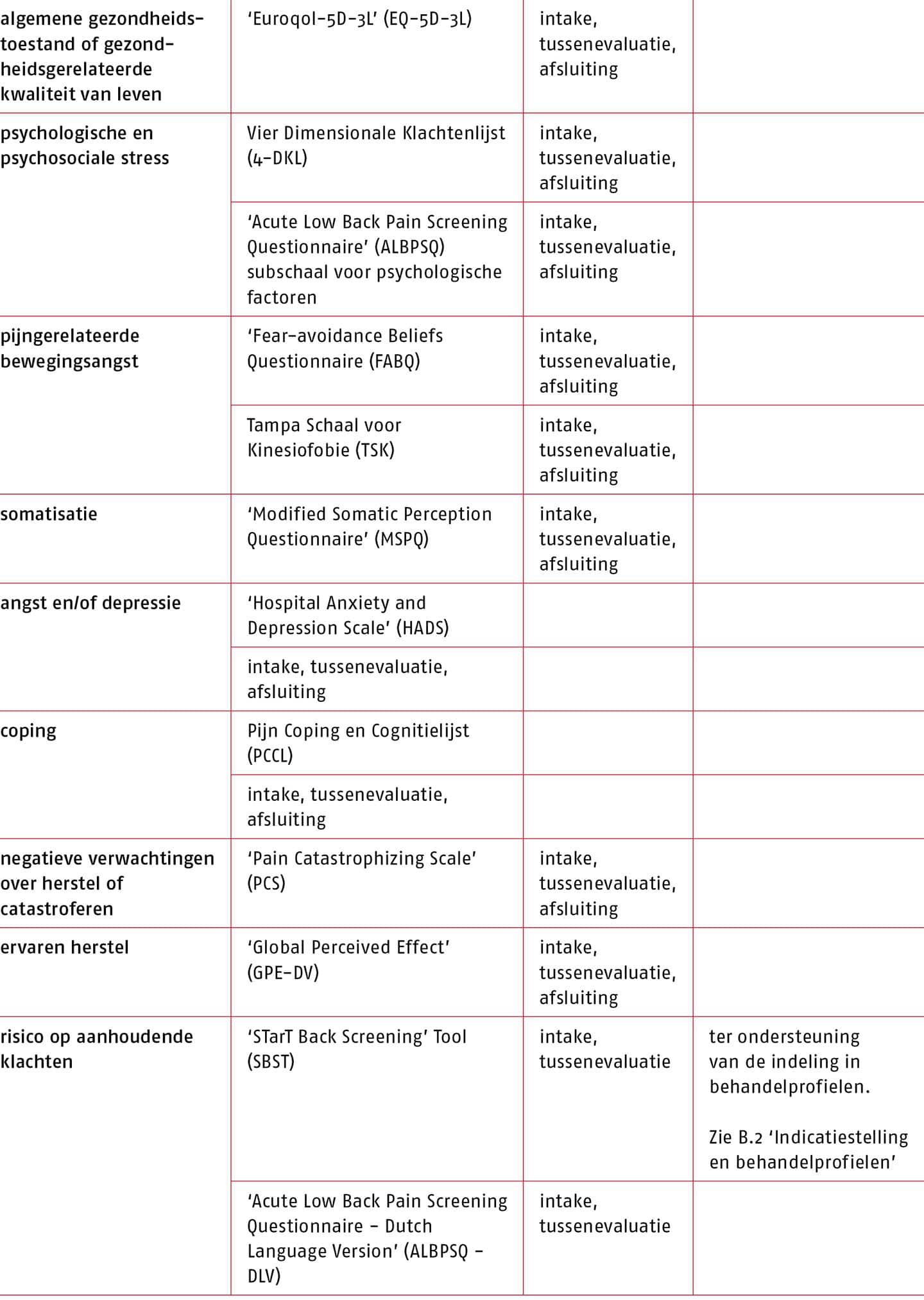
<
Literatuur
Deze vraag is beantwoord door de aanbevolen en optionele meetinstrumenten te beschrijven die tijdens de het diagnostisch proces ingezet kunnen worden. Hierbij is het ‘Raamwerk Klinimetrie voor evidence-based products’ gebruikt (KNGF 2016).
Het raamwerk betreft een stappenplan waarmee in acht stappen via een iteratief proces doelgericht meetinstrumenten kunnen worden geselecteerd:
Stap 1 Wat wil je meten?
Stap 2 Waarom wil je meten?
Stap 3 Met welk soort meetinstrument wil je meten?
Stap 4 Hoe vind je een meetinstrument?
Stap 5 Wat is de hanteerbaarheid?
Stap 6 Wat is de klinimetrische kwaliteit?
Stap 7 Zijn er normwaarden beschikbaar?
Stap 8 Hoe bereken en interpreteer je de gegevens?
Hierna wordt een beschrijving gegeven waarmee de keuze voor de meetinstrumenten verantwoord wordt.
Bij de beantwoording van de uitgangsvraag is wetenschappelijke literatuur gebruikt over de ontwikkeling van een set kernmeetinstrumenten voor patiënten met lage rugpijn vanuit drie initiatieven (Chiarotto 2018a, ICHOM Working Group Members for Low Back Pain 2017; Verburg 2019). Alle drie initiatieven berusten op een literatuuronderzoek en een formeel besluitvormings- en consensusproces met patiënten, zorgverleners, onderzoekers, beleidsmakers en zorgverzekeraars, waarbij het initiatief van Chiarotto (Chiarotto 2018a) primair tot doel had het gebruik van meetinstrumenten in wetenschappelijk onderzoek te uniformeren en beide andere initiatieven gericht waren op het gebruik van meetinstrumenten in de praktijk (ICHOM Working Group Members for Low Back Pain 2017; Verburg 2019).
In de richtlijn wordt onderscheid gemaakt tussen aanbevolen meetinstrumenten en optionele meetinstrumenten. Het wordt aanbevolen om de eerste set af te nemen bij alle patiënten, tenzij er bij een patiënt een speciale aanleiding is om een bepaald meetinstrument niet af te nemen. Optionele meetinstrumenten worden afgenomen indien hiertoe bij een patiënt een specifieke aanleiding bestaat.
Literatuur stap 1 ‘Wat wil je meten’
Er is consensus tussen de sets over de meetdomeinen ‘pijnintensiteit’ en ‘fysiek functioneren’. In twee sets is ‘gezondheidsgerelateerde kwaliteit van leven’ aangewezen als relevant domein (Chiarotto 2015; ICHOM Working Group Members for Low Back Pain 2017); de andere set richt zich op een meer globale evaluatie van het door de patiënt ervaren herstel van de klachten (Verburg 2019). In een van de drie sets wordt geadviseerd het risico op aanhoudende klachten in kaart te brengen (Verburg 2019). De werkgroep heeft het meten van de domeinen ‘pijn’, ‘fysiek functioneren’ en ‘activiteiten en participatie’ geprioriteerd als domeinen om de aanbevolen meetinstrumenten op te richten.
In de volgende tabel worden de geselecteerde domeinen en meetinstrumenten binnen de verschillende initiatieven met elkaar vergeleken.
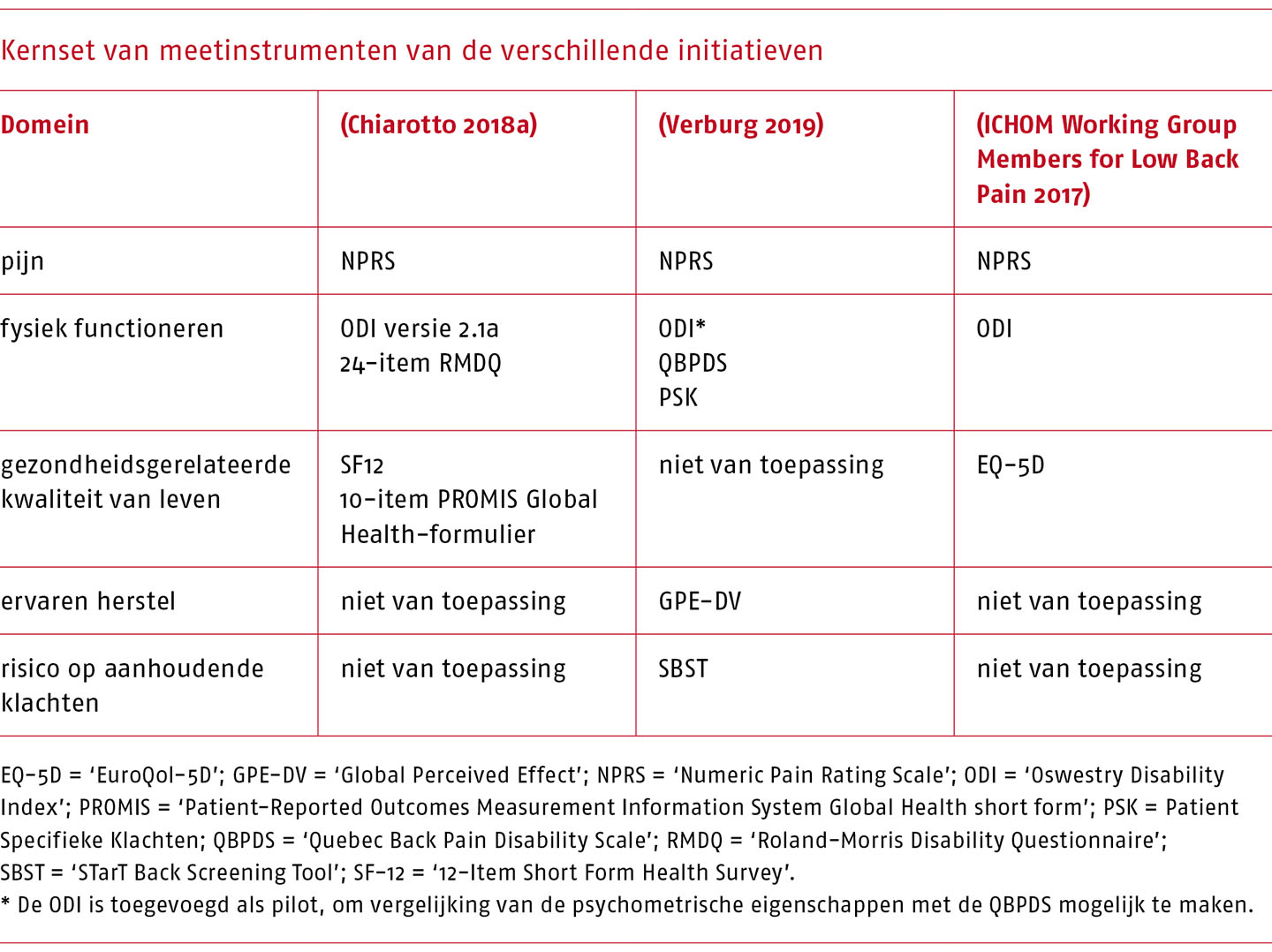
Literatuur stap 2 ‘Waarom wil je meten?’
Het primaire doel van de metingen is de diagnostiek of de behandeling te evalueren.
Literatuur stap 3 ‘Met welk soort meetinstrument wil je meten?’
De werkgroep heeft ervoor gekozen de vastgestelde domeinen in kaart te brengen met vragenlijsten, omdat deze het meest frequent worden gebruikt in de dagelijkse praktijk en wetenschappelijk onderzoek, en vragenlijsten een goede hanteerbaarheid kennen (zie stap 5). De werkgroep is van mening dat idealiter vragenlijsten gecombineerd worden met een performance- of functietest, maar de werkgroep erkent dat er geen solide instrumenten beschikbaar zijn om aan deze wens tegemoet te komen.
Ten behoeve van de implementeerbaarheid van richtlijnen wordt in het ‘KNGF-raamwerk klinimetrie’ aanbevolen aan een domein slechts één of enkele meetinstrumenten toe te kennen, om het totale aantal aanbevolen meetinstrumenten in een richtlijn te reduceren (KNGF 2016).
Literatuur stap 4 ‘Hoe vind je een meetinstrument?’
De aanbevolen en optionele meetinstrumenten zijn vrij beschikbaar via www.meetinstrumentenzorg.nl.
Literatuur stap 5 ‘Wat is de hanteerbaarheid voor de therapeut en de patiënt?’
Deze stap is in het kader van deze richtlijn alleen uitgewerkt voor de aanbevolen meetinstrumenten.
Pijn
Tussen de drie initiatieven bestaat consensus over de NPRS als meetinstrument om pijn te meten. De NPRS is eenvoudig in gebruik. Afname neemt niet veel tijd in beslag, vraagt nagenoeg geen aanvullende expertise of ervaring van de therapeut en daarnaast minimale inspanning van de patiënt. De NPRS is gratis beschikbaar voor organisaties binnen de gezondheidszorg; een licentie is niet noodzakelijk (ICHOM Working Group Members for Low Back Pain 2017). De hanteerbaarheid van de NPRS wordt beter geacht dan die van de VAS.
Fysiek functioneren
Over de vraag met welk meetinstrument het domein fysiek functioneren het beste gemeten kan worden, met de ‘Oswestry Disability Index’ (ODI), de ‘Roland-Morris Disability Questionnaire’ (RMDQ) of de ‘Quebec Back Pain Disability Scale’ (QBPDS), bestaat tussen de initiatieven geen consensus.
De ODI bestaat uit 10 items over de ernst van pijn, zelfverzorging, tillen, lopen, zitten, staan, slapen, het seksleven, het sociale leven en reizen/transport, gemeten op een zespuntsschaal (0 = ‘geen beperkingen’ en 5 = ‘meeste beperkingen’. De totaalscore met een range van 0 tot 100 wordt berekend door de somscores van de items te vermenigvuldigen met een factor 2 (een hogere score komt overeen met meer beperkingen). De oorspronkelijke versie (Fairbank 1980) is vertaald in het Nederlands (Van Hooff 2015). Er zijn echter meerdere versies van de ODI in omloop. In een aangepaste versie van de vragenlijst, de ‘(modified) Oswestry Low Back Pain Disability Questionnaire’ (Oswestry LBPDQ) is het item over het seksleven vervangen door een item over werk/huishouden. Er bestaat geen officiële Nederlandse vertaling van de Oswestry LBPDQ en de psychometrische eigenschappen van deze vragenlijst zijn nog grotendeels onbekend. In het kader van deze richtlijn zijn we daarom uitgegaan van de oorspronkelijke vragenlijst (Fairbank 1980). De meest recente versie van de Engelstalige vragenlijst (die toen deze richtlijn werd ontwikkeld nog niet was vertaald) is versie 2.1b. De verschillen zijn echter niet zodanig dat de Nederlandse vertaling van versie 2.1a (Van Hooff 2015) niet zou kunnen worden gebruik tot deze is bijgewerkt naar versie 2.1b (zie https://eprovide.mapi-trust.org/instruments/oswestry-disability-index#review_copy).
De RMDQ betreft een vragenlijst met 24 items over het fysiek functioneren met een dichotome meetschaal (ja/nee). De totaalscore is de som van alle positief gescoorde items en varieert van 0 tot 24 punten. Een hogere score komt overeen met meer beperkingen. De originele vragenlijst en de vertaling zijn openbaar. De oorspronkelijke versie (Roland 1983) is vertaald in het Nederlands door Van der Heijden (van der Heijden 1991; niet nader onderzocht). Er bestaan verschillende versies van de RMDQ. Geadviseerd wordt de RMDQ-24 te gebruiken met de toevoeging ‘vanwege mijn rug- of beenproblemen’ (Smeets 2011).
De QBPDS betreft een vragenlijst met 20 items over bedrust, zitten en staan, lopen, bewegen, bukken en zware voorwerpen verplaatsen, gemeten op een zespuntsschaal (0 = ‘totaal geen moeite’ en 5 = ‘niet in staat’). De totaalscore is de som van alle items en varieert van 0 tot 100 punten (0 = ‘geen beperking’ en 100 = ‘volledig beperkt’). De originele versie (Kopec 1995) is vertaald in het Nederlands (Schoppink 1996).
De ODI, RMDQ en QBPDS zijn eenvoudig in gebruik; afname neemt gemiddeld 5 tot 10 minuten in beslag en er is nagenoeg geen aanvullende expertise of ervaring voor nodig van de therapeut. Afname van de vragenlijsten zorgt voor enige mentale belasting van de patiënt.
De ODI en de QBPDS zijn vrij verkrijgbaar voor clinici, maar voor het downloaden van de originele vragenlijsten is een licentie nodig (ODI: zie https://eprovide.mapi-trust.org/instruments/oswestry-disability-index; QBPDS: https://eprovide.mapi-trust.org/instruments/quebec-back-pain-disability-scale). Voor IT-bedrijven zijn er aan de licentie kosten verbonden, wat een belemmering kan vormen voor het incorporeren van de vragenlijst in de elektronische patiëntendossiers. Voor gebruik en reproductie van de RMDQ is geen toestemming vereist en er zijn geen kosten verbonden aan het gebruik ervan (zie http://www.rmdq.org/).
De werkgroep schat in dat de ODI, RMDQ en QBPDS goed hanteerbaar zijn voor de therapeut en de patiënt. Mogelijk is de RMDQ iets beter hanteerbaar dan de ODI en de QBPDS, omdat voor gebruik van de RMDQ geen toestemming vereist is.
Activiteiten en participatie in ADL
Voor het domein activiteiten en participatie in ADL heeft de werkgroep de PSK toegevoegd aan een van de sets kernmeetinstrumenten (Verburg 2019). De PSK maakt het mogelijk de functionele status van de individuele patiënt te bepalen. De patiënt selecteert de drie tot vijf belangrijkste klachten op het gebied van fysieke activiteiten. De mate van hinder wordt door de patiënt gescoord op een ‘Numeric Pain Rating Scale’ (NPRS) van 0 tot 10 (0 = ‘geen enkele moeite’ en 10 = ‘onmogelijk’). Hoe hoger de totaalscore, des te meer problemen worden ervaren bij het uitvoeren van de activiteit. Voor patiënten met lage rugpijn is een lijst met activiteiten als hulpmiddel beschikbaar via www.meetinstrumentenzorg.nl.
De PSK is eenvoudig in gebruik. Afname neemt niet veel tijd in beslag (Stevens 2013) en vraagt nagenoeg geen aanvullende expertise of ervaring van de therapeut en minimale inspanning van de patiënt. De PSK is gratis beschikbaar voor organisaties binnen de gezondheidszorg; een licentie is niet noodzakelijk. Het is een in oorsprong Nederlands meetinstrument (Beurskens 1999).
De Patiënt Specifieke ‘Goal-setting’ methode (PSG) (Stevens 2017a,b, 2018) is de vernieuwde versie van de PSK. De PSG kan als methode worden ingezet om samen met de patiënt doelen te stellen, wat het stellen van doelen beter integreert in het therapeutisch methodisch handelen. Er is echter scholing nodig om de PSG op de juiste manier toe te kunnen passen en naar de klinimetrische kwaliteit van de PSG is (nog) vrijwel geen onderzoek gedaan. De werkgroep heeft daarom besloten om de PSK in de richtlijn op te nemen als aanbevolen meetinstrument en de PSG als alternatief op te nemen als één van de optionele) meetinstrumenten.
Literatuur stap 6 ‘Wat is de klinimetrische kwaliteit van de aanbevolen meetinstrumenten?’
Pijn
Ondanks het veelvuldige gebruik van de VAS en de NPRS is er geen bewijs dat duidelijk suggereert dat een van beide superieur is ten opzichte van de ander bij patiënten met lage rugpijn. Er is onderzoek nodig van hoge methodologische kwaliteit waarin de klinimetrische kwaliteit van beide instrumenten met elkaar wordt vergeleken (Chiarotto 2019).
Een beperking van de NPRS is dat daarmee slechts één dimensie van pijn kan worden vastgelegd, namelijk de pijnintensiteit, een van de kernsets van het instrument. Dat is dan ook de reden dat dit begrip in de richtlijn wordt gehanteerd (Chiarotto 2019). Ten behoeven van uniformiteit met de voorgaande richtlijn is ervoor gekozen de gemiddelde pijnintensiteit te evalueren over de afgelopen 24 uur.
De werkgroep sluit zich aan bij de aanbeveling van een internationaal panel van experts om de NPRS af te nemen voor gemiddelde pijn over de afgelopen 24 uur.
Fysiek functioneren
Voor het domein fysiek functioneren was er geen consensus tussen de initiatieven over het geselecteerde instrument voor de set met kernmeetinstrumenten. Hierna volgt de beoordeling van de klinimetrische kwaliteit van de drie geselecteerde meetinstrumenten: de ODI, de RMDQ en de ‘Quebec Back Pain Disability Scale’ (QBPDS).
Een systematisch literatuuronderzoek naar de content- en constructvaliditeit van de meetinstrumenten voor fysiek functioneren bij patiënten met lage rugpijn concludeert dat er lage tot zeer lage bewijskracht is voor de contentvaliditeit van de 16 onderzochte meetinstrumenten, waaronder de ODI en de QBPDS (Chiarotto 2018b). Voor de RMDQ-24 wordt bewijs van hoge kwaliteit gevonden voor voldoende begrijpelijkheid (‘comprehensibility’) en voor onvoldoende volledigheid (‘comprehensiveness’), waarbij de bewijskracht voor de relevantie is beoordeeld als zeer laag (Chiarotto 2018b). Tevens is vastgesteld dat de RMDQ-24 niet unidimensionaal meet; de resultaten van de ODI en de QBPDS over de unidimensionaliteit zijn inconsistent (Chiarotto 2018b).
Een narratief literatuuronderzoek concludeert dat er bij de ODI sprake is van hoge interne consistentie (Cronbachs alfa 0,71 tot 0,87) en een goede test-hertestbetrouwbaarheid (intraclass correlatiecoëfficient (ICC) 0,84, 95%-BI 0,73 tot 0,91). Er wordt een meetfout van 4 tot 6 gevonden (Smeets 2011). De reproduceerbaarheid van de QBPDS wordt in hetzelfde narratieve literatuuronderzoek als volgt beoordeeld: hoge interne consistentie (Cronbachs alfa 0,90); goede test-hertestbetrouwbaarheid (ICC 0,92) en een meetfout (‘minimum detectable change’) van 0,84 (95%-BI 0,73 tot 0,91) (Smeets 2011). De reproduceerbaarheid van de RMDQ wordt als volgt beoordeeld: hoge interne consistentie (Cronbachs alfa 0,84 tot 0,96); matige test-hertestbetrouwbaarheid (ICC 0,42-0,53) bij een gemengde populatie van acute, subacute en chronische lage rugpijn en een meetfout (SEM) van 3,7 tot 4,1.
Een narratief literatuuronderzoek concludeert dat de ODI responsief is in het detecteren van verandering (AUC > 0,76); voor de QBPDS en de RMDQ worden conflicterende resultaten gevonden (Smeets 2011).
De werkgroep stelt vast dat op basis van de validiteit, reproduceerbaarheid en responsiviteit geen duidelijke voorkeur kan worden uitgesproken voor de ODI, RMDQ of de QBPDS.
Op basis van de hanteerbaarheid en de klinimetrische eigenschappen is het niet mogelijk om een van de geselecteerde meetinstrumenten te verkiezen boven een andere.
Hoewel de ODI en de QBPDS tijdens de consensusprocedure meer stemmen kregen (78% van de stemmen resp. 62%) koos een internationale multidisciplinaire groep experts voor wetenschappelijk onderzoek er uiteindelijk voor om de RMDQ (met slechts 50% van de stemmen) in de kernset op te nemen, omdat dit meetinstrument vrij verkrijgbaar is (Chiarotto 2018a).
Van een groep experts bestaande uit patiënten, patiëntvertegenwoordigers, onderzoekers, fysiotherapeuten, beleidsmakers en zorgverzekeraars stemde 80% voor opname van de QBPDS in de kernset en 64% voor opname van de ODI (Verburg 2019). Zij veronderstelden dat de ODI in Nederland minder gangbaar is. De RMDQ is niet meegenomen in de stemming, omdat deze al eerder in het consensusproces was afgevallen na discussie binnen de projectgroep.
De projectgroep heeft per domein slechts een beperkt aantal meetinstrumenten ingebracht om over te stemmen. Bovendien is zo veel mogelijk gezocht naar aansluiting met bestaande richtlijnen.
De werkgroep is van mening dat – rekening houdend met de lokale context en het belang van consistentie in het aanbevelen van meetinstrumenten – de QBPDS als aanbevolen meetinstrument opgenomen dient te worden in de richtlijn voor het meten van het fysiek functioneren.
Activiteiten en participatie in ADL
De responsiviteit van de PSK is beoordeeld in een gerandomiseerd gecontroleerd onderzoek bij een subgroep van 81 patiënten met lage rugpijn van minstens 6 weken (Beurskens 1996). In dit onderzoek is de PSK voldoende responsief bevonden (AUC 0,82) en kon het goed discrimineren tussen herstelde en niet herstelde patiënten.
Naar de validiteit van de Nederlandse versie van de PSK is geen onderzoek gedaan bij patiënten met lage rugpijn. Bij patiënten met enkelklachten is de vragenlijst voldoende valide: 100% van de hypothesen worden bevestigd in een vergelijking met de ‘Ankle Function Score’ en de ‘Molander Ankle Score’ (Van der Wees 2012). Bij patiënten met de ziekte van Parkinson blijkt de betrouwbaarheid wisselend en afhankelijk van de gekozen activiteit; Cohen’s Kappa varieert van 0,39-0,83 (Nijkrake 2009).
Naar de Engelse variant, de ‘Patient-Specific Functional Scale’ (PSFS), is meer onderzoek gedaan. In een literatuuronderzoek blijkt de PSFS valide, betrouwbaar en responsief bij patiënten met artrose van de heup of knie (Barten 2012).
Literatuur stap 7 en 8 ‘Zijn er normwaarden beschikbaar en hoe bereken en interpreteer je de gegevens?’
De berekeningswijze van ieder instrument is opgenomen onder het kopje ‘hanteerbaarheid’ en wordt beschreven op www.meetinstrumentenzorg.nl. In de meeste elektronische patiëntendossiers is de berekening van de totaalscore opgenomen.
Bij de interpretatie van de totaalscore gaat het om de mate waarin betekenis kan worden gegeven aan de (verandering in) score van het meetinstrument. Hierbij kan het een maat zoals het minimaal klinisch-relevant verschil (‘minimal clinically important difference’ (MCID) of de ‘minimal important change’ (MIC)) gehanteerd worden (KNGF 2016). [Maten voor interpretatie (zoals de MCID en MIC) zijn vaak op basis van gegevens op groepsniveau verkregen. Bij toepassing in de praktijk kan de bruikbaarheid daarom beperkt zijn, aangezien een waarde die is verkregen op groepsniveau moet worden vertaald naar individueel niveau. Toch geeft de score op het instrument een indicatie van de individuele verandering in gezondheidsstatus. Bij de interpretatie van de score moet ook rekening worden gehouden met bodem- of plafondeffecten; deze hebben namelijk invloed op de verbetermogelijkheid.]
Van de PSK zijn geen normwaarden bekend. De gegevens over de MIC van de overige aanbevolen meetinstrumenten zijn gebaseerd op een literatuuronderzoek, een expertpanel en een workshop met als doel praktische richtlijnen te ontwikkelen voor veel gebruikte meetinstrumenten voor pijn en fysieke beperkingen bij patiënten met lage rugpijn (Ostelo 2008). Na discussie is binnen dit onderzoek consensus bereikt over de volgende MIC-waarden:
Er zijn enige aanwijzingen dat, wanneer rekening wordt gehouden met de baselinescore, een verbetering van 30% op de NPRS en/of de QBPDS beschouwd kan worden als nuttige drempel voor het identificeren van een klinisch-relevante verbetering bij de individuele patiënt (Ostelo 2008).
Overwegingen
Conform het ‘Raamwerk Klinimetrie voor evidence-based products’ (KNGF 2016) is in eerste instantie bepaald welke domeinen of parameters in kaart gebracht dienen te worden. Dit is voornamelijk gebaseerd op items die belangrijk zijn bevonden in de anamnese, het lichamelijk onderzoek en de indicatiestelling. Op grond daarvan zijn aanbevolen en optionele meetinstrumenten geselecteerd. Zie de Toelichting bij deze module voor een overzicht van de parameters.
De optionele meetinstrumenten kunnen op basis van het klinisch redeneren gekozen worden ter ondersteuning van het diagnostisch proces of ter evaluatie, indien hier een specifieke aanleiding voor is.
Voor informatie over de hanteerbaarheid, klinimetrische kwaliteit en interpretatie van de resultaten van de optionele meetinstrumenten wordt verwezen naar www.meetinstrumentenzorg.nl.
- Beurskens AJ, de Vet HC, Koke AJ, Lindeman E, van der Heijden GJ, Regtop W, Knipschild PG. A patient-specific approach for measuring functional status in low back pain. J Manipulative Physiol Ther. 1999;22(3):144-8.
- Beurskens AJ, de Vet HC, Koke AJ. Responsiveness of functional status in low back pain: a comparison of different instruments. Pain. 1996;65(1):71-6.
- Chiarotto A, Boers M, Deyo RA, Buchbinder R, Corbin TP, Costa LOP, Foster NE, Grotle M, Koes BW, Kovacs FM, Lin CC, Maher CG, Pearson AM, Peul WC, Schoene ML, Turk DC, van Tulder MW, Terwee CB, Ostelo RW. Core outcome measurement instruments for clinical trials in nonspecific low back pain. Pain. 2018a;159(3):481-95.
- Chiarotto A, Deyo RA, Terwee CB, Boers M, Buchbinder R, Corbin TP, Costa LO, Foster NE, Grotle M, Koes BW, Kovacs FM, Lin CW, Maher CG, Pearson AM, Peul WC, Schoene ML, Turk DC, van Tulder MW, Ostelo RW. Core outcome domains for clinical trials in non-specific low back pain. Eur Spine J. 2015;24(6):1127-42.
- Chiarotto A, Maxwell LJ, Ostelo RW, Boers M, Tugwell P, Terwee CB. Measurement properties of visual analogue scale, numeric rating scale, and pain severity subscale of the brief pain inventory in patients with low back pain: a systematic review. J Pain. 2019;20(3):245-63.
- Chiarotto A, Ostelo RW, Boers M, Terwee CB. A systematic review highlights the need to investigate the content validity of patient-reported outcome measures for physical functioning in patients with low back pain. J Clin Epidemiol. 2018b;95:73-93.
- Fairbank JC, Couper J, Davies JB, O’Brien JP. The Oswestry low back pain disability questionnaire. Physiotherapy. 1980;66(8):271-3.
- ICHOM Working Group Members for Low Back Pain. The ICHOM Standard Set for Low Back Pain. Boston, United States of America: International Consortium For Health Outcomes Measurements; 2017 [updated August 24th, 2017]. Version 2.0.3. Beschikbaar via: https://www.ichom.org/portfolio/low-back-pain/. Geraadpleegd op 27 juni 2019.
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF). Raamwerk klinimetrie voor evidence based products. Amersfoort: KNGF; 2016. Beschikbaar via: https://www.kngf.nl/binaries/content/assets/kennisplatform/onbeveiligd/klinimetrie/raamwerk-klinimetrie-november-2016-def.pdf.
- Kopec JA, Esdaile JM, Abrahamowicz M, Abenhaim L, Wood-Dauphinee S, Lamping DL, Williams JI. The Quebec back pain disability scale. Measurement properties. Spine. 1995;20(3):341-52.
- Nijkrake MJ, Keus SH, Quist-Anholts GW, Overeem S, de Roode MH, Lindeboom R, Mulleners W, Bloem BR, Munneke M. Evaluation of a Patient-Specific Index as an outcome measure for physiotherapy in Parkinson’s disease. Eur J Phys Rehabil Med. 2009;45(4):507-12.
- Ostelo RW, Deyo RA, Stratford P, Waddell G, Croft P, von Korff M, Bouter LM, de Vet HC. Interpreting change scores for pain and functional status in low back pain: towards international consensus regarding minimal important change. Spine. 2008;33(1):90-4.
- Roland M, Morris R. A study of the natural history of back pain. Part I: development of a reliable and sensitive measure of disability in low-back pain. Spine. 1983;8(2):141-4.
- Schoppink LE, van Tulder MW, Koes BW, Beurskens SA, de Bie RA. Reliability and validity of the Dutch adaptation of the Quebec Back Pain Disability Scale. Phys Ther. 1996;76(3):268-75.
- Smeets R, Koke A, Lin CW, Ferreira M, Demoulin C. Measures of function in low back pain/disorders: Low Back Pain Rating Scale (LBPRS), Oswestry Disability Index (ODI), Progressive Isoinertial Lifting Evaluation (PILE), Quebec Back Pain Disability Scale (QBPDS), and Roland-Morris Disability Questionnaire (RDQ). Arthritis Care Res (Hoboken). 2011;63 Suppl 11:S158-73.
- Stevens A, Beurskens A, Koke A, van der Weijden T. The use of patient-specific measurement instruments in the process of goal-setting: a systematic review of available instruments and their feasibility. Clin Rehabil. 2013;27(11):1005-19.
- Stevens A, Koke A, van der Weijden T, Beurskens A. Ready for goal setting? Process evaluation of a patient-specific goal-setting method in physiotherapy. BMC Health Serv Res. 2017a;17(1):618.
- Stevens A, Koke A, van der Weijden T, Beurskens A. The development of a patient-specific method for physiotherapy goal setting: a user-centered design. Disabil Rehabil. 2018;40(17):2048-55.
- Stevens A, Moser A, Koke A, van der Weijden T, Beurskens A. The use and perceived usefulness of a patient-specific measurement instrument in physiotherapy goal setting. A qualitative study. Musculoskeletal science & practice. 2017b;27:23-31.
- van der Wees P, Hendriks E, van Beers H, van Rijn R, Dekker J, de Bie R. Validity and responsiveness of the ankle function score after acute ankle injury. Scand J Med Sci Sports. 2012;22(2):170-4.
- van Hooff ML, Spruit M, Fairbank JC, van Limbeek J, Jacobs WC. The Oswestry Disability Index (version 2.1a): validation of a Dutch language version. Spine. 2015;40(2):E83-90.
- Verburg AC, van Dulmen SA, Kiers H, Nijhuis-van der Sanden MWG, van der Wees PJ. Development of a standard set of outcome measures for non-specific low back pain in Dutch primary care physiotherapy practices: a Delphi study. Eur Spine J. 2019.

