Algemene informatie
A.1 Aanleiding
Verbeteringen in (vroeg)diagnostiek en nieuwe behandelingen van kanker resulteren in een toename van het aantal patiënten dat jaren na de diagnose nog in leven is. De verbeterde overlevingspercentages leiden tot een groeiende groep mensen die leeft met de fysieke en psychosociale gevolgen van kanker en de behandeling daarvan. Hierdoor krijgt kanker meer en meer het karakter van een chronische aandoening.
Daarnaast is er steeds meer wetenschappelijke literatuur waarin positieve effecten worden beschreven van beweeginterventies en fysieke activiteit op verschillende gezondheidsgerelateerde uitkomsten bij mensen met kanker. De nieuwe inzichten hebben geleid tot (inter)nationale richtlijnen waarin fysieke activiteit wordt aanbevolen, zowel tijdens als na de behandeling van kanker. Kanker en de behandeling ervan kunnen echter leiden tot barrières om te bewegen, waardoor begeleiding van een fysio- of oefentherapeut nodig kan zijn. Bij deze begeleiding kan de therapeut knelpunten ervaren die voortkomen uit de complexiteit van een behandeltraject bij mensen die leven met of na kanker. In veel gevallen zijn deze knelpunten generiek van aard en niet alleen van toepassing op één type kanker. Deze richtlijn beschrijft daarom aanbevelingen die betrekking hebben op de fysio- en oefentherapeutische behandeling van mensen die leven met of na kanker. Bij het aanbieden van een beweeginterventie voor een specifieke doelgroep zal de therapeut zich verder moeten verdiepen in tumorspecifieke richtlijnen, die onder andere beschikbaar zijn via de richtlijnendatabase van de Federatie Medisch Specialisten (opent in nieuw tabblad).
Doel van de richtlijn
Deze richtlijn beschrijft aanbevelingen die betrekking hebben op patiënten die bijwerkingen en symptomen van de behandeling van kanker ervaren en bij wie die bijwerkingen de behandeling door de therapeut bemoeilijken.
Deze aanbevelingen betreffen specifiek de toepassing van beweeginterventies en de aanpassingen die daarin noodzakelijk zijn in geval van botmetastasen, cardiotoxiciteit, chemotherapie-geïnduceerde perifere neuropathie (CIPN) en vermoeidheid. Deze aspecten worden binnen deze richtlijn ‘complicerende factoren’ genoemd.
Het doel van beweegzorg is in algemene zin het bevorderen van gezondheid, het wegnemen van barrières voor c.q. het faciliteren van bewegen en het ontwikkelen en/of in stand houden van een zo actief mogelijke levensstijl. Beweegzorg richt zich op het optimaliseren van het niveau van fysieke capaciteit, functioneren en fysieke activiteit en voor de kwaliteit van leven in het dagelijks leven.
Doelgroep
Patiëntengroep
Deze richtlijn is bedoeld voor de behandeling van volwassen mensen die leven met of na kanker voor wie fysio- of oefentherapeutische behandeling geïndiceerd kan zijn. De term ‘patiënten’ wordt in dit document gebruikt voor ‘de patiënt van de fysio- of oefentherapeut die kanker heeft of heeft gehad’.
Beoogde gebruikers van de richtlijn
Deze richtlijn is primair gericht op fysiotherapeuten en oefentherapeuten die de hiervoor gedefinieerde patiëntengroep behandelen en begeleiden. Deze beroepsgroepen worden beschreven in het ‘Beroepsprofiel Fysiotherapeut (opent in nieuw tabblad)’ en het ‘Beroepsprofiel Oefentherapeut’.
De richtlijn is ook relevant voor andere zorgverleners die betrokken zijn bij de behandeling en begeleiding van mensen die leven met of na kanker.
Afbakening
Deze richtlijn is gericht op het diagnostisch en therapeutisch proces van de fysio- en oefentherapeut bij patiënten tijdens of na de in opzet curatieve behandeling of tijdens palliatieve behandeling van kanker. Deze aanbevelingen gelden onafhankelijk van het type kanker dat een patiënt heeft of heeft gehad.
Leeswijzer
De informatie in de richtlijn is inhoudelijk toegekend aan Deel A ‘Algemene informatie’, Deel B ‘Beweeginterventies bij kanker’ en Deel C ‘Complicerende factoren’. Deel A bevat een algemene inleiding, geeft achtergrondinformatie over de behandeling bij kanker ten tijde van het schrijven van deze richtlijn en gaat in op de organisatie van zorg rond deze patiëntengroep. In onderdeel B staat een algemene beschrijving van de wijze waarop beweeginterventies door een fysio- of oefentherapeut vormgegeven worden bij patiënten met kanker. Onderdeel C bevat aanbevelingen voor de toepassing van beweeginterventies bij kanker indien er sprake is van factoren die het aanbieden van een therapeutische interventie kunnen belemmeren.
De verschillende onderwerpen binnen een deel vormen afzonderlijke, op zichzelf staande modules. In elke module is de informatie vervolgens verdeeld over drie lagen, waarbij met elke laag het desbetreffende onderwerp verder is uitgediept:
- De praktische handvatten, de aanbevelingen, zijn opgenomen in de Praktijkrichtlijn (de eerste laag).
- Achterliggende informatie en de afweging van de belangrijkste argumenten die leiden tot de aanbeveling, staan in de Toelichting oftewel de noten (de tweede laag).
- De details over de wijze waarop deze informatie is vergaard (o.a. zoekstrategie, samenvatting van resultaten, beoordeling van bewijskracht en beschrijving van overwegingen), het proces waarmee deze afweging tot stand is gekomen en de referenties van de gebruikte (wetenschappelijke) literatuur, staan in de Verantwoording (de derde laag).
Waar ‘hij’ geschreven staat, kan ook ‘zij’ gelezen worden. Waar ‘therapeut’ geschreven staat, kan ‘fysiotherapeut’ of ‘oefentherapeut’ worden gelezen. Waar ‘therapie’ geschreven staat, kan ‘fysiotherapie’ of ‘oefentherapie’ worden gelezen.’
Methodiek
De ontwikkeling van deze richtlijn heeft plaatsgevonden conform de ‘KNGF Richtlijnenmethodiek 2019’. In aanvulling op deze bestaande methodiek is gedurende de ontwikkeling van deze richtlijn een ‘Addendum KNGF Richtlijnenmethodiek’ ontwikkeld, met specifieke aandacht voor het ontwikkelen van een richtlijn met een generiek of domeinspecifiek karakter. De wijze waarop deze methodiek toegepast is en de wijze waarop relevante externe partijen betrokken zijn bij de ontwikkeling, staan beschreven in de Verantwoording van deze module.
Onderbouwing
In de Praktijkrichtlijn staan de aanleiding en het doel van deze richtlijn omschreven. In dit onderdeel van de richtlijn staat een toelichting op het FAST-project en zijn de belangrijkste begrippen omschreven die in deze richtlijn aan de orde komen. De ‘KNGF-richtlijn Oncologie’ is ontwikkeld volgens de ‘KNGF-richtlijnenmethodiek 2019’ (KNGF 2019). In de verantwoording van deze module staat beschreven op welke wijze deze methodiek is toegepast voor deze specifieke richtlijn.
FAST-project
Ontwikkeling van richtlijnen is een kostbaar en langdurig proces en de wijze waarop dit proces tot op heden voor de fysio- en oefentherapie gestalte krijgt (te weten op diagnose-/aandoeningsniveau) sluit niet altijd aan op de dagelijkse zorgpraktijk. Vanuit het systeemadvies fysio- en oefentherapie is onderzoek gedaan naar mogelijkheden om op een efficiëntere wijze aandoeningoverstijgende richtlijnen voor de fysio- en oefentherapie te ontwikkelen (Zorginstituut Nederland 2016). Begin 2018 is hiertoe door VUmc (sinds 7 juni 2018 Amsterdam UMC, locatie VUmc) en Ecorys een plan van aanpak opgesteld voor de ontwikkeling van dergelijke aandoeningoverstijgende richtlijnen (zowel generieke als domeinspecifieke), waardoor thema’s met gemeenschappelijke elementen niet meer voor iedere aandoeningsspecifieke richtlijn afzonderlijk uitgewerkt hoeven te worden (VUmc/Ecorys 2018). De generieke richtlijnen betreffen aspecten van zorg die voor alle patiënten die bij een hulpverlener komen, van toepassing kunnen zijn, zoals zelfmanagement. De domeinspecifieke richtlijnen betreffen aspecten van zorg die van toepassing kunnen zijn voor alle patiënten met nauw aan elkaar verwante aandoeningen, zoals oncologische aandoeningen, het onderwerp van voorliggende richtlijn.
Dit advies van het VUmc en Ecorys werd uitgevoerd binnen het FAST-project (Fysio-/oefentherapie Aanpak Stroomlijning kwaliteitsstandaarden).
Het FAST-project is als volgt opgebouwd:
- Deelproject 1 Ontwikkeling addendum op KNGF-richtlijnenmethodiek voor de ontwikkeling van generieke/domeinspecifieke richtlijnen en procesevaluatie.
- Deelproject 2 Een ‘proof-of-concept’ van een generieke richtlijn met als onderwerp ‘zelfmanagement’.
- Deelproject 3 Een ‘proof-of-concept’ van een domeinspecifieke richtlijn met als onderwerp ‘oncologie’.
Indien het plan van aanpak haalbaar blijkt en voor het werkveld relevante richtlijnen oplevert, wordt het addendum (deelproject 1) verwerkt in de KNGF-richtlijnenmethodiek (KNGF 2019). Daarmee kunnen in de toekomst (ook door andere paramedische beroepsgroepen) andere generieke en domeinspecifieke richtlijnen ontwikkeld worden.
Door in aandoeningsspecifieke richtlijnen naar deze generieke en domeinspecifieke richtlijnen te verwijzen en niet meermaals overeenkomstige uitgangsvragen te beantwoorden, zoals tot nog toe gebruikelijk is, zal richtlijnontwikkeling binnen de fysio- en oefentherapie efficiënter kunnen verlopen.
Status van een richtlijn
Aanbevelingen in een richtlijn zijn geen wetten of dwingende voorschriften. In principe wordt een therapeut geacht zich hieraan te houden, maar beargumenteerd afwijken is legitiem of zelfs noodzakelijk indien dit past bij de situatie en wensen van een individuele patiënt (AQUA 2021).
Belangrijkste definities en begrippen
- Adjuvant: aanvullend op de primaire behandeling
- Aeroob: inspanning waarbij het lichaam energie produceert met behulp van zuurstof
- Antigeen: een eiwit op een celmembraan waaraan een tumorcel herkend kan worden
- Anthracycline: verzamelnaam voor een groep cytostatica
- Apoptose: zelfdoding van een cel
- Beenmergsuppressie: verminderde functie van beenmerg, leidend tot een afname van het aantal bloedcellen
- Cachexie: afname van spiermassa en onbedoeld gewichtsverlies
- Cardiomyopathie: aandoening van de hartspier waardoor er minder bloed wordt rondgepompt
- Celdeling: proces waarbij een cel zich opsplitst in twee of meer nieuwe cellen
- Continuïteit (chirurgie): het operatiepreparaat bestaat uit een deel (doel: de tumor wordt niet doorsneden)
- Curatief: bedoeld om te genezen
- Cytostatica: geneesmiddelen die een remmende werking hebben op de deling van (tumor)cellen
- Celdifferentiatie: proces waarin een (stam)cel zich ontwikkelt tot een cel met weefselspecifieke kenmerken
- DNA: molecuul dat fungeert als de belangrijkste chemische drager van erfelijke informatie
- Dyspnoe: kortademigheid
- ECOG-prestatiestatus: maatstaf voor hoe goed een persoon in staat is om dagelijkse activiteiten uit te voeren die is ontwikkeld door de ‘Eastern Cooperative Oncology Group’
- Fibrose: verharding door overmatige bindweefselvorming in een orgaan of weefsel
- Induratie: plaatselijke verharding van weefsel
- Infiltratie/invasieve groei: langzaam doordringen (e.g. kankercellen die ingroeien in gezond weefsel)
- Initiatie (cel): mutatie in erfelijk materiaal zonder dat de schade wordt hersteld.
- Ioniserende straling: straling met hoge energie die leidt tot vorming van vrije zuurstofradicalen
- Maligne: kwaadaardig
- Metastase: uitzaaiing van primaire kwaadaardige tumor; een osteolytische metastase kenmerkt zich door afbraak van bot waardoor het bot zwak en broos wordt
- Mucositis: ontstekingsreactie van slijmvliezen
- Mutatie: verandering in het DNA
- Neoadjuvant: voorafgaand aan de primaire behandeling
- Neuropathie: neurologische stoornis waarbij een of meerdere zenuwen niet goed meer werken
- Oedeem: vochtophoping in een lichaamsdeel
- Oestrogeen: vrouwelijk geslachtshormoon
- Osteoporose: ernstige botontkalking
- Ovariëctomie: ingreep waarbij een of beide eierstokken worden verwijderd
- Palliatief: gericht op ziekteremming en symptoombestrijding, maar niet op genezing
- Premaligne: afwijking die (nog) niet kwaadaardig (maligne) is, maar ook niet helemaal goedaardig
- Promotie(cel): stimulatie van celgroei door mutatie
- Radicale resectie: volledige verwijdering van de tumor met tumorvrije snijranden
- Sarcopenie: verlies van zowel spiermassa als spierfunctie
- Schildwachtklier: lymfeklier die als eerste het lymfevocht uit het gebied rond de tumor opvangt
- Testosteron: mannelijk geslachtshormoon
Tijdens de voorbereidingsfase vond een ‘invitational conference’ plaats om de knelpunten te inventariseren. Behalve 16 therapeuten en andere zorgverleners die betrokken zijn bij de behandeling van mensen die leven met of na kanker, gaven ook patiëntenvertegenwoordigers input tijdens de bijeenkomst. De knelpunten werden daarna geïnventariseerd tijdens een focusgroepbijeenkomst, waaraan negen therapeuten deelnamen. De verzamelde knelpunten zijn voorgelegd aan de leden van de werkgroep en de klankbordgroep tijdens de eerste werkgroep- respectievelijk klankbordgroepbijeenkomst, waarbij ook een selectie is gemaakt van de meest relevante knelpunten, die vervolgens zijn omgezet in uitgangsvragen.
Eén knelpunt werd vaak genoemd, namelijk dat bijwerkingen en symptomen van de kankerbehandeling fysio- of oefentherapeutische behandeling kunnen bemoeilijken. Deze werden benoemd als ‘complicerende factoren’. Zo’n complicerende factor kan aanleiding zijn voor het aanpassen van de fysio- of oefentherapeutische behandeling, maar kan ook een negatieve invloed hebben op de prognose en het resultaat van die behandeling en zou om die reden al geïdentificeerd of gediagnosticeerd moeten worden bij de intake.
Door de beperkte looptijd van het project was het niet mogelijk om voor alle veelvoorkomende problematiek een evidence based aanbeveling op te stellen. Op basis van de gesignaleerde knelpunten is daarom een longlist van complicerende factoren opgesteld die zich vaak voordoen bij mensen die leven met of na kanker. Deze longlist is vervolgens als enquête uitgezet onder oefen- en fysiotherapeuten, met als doel informatie te verzamelen over de complicerende factoren waarover de meeste klinische onzekerheid bestaat. Aan de respondenten werd gevraagd om uit de longlist vijf complicerende factoren te kiezen waar zij het liefst een evidence-based aanbeveling over zouden willen krijgen, en vervolgens wat voor soort advies zij graag zouden willen ontvangen. De enquête is ingevuld door 117 oefen- en fysiotherapeuten.
In de volgende tabel is te zien hoeveel procent van de respondenten de verschillende complicerende factoren het meest relevant voor de richtlijn vonden.
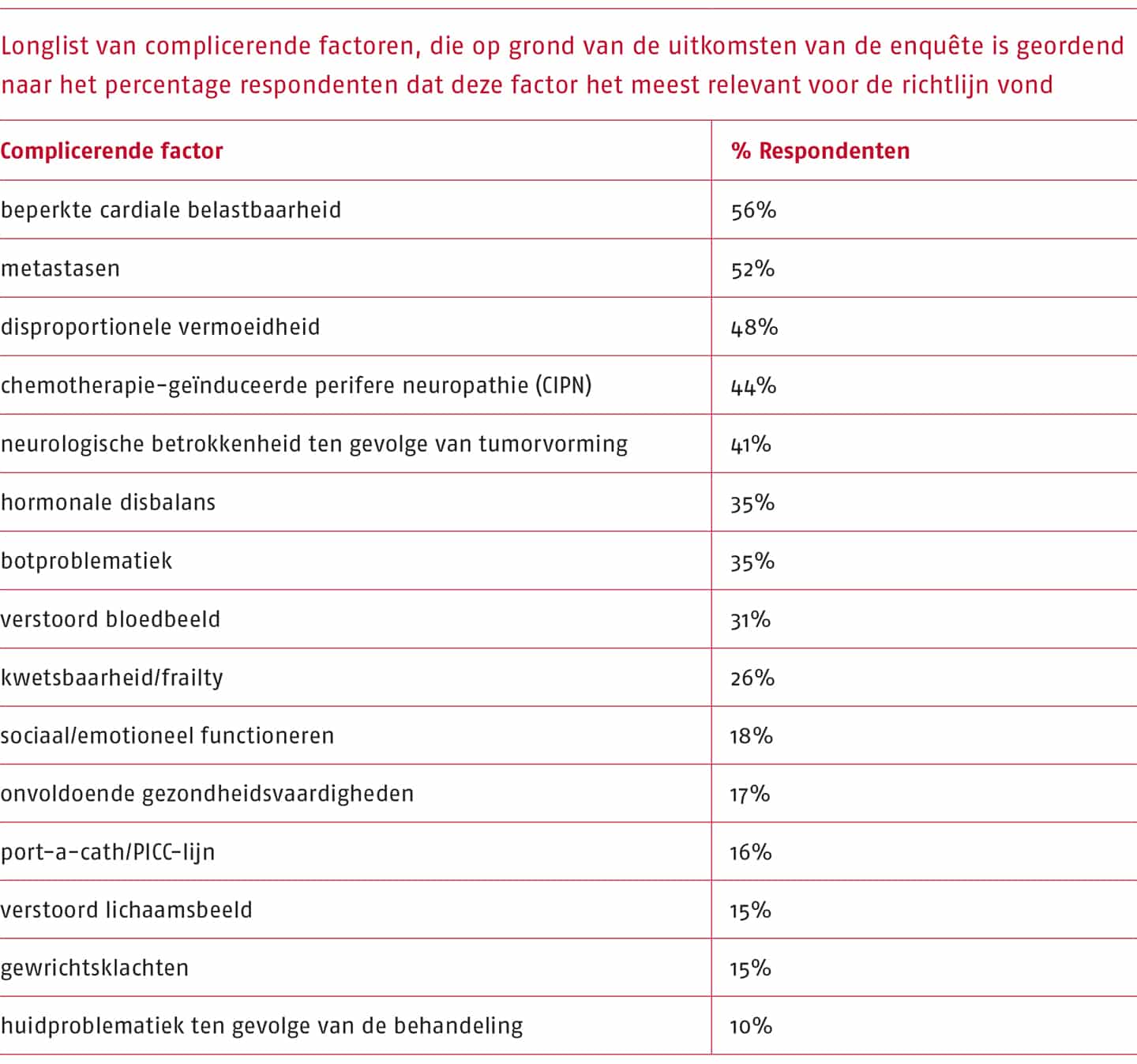
Met behulp van de resultaten van de enquête konden de uitgangsvragen zorgvuldig geformuleerd en afgebakend worden, zodat ze te beantwoorden waren binnen het beperkte tijdsbestek.
Patiëntenperspectief
Zowel in de voorbereidingsfase, de ontwikkelfase als de commentaarfase is het patiëntenperspectief geborgd. De Nederlandse Federatie van Kankerpatiënten organisaties (NFK) heeft in de voorbereidingsfase input gegeven voor de knelpunten, tijdens de ontwikkelfase de overwegingen vanuit patiëntenperspectief verwoord en in de commentaarfase is de conceptrichtlijn becommentarieerd.
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF). KNGF-Richtlijnenmethodiek 2019. Amersfoort: KNGF; 2019.
- VUMC/Ecorys. Een kwaliteitsstandaard fysio- en oefentherapie: a roadmap voor een gestroomlijnde aanpak. Amsterdam: VUMC/Ecorys; 2018.
- AQUA. AQUA-Leidraad. Ten behoeve van de ontwikkeling van een richtlijn, module, zorgstandaard of organisatiebeschrijving, die betrekking heeft op (een deel van) een zorgproces en vastlegt wat noodzakelijk is om vanuit het perspectief van de cliënt goede zorg te verlenen. Diemen: Zorginstituut Nederland; 2021.
A.2 Kenmerken en behandeling van kanker
Kanker is in feite niet één medische aandoening, maar een paraplubegrip waaronder een veelheid aan ziektebeelden valt. Tussen de verschillende kankertypen is een grote variëteit in biologisch gedrag en prognose. Het gemeenschappelijke kenmerk van kanker is ongereguleerde celgroei, waarbij schade aan gezonde weefsels kan optreden als gevolg van het ruimte-innemende proces (benigne tumor), of vanwege invasieve groei van de kanker (maligne of kwaadaardige tumor). Bij de meeste kankersoorten treedt verspreiding van maligne cellen op door ‘uitzaaiing’ ofwel metastasering.
Medische behandeling van kanker loopt sterk uiteen, zowel tussen verschillende typen als tussen verschillende stadia van één soort kanker. Het doel van een in opzet curatieve behandeling is genezing. Is genezing niet (meer) mogelijk, dan wordt een palliatieve behandeling ingezet die is gericht op het remmen van de ziekte (c.q. het verlengen van de levensverwachting) en/of het voorkomen of verminderen van klachten en symptomen.
Afhankelijk van het type kanker en hoe ver de ziekte gevorderd is, worden een of meerdere vormen van behandeling toegepast. Behandelopties bij kanker zijn chirurgie, radiotherapie, chemotherapie, antihormonale therapie en doelgerichte therapie. Elk van deze behandelmodaliteiten heeft haar eigen mogelijke bijwerkingen in de vorm van symptomen, beperkingen en gezondheidsrisico’s. Deze bijwerkingen kunnen zowel aanleiding voor een hulpvraag als complicerende factoren zijn bij de fysio-/oefentherapeutische begeleiding.
Onderbouwing
Chirurgie
Bij chirurgische behandeling is het doel het tumorweefsel in zijn geheel te verwijderen, waarmee beoogd wordt de ziekte te genezen. Bij een chirurgische ingreep wordt gestreefd naar ‘continuïteit’ (het operatiepreparaat bestaat uit één deel; de tumor wordt niet doorsneden), ‘radicaliteit’ (de tumor wordt volledig verwijderd) en voldoende marge tot aan het gezonde weefsel.
Chirurgie wordt vaak toegepast in combinatie met andere behandelmodaliteiten die voorafgaand (neoadjuvant) of na afloop (adjuvant) van de chirurgie worden ingezet. Chirurgie kan ook worden toegepast in directe combinatie met andere therapieën, zoals radiotherapie (waarbij peroperatief in het lichaam de directe omgeving van de tumor wordt bestraald) of chemotherapie (bijvoorbeeld het spoelen van de buikholte met medicijnen in aanvulling op het chirurgisch verwijderen van de tumor bij metastasen in het buikvlies).
Bij chirurgische verwijdering van de primaire tumor kan er een indicatie zijn voor verwijdering van de locoregionale lymfeklieren. Indien mogelijk wordt de sentinelnodeprocedure toegepast, de procedure waarbij met behulp van beeldvorming de lymfeklier wordt geïdentificeerd waarop het tumorgebied als eerste draineert. Deze zogeheten schildwachtklier wordt dan verwijderd en beoordeeld door de patholoog. Ontbreken in de klier de kankercellen, dan wordt een volledige lymfeklierresectie achterwege gelaten.
Chirurgie wordt niet als vorm van curatieve behandeling ingezet bij hematologische tumoren en ziekten van het lymfestelsel. In de palliatieve fase kan chirurgie worden toegepast om klachten te verhelpen of verminderen.
Radiotherapie
Radiotherapie is het blootstellen van weefsel aan gerichte, hoogenergetische straling. Voor bestraling kan gebruikgemaakt worden van externe stralingstoestellen, maar ook van kleine stralingsbronnen die in de patiënt worden gebracht (zogeheten brachytherapie).
Sinds 2018 wordt een nieuwe vorm van radiotherapie in Nederland toegepast: protonentherapie. Daarbij worden kleine geladen deeltjes uit de atoomkern (de protonen) gebruikt in plaats van de fotonen of elektronen. Hierdoor is protonentherapie vooral geschikt voor patiënten met tumoren die gelegen zijn bij kwetsbare organen en voor patiënten bij wie de gebruikelijke radiotherapie veel bijwerkingen geeft.
Het werkingsmechanisme van radiotherapie berust op de ioniserende werking van röntgenstraling. In het bestraalde weefsel worden door deze ionisatie van moleculen vrije zuurstofradicalen gevormd, die vervolgens het DNA van de cellen beschadigen. De radiotherapie wordt zo gedoseerd en toegediend dat een maximaal effect op de tumor wordt bereikt en een minimum aan schade aan gezonde weefsels wordt aangericht. Het herstel van gezonde weefsels wordt met name mogelijk door de bestralingsdosis op te delen in herhaalde kleine fracties. Gezonde cellen in het weefsel kunnen in de tussenliggende perioden – tot op zekere hoogte – de schade namelijk herstellen. Maligne cellen zijn niet in staat om de DNA-schade te repareren en gaan na bestraling dood bij de celdeling.
Radiotherapie kan ook worden toegepast in combinatie met chemotherapie, waarbij de chemotherapie het effect van de radiotherapie versterkt. Radiotherapie kan zowel adjuvant (aanvullend aan de primaire behandeling) als neoadjuvant (voorafgaand aan de primaire behandeling) worden toegepast, al dan niet in combinatie met andere behandelingen. Ook tijdens de palliatieve fase kan radiotherapie worden ingezet ter vermindering van bijvoorbeeld pijnklachten.
Chemotherapie
Chemotherapie bestaat uit het toedienen van medicijnen die cytostatica worden genoemd. De cytostatica worden, afhankelijk van de situatie, toegediend via een infuus, tabletten, injecties of een katheter. Ze remmen de celdeling (het proces waarbij een cel zich opsplitst in twee of meer nieuwe cellen) of doden kankercellen. Ze kunnen op bijna alle plaatsen kankercellen bereiken, omdat ze zich via het bloed verspreiden. In sommige gevallen worden cytostatica in het hersenvocht toegediend.
Cytostatica worden meestal ingezet als adjuvante, neoadjuvante of palliatieve behandeling in de vorm van een kuur (chemotherapie). Doorgaans worden in een dergelijke kuur verschillende middelen gecombineerd, met elk hun eigen aangrijpingspunt. Een uitvoerig overzicht van de middelen en mogelijke bijwerkingen ervan is te vinden op de website van het Integraal Kankercentrum Nederland, en op de website van het Farmacotherapeutisch Kompas.
Antihormonale therapie
Een aantal tumoren is voor de groei afhankelijk van geslachtshormonen (het vrouwelijk geslachtshormoon oestrogeen en het mannelijk geslachtshormoon testosteron). Antihormonale therapie remt of blokkeert de werking van hormonen of remt de aanmaak van hormonen. Beïnvloeding van het hormonale milieu kan worden bereikt door uitschakeling van de geslachtsklieren. Dit kan door middel van chirurgie (het verwijderen van ovaria of testes), door radiotherapie of door medicamenten.
Antihormonale middelen werken door de productie te remmen van oestrogenen in andere weefsels dan de eierstokken of door de werking tegen te gaan van oestrogenen (tamoxifen) of testosteron (gonadoreline-agonisten). Ze kunnen worden ingezet als adjuvante, neoadjuvante of palliatieve behandeling.
Doelgerichte therapie
Doelgerichte therapie (‘targeted therapy’) is behandeling met medicijnen die zich – anders dan chemotherapie – specifiek richten op (processen in) tumorcellen. Er zijn twee groepen doelgerichte therapie: monoklonale antilichamen en ‘small molecules’.
Monoklonale antilichamen worden geproduceerd in het laboratorium. Ze herkennen het antigen (een eiwit, in dit geval gelegen op het celmembraan) van een kankercel en binden zich daaraan. Die binding belemmert vervolgens de groeiprocessen of de nieuwvorming van bloedvaten van de tumorcel of zet zelfs apoptose (het proces waarbij de cel zichzelf doodt) in gang. Er zijn ook monoklonale antilichamen die het immuunsysteem stimuleren, waardoor op die manier de groei van kankercellen wordt belemmerd of kankercellen worden gedood.
‘Small molecules’ zijn medicijnen die heel specifiek aangrijpen op processen en signalen die verantwoordelijk zijn voor de groei, deling en overleving van kankercellen.
Doelgerichte therapie wordt vaak ingezet in combinatie met andere behandelingen, zowel in de (neo)adjuvante als tijdens de palliatieve fase.
De informatie die nodig was voor het beantwoorden van de uitgangsvraag is, in overleg met de werkgroep, op niet-systematische wijze vergaard uit de hier genoemde bronnen, waaronder een recentelijk ontwikkelde internationale richtlijn, en de overwegingen van de werkgroep.
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF). KNGF-standaard Beweeginterventie oncologie. Amersfoort: KNGF; 2011.
- Nederlandse Vereniging voor Revalidatieartsen (VRA). Richtlijn medisch specialistische revalidatie bij oncologie (2.0). Utrecht: VRA; 2018. Geraadpleegd op 11 mei 2021. Beschikbaar via https://richtlijnendatabase.nl/
- van Spil JA, van Muilekom HAM, Folsche M, Schreuder-Cats HA. Leerboek Oncologieverpleegkunde. Houten: BSL; 2021.
A.3 Effecten van behandeling op bewegend functioneren
De medische behandeling tegen kanker gaat in veel gevallen gepaard met functieverlies van het bewegingsapparaat en gerelateerde systemen. Het betreft bij veel patiënten een verminderd uithoudingsvermogen (verminderde VO2max), een lagere spiermassa en functieverlies.
Het functieverlies van het bewegingsapparaat en gerelateerde systemen is multifactorieel en het gevolg van zowel ziekteprocessen en effecten van de medische behandeling, als van verminderde lichamelijke activiteit tijdens de behandeling.
Een verminderd activiteitenniveau na afloop van de behandeling draagt bij aan het in stand houden van de afgenomen fysieke belastbaarheid. De ziekte of behandeling van kanker kan ook invloed hebben op het functioneren in het dagelijks leven en op participatie door bijvoorbeeld (chronische) vermoeidheid, beperkte longfunctie of pijn.
Onderbouwing
Een verminderd uithoudingsvermogen is in verschillende studies beschreven (Courneya 2007, 2009; Jones 2007, Van Waart 2015). De VO2max, – de belangrijkste marker voor uithoudingsvermogen – is geassocieerd met kwaliteit van leven (Herrero 2006); bij een laag uithoudingsvermogen komt de functionele onafhankelijkheid in gevaar (Shephard 2009). Gemiddeld is de VO2max van patiënten met borstkanker na de behandeling met chemotherapie 25% lager dan bij gezonde inactieve vrouwen (Peel 2014). Ook kan een afname van spierkracht en spiermassa optreden bij mensen die leven met of na kanker (Vega 2016). Een lage spiermassa is in verband gebracht met een hogere behandelingstoxiciteit, een verminderde overlevingskans en een lagere kwaliteit van leven (Blauwhoff-Buskermolen 2016; Kurk 2019; Vega 2016).
Een volledige beschrijving van alle negatieve effecten van kanker en de behandeling van kanker valt buiten het bestek van deze richtlijn en is onder andere te vinden op de websites van het KWF en het IKNL.
Een beknopt overzicht van de in het kader van beweeginterventies meest relevante effecten wordt hieronder gegeven. Voor meer gedetailleerde informatie wordt verwezen naar de beschikbare tekstboeken en naar beschikbare tumorspecifieke richtlijnen.
Effecten van chirurgie
De gevolgen van chirurgische behandeling voor het bewegend functioneren zijn afhankelijk van plaats en uitgebreidheid van de chirurgie. Ziekenhuisopname en chirurgie kunnen leiden tot een afname in fysieke capaciteit (Van Rooijen 2019) en kunnen (vooral bij ouderen) effect hebben op de mobiliteit en de conditie. Het litteken kan aanleiding geven tot het ontstaan van bewegingsbeperking en er kan sprake zijn van motorisch of sensibel zenuwletsel. Chirurgische verwijdering van lymfeklieren kan aanleiding zijn voor het ontstaan van lymfoedeem (Schmitz 2010). Het verwijderen van de prostaat leidt vaak tot incontinentie en geeft net als het aanleggen van een stoma, bijvoorbeeld op colon of ileum, beperkingen voor trainingsvormen waarbij hoge intra-abdominale druk ontstaat en voor contactsporten (Schmitz 2010; Heydenreich 2020). Bij reconstructies kan tijdelijk een restrictie gelden voor beweging of belasting.
Effecten van radiotherapie
Bijwerkingen van radiotherapie uiten zich het eerst in snel delende weefsels. Patiënten kunnen, afhankelijk van de plaats van bestraling, klachten krijgen als mucositis (ontsteking van slijmvliezen in bijvoorbeeld mond, long of darm), roodheid en gevoeligheid van de huid. Vaak zijn deze vroege reacties reversibel.
Late reacties (zoals stralingsfibrose) treden maanden tot jaren na beëindiging van de behandeling op in langzamer delende weefsels, en zijn veelal irreversibel. Stralingsfibrose uit zich als een verminderde elasticiteit in combinatie met induratie (verharding) van het weefsel. Radiotherapie kan aanleiding geven tot het ontstaan van lymfoedeem door functieverlies van lymfeklieren of lymfevaten, of door fibrosering van de huid en het onderhuids bindweefsel (Barazzuol 2020).
Op zeer lange termijn kan door radiotherapie ook zenuwletsel ontstaan. Afhankelijk van de dosis kan radiotherapie op spierweefsel lokaal leiden tot disfunctie en onvermogen tot hypertrofie. Dit geldt zowel voor de skeletspieren als voor de hartspier.
Effecten van chemotherapie
De bijwerkingen van chemotherapie en de gevolgen daarvan voor het bewegend functioneren lopen sterk uiteen en kunnen, ook bij gebruik van dezelfde middelen, van persoon tot persoon verschillen. Bij de behandeling met anthracyclines kan hartschade optreden (Kirkham 2019). Deze schade kan leiden tot hartfalen en een negatieve invloed hebben op de inspanningstolerantie. Beenmergsuppressie, een verminderde functie van het beenmerg die leidt tot een afname van het aantal bloedcellen, treedt op bij een groot aantal cytostatica en kan leiden tot een verminderd aantal witte bloedcellen en een (tijdelijk) verlaagd hemoglobinegehalte, wat leidt tot een verhoogd risico op infectie, vermoeidheidsklachten en verminderde inspanningstolerantie (Jones 2009). Ook kan het gehalte aan stollingsfactoren afnemen, waardoor een groter risico op bloedingen ontstaat bij grote belasting of bij puntbelasting. Beenmergstimulerende middelen (zoals G-CSF) kunnen bot- of spierpijn geven, maar deze pijn vormt geen contra-indicatie voor inspanning. Neuropathieën kunnen leiden tot gevoelsstoornissen en krachtverlies. Het hand-voetsyndroom is een combinatie van sensorische neuropathie, roodheid, zwelling en soms blaarvorming aan de handen en de voeten die verergerd wordt door druk of wrijvingskrachten.
Tijdens en na behandeling met chemotherapie kan door een combinatie van metabole factoren en gedragsverandering de lichaamssamenstelling veranderen, waarbij een afname van spiermassa optreedt die gepaard kan gaan met een toename van vetmassa (Pedersen 2017). Een veranderde lichaamssamenstelling op haar beurt kan weer leiden tot een afgenomen inspanningstolerantie, met name bij activiteiten waarbij de spierkracht in relatie tot het lichaamsgewicht belangrijk is (bijvoorbeeld lopen en traplopen).
Effecten van antihormonale behandeling
Antihormonale therapie gericht tegen oestrogeen leidt tot vroegtijdige inductie van de menopauze en geeft daarmee een verhoogd risico op osteoporose. Antihormonale therapie kan ook gepaard gaan met (non-inflammatoire) gewrichtsklachten, stemmingswisselingen en depressieve gevoelens. Hoge doses progestagenen kunnen onder andere leiden tot perifeer oedeem en spierkrampen. Bij vrouwen kan antihormonale behandeling leiden tot opvliegers en toename van de vetmassa en afname van de vetvrije massa. Bij mannen kan antihormonale behandeling leiden tot krachteloosheid en gewichtstoename, toename van de vetmassa en afname van de vetvrije massa (Smith 2002). Bij mannen ontstaat bovendien een verhoogd risico op cardiovasculaire ziekte (Boland 2021), een sterk verhoogd valrisico door fysieke veranderingen zoals zwakte, lage loopsnelheid en lage fysieke activiteit (zie Kwetsbaarheid), zeker als er ook sprake is van overgewicht (Winters-Stone 2017). Ook hier is sprake van afname van botmineraaldichtheid die uiteindelijk kan leiden tot osteoporose (Galvao 2008).
Effecten van behandeling met doelgerichte therapie
Over de effecten van doelgerichte therapie op het inspanningsvermogen is in algemene zin nog niet veel bekend. Een uitzondering vormt het bij specifieke vormen van borstkanker veelgebruikte monoklonaal antilichaam trastuzumab. Het heeft een (reversibele) cardiotoxische werking. Anders dan bij anthracyclines is bij trastuzumab geen sprake van celdood, maar van celdisfunctie. Hierdoor kan een afname van functie van de linkerventrikel optreden (Procter 2010). Bij behandeling met trastuzumab wordt daarom standaard gescreend op linkerventrikelfunctie. Te sterke afname van deze functie is aanleiding tot onderbreken of stoppen van de behandeling. Symptomatisch hartfalen door trastuzumab is daardoor zeldzaam.
Behandeling met trastuzumab wordt dan ook niet als contra-indicatie voor inspanning gezien. Het is belangrijk dat de therapeut alert is op tekenen van hartfalen tijdens bewegen (met name dyspnoe (kortademigheid) bij inspanning, plotselinge gewichtstoename of perifeer oedeem), zeker als er sprake is geweest van voorafgaande behandeling met anthracyclines (bijvoorbeeld adriamycine, doxorubicine; zie C.2 ‘Cardiotoxiciteit’).
Andere middelen die worden ingezet als doelgerichte therapie, kunnen vergelijkbare effecten hebben op factoren die samenhangen met het inspanningsvermogen. Een uitgebreide beschrijving van de bijwerkingen en effecten van doelgerichte therapie is te vinden op www.bijwerkingenbijkanker.nl.
De informatie die nodig was voor het beantwoorden van de uitgangsvraag is, in overleg met de werkgroep, op niet-systematische wijze vergaard uit de hier genoemde bronnen, waaronder een recentelijk ontwikkelde internationale richtlijn, en de overwegingen van de werkgroep.
- Barazzuol L, Coppes RP, van Luijk P. Prevention and treatment of radiotherapy‐induced side effects. Molecular Oncol. 2020 Jul;14(7):1538-54.
- Blauwhoff-Buskermolen S, Versteeg KS, van der Schueren MAE, den Braver NR, Berkhof J, Langius, JAE, Verheul HMW. Loss of muscle mass during chemotherapy is predictive for poor survival of patients with metastatic colorectal cancer. J Clin Oncol. 2016;34(12):1339-44.
- Boland J, Choi W, Lee M, Lin J. Cardiovascular toxicity of androgen deprivation therapy. Curr Cardiol Rep. 2021. Jul 3;23(8):109.
- Courneya KS, Friedenreich CM. Physical activity and cancer control. Semin Oncol Nurs. 2007;23(4):242-52.
- Courneya KS, Sellar CM, Stevinson C, McNeely ML, Peddle CJ, Friedenreich CM, Tankel K, Basi S, Chua N, Mazurek A, Reiman T. Randomized controlled trial of the effects of aerobic exercise on physical functioning and quality of life in lymphoma patients. J Clin Oncol. 2009;27(27):4605-12.
- Galvao DA, Spry NA, Taaffe DR, Newton RU, Stanley J, Shannon T, Rowling C, Prince R. Changes in muscle, fat and bone mass after 36 weeks of maximal androgen blockade for prostate cancer. BJU Int. 2008;102:44-7.
- Herrero F, Balmer J, San Juan AF, Foster C, Fleck SJ, Perez M, Canete S, Earnest CP, Lucia A. Is cardiorespiratory fitness related to quality of life in survivors of breast cancer? J Strength Cond Res. 2006;20(3):535-40.
- Heydenreich M, Puta C, Gabriel HH, Dietze A, Wright P, Zermann DH. Does trunk muscle training with an oscillating rod improve urinary incontinence after radical prostatectomy? A prospective randomized controlled trial. Clin Rehabil. 2020;34(3):320-33.
- Jones LW, Eves ND, Mackey JR, Peddle CJ, Haykowsky M, Joy AA, Courneya KS, Tankel K, Spratlin J, Reiman T. Safety and feasibility of cardiopulmonary exercise testing in patients with advanced cancer. Lung Cancer. 2007;55(2):225-32.
- Jones LW, Eves ND, Haykowsky M, Freedland SJ, Mackey JR. Exercise intolerance in cancer and the role of exercise therapy to reverse dysfunction. Lancet Oncol. 2009;10(6):598-605.
- Kirkham AA, Beaudry RI, Paterson DI, Mackey JR, Haykowsky MJ. Curing breast cancer and killing the heart: A novel model to explain elevated cardiovascular disease and mortality risk among women with early stage breast cancer. Prog Cardiovasc Dis. 2019;62(2):116-26.
- Kurk S, Peeters P, Stellato R, Dorresteijn B, de Jong P, Jourdan M, Creemers GJ, Erdkamp F, de Jongh F, Kint P, Simkens L, Tanis B, Tjin-A-Ton M, van der Velden A, Punt C, Koopman M, May A. Skeletal muscle mass loss and dose-limiting toxicities in metastatic colorectal cancer patients. J Cachexia Sarcopenia Muscle. 2019;10(4):803-13.
- Pedersen B, Delmar C, Bendtsen MD, Bosaeus I, Carus A, Falkmer U, Groenkjaer M. Changes in weight and body composition among women with breast cancer during and after adjuvant treatment: a prospective follow-up study. Cancer Nurs. 2017;40(5):369-76.
- Peel AB, Thomas SM, Dittus K, Jones LW, Lakoski GS. Cardiorespiratory fitness in breast cancer patients: a call for normative values. J Am Heart Assoc. 2014;3(1): e000432.
- Procter M, Suter TM, de Azambuja E, Dafni U, van Dooren V, Muehlbauer S, Climent MA, Rechberger E, Liu WT, Toi M, Coombes RC, Dodwell D, Pagani O, Madrid J, Hall M, Chen SC, Focan C, Muschol M, van Veldhuisen DJ, Piccart-Gebhart MJ. Longer-term assessment of trastuzumab- related cardiac adverse events in the Herceptin Adjuvant (HERA) trial. J Clin Oncol. 2010;28(21):3422-8.
- Schmitz KH, Courneya KS, Matthews C, Demark-Wahnefried W, Galvao DA, Pinto BM, Irwin ML, Wolin KY, Segal RJ, Lucia A, Schneider CM, von Gruenigen VE, Schwartz AL, American College of Sports Medicine. American College of Sports Medicine roundtable on exercise guidelines for cancer survivors. Med Sci Sports Exerc. 2010. 42(7):1409-26.
- Shephard RJ. Independence: a new reason for recommending regular exercise to your patients, Phys Sportsmed. 2009. 37(1):115-8.
- Smith MR, Finkelstein JS, McGovern FJ, Zietman AL, Fallon MA, Schoenfeld DA, Kantoff PW. Changes in body composition during androgen deprivation therapy for prostate cancer. J Clin Endocrinol Metab. 2002;87(2):599-603.
- van Rooijen SJ, Molenaar CJL, Schep G, van Lieshout RHMA, Beijer S, Dubbers R, Rademakers N, Papen-Botterhuis NE, van Kempen S, Carli F, Roumen RMH, Slooter GD. Making patients fit for surgery: introducing a four pillar multimodal prehabilitation program in colorectal cancer. Am J Phys Med Rehabil. 2019;98(10):888-96.
- van Spil JA, van Muilekom HAM, Folsche M, Schreuder-Cats HA. Leerboek Oncologieverpleegkunde. Houten: Bohn Stafleu van Loghum; 2021.
- van Waart H, Stuiver MM, van Harten WH, Geleijn E, Kieffer JM, Buffart LM, de Maaker-Berkhof M, Boven E, Schrama J, Geenen MM, Meerum Terwogt JM, van Bochove A, Lustig V, van den Heiligenberg SM, Smorenburg CH, Hellendoorn-van Vreeswijk JA, Sonke GS, Aaronson NK. Effect of low-intensity physical activity and moderate- to high-intensity physical exercise during adjuvant chemotherapy on physical fitness, fatigue, and chemotherapy completion rates: results of the PACES randomized clinical trial. J Clin Oncol. 2015;33(17):1918-27.
- Vega MC, Laviano A, Pimentel GD. Sarcopenia and chemotherapy-mediated toxicity. Einstein (Sao Paulo). 2016;14(4):580-4.
- Winters-Stone KM, Moe E, Graff JN, Dieckmann NF, Stoyles S, Borsch C, Alumkal JJ, Amling CL, Beer TM. Falls and frailty in prostate cancer survivors: current, past, and never users of androgen deprivation therapy. J Am Geriatr Soc. 2017;65(7):1414-9.
A.4 De rol van bewegen bij kanker
Mensen die leven met of na kanker kunnen barrières ervaren om te bewegen. Deze barrières kunnen praktisch, sociaal, mentaal/emotioneel, gedragsmatig of fysiek van aard zijn. Een deel van de barrières zal bovendien direct of indirect het gevolg zijn van kanker of de behandeling van kanker. Daarom zullen veel mensen die leven met of na kanker op een gegeven moment behoefte hebben aan begeleiding bij het bewegend functioneren.
Om te bepalen welke begeleiding het beste aansluit bij de individuele patiënt is het belangrijk dat de beweegzorg wordt bekeken vanuit een perspectief dat de fysiotherapie of oefentherapie overstijgt. De barrières die een patiënt ervaart kunnen een multidimensionaal karakter hebben en het is belangrijk dat deze tijdig worden opgemerkt. Hetzelfde geldt voor het herkennen en toepassen van factoren die het bewegend functioneren bevorderen.
Wanneer barrières voor het bewegend functioneren aanwezig zijn die met een fysio- of oefentherapeutische interventie kunnen worden weggenomen (denk aan: (dreigende) functiebeperkingen, (verwachte) risico’s die zijn gerelateerd aan de klinische staat of mentale/emotionele barrières die om een specifieke therapeutische aanpak vragen), zullen patiënten begeleiding nodig hebben van een fysiotherapeut of oefentherapeut. Deze begeleiding kan bestaan uit counseling (bijvoorbeeld via motiverende gespreksvoering), advies over veilig en effectief uitvoeren van bepaalde handelingen of oefeningen en advies over keuzes voor zelf oefenen met een specifiek beoogd effect, maar ook uit een geheel of gedeeltelijk gesuperviseerde beweeginterventie.
Onderbouwing
De therapeut moedigt mensen die leven met of na kanker aan om voldoende lichamelijk actief te zijn. Hoewel veel mensen na de diagnose kanker meer aandacht lijken te besteden aan een gezond eetpatroon en het stoppen met roken, is de invloed van kanker op het beweeggedrag echter vaak negatief (Courneya 1997; Schwartz 1998). Mensen die leven met of na kanker bewegen in het algemeen minder dan een vergelijkbare groep zonder chronische aandoeningen (Eng 2018; Ooijendijk 2006). Zij kunnen barrières ervaren om te bewegen. Deze barrières kunnen praktisch, sociaal, mentaal/emotioneel, gedragsmatig of fysiek zijn. Een deel van de barrières zal bovendien direct of indirect het gevolg zijn van kanker of de behandeling van kanker. Daarom zullen veel mensen die leven met of na kanker op een gegeven moment behoefte hebben aan begeleiding bij het bewegend functioneren.
PACC framework
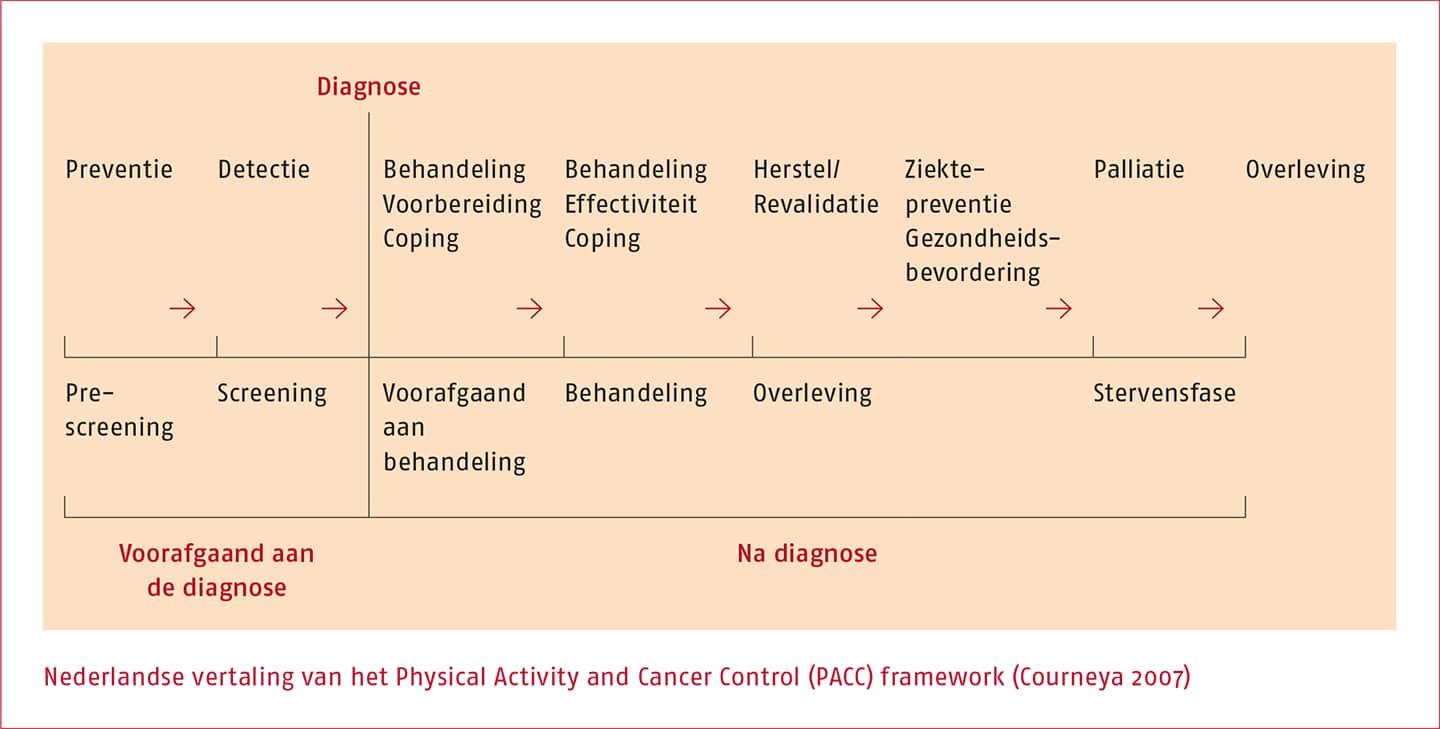
Om onderzoek en beweegzorg tijdens en na de behandeling van kanker te organiseren en gerichter plaats te laten vinden, is door onderzoekers een kader geschetst rond lichamelijke activiteit en kanker, het zogeheten ‘PACC framework’ (Courneya 2007), zie de volgende figuur.
In het ‘PACC framework’ wordt onderscheid gemaakt tussen preventie, de fasen voorafgaand aan de diagnose, de fasen tijdens de behandeling en de fasen na afloop van de behandeling. De primaire doelstellingen voor beweeginterventies in de verschillende fasen zijn:
- preventie van kanker tijdens de fase voorafgaand aan een diagnose;
- voorbereiding op de behandeling in de fase na de diagnose en voorafgaand aan de behandeling (prehabilitatie);
- verhogen van de effectiviteit van de behandeling en beperken van negatieve effecten in de fase tijdens de behandeling;
- herstel van functioneren en ziektepreventie (zowel recidief van kanker als preventie van andere aandoeningen, waaronder cardiovasculaire aandoeningen), na afloop van de curatieve behandeling, en
- symptoombestrijding en behoud van autonomie van patiënten in de palliatieve fase.
Op al deze fasen zal hierna dieper worden ingegaan.
Preventie
Primaire preventie beschrijft activiteiten die het ontstaan van ziekte voorkomen (Adami 2001). Het naleven van richtlijnen voor kankerpreventie wordt in verband gebracht met een kleinere kans op het ontstaan van kanker (Kabat 2015). Deze richtlijnen bevatten aanbevelingen over het behouden van een gezond lichaamsgewicht, voldoende lichaamsbeweging en het eten van gezonde producten (Kushi 2012). Een associatie tussen fysieke activiteit en het risico op het ontstaan van kanker is met name onderzocht in observationele studies. Op basis van deze studies is sterk bewijs gevonden voor een preventief effect van voldoende inspanning op het risico van borst-, darm-, endometrium-, blaas-, oesofagus-, nier- en maagkanker (Patel 2020). De aanbevolen hoeveelheid lichaamsbeweging voor preventie van deze vormen van kanker is 150 tot 300 minuten per week aerobe training van ten minste matige intensiteit, of 75 tot 150 minuten intensieve aerobe training (ACSM 2019). Om gerichte aanbevelingen voor de optimale hoeveelheid fysieke activiteit ter preventie van kanker op te stellen, is meer onderzoek nodig.
Prehabilitatie
Prehabilitatie is zorg voorafgaand aan de operatie met als doel een patiënt fysiek en mentaal-emotioneel voor te bereiden op de operatie, het herstel te bevorderen en complicaties te verminderen. Prehabilitatie is doorgaans multimodaal met een gedragsveranderingsprogramma (zoals stoppen met roken), dieetbegeleiding, mentale of emotionele begeleiding en/of fysio- of oefentherapie. Het succes van prehabilitatie is afhankelijk van de inzet en medewerking van alle betrokkenen: zowel de patiënt als de naaste(n) van de patiënt als alle (in)direct betrokken zorgverleners.
Bij een aantal vormen van kanker, zoals darmkanker, is prehabilitatie haalbaar, veilig en effectief bevonden, maar bij andere vormen van kanker is het bewijs voor die effectiviteit beperkt (Bobbio 2008; Van Rooijen 2019). Desondanks wordt deze vorm van zorg nu op veel plaatsen geïmplementeerd.
Uit onderzoek is gebleken dat met prehabilitatie het uithoudingsvermogen en de fysieke kracht kunnen toenemen, de opnameduur korter kan zijn en de functionele capaciteit zich sneller kan herstellen (Van Rooijen 2019). Prehabilitatie lijkt het meest succesvol bij mensen met een hoog risico op complicaties of vertraagd of onvolledig functioneel herstel (Berkel 2021; Thomas 2019).
Tijdens de behandeling
De therapeut adviseert patiënten om inactiviteit te vermijden en ernaar te streven de adviezen uit richtlijnen voor lichamelijke activiteit voor mensen met kanker te volgen: 3x per week aerobe training gedurende 30 minuten en 2x per week krachttraining gedurende 20 minuten (ACSM 2019). Zie de adviezen ten aanzien van de FITT-factoren in B.2 ‘Trainingsvoorschriften’.
Het is belangrijk dat de therapeut op zoek gaat naar een trainingsniveau dat zowel effectief als haalbaar is voor de patiënt. De belastbaarheid van de patiënt kan tijdens de behandeling sterk wisselen, hetgeen vraagt om een continue heroverweging en (waar nodig) bijstelling van het trainingsvoorschrift.
Trainen tijdens de behandeling van kanker is gericht op het verminderen van bijwerkingen van de behandeling, het tegengaan van de afname van de fysieke capaciteit, het vergemakkelijken van het volhouden van de behandeling en mogelijk het verbeteren van de effectiviteit van de behandeling.
Resultaten van systematisch literatuuronderzoek laten zien dat er sterk bewijs is dat doelgerichte fysieke activiteit tijdens de behandeling op zijn minst een deel van de behandelinggerelateerde afname van spiermassa, spierkracht, uithoudingsvermogen en vermoeidheidsklachten kan verminderen, zo niet verbeteren (Lee 2020; Sweegers 2019; Van Rooijen 2018; Van Vulpen 2020). Ook kan fysieke activiteit tijdens de behandeling mogelijk bepaalde aspecten van kwaliteit van leven verbeteren (Buffart 2017; Lipsett 2017; Sweegers 2018). Beweeginterventies in deze fase zijn het meest effectief als ze onder begeleiding plaatsvinden (Buffart 2017; Campbell 2019; Sweegers 2018). Er is aanleiding voor begeleiding (door een fysio- of oefentherapeut) in het kader van gezondheidszorg bij een behandeling met een hoge symptoomlast en/of een snel wisselende belastbaarheid (Campbell 2019; Schmitz 2019). Rond een operatie (o.a. colorectaal, thoracaal, gynaecologie, urologie) kan het ‘Enhanced Recovery After Surgery’ (ERAS)-programma worden ingezet. Dit is een kwaliteitsprogramma waarin verschillende factoren zijn samengebracht die een positieve invloed hebben op herstel (NVH 2020). Onderdeel van dit programma is een zo kort mogelijke periode van bedrust, zodat inactiviteit en het verlies van spierkracht worden beperkt.
Herstel
Er bestaat overtuigend bewijs dat fysieke activiteit na afloop van de behandeling van kanker positieve effecten heeft op de lichamelijke en geestelijke gezondheid van de patiënt. Samenvattingen van verschillende gerandomiseerde studies hebben aangetoond dat fysieke activiteit en beweeginterventies kunnen leiden tot winst in fysieke functies, afname van symptomen en verhoging van kwaliteit van leven (Buffart 2017; Sweegers 2018). Beweeginterventies zijn ook in deze fase over het algemeen het meest effectief wanneer ze onder begeleiding plaatsvinden.
In het kader van gezondheidszorg hebben beweeginterventies na afloop van de behandeling tot doel het inspanningsvermogen van de patiënt te optimaliseren voor zover noodzakelijk voor het bereiken van de persoonlijke levensdoelen in relatie tot dagelijkse activiteiten, werk en sport. Beweeginterventies kunnen daarnaast in meer algemene zin gericht zijn op het hernemen of ontwikkelen van een actieve levensstijl en het wegnemen van barrières voor, c.q. het faciliteren van het bewegen. Beweeginterventies na afloop van de behandeling kunnen worden geclassificeerd als gezondheidszorg als er sprake is van een therapeutische doelstelling.
Belangrijke componenten van beweeginterventies zijn daarbij:
- het verleggen van en/of het leren omgaan met grenzen;
- het verkrijgen/vergroten van vertrouwen in het lichaam;
- het vergroten van het plezier in het bewegen;
- het ontwikkelen of herwinnen van een actieve levensstijl;
- het verbeteren van de voor het bewegen voorwaardelijke fysieke functies en anatomische eigenschappen voor zover de patiënt dit niet (veilig) zelfstandig kan;
- het scheppen van voorwaarden (kennis, vaardigheden, ervaren competentie) voor het zelfstandig vergroten/onderhouden van het gewenste niveau van fysiek functioneren.
Welke componenten van toepassing zijn en waar de nadruk van de zorg ligt, zal de therapeut in overleg met de patiënt vaststellen. De vorm van de beweeginterventie dient aan te sluiten bij de persoonlijke wensen en doelen en de uitgangssituatie van de patiënt. Met uitgangssituatie wordt in deze context bedoeld: de aanwezige stoornissen in functie en anatomische eigenschappen, aanwezige beperkingen in activiteiten, beschikbare adaptatieruimte, het gedrag en de ervaren barrières voor bewegen. De keuze van individuele activiteiten en het niveau van belasten zal de therapeut afstemmen op de individuele patiënt, oftewel, de verleende zorg is maatwerk.
In het algemeen kan worden gesteld dat de motivatie voor activiteiten het grootst is als de activiteit wordt aangeboden op het juiste competentieniveau van de patiënt (uitdagend, maar niet te moeilijk) en als de activiteit leidt tot een grotere eigen autonomie en sociale verbondenheid.
Gemetastaseerde ziekte
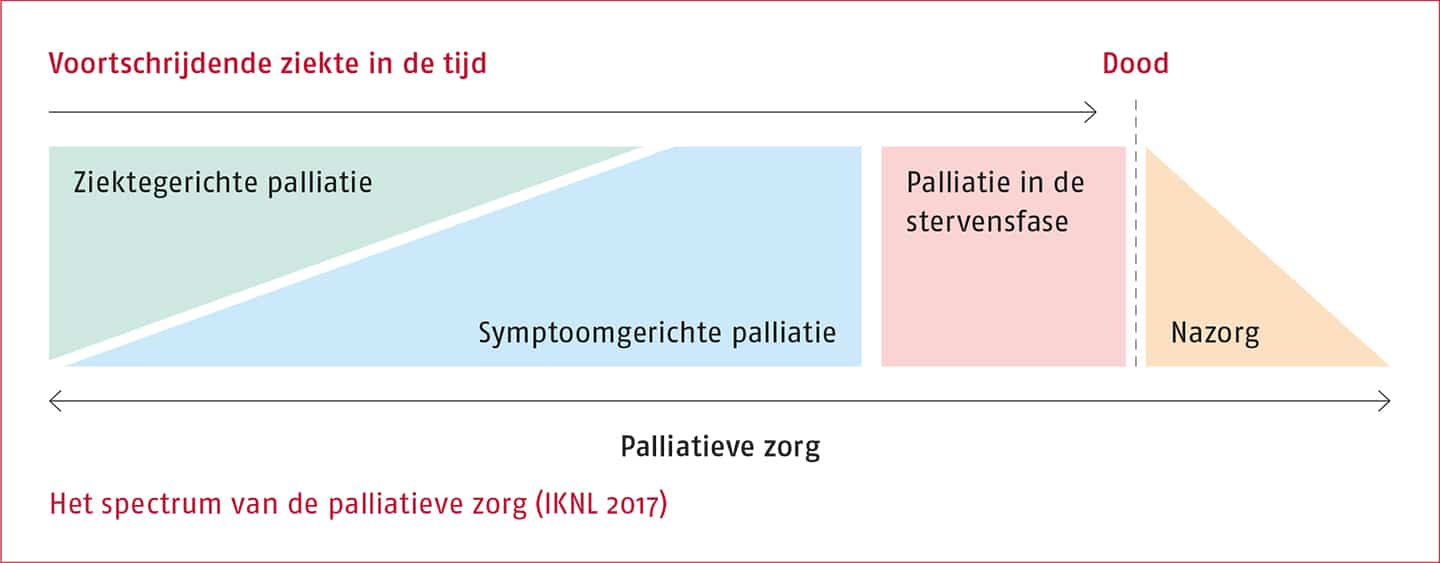
Bij de meeste vormen van kanker betekent de aanwezigheid van afstandsmetastasen dat er geen curatie meer mogelijk is en dat de patiënt vanaf dat moment in de palliatieve fase van de ziekte is. Dit wil overigens lang niet altijd zeggen dat de patiënt snel zal overlijden. De behandeling is vanaf dat moment niet meer gericht op het elimineren van de ziekte, maar op het zo lang mogelijk terugdringen van de ziekte, het uitstellen en bestrijden van klachten en symptomen, het bevorderen van de kwaliteit van leven en het dagelijks functioneren en soms ook op levensverlenging. In het spectrum van de palliatieve zorg wordt in de volgende figuur een overzicht gegeven van de verschillende stadia van de palliatieve zorg (IKNL 2017).
Bij sommige vormen van kanker is genezing nog wel mogelijk, ook al zijn er afstandsmetastasen. Beweeginterventies in de aanwezigheid van gemetastaseerde ziekte is een veelbelovende strategie om de functionele capaciteit, onafhankelijkheid en kwaliteit van leven te optimaliseren (Dittus 2017). Fysieke activiteit kan helpen om achteruitgang in uithoudingsvermogen of spierkracht te voorkomen of te vertragen. Zo kan een adequate fysieke functie voor het uitvoeren van dagelijkse activiteiten behouden blijven. Daarmee kan fysieke activiteit ervoor zorgen dat de patiënt zijn functionele status behoudt en/of verhoogt, een belangrijke factor in de besluitvorming van de medische behandeling. Dit onderstreept hoe belangrijk het is om achteruitgang in fysieke functie en kwaliteit van leven te verminderen. Beweeginterventies in het kader van de gezondheidszorg (dus onder begeleiding van een fysio- of oefentherapeut) als onderdeel van palliatieve zorg, zijn aanbevolen als er sprake is van een therapeutische doelstelling of van veiligheidsrisico’s in relatie tot bewegen en belasten.
De informatie die nodig was voor het beantwoorden van de uitgangsvraag betreft tekstboekkennis en is daarom, in overleg met de werkgroep, op niet-systematische wijze vergaard uit de hier genoemde bronnen, waaronder recentelijk ontwikkelde internationale richtlijnen, en overwegingen van de werkgroep.
- Adami HO, Day NE, Trichopoulos D, Willett WC. Primary and secondary prevention in the reduction of cancer morbidity and mortality. Eur J Cancer. 2001;37(Suppl 8):118-27.
- American College of Sports Medicine. Effects of exercise on health-related outcomes in those with cancer. Indianapolis IL: ACSM; 2019. Geraadpleegd op 1 februari 2020. Beschikbaar via: https://www.acsm.org/docs/default-source/files-for-resource-library/exercise-guidelines-cancer-infographic.pdf?sfvrsn=c48d8d86_4
- Berkel A, Bongers B, Kotte H, Weltevreden P, de Jongh F, Eijsvogel M, Wymenga M, Bigirwamungu-Bargeman M, van der Palen J, van Det M, van Meeteren N, Klaasse J. Effects of community-based exercise prehabilitation for patients scheduled for colorectal surgery with high risk for postoperative complications. Ann Surg. 2022 Feb 1;275(2):e299-e306.
- Bobbio A, Chetta A, Ampollini L, Primomo GL, Internullo E, Carbognani P, Rusca M, Olivieri D. Preoperative pulmonary rehabilitation in patients undergoing lung resection for non-small cell lung cancer. Eur J Cardiothorac Surg. 2008;33(1):95-8.
- Buffart LM, Kalter J, Sweegers MG, Courneya KS, Newton RU, Aaronson NK, Jacobsen PB, May AM, Galvao DA, Chinapaw MJ, Steindorf K, Irwin ML, Stuiver MM, Hayes S, Griffith KA, Lucia A, Mesters I, van Weert E, Knoop H, Goedendorp MM, Mutrie N, Daley AJ, McConnachie A, Bohus M, Thorsen L, Schulz KH, Short CE, James EL, Plotnikoff RC, Arbane G, Schmidt ME, Potthoff K, van Beurden M, Oldenburg HS, Sonke GS, van Harten WH, Garrod R, Schmitz KH, Winters-Stone KM, Velthuis MJ, Taaffe DR, van Mechelen W, Kersten MJ, Nollet F, Wenzel J, Wiskemann J, Verdonck-de Leeuw IM, Brug J. Effects and moderators of exercise on quality of life and physical function in patients with cancer: An individual patient data meta-analysis of 34 RCTs. Cancer Treat Rev. 2017;52;91-104.
- Campbell KL, Winters-Stone KM, Wiskemann J, May AM, Schwartz AL, Courneya KS, Zucker DS, Matthews CE, Ligibel JA, Gerber LH, Morris GS, Patel AV, Hue TF, Perna FM, Schmitz KH. Exercise guidelines for cancer survivors: consensus statement from international multidisciplinary roundtable. Med Sci Sports Exerc. 2019;51(11):2375-90.
- Courneya KS, Friedenreich CM. Relationship between exercise pattern across the cancer experience and current quality of life in colorectal cancer survivors. J Altern Complement Med. 1997;3(3):215-26.
- Courneya KS, Segal RJ, Mackey JR, Gelmon K, Reid RD, Friedenreich CM, Ladha AB, Proulx C, Vallance JKH, Lane K, Yasui Y, McKenzie DC. Effects of aerobic and resistance exercise in breast cancer patients receiving adjuvant chemotherapy: a multicenter randomized controlled trial. J Clin Oncol. 2007;25(28):4396-404.
- Dittus KL, Gramling RE, Ades PA. Exercise interventions for individuals with advanced cancer: A systematic review. Prev Med. 2017;104:124-32.
- Eng L, Pringle D, Su J, Shen X, Mahler M, Niu C, Charow R, Tiessen K, Lam C, Halytskyy O, Naik H, Hon H, Irwin M, Pat V, Gonos C, Chan C, Villeneuve J, Harland L, Shani RM, Brown MC, Selby P, Howell D, Xu W, Liu G, Alibhai SMH, Jones JM. Patterns, perceptions, and perceived barriers to physical activity in adult cancer survivors. Support Care Cancer. 2018;26(11):3755-63.
- Integraal Kankercentrum Nederland (IKNL). Algemene principes van palliatieve zorg versie 3.0. Utrecht: IKNL; 2017. Geraadpleegd op 11 mei 2021. Beschikbaar via https://www.pallialine.nl/
- Integraal Kankercentrum Nederland (IKNL). Handreiking veilig omgaan met cystostatica. Utrecht: IKNL; 2015. Geraadpleegd op 11 mei 2021. Beschikbaar via https://www.pallialine.nl/
- Kabat GC, Matthews CE, Kamensky V, Hollenbeck AR, Rohan TE. Adherence to cancer prevention guidelines and cancer incidence, cancer mortality, and total mortality: a prospective cohort study. Am J Clin Nutr. 2015;101(3):558-69.
- Kushi LH, Doyle C, McCullough M, Rock CL, Demark-Wahnefried W, Bandera EV, Gapstur S, Patel AV, Andrews K, Gansler T. Nutrition American Cancer Society, and Committee Physical Activity Guidelines Advisory. American Cancer Society Guidelines on nutrition and physical activity for cancer prevention: reducing the risk of cancer with healthy food choices and physical activity. CA Cancer J Clin. 2012;62(1):30-67.
- Lee J, Lee MG. Effects of exercise interventions on breast cancer patients during adjuvant therapy: a systematic review and meta-analysis of randomized controlled trials. Cancer Nurs. 2020;43(2):115-25.
- Lipsett A, Barrett S, Haruna F, Mustian K, O’Donovan A. The impact of exercise during adjuvant radiotherapy for breast cancer on fatigue and quality of life: A systematic review and meta- analysis. Breast. 2017;32:144-55.
- Nederlandse Vereniging voor Heelkunde (NVH). Colorectaal carcinoom (CRC). Module ‘Versneld postoperatief herstel programma (ERAS) bij CRC’. Utrecht: FMS; 2020. Geraadpleegd op 1 februari 2020. Beschikbaar via https://richtlijnendatabase.nl
- Ooijendijk WTM, Hildebrandt VH, Hopman-Rock M. Bewegen Gemeten 2002-2004. Delft: TNO; 2006.
- Patel AV, Friedenreich CM, Moore SC, Hayes SC, Silver JK, Campbell KL, Winters-Stone K, Gerber LH, George SM, Fulton JE, Denlinger C, Morris GS, Hue T, Schmitz KH, Matthews CE. American College of Sports Medicine Roundtable Report on physical activity, sedentary behavior, and cancer prevention and control. Med Sci Sports Exerc. 2020. 51(11):2391-402.
- Schmitz KH, Campbell AM, Stuiver MM, Pinto BM, Schwartz AL, Morris GS, Ligibel JA, Cheville A, Galvão DA, Alfano CM, Patel AV, Hue T, Gerber LH, Sallis R, Gusani NJ, Stout NL, Chan L, Flowers F, Doyle C, Helmrich S, Bain W, Sokolof J, Winters-Stone KM, Campbell KL, Matthews CE. Exercise is medicine in oncology: Engaging clinicians to help patients move through cancer. CA Cancer J Clin. 2019 Nov;69(6):468-84.
- Schwartz AL. Patterns of exercise and fatigue in physically active cancer survivors. Oncol Nurs Forum. 1998;25(3):485-91.
- Sweegers MG, Altenburg TM, Chinapaw MJ, Kalter J, Verdonck-de Leeuw IM, Courneya KS, Newton RU, Aaronson NK, Jacobsen PB, Brug J, Buffart LM. Which exercise prescriptions improve quality of life and physical function in patients with cancer during and following treatment? A systematic review and meta-analysis of randomised controlled trials. Br J Sports Med. 2018;52(8):505-13.
- Sweegers MG, Altenburg TM, Brug J, May AM, van Vulpen JK, Aaronson NK, Arbane G, Bohus M, Courneya KS, Daley AJ, Galvao DA, Garrod R, Griffith KA, van Harten WH, Hayes SC, Herrero- Roman F, Kersten MJ, Lucia A, McConnachie A, van Mechelen W, Mutrie N, Newton RU, Nollet F, Potthoff K, Schmidt ME, Schmitz KH, Schulz KH, Sonke G, Steindorf K, Stuiver MM, Taaffe DR, Thorsen L, Twisk JW, Velthuis MJ, Wenzel J, Winters-Stone KM, Wiskemann J, Chinapaw MJ, Buffart LM. Effects and moderators of exercise on muscle strength, muscle function and aerobic fitness in patients with cancer: a meta-analysis of individual patient data. Br J Sports Med. 2019;53(13):812.
- Thomas G, Tahir MR, Bongers BC, Kallen VL, Slooter GD, van Meeteren NL. Prehabilitation before major intra-abdominal cancer surgery: A systematic review of randomised controlled trials. Eur J Anaesthesiol. 2019;36(12):933-45.
- van Rooijen SJ, Engelen MA, Scheede-Bergdahl C, Carli F, Roumen RMH, Slooter GD, Schep G. Systematic review of exercise training in colorectal cancer patients during treatment. Scand J Med Sci Sports. 2018;28(2):360-70.
- van Rooijen SJ, Molenaar CJL, Schep G, van Lieshout RHMA, Beijer S, Dubbers R, Rademakers N, Papen-Botterhuis NE, van Kempen S, Carli F, Roumen RMH, Slooter GD. Making patients fit for surgery: introducing a four pillar multimodal prehabilitation program in colorectal cancer. Am J Phys Med Rehabil. 2019;98(10):888-96.
- van Vulpen JK, Sweegers MG, Peeters PHM, Courneya KS, Newton RU, Aaronson NK, Jacobsen PB, Galvao DA, Chinapaw MJ, Steindorf K, Irwin ML, Stuiver MM, Hayes S, Griffith KA, Mesters I, Knoop H, Goedendorp MM, Mutrie N, Daley AJ, McConnachie A, Bohus M, Thorsen L, Schulz KH, Short CE, James EL, Plotnikoff RC, Schmidt ME, Ulrich CM, van Beurden M, Oldenburg HS, Sonke GS, van Harten WH, Schmitz KH, Winters-Stone KM, Velthuis MJ, Taaffe DR, van Mechelen W, Kersten MJ, Nollet F, Wenzel J, Wiskemann J, de Leeuw-Verdonck IM, Brug J, May AM, Buffart LM. Moderators of exercise effects on cancer-related fatigue: a meta- analysis of individual patient data. Med Sci Sports Exerc. 2020;52(2):303-14.
A.5 Organisatie van zorg
Fysio- en oefentherapie zijn bij uitstek de beroepsgroepen die zich met beweegzorg bezighouden. De geregistreerd oncologiefysiotherapeuten en in oncologie-revalidatiewetenschappen verbijzonderde algemeen fysiotherapeuten en oefentherapeuten hebben zich bekwaamd in de begeleiding van patiënten die geconfronteerd zijn met de diagnose kanker; een verdieping en specialisatie die in gang werd gezet in de jaren 90 van de vorige eeuw.
Mogelijk is door de complexiteit van een behandeltraject bij een intake of de uitvoering van het behandelplan de inzet van een verbijzonderd oncologiefysiotherapeut of andere gespecialiseerde fysiotherapeut noodzakelijk. Het is daarom van belang dat een therapeut zich bewust is van zijn eigen bekwaamheden en de patiënten tijdig doorverwijst indien nodig. Hierbij geldt de algemene stelregel: onbekwaam is onbevoegd.
Het is belangrijk dat bestaande afwijkingen of contra-indicaties bekend zijn bij de behandelend therapeut alvorens er een fysio- of oefentherapeutische interventie gestart wordt. Dit vraagt om een goede overdracht van de (huis)arts, waarin de relevante informatie over klachten, symptomen en behandeling is opgenomen. Het belang van een goede supervisie tijdens de interventie en de onderlinge communicatie tussen betrokken zorgverleners bij het uitvoeren van een beweeginterventie is groot.
Per individu zal de therapeut daarnaast moeten overwegen of de patiënt aanvullende begeleiding nodig heeft, bijvoorbeeld ergotherapie, diëtetiek, podotherapie of cognitieve gedragstherapie. Vanwege een mogelijke vergoeding vanuit de basisverzekering is in sommige gevallen voor disciplines buiten de fysio- of oefentherapie een verwijzing van de (huis)arts nodig.
Het is van belang om bij het aanbieden van een beweeginterventie voor mensen die leven met of na kanker, afstemming te zoeken binnen het netwerk van professionals, maar ook met de behandelend medisch specialist en, indien aan de orde, Bedrijfsarts Consulent Oncologie (BACO).
Onderbouwing
Bij het aanbieden van een beweeginterventie is het van belang dat de therapeut zich verdiept in kankerspecifieke richtlijnen. De therapeut oriënteert zich op bijwerkingen en de mogelijke effecten van de medische behandeling van kanker op het (bewegend) functioneren, en op het veilig omgaan met deze effecten tijdens het uitvoeren van de beweeginterventie.
Door het levensbedreigende karakter van kanker is er vaak sprake van ziektegerelateerde (al dan niet reële) angst of stress; voor zover deze angst en stress interfereren met de behandeling zal de therapeut ook hiermee adequaat om moeten gaan. Dat het bij patiënten vaak gaat om complexe ziekteprocessen, die grote gevolgen hebben voor het functioneren van de patiënt, moge duidelijk zijn. We spreken in dit kader dan ook over biopsychosociale en spirituele problematiek; de hele mens wordt geraakt door de ziekte en de gevolgen ervan. In die complexiteit speelt de therapeut een belangrijke rol. De rollen van de therapeut en de daarbij horende uitdagingen kunnen als volgt worden ingedeeld.
De therapeut als professional
Als professional voldoet de therapeut aan de door de beroepsgroepen omschreven minimale eisen om bevoegd en bekwaam te zijn en van daaruit een beoordeling te doen over de aan hem gestelde zorgvraag. De fysio- en oefentherapeut zijn actief in een zich sterk ontwikkelend medisch veld van steeds verbeterende diagnostiek, gepersonaliseerde behandelvormen, wetenschappelijke onderbouwing en verdieping van kennis over de (late) gevolgen van de ziekte en haar behandeling. Dit alles doet een groot appel op therapeuten om behalve uitvoerend ook lerend professional te zijn. (Zelf)scholing en differentiatie maken een sterke groei door.
Daarnaast plaatst de toenemende tumorspecifieke verdieping de beroepsgroepen voor nieuwe uitdagingen, zoals de vraag of men nog als gespecialiseerd generalist in de oncologie kan werken of dat er een noodzaak is om (sub)specialisaties te ontwikkelen.
In de laatste jaren zijn er veel en grote stappen gezet als het gaat om wetenschappelijke onderbouwing van het bewegend functioneren in samenhang tot de oncologie. Helaas is nog niet voor alle problemen een evidence-based oplossing. Het is aan de professional om de kennis goed te vertalen, zodat de positie van een beweeginterventie een erkende, maar vooral ook door anderen begrepen plaats krijgt in het continuüm van de oncologische zorg.
De relatie tot de patiënt
Als professional wordt men geconfronteerd met een patiënt die de diagnose kanker heeft gekregen en die een zorgvraag heeft over het bewegend functioneren. In het continuüm van oncologische zorg spelen vele aspecten een rol. Voorop staat de diagnose, waarbij de fase van de ziekte en de uitgebreidheid en prognose ervan, tot een grote mate van onzekerheid, twijfels, emoties en zorgen kunnen leiden. Gaande het proces van begeleiding en advies kan het bijna niet anders dat contacten zich verdiepen. Vindt de begeleiding plaats tijdens een periode van medisch-therapeutische behandelingen, dan zullen chemotherapie, bestraling en immunotherapie steeds weer, mogelijk kortdurend, invloed hebben op de fysieke capaciteiten van de patiënt. Deze reacties kunnen worden versterkt door de geschiedenis van de individuele patiënt. Zo zal iedere fase haar bijzonderheden hebben met grote individuele variatie.
Vaak start de fysio- of oefentherapeutische behandeling pas na afloop van de medische behandeling en de patiënt tegen de gevolgen van het medisch-therapeutisch handelen aanloopt. Binnen de prehabilitatie vindt kennismaking plaats als het nog relatief goed gaat, waarmee een ander gesprek ontstaat en beter inzicht kan worden verkregen in wie de ander is. Dat een op de drie mensen in zijn leven geconfronteerd wordt met kanker als directe of indirecte realiteit geldt ook voor de professional. De menselijke ervaringen met het lijden aan kanker maken een diepe persoonlijke indruk. Het is aan de professional zich bewust te zijn van de eigen levenservaringen en ten aanzien van de patiënt zicht te houden op de professionele betrokkenheid, echter, met behoud van de juiste afstand.
Samenwerking met collega’s
Door de complexiteit van de ziekte is het om meerdere redenen wenselijk dat de professional samenwerkt met collega-therapeuten; voor de continuïteit van beweegzorg in de eigen werkomgeving en praktijk- en lijnoverstijgend. Dit krijgt gestalte in het delen van ervaring en deskundigheid, het optimaliseren van de kwaliteit van de behandeling en het bevorderen van de deskundigheid van andere zorgverleners die bij de oncologische zorg betrokken zijn. Samenwerking is ook nodig om patiënttransities soepel te laten verlopen en daarmee de patiënt te ontlasten, maar ook om zicht te houden op de eigen competenties en op wat het werken in de oncologische zorg betekent voor de professional als mens.
De therapeut zal in zijn analyse bij elke individuele patiënt op zoek gaan naar het meest adequate antwoord op de zorgvraag van de patiënt. Dat er aspecten aan het licht komen die direct of indirect invloed hebben op dat bewegend functioneren die niet binnen die hulpvraag vallen, is onvermijdelijk. De therapeut bepaalt binnen de beroepscompetenties de grenzen van de (beroepsspecifieke en eigen) therapeutische mogelijkheden en gaat in samenspraak met de patiënt na of er vragen liggen die niet tot het domein van de fysio- of oefentherapie behoren en die, dientengevolge, beter elders gesteld (en beantwoord) kunnen worden.
Op basis van scholing en ervaring, maar ook op basis van kennis van het grotere geheel van de oncologische zorg, zal iedere individuele zorgprofessional een weloverwogen keuze maken. Kennis hebben van en toegang hebben tot een netwerk kunnen helpen bij het bieden van de meest optimale zorg. Dit zal extra inspanningen van de professional vragen, ook inspanningen die beroepsgroepoverstijgend zijn. Deze inspanningen dragen inhoudelijk bij aan de kwaliteit van handelen.
Ondersteunen van zorgprocessen op het beweegvlak
Fysio- en oefentherapie binnen de oncologische zorg hebben als kenmerk dat ze de zorgprocessen op het beweegvlak ondersteunen. De therapie is erop gericht de patiënt te begeleiden naar een actievere leefstijl. Om ervoor te zorgen dat er op een goede en verantwoorde manier wordt bewogen, is het belangrijk dat de therapeut de (on)mogelijkheden van de oncologische patiënt individueel in kaart brengt op het gebied van beweeglijkheid, spierkracht, houding en conditie, kwaliteit van leven, zingeving en participatie in de maatschappij. Hierbij houdt de therapeut rekening met de door de individuele patiënt gestelde doelen.
Het doel van de fysio- en oefentherapie is dat de patiënt na afloop van de therapeutische interventie zelf met deze verbeterde leefstijl verder kan gaan. De therapeut houdt zich bezig met het bewegend functioneren in de zin van preventie, begeleiding, behandeling en training. De rol van de therapeut is de patiënt te coachen bij het ontdekken van de veelheid van manieren om te bewegen en bij het vergroten van het repertoire van houdingen en bewegingsstrategieën.
Complexiteit van zorg
In de ‘Domeinbeschrijving fysiotherapie binnen de oncologie’ (NVFL 2017) is een overzicht opgenomen dat helpt inschatten wat de zorgbehoefte van de patiënt is op basis van de complexiteit van de problemen. Het is van belang dat een therapeut zich bewust is van zijn eigen bekwaamheden en tijdig doorverwijst indien nodig. Dit geldt ook voor doorverwijzing naar andere mogelijk relevante verbijzonderingen binnen de fysiotherapie, zoals geriatrie, psychosomatische of bekkenbodemfysiotherapie. Hierbij geldt de algemene stelregel: onbekwaam is onbevoegd.
De informatie die nodig was voor het beantwoorden van de uitgangsvraag betreft tekstboekkennis en is daarom, in overleg met de werkgroep, op niet-systematische wijze vergaard uit de hier genoemde bronnen, waaronder recentelijk ontwikkelde internationale richtlijnen, en overwegingen van de werkgroep.
- Nederlandse Vereniging voor Fysiotherapie binnen de Lymfologie en Oncologie (NVFL). Domeinbeschrijving fysiotherapie binnen de oncologie. Amersfoort: NVFL; 2017.

