Beweeginterventies bij kanker
B.1 Keuze van de beweeginterventie
De invulling van een beweeginterventie wordt bepaald door de fase van behandeling, de individuele doelen en wensen van de patiënt, het belastbaarheidsniveau (zowel fysiek als mentaal/emotioneel), de mate van trainbaarheid, het gedrag en de voorkeuren voor trainingsmiddelen van de patiënt.
Zelfstandig continueren van het bewegen na afloop van de begeleiding door de therapeut moet al vanaf het begin van het begeleidingstraject een punt van aandacht zijn en vraagt om een advies op maat. Bewegen kan in deze context zowel intentioneel bewegen (bewegen als doel) als functioneel bewegen (bewegen als middel om andere levensdoelen te bereiken) betreffen.
Ongeacht de fase waarin een patiënt zich bevindt, kan begeleiding bestaan uit de volgende componenten:
- het stimuleren van bewegen en het adviseren daaromtrent;
- het optimaliseren van activiteiten die voor de patiënt relevant zijn, en het optimaliseren van de functies en anatomische eigenschappen die een voorwaarde vormen voor bewegen, en aan de patiënt leren om deze te onderhouden;
- het bestrijden van klachten en barrières die de patiënt bij het bewegen ervaart;
- het bevorderen van gedragsverandering in de richting van een actieve levensstijl.
Onderbouwing
Om te bepalen of een beweeginterventie geïndiceerd is en wat in dat geval de meest geschikte beweeginterventie is voor de individuele patiënt, heeft de werkgroep ervoor gekozen het stappenplan zoals beschreven in Stuiver (2020) te volgen.
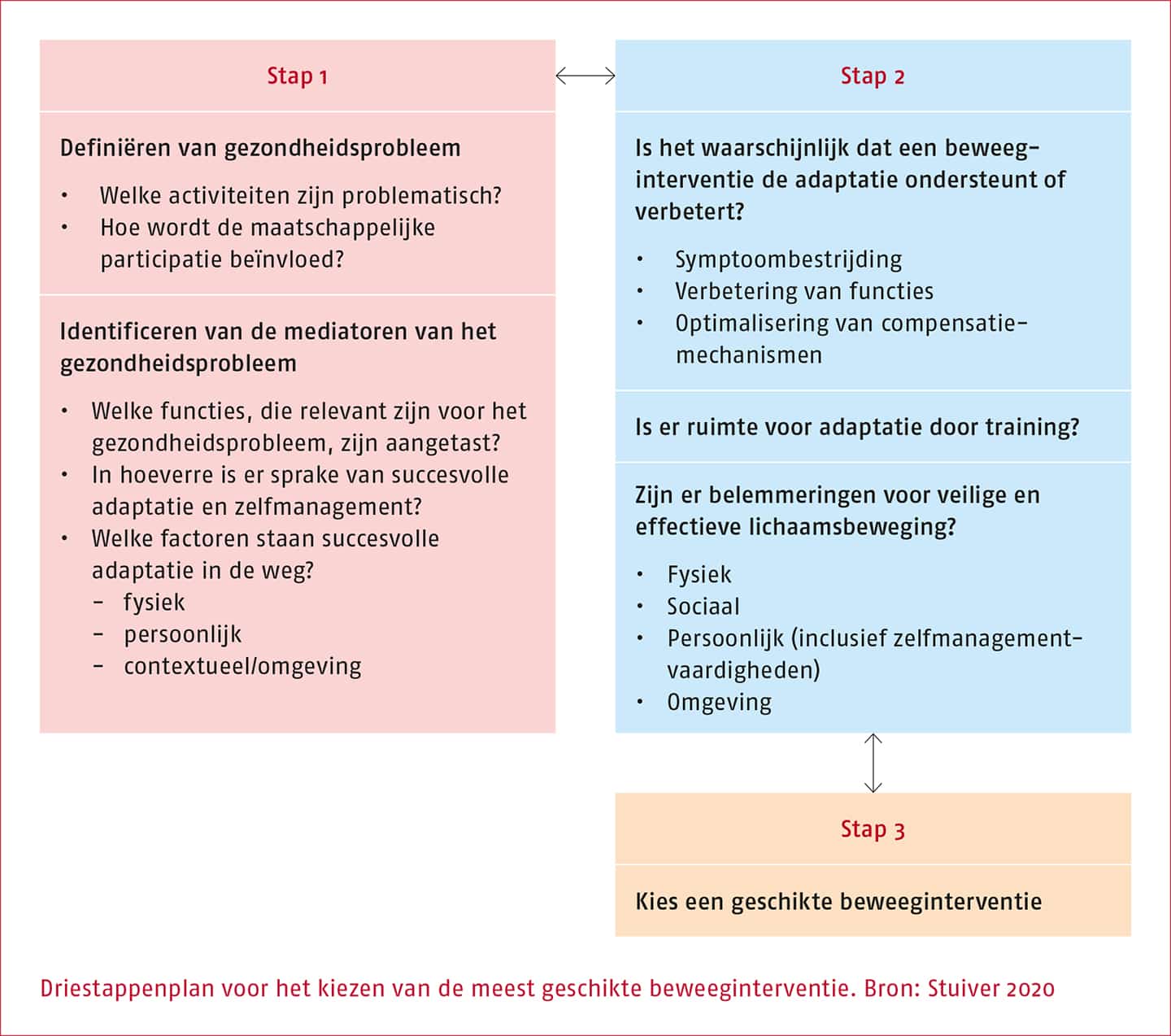
Stap 1 bestaat uit het vaststellen van de hulpvraag en de factoren die met de hulpvraag samenhangen. In stap 2 wordt bepaald of deze factoren met een beweeginterventie positief beïnvloed kunnen worden en in welke mate er ruimte is voor verandering (adaptatie). Daartoe worden de capaciteit en de barrières van de individuele patiënt ten aanzien van (al dan niet zelfstandig) bewegen in kaart gebracht. Op grond van deze afwegingen wordt in stap 3 de meest geschikte aanpak gekozen. Periodiek wordt opnieuw afgewogen of ondersteuning met de gekozen beweeginterventie nog past bij de situatie van de patiënt en of er nog een indicatie is voor begeleiding binnen de gezondheidszorg. De verschillende stappen worden uiteraard in gedeelde besluitvorming met de patiënt doorlopen.
Stap 1: Identificeren van hulpvraag
Het doel van de intake (anamnese en lichamelijk onderzoek) is te onderzoeken welke factoren gerelateerd zijn aan de hulpvraag. Deze factoren worden mediatoren genoemd.
Een bruikbaar concept bij het identificeren van mediatoren van een gezondheidsprobleem en de daaruit voortvloeiende hulpvraag is het model van de ‘International Classification of Functioning, Disability and Health’ (ICF) (WHO 2001). Zie de volgende figuur.
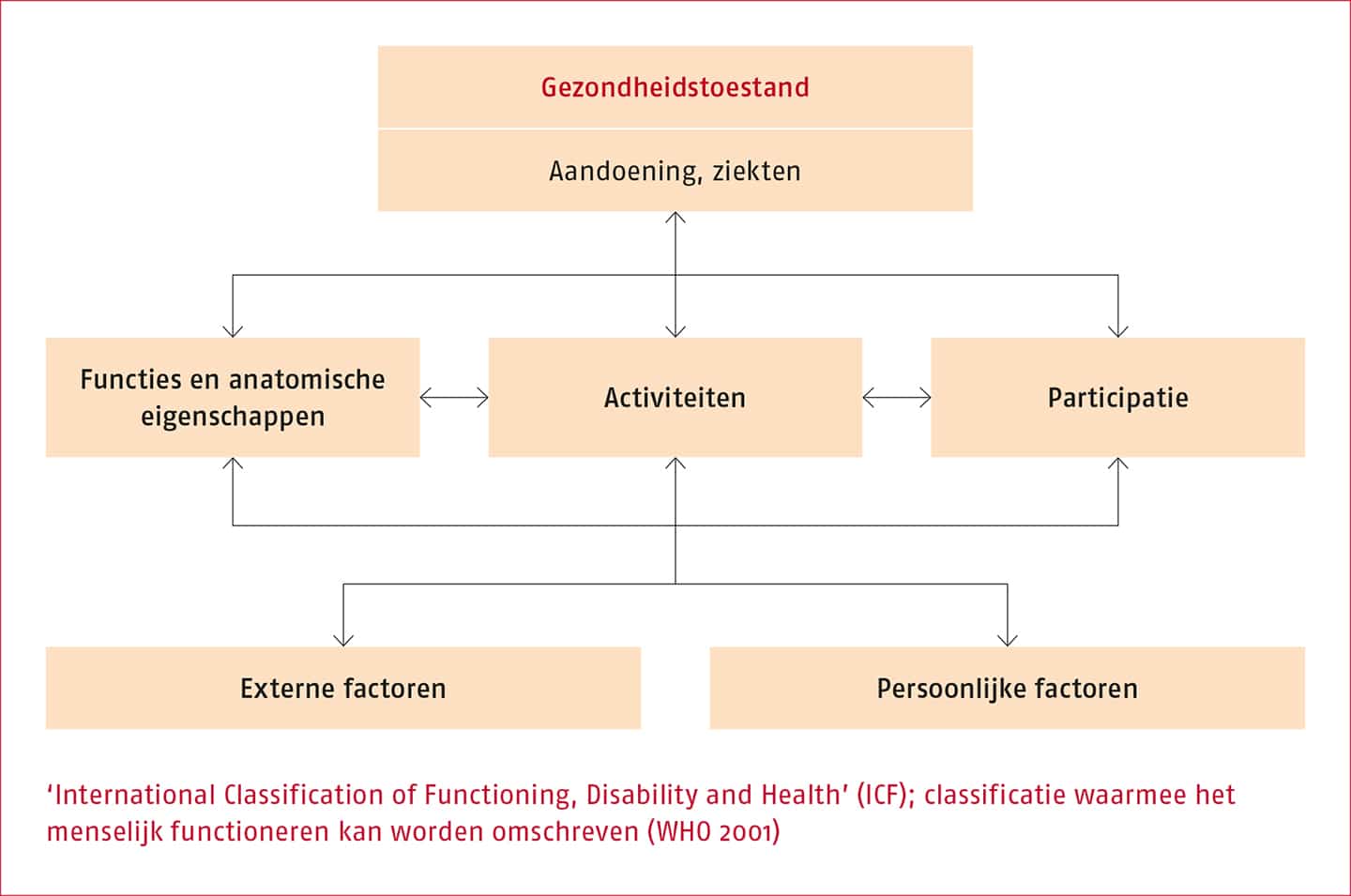
Het ICF-model beschrijft het functioneren van mensen, inclusief de factoren die mogelijk invloed hebben op dat functioneren. Zo kan iemands gezondheid gekarakteriseerd worden op het niveau van lichaamsfuncties en anatomische eigenschappen, op het niveau van activiteiten en op het niveau van participatie. In het model zijn ook factoren opgenomen op het niveau van de omgeving, in het model externe factoren genoemd, en op het persoonlijke niveau; de zogeheten persoonlijke factoren die iemands functioneren kunnen beïnvloeden.
Op het niveau van activiteiten en participatie kan onderscheid worden gemaakt tussen de capaciteit (dat wat een individu kan, onder gestandaardiseerde omstandigheden) en de prestaties (dat wat een individu doet in het dagelijks functioneren).
Mediatoren kunnen zich voordoen op alle ICF-niveaus, inclusief omgevingsfactoren en persoonlijke factoren. Wanneer bij het identificeren van de hulpvraag mediatoren aan het licht komen die mogelijk beïnvloedbaar zijn door middel van bewegen, kan een beweeginterventie overwogen worden.
Stap 2: Vermogen tot adaptatie
Bij deze stap wordt bepaald of een beweeginterventie een geschikte interventie is om de mediatoren van het gezondheidsprobleem te beïnvloeden. Hierbij kan een beweeginterventie worden beschouwd als het geheel van interventies dat is gericht op het verbeteren van de uitvoering van fysieke activiteiten. Deze interventies omvatten dus informatievoorziening en training, maar ook interventies die zijn gericht op gedragsverandering.
Wat de meest geschikte interventie is, wordt bepaald door de huidige capaciteit en prestaties van de individu te beoordelen, door na te gaan hoe de capaciteit of prestaties verbeterd kunnen worden, en door te identificeren welke factoren deze verbetering belemmeren of juist bevorderen. Wanneer wordt besloten dat een beweeginterventie een geschikte interventie is, is het belangrijk te bepalen of de patiënt veilig en effectief zelfstandig kan bewegen. Dit houdt in dat enerzijds de voorwaarden voor effectieve trainingsprikkels (klinische staat) geëvalueerd worden, maar anderzijds ook de zelfmanagementvaardigheden.
Barrières kunnen betrekking hebben op mentale, emotionele, sociale, persoonlijke of omgevingsfactoren. De sociale omgeving kan een belangrijke rol spelen in het ontstaan van de intentie tot (nieuw) gedrag. Naasten van mensen die leven met of na kanker kunnen een belangrijke rol spelen in de mate waarin een individu wordt uitgedaagd of juist wordt geremd om te bewegen.
Stap 3: Kiezen van een geschikte beweeginterventie
De aanwezigheid van barrières voor veilig en/of effectief zelfstandig bewegen is een indicatie voor het starten van een beweegprogramma begeleid door een fysio- of oefentherapeut.
Als een fysio- of oefentherapeutische beweeginterventie is geïndiceerd wordt een specifieke intake verricht. Het eerste onderdeel daarvan is een gesprek waarbij de wensen en doelen van de patiënt in kaart worden gebracht. Aan de hand van exclusiecriteria stelt de therapeut vast of de patiënt veilig kan bewegen. Exclusiecriteria kunnen bestaan uit klachten en symptomen die effectief en veilig bewegen in de weg staan of ernstige fysieke risico’s inhouden naar aanleiding van de behandeling of aanwezige comorbiditeit.
(Voorlopige) exclusie kan aanleiding zijn voor overleg met de medisch specialist, het verrichten van inspanningsdiagnostiek of verwijzing naar een gespecialiseerd fysiotherapeut, huisarts, revalidatiearts of psychosociaal hulpverlener.
Ongeacht de fase van de ziekte/behandeling waarin een patiënt zich bevindt, kan begeleiding bestaan uit de volgende componenten:
- beweegstimulering en advies;
- optimalisatie van voor de patiënt relevante activiteiten en optimalisatie en onderhouden van de voor het bewegen voorwaardelijke functies en anatomische eigenschappen;
- bestrijden van klachten bij het bewegen en bestrijden van barrières voor het bewegen en 4) bevorderen van gedragsverandering ten aanzien van een actieve levensstijl.
De concrete invulling van een beweeginterventie wordt bepaald door de fase van behandeling, de individuele doelen en wensen van de patiënt, het belastbaarheidsniveau (zowel fysiek als mentaal-emotioneel), de mate van trainbaarheid en het gedrag en de voorkeuren voor trainingsmiddelen van de patiënt. Bij de invulling van de beweeginterventie kan het van toegevoegde waarde zijn om een onderscheid te maken tussen behandelbare grootheden en behandeldoelen. Een behandeldoel is waar je naar toewerkt, bijvoorbeeld werkhervatting, ontwikkelen of onderhouden van een actieve leefstijl of het zelfstandig uitvoeren van algemene dagelijkse levensverrichtingen (ADL). Vanuit het behandeldoel kan de therapeut onderzoeken waar iemand vastloopt of wat lastig is.
De activiteiten, functies of factoren die invloed hebben op het functioneren zijn behandelbare grootheden. Het behandeldoel kan een functie of klacht zijn die geëvalueerd kan worden met bijvoorbeeld de PSK; een behandelbare grootheid kan in de meeste gevallen worden geëvalueerd met een meetinstrument.
Mogelijke behandelbare grootheden zijn:
- vergroten van het maximale aerobe uithoudingsvermogen (belastbaarheid);
- vergroten van de kracht van lokale spiergroepen en het spieruithoudingsvermogen;
- vergroten van de flexibiliteit (in het kader van littekenweefsel en spier- en/of gewrichtsstijfheid);
- verbeteren van de lichaamssamenstelling, de houding en de manier van bewegen en het verbeteren van de coördinatie en de balans;
- vergroten van het inzicht in belasting en belastbaarheid;
- verminderen van bewegingsangst;
- verkrijgen van een positieve (affectieve en instrumentele) attitude en de intentie om een actieve leefstijl te hebben.
De beweeginterventie wordt zo ingericht dat verbeteringen van motorische grondeigenschappen zo goed mogelijk aansluiten bij de activiteiten waarvoor ze als voorwaardelijk worden beschouwd. Naast training op functieniveau (motorische grondeigenschappen) wordt ook aandacht besteed aan het activiteitenniveau (vaardigheid, handelings- en bewegingsstrategie en variatie in die strategieën). Met functionele training kunnen de (deel)vaardigheden die vereist zijn voor het uitvoeren van activiteiten worden verbeterd. Functioneel trainen is bij uitstek geschikt om trainingseffecten te integreren in het dagelijks leven.
In overleg met de werkgroep en de klankbordgroep is besloten deze richtlijn te voorzien van een actuele beschrijving van beweeginterventies ter bevordering van een actieve leefstijl en verbetering van de kwaliteit van leven van patiënten die leven met en na kanker, en nieuwe inzichten voor het opstellen van een behandelplan voor deze patiëntengroep. Deze beschrijving berust op de hier genoemde bronnen.
- American College of Sports Medicine. ACSM’s Guidelines for exercise testing and prescription. 10e druk. Philadelphia, PA: Wolters Kluwer; 2018.
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF). KNGF-standaard Beweeginterventie oncologie. Amersfoort: KNGF; 2011.
- Nederlandse Vereniging voor Revalidatieartsen (VRA). Richtlijn medisch specialistische revalidatie bij oncologie (2.0). Utrecht: VRA; 2018. Geraadpleegd op 11 mei 2021. Beschikbaar via https://richtlijnendatabase.nl/
- Stuiver MM. Viewing exercise oncology through the lens of multidisciplinarity. In: Schmitz KH, editor. Exercise oncology: prescribing physical activity before and after a cancer diagnosis. Springer Nature; Hershey, PA, Verenigde Staten; 2020.
- World Health Organization (WHO). International classification of functioning, disability and health (ICF). Genève, Zwitserland; WHO; 2001.
B.2 Trainingsvoorschriften
De algemene aanbevelingen voor fysieke activiteit ter bevordering van de algehele gezondheid bij mensen die leven met en na kanker, volgen grotendeels de aanbevelingen voor fysieke activiteit bij volwassenen met een chronische aandoening.
Hierbij wordt gestreefd naar drie keer per week aerobe activiteit gedurende ten minste 30 minuten per keer en krachttraining op twee of meer dagen per week gedurende 20 minuten.
Aan deze activiteit worden bij voorkeur dagelijkse rekoefeningen toegevoegd en eventueel specifieke oefeningen op basis van de gezondheidstoestand en de aan behandeling gerelateerde bijwerkingen van de ziekte (bijvoorbeeld coördinatie en balansoefeningen). Het minimale bewegingsadvies aan mensen die leven met en na kanker is om inactiviteit te vermijden en zo actief mogelijk te zijn. Trainingsvoorschriften voor een aantal specifieke uitkomsten zijn opgenomen in de toelichting bij deze module.
Het beweegprogramma dient te worden geoptimaliseerd zodat het aansluit bij de hulpvraag. Dit kan betekenen dat wordt afgeweken van de algemene aanbevelingen.
Sommige patiënten zijn mogelijk initieel niet in staat om de aanbevolen beweegvoorschriften vol te houden, waardoor een belangrijke rol voor de therapeut is weggelegd om te patiënt te adviseren, ondersteunen en motiveren om zoveel mogelijk toe te werken naar de beoogde trainingsparameters en het beoogde belastingniveau.
Het verdient aanbeveling om de trainingsintensiteit te baseren op fysiologische parameters (hartslag, klinische verschijnselen van inspanning) en ervaren inspanningsniveau.
Onderbouwing
Fysieke activiteit voor mensen die leven met of na kanker is over het algemeen veilig. Er is voldoende bewijs om te kunnen concluderen dat duur- en/of krachttraining bij mensen die leven met of na kanker de algemene gezondheid, het lichamelijk functioneren en de kwaliteit van leven kan verbeteren, alsmede angst, depressieve symptomen en vermoeidheid kan verminderen (Buffart 2017; Campbell 2019; Van Vulpen 2020).
In de volgende tabel zijn de FITT-factoren gespecificeerd per gezondheidsuitkomst (Campbell 2019). Deze FITT-factoren zijn effectief gebleken voor patiënten die dit niveau aankunnen.
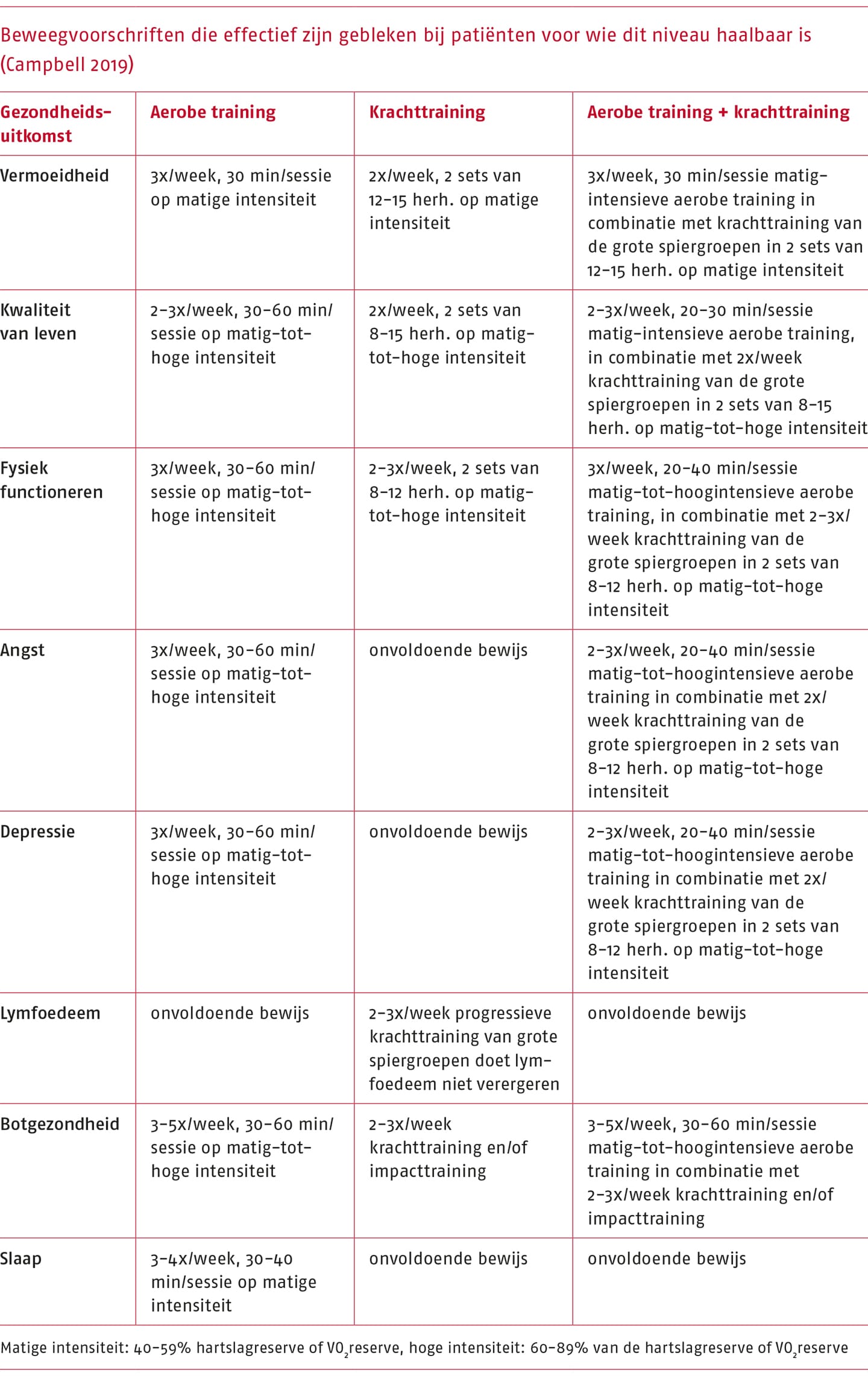
Op basis van aanbevelingen over bewegen bij kanker, persoonlijke doelen, klinische staat en omstandigheden van de patiënt (waartoe ook het vermogen van de patiënt behoort om zich aan veranderende omstandigheden aan te passen), kan de therapeut trainingsparameters opstellen. Het is echter belangrijk om bij het interpreteren en toepassen van de aanbevelingen rekening te houden met het feit dat bewijs vaak is gebaseerd op onderzoek bij een beperkt aantal vormen van kanker (bijvoorbeeld borstkanker). Daarnaast is onderzoek vaak niet gericht op patiënten met een zeer slecht initieel uithoudingsvermogen of lage spierkracht.
Er zijn aanwijzingen vanuit de wetenschappelijke literatuur dat de effecten van bepaalde interventies groter zijn bij patiënten met de grootste behoefte aan verbetering van de fysieke fitheid of vermindering van vermoeidheidsklachten (Buffart 2018). Deze patiënten zijn mogelijk initieel niet in staat om de aanbevolen FITT-factoren vol te houden, waardoor een belangrijke rol voor de therapeut is weggelegd bij het adviseren, ondersteunen en motiveren van de patiënt en het toewerken naar de trainingsparameters en het belastingsniveau dat wordt beoogd.
Voor het bereiken van centrale trainingseffecten is een trainingsintensiteit nodig waarbij hart en circulatie ten minste worden belast op een niveau van 50 tot 60% van de VO2max of 70 tot 75% van de maximale hartslag. Aerobe training wordt daarom bij voorkeur gedoseerd aan de hand van de VO2max of de maximale hartslag en de hartslagreserve. De hartslagreserve wordt bepaald door de rusthartslag af te trekken van de maximale hartslag. De optimale trainingsintensiteit kan worden berekend met de formule van Karvonen.
Formule van Karvonen
Trainingshartfrequentie = rusthartfrequentie + (gewenste % belasting x hartslagreserve)
Bij het bepalen van de trainingsintensiteit houdt de therapeut rekening met bijwerkingen of symptomen van de ziekte of behandeling die invloed hebben op de belastbaarheid van de patiënt. Het verdient aanbeveling om, naast valide en betrouwbare inspanningstests, de trainingsintensiteit mede te baseren op fysiologische parameters (hartslag, klinische verschijnselen van inspanning) en ervaren inspanningsniveau tijdens de training. Voor dit laatste is afname van de ‘Borg Rating of Perceived Exhaustion’ (RPE) schaal (6-20) een geschikt hulpmiddel. Op deze meetschaal geeft de patiënt aan in welke mate een activiteit of test als inspannend wordt ervaren.
Krachttraining bij mensen die leven met of na kanker wordt in de literatuur voornamelijk beschreven in combinatie met aerobe training. Vanuit fysiologisch oogpunt lijkt het aannemelijk dat het toevoegen van kracht- aan duurtraining bijdraagt aan een toename van de aerobe capaciteit. Omdat krachttraining deel uitmaakt van de algemene beweegrichtlijnen voor mensen die leven met en na kanker, zal het vaak wenselijk zijn om krachttraining ook onderdeel te laten zijn van een beweeginterventie.
Klassiek omvat krachttraining een circuittraining voor 8 tot 10 grote spiergroepen van de onderste en bovenste extremiteiten en de romp. In de opbouw van krachttraining kan onderscheid gemaakt worden tussen de volgende fasen:
- de gewenningsfase, waarin de coördinatie van de beweging wordt aangeleerd en de patiënt vertrouwd raakt met de beweging en de belasting;
- de uithoudingsfase, waarin het aantal herhalingen en het gebruikte gewicht geleidelijk worden opgevoerd;
- de hypertrofie-krachtfase, waarin de diameter van de individuele spiervezels toeneemt en er een toename van de hoeveelheid en sterkte van het bindweefsel optreedt.
In de gewenningsfase wordt getraind met een lage belasting (< 50% 1RM) met 5 tot 10 herhalingen. Hierbij ligt het accent op het correct leren uitvoeren van de beweging. In de uithoudingsfase wordt de belasting opgebouwd naar 50 tot 60% van het 1RM met 10 tot 15 herhalingen, of meer als dit wenselijk is. In de hypertrofie-krachtfase kan gebruik worden gemaakt van 6 herhalingen (85% 1RM) tot 12 herhalingen (65% 1RM). Voor een toename van kracht is training met een hoger percentage van het 1RM (en dus minder herhalingen per set) effectiever dan training met lagere weerstand. Voor het bereiken van hypertrofie is de weerstand minder van belang, zolang maar tot lokale uitputting wordt getraind (Lopez 2020).
In overleg met de werkgroep en de klankbordgroep is besloten deze richtlijn te voorzien van een actuele beschrijving van trainingsvoorschriften bij beweeginterventies ter bevordering van een actieve leefstijl en verbetering van de kwaliteit van leven van patiënten die leven met en na kanker, en de hieraan gerelateerde nieuwe inzichten voor het opstellen van een behandelplan voor deze patiëntengroep. Deze beschrijving berust op de hier genoemde bronnen.
- American College of Sports Medicine. ACSM’s Guidelines for exercise testing and prescription. 10e druk. Philadelphia, PA: Wolters Kluwer; 2018.
- Buffart LM, Kalter J, Sweegers MG, Courneya KS, Newton RU, Aaronson NK, Jacobsen PB, May AM, Galvao DA, Chinapaw MJ, Steindorf K, Irwin ML, Stuiver MM, Hayes S, Griffith KA, Lucia A, Mesters I, van Weert E, Knoop H, Goedendorp MM, Mutrie N, Daley AJ, McConnachie A, Bohus M, Thorsen L, Schulz KH, Short CE, James EL, Plotnikoff RC, Arbane G, Schmidt ME, Potthoff K, van Beurden M, Oldenburg HS, Sonke GS, van Harten WH, Garrod R, Schmitz KH, Winters-Stone KM, Velthuis MJ, Taaffe DR, van Mechelen W, Kersten MJ, Nollet F, Wenzel J, Wiskemann J, Verdonck-de Leeuw IM, Brug J. Effects and moderators of exercise on quality of life and physical function in patients with cancer: An individual patient data meta-analysis of 34 RCTs. Cancer Treat Rev. 2017;52;91-104.
- Buffart LM, Sweegers MG, May AM, Chinapaw MJ, van Vulpen JK, Newton RU, Galvao DA, Aaronson NK, Stuiver MM, Jacobsen PB, Verdonck-de Leeuw IM, Steindorf K, Irwin ML, Hayes S, Griffith KA, Lucia A, Herrero-Roman F, Mesters I, van Weert E, Knoop H, Goedendorp MM, Mutrie N, Daley AJ, McConnachie A, Bohus M, Thorsen L, Schulz KH, Short CE, James EL, Plotnikoff RC, Arbane G, Schmidt ME, Potthoff K, van Beurden M, Oldenburg HS, Sonke GS, van Harten WH, Garrod R, Schmitz KH, Winters-Stone KM, Velthuis MJ, Taaffe DR, van Mechelen W, Jose Kersten M, Nollet F, Wenzel J, Wiskemann J, Brug J, Courneya KS. Targeting exercise interventions to patients with cancer in need: an individual patient data meta-analysis. J Natl Cancer Inst. 2018;110(11):1190-200.
- Campbell KL, Winters-Stone KM, Wiskemann J, May AM, Schwartz AL, Courneya KS, Zucker DS, Matthews CE, Ligibel JA, Gerber LH, Morris GS, Patel AV, Hue TF, Perna FM, Schmitz KH. Exercise guidelines for cancer survivors: consensus statement from international multidisciplinary roundtable. Med Sci Sports Exerc. 2019;51(11):2375-90.
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF). KNGF-standaard Beweeginterventie oncologie. Amersfoort: KNGF; 2011.
- Lopez P, Radaelli R, Taaffe DR, Newton RU, Galvao DA, Trajano GS, Teodoro J, Kraemer WJ, Hakkinen K, Pinto RS. Resistance training load effects on muscle hypertrophy and strength gain: systematic review and network meta-analysis. Med Sci Sports Exerc. 2020;53(6):1206-16.
- Nederlandse Vereniging voor Revalidatieartsen (VRA). Richtlijn medisch specialistische revalidatie bij oncologie (2.0). Utrecht: VRA; 2018. Geraadpleegd op 11 mei 2021. Beschikbaar via https://richtlijnendatabase.nl/
- van Vulpen JK, Sweegers MG, Peeters PHM, Courneya KS, Newton RU, Aaronson NK, Jacobsen PB, Galvao DA, Chinapaw MJ, Steindorf K, Irwin ML, Stuiver MM, Hayes S, Griffith KA, Mesters I, Knoop H, Goedendorp MM, Mutrie N, Daley AJ, McConnachie A, Bohus M, Thorsen L, Schulz KH, Short CE, James EL, Plotnikoff RC, Schmidt ME, Ulrich CM, van Beurden M, Oldenburg HS, Sonke GS, van Harten WH, Schmitz KH, Winters-Stone KM, Velthuis MJ, Taaffe DR, van Mechelen W, Kersten MJ, Nollet F, Wenzel J, Wiskemann J, de Leeuw-Verdonck IM, Brug J, May AM, Buffart LM. Moderators of exercise effects on cancer-related fatigue: a meta- analysis of individual patient data. Med Sci Sports Exerc. 2020;52(2):303-14.
B.3 Meetinstrumenten
Om een keuze te maken uit de grote hoeveelheid beschikbare tests moet het relatieve belang van de test worden afgewogen tegen de klinimetrische eigenschappen, veiligheid en uitvoerbaarheid (waaronder de belasting van de patiënt) van de test. In de toelichting zijn meetinstrumenten opgenomen die veel worden gebruikt bij oncologische problematiek.
Onderbouwing
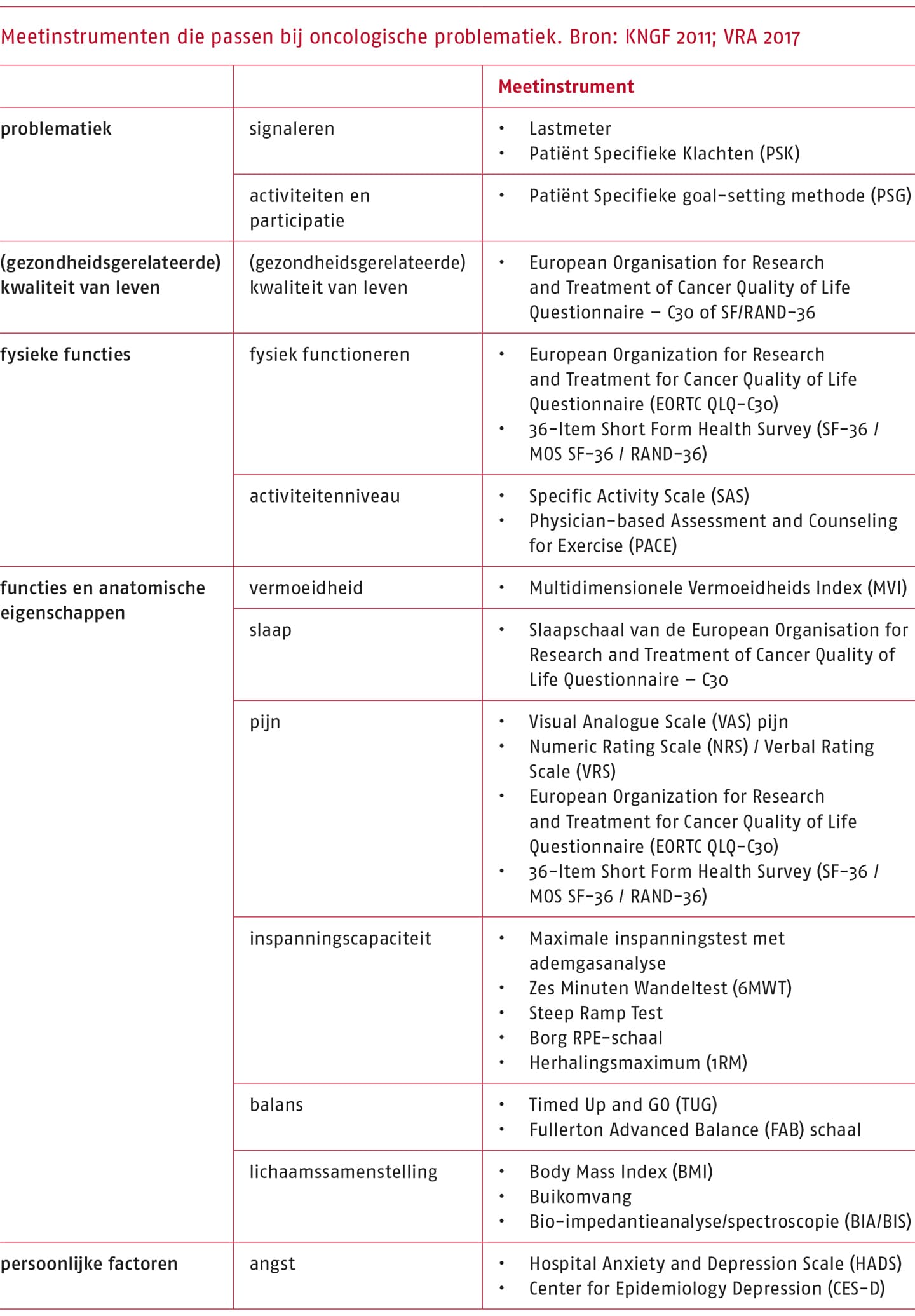
De volgende meetinstrumenten zijn beschikbaar via https://meetinstrumentenzorg.nl/
| 1RM | NRS |
| 6MWT | PACE |
| BMI | PSG |
| Borg RPE-schaal | PSK |
| Buikomvang | SAS |
| CES-D | SF/RAND-36 |
| EORTC QLQ-C30 | Slaapschaal |
| HADS | SRT |
| Lastmeter | TUG |
| MVI | VAS-pijn |
In overleg met de werkgroep en de klankbordgroep is besloten deze richtlijn te voorzien van een actuele beschrijving van de meetinstrumenten ten behoeve van beweeginterventies ter bevordering van een actieve leefstijl en verbetering van de kwaliteit van leven van patiënten die leven met en na kanker, en de hieraan gerelateerde nieuwe inzichten voor het opstellen van een behandelplan voor deze patiëntengroep. Deze beschrijving berust op de hier genoemde bronnen.
- American College of Sports Medicine (ACSM). ACSM’s Guidelines for exercise testing and prescription. 10e druk. Philadelphia, PA: Wolters Kluwer; 2018.
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF). KNGF-standaard Beweeginterventie oncologie. Amersfoort: KNGF; 2011. Geraadpleegd op 11 mei 2021. Beschikbaar via https://www.kngf.nl/kennisplatform/beweeginterventies/oncologie
- Nederlandse Vereniging voor Revalidatieartsen (VRA). Richtlijn medisch specialistische revalidatie bij oncologie (2.0). Utrecht: VRA; 2018. Geraadpleegd op 11 mei 2021. Beschikbaar via https://richtlijnendatabase.nl/
B.4 Gepersonaliseerde begeleiding
Het doel van de behandeling is patiënten op de korte en middellange tot lange termijn op een dusdanig functioneringsniveau te brengen dat autonoom gezond beweeggedrag mogelijk is. Hierbij zoekt de therapeut naar de juiste beweegvorm in relatie tot de fysieke mogelijkheden die iemand (nog) heeft. In samenspraak met de patiënt kan de therapeut een beweeginterventie op maat opstellen. De therapeut kan belemmeringen die de patiënt ervaart als gevolg van de ziekte of behandeling van kanker, en die ten grondslag liggen aan het niet behalen van het gewenste activiteitenniveau, helpen opheffen of verminderen.
Onderbouwing
Bij klachten of problemen als gevolg van de ziekte of behandeling van kanker kan het noodzakelijk zijn de beweeginterventie aan te passen (‘complicerende factoren’). Dekker (2016) beschrijft een strategie om een beweeginterventie aan te passen aan de aanwezigheid van comorbiditeit. Deze strategie is vervolgens ook gebruikt voor afstemming van beweeginterventies bij patiënten met borst- of eierstokkanker met andere vormen van comorbiditeit (Stelten 2020; Van der Leeden 2018). Voor een aantal complicerende factoren zijn in deze richtlijn specifieke aanbevelingen opgesteld. Daarnaast zijn er mogelijke aandachtspunten die voortkomen uit de behandeling van kanker die relevant zijn voor de vormgeving van het beweegprogramma. Deze worden hieronder besproken.
Lymfoedeem
Er bestaat sterk bewijs dat lichaamsbeweging het risico op het ontwikkelen van lymfoedeem bij borstkanker niet verhoogt (Campbell 2019) en matig tot sterk bewijs dat lichaamsbeweging symptomen die zijn gerelateerd aan lymfoedeem kan verminderen (Nelson 2016). Met name krachttraining heeft mogelijk een positief effect op het verminderen van symptomen van lymfoedeem (Hasenoehrl 2020). Bij vrouwen na een operatie in verband met een gynaecologische tumor heeft krachttraining mogelijk positieve effecten op fysiek functioneren, vermoeidheid en kracht, zonder invloed te hebben op de status van oedeem (Do 2017).
De aanwezigheid van of het risico op lymfoedeem is op zichzelf geen indicatie voor begeleiding van krachttraining door een therapeut; de krachttraining kan ook veilig door een sportbegeleider worden begeleid. Fysio- of oefentherapie is alleen geïndiceerd tijdens een eerste acute fase, als er een therapeutische doelstelling is, of een specifiek risico (bijvoorbeeld bij exacerbatie van oedeem, bewegingsbeperkingen, pijnklachten die trainen belemmeren en waar de patiënt niet zelf goed mee kan omgaan, of bewegingsangst).
Inspanning heeft geen negatieve invloed op het armvolume of de ernst van symptomen. Hoewel er aanwijzingen zijn dat ook krachttraining met grotere weerstanden veilig is voor mensen met lymfoedeem van de bovenste extremiteit (Cormie 2013), wordt in het algemeen aangeraden om te beginnen met lichte weerstand die langzaam wordt opgebouwd. De nadruk ligt op het verplaatsen van het gewicht door het volledige bewegingsbereik en het aanhouden van de juiste houding. Hierbij monitort de therapeut voortdurend de symptomen en klachten van lymfoedeem. De ‘Richtlijn Lymfoedeem’ geeft aan dat actief blijven en het nastreven van voldoende beweging helpen om lymfoedeem te voorkomen (NVDV 2014).
Botgezondheid
Vrouwen kunnen vervroegd in de menopauze raken door de behandeling van kanker, wat gepaard gaat met een verhoogd risico op osteoporose. Met name bij borstkanker zijn afname van de botdichtheid (osteopenie) en een verhoogd risico op fracturen beschreven (Chen 2005). Ook bij mannen treedt door antihormonale therapie een afname van botmassa op. Het bewijs van de effectiviteit van bewegen op botgezondheid is tegenstrijdig. Mogelijk heeft matig-tot-hoogintensieve duurtraining in combinatie met krachttraining en impacttraining, gedurende 30 tot 60 minuten per sessie op twee tot drie dagen per week positieve effecten op de botgezondheid bij patiënten met borst- of prostaatkanker (Schwartz 2020).
Trainingsprogramma’s zonder impactcomponent hebben waarschijnlijk te weinig effect op botgezondheid. Voor patiënten met osteoporose bestaat een contra-indicatie voor bewegingen met overmatig hoge belasting op kwetsbare locaties. Het is mogelijk onveilig om belastende oefeningen voor de botten voor te schrijven aan mensen met osteoporose. Mensen met gewrichts-, orthopedische of stabiliteitsproblemen zijn beter gebaat bij een beweeginterventie die is gericht op het verminderen van het valrisico.
De botgezondheid kan ook zijn aangedaan door de ziekte zelf, in de vorm van botmetastasen. Botmetastasen komen het meest voor bij patiënten met multipel myeloom, prostaatkanker, borstkanker en longkanker (D’Oronzo 2019). Botpijn en een hoge incidentie van fracturen dragen bij aan een slechte prestatiestatus en verminderde kwaliteit van leven (Aielli 2019). Uit onderzoek blijkt dat (kracht)training mogelijk is zonder ernstige bijwerkingen. Afhankelijk van de locatie van de botmetastasen is het van belang dat de therapeut een trainingsinterventie wel dusdanig aanpast dat er veilig getraind kan worden (Cormie 2014). In C.1 ‘Botmetastasen’ staat het veilig toepassen van beweeginterventies bij patiënten met botmetastasen uitgebreid beschreven.
Lichaamssamenstelling
De nadelige veranderingen in lichaamssamenstelling die samenhangen met (de behandeling van) kanker kunnen leiden tot een hulpvraag van de patiënt ten aanzien van gewichtstoename of -behoud (waarbij het uiteraard gaat om toename van vetvrije massa) of gewichtsverlies (door afname van vetmassa). Sarcopenie, verlies van zowel spiermassa als -functie, kan optreden bij verschillende typen kanker (Baracos 2018). Bij cachexie is er sprake van een afname van spiermassa en onbedoeld gewichtsverlies, vaak veroorzaakt door ondervoeding bij ziekte. Cachexie komt vaker voor bij mensen met long-, colon- en pancreaskanker, bij een slechte prognose en een vergevorderd stadium van kanker (Carson 2013).
Door training kan de lichaamssamenstelling worden verbeterd. Matig-intensieve aerobe activiteiten en gecombineerde (matig-intensieve) aerobe training en krachttraining hebben gunstige effecten op de lichaamssamenstelling (Courneya 2007). Ook bij patiënten met gemetastaseerde ziekte kan een interventie die is gericht op het verbeteren van de lichaamssamenstelling (toename van vetvrije massa) mogelijk gunstige effecten hebben. Zo is er een associatie gevonden tussen de spierindex (berekend als de spiermassa op een CT-scan gecorrigeerd voor lengte) en vermoeidheid bij mannelijke patiënten tijdens de behandeling met chemotherapie in de palliatieve fase (Neefjes 2017).
Lichamelijke activiteit kost energie en de hoeveelheid energieverbruik is afhankelijk van de duur, de intensiteit, het type en de frequentie van de activiteit, alsmede het lichaamsgewicht en de lichaamssamenstelling van de patiënt. Bij het onderhouden en opbouwen van spiermassa spelen met name eiwitten een belangrijke rol. Ook is het belangrijk dat er koolhydraten worden gebruikt na matig-tot-hoogintensieve fysieke activiteit, zodat de eiwitten effectief worden opgenomen en beschikbaar komen voor spieropbouw. Daarnaast kan vitamine-D-suppletie de spierkracht en -functie positief beïnvloeden (Halfon 2015). Geadviseerd wordt om patiënten met of na kanker regelmatig te screenen op de behoefte aan zorg voor voldoende en volwaardige voeding (Muscaritoli 2021). Het risico op ondervoeding kan in kaart gebracht worden met behulp van de ‘Patient Generated-Subjective Global Assessment’ (PG-SGA; volledige versie). Bij signalering van (risico op) ondervoeding verwijst de therapeut de patiënt naar een diëtist.
Voor een effectieve opbouw van de spiermassa en -functie zijn een adequate voedingstoestand en voedingsinname voorwaardelijk. Daarom kan het relevant zijn om ook een diëtist te betrekken bij de behandeling van patiënten die geen (risico op) ondervoeding hebben. In het bijzonder wanneer verbetering van de lichaamssamenstelling of gewichtsverlies een belangrijke doelstelling is van de patiënt, is een consult bij een diëtist van belang, omdat een diëtist gericht advies kan geven over eventuele aanpassingen in het voedingspatroon. Het aanpassen van het voedingspatroon bij mensen die leven met of na kanker is complex en kan de inzet van een verbijzonderd oncologiediëtist noodzakelijk maken. De therapeut kan de patiënt ook attenderen op de website voedingenkankerinfo.nl. Meer gedetailleerde informatie voor fysio- en oefentherapeuten is te vinden in het Handboek Voeding en Kanker (Vogel 2016).
Lichaamshouding en veilige effectieve uitvoering van bewegingen
De manier waarop bewegingen worden uitgevoerd, is essentieel om tot een effectieve training te komen. Het verkeerd uitvoeren van een oefening kan onnodige klachten opleveren en daarmee demotiverend werken voor de patiënt. Bij alle patiënten, maar in het bijzonder bij patiënten met beperkingen, is het daarom belangrijk zorgvuldig te analyseren hoe de patiënt beweegt, hoe effectief dat bewegen verloopt en of die manier van bewegen eventuele huidige klachten veroorzaakt of onderhoudt, dan wel in de toekomst klachten kan veroorzaken. Het is de taak van de therapeut dat de patiënt zich bewust wordt van zijn manier van bewegen (eventueel met behulp van een spiegel). De patiënt krijgt ook een duidelijke uitleg over welke (on)mogelijkheden er op fysiek vlak bestaan. Bewustwording is een leerproces waarin de therapeut de patiënt helpt om, ook in het dagelijks leven, op een betere en functionelere manier te bewegen met reeds bestaande fysieke beperkingen.
Cognitief functioneren en emotioneel welbevinden
De impact van de ziekte op het mentaal/emotioneel welbevinden van de patiënt is afhankelijk van het type kanker, het type behandeling, de dosis en de duur van de behandelingen, de coping van de patiënt en de omgeving van de patiënt. Patiënten kunnen als gevolg van kanker kampen met angst- en verwerkingsklachten, vermoeidheid, een verstoord lichaamsbeeld of depressieve gevoelens. Zij kunnen een verlies van vertrouwen in het eigen lichaam ervaren. In de context van een beweeginterventie kan de emotionele gesteldheid een belemmerende factor zijn in het bewegend functioneren. Cognitieve stoornissen komen veel voor bij patiënten. Het is van belang dat de therapeut een inschatting maakt van eventuele cognitieve problemen en de informatieoverdracht daarop afstemt.
Bewegen heeft mogelijk een positief effect op het cognitief functioneren en emotioneel welbevinden van de patiënt (Campbell 2019; Husson 2015), maar in sommige gevallen heeft de patiënt mentaal-emotioneel oncologische zorg of begeleiding nodig (beschikbaar via de psychosomatische, psychomotorische of oncologiefysiotherapeut of via multidisciplinaire specialistische revalidatie). Specifieke problemen kunnen onopgemerkt blijven, omdat de patiënt klachten niet bekendmaakt of klachten niet als zodanig herkent. Met signaleringsinstrumenten kan de zorgbehoefte van de patiënt worden geïdentificeerd. Raadpleeg voor meer informatie de richtlijn ‘Detecteren behoefte psychosociale zorg’ van de Nederlandse Vereniging voor Psychosociale Oncologie (NVPO 2017).
Kwetsbaarheid
Kanker en de behandeling van kanker kunnen leiden tot een toegenomen kwetsbaarheid. Kwetsbaarheid uit zich in een achteruitgang van verschillende fysiologische systemen met als gevolg daarvan onbedoeld gewichtsverlies, verlaagd uithoudingsvermogen, algemene zwakte, lagere loopsnelheid en lage fysieke activiteit. Kwetsbaarheid komt veel voor bij ouderen en patiënten met veel comorbiditeit. Kwetsbare ouderen lopen een verhoogd risico op ziekenhuisopnames, slechte mobiliteit en overlijden (Fried 2001; Gill 2010). Fysieke problemen zoals neuropathie, sarcopenie, spierzwakte en vermoeidheid kunnen vergelijkbaar zijn met die bij ouderen zonder kanker. De behandeling van kanker kan reeds bestaande problemen verergeren, achteruitgang versnellen en bij jonge patiënten kunnen er problemen ontstaan die gewoonlijk niet op jongere leeftijd voorkomen (Maccormick 2006). De inspanningstolerantie kan daarom lager zijn dan te verwachten is voor een bepaalde leeftijdsgroep.
Omdat inactiviteit een onderdeel is van kwetsbaarheid en componenten van kwetsbaarheid beïnvloedt, kan een beweeginterventie een strategie zijn om klachten aan te pakken. Begeleiding door een therapeut en stimulering van een actieve leefstijl kunnen helpen bij het voorkomen of verminderen van problemen die geassocieerd zijn met kwetsbaarheid (Schwartz, 2020). Daarnaast kunnen patiënten ook op andere dan het fysieke domein kwetsbaarheid tonen of ervaren. Het doormaken van de ziekte kanker en de behandeling daarvan is van grote invloed op het dagelijks leven, de levensverwachting en de sociale rolverandering, en roept existentiële vragen en onzekerheden op die invloed kunnen hebben op het fysiek functioneren. Kwetsbaarheid verdient daarom de volle en brede aandacht van fysio- en oefentherapeuten.
Het is belangrijk dat de therapeut vroegtijdig signalen herkent die liggen in het sociale, mentaal-emotionele, gedragsmatige en existentiële domein, deze benoemt en, in overleg met de patiënt en de verwijzer, zo nodig deskundigen (bijvoorbeeld geriatriefysiotherapeut, klinisch geriater of specialist ouderengeneeskunde) inroept als medebehandelaar (KNGF 2014).
In overleg met de werkgroep en de klankbordgroep is besloten deze richtlijn te voorzien van een actuele beschrijving van klachten of problemen die zijn gerelateerd aan kanker(behandeling) in relatie tot beweeginterventies ter bevordering van een actieve leefstijl en verbetering van de kwaliteit van leven van patiënten die leven met en na kanker, en de hieraan gerelateerde nieuwe inzichten voor het opstellen van een behandelplan voor deze patiëntengroep. Deze beschrijving berust op de hier genoemde bronnen.
- Aielli F, Ponzetti M, Rucci N. Bone metastasis pain, from the bench to the bedside. Int J Mol Sci. 2019;20(2):280.
- American College of Sports Medicine. ACSM’s Guidelines for exercise testing and prescription. 10e druk . Philadelphia, PA: Wolters Kluwer; 2018.
- Baracos VE, Arribas L. Sarcopenic obesity: hidden muscle wasting and its impact for survival and complications of cancer therapy. Ann Oncol. 2018 Feb 1;29(suppl_2):ii1-ii9.
- Campbell KL, Winters-Stone KM, Wiskemann J, May AM, Schwartz AL, Courneya KS, Zucker DS, Matthews CE, Ligibel JA, Gerber LH, Morris GS, Patel AV, Hue TF, Perna FM, Schmitz KH. Exercise guidelines for cancer survivors: consensus statement from international multidisciplinary roundtable. Med Sci Sports Exerc. 2019;51(11):2375-90.
- Carson J, Puppa M. Exercise, energy, balance and cancer. Chapter 5: Biological pathways impacting cancer survival – Exercise as a countermeasure for the development and progression of cachexia. New York: Springer; 2013.
- Chen Z, Maricic M, Pettinger M, Ritenbaugh C, Lopez AM, Barad DH, Gass M, Leboff MS, Bassford TL. Osteoporosis and rate of bone loss among postmenopausal survivors of breast cancer. Cancer. 2005;104(7);1520-30.
- Cormie P, Newton RU, Spry N, Joseph D, Taaffe DR, Galvao DA. Safety and efficacy of resistance exercise in prostate cancer patients with bone metastases. Prostate Cancer Prostatic Dis. 2013;16(4):328-35.
- Cormie P, Pumpa K, Galvao DA, Turner E, Spry N, Saunders C, Zissiadis Y, Newton RU. Is it safe and efficacious for women with lymphedema secondary to breast cancer to lift heavy weights during exercise: a randomised controlled trial. J Cancer Surviv. 2014;7(3):413-21.
- Courneya KS, Segal RJ, Mackey JR, Gelmon K, Reid RD, Friedenreich CM, Ladha AB, Proulx C, Vallance JKH, Lane K, Yasui Y, McKenzie DC. Effects of aerobic and resistance exercise in breast cancer patients receiving adjuvant chemotherapy: a multicenter randomized controlled trial. J Clin Oncol. 2007;25(28):4396-404.
- Dekker J, de Rooij M, van der Leeden M. Exercise and comorbidity: the i3-S strategy for developing comorbidity-related adaptations to exercise therapy. Disabil Rehabil, 2016:38(9), 905-9.
- D’Oronzo S, Coleman R, Brown J, Silvestris F. Metastatic bone disease: pathogenesis and therapeutic options: up-date on bone metastasis management. J Bone Oncol. 2019;15:004-4.
- Do JH, Choi KH, Ahn JS, Jeon JY. Effects of a complex rehabilitation program on edema status, physical function, and quality of life in lower-limb lymphedema after gynecological cancer surgery. Gynecol Oncol. 2017;147(2):450-5.
- Fried LP, Tangen CM, Walston J, Newman AB, Hirsch C, Gottdiener J, Seeman T, Tracy R, Kop WJ, Burke G, McBurnie MA, Cardiovascular Health Study Collaborative Research Group. Frailty in older adults: evidence for a phenotype. J Gerontol A Biol Sci Med Sci. 2001. 56(3):146-56.
- Gill TM, Gahbauer EA, Han L, Allore HG. Trajectories of disability in the last year of life. N Engl J Med. 2010;362(13):1173-80.
- Halfon M, Phan O, Teta D. Vitamin D: a review on its effects on muscle strength, the risk of fall, and frailty. Biomed Res Int. 2015;2015:953241.
- Hasenoehrl T, Palma S, Ramazanova D, Kolbl H, Dorner TE, Keilani M, Crevenna R. Resistance exercise and breast cancer-related lymphedema-a systematic review update and meta-analysis. Support Care Cancer. 2020;28(8):3593-603.
- Husson O, Mols F, Ezendam NPM, Schep G, van de Poll-Franse LV. Health-related quality of life is associated with physical activity levels among colorectal cancer survivors: a longitudinal, 3-year study of the PROFILES registry. J Cancer Surviv. 2015;9(3):472-80.
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF). KNGF-standaard Beweeginterventie oncologie. Amersfoort: KNGF; 2011.
- Koninklijk Nederlands Genootschap voor Fysiotherapie. KNGF-standaard Beweeginterventie kwetsbare ouderen. Amersfoort: KNGF; 2014.
- Maccormick RE. Possible acceleration of aging by adjuvant chemotherapy: a cause of early onset frailty? Med Hypotheses. 2006;67(2):212-5.
- Muscaritoli M, Arends J, Bachmann P, Baracos V, Barthelemy N, Bertz H, Bozzetti F, Hütterer E, Isenring E, Kaasa S, Krznaric Z, Laird B, Larsson M, Laviano A, Mühlebach S, Oldervoll L, Ravasco P, Solheim TS, Strasser F, de van der Schueren M, Preiser JC, Bischoff SC. ESPEN practical guideline: Clinical Nutrition in cancer. Clin Nutr. 2021 May;40(5):2898-913.
- Nederlandse Vereniging voor Dermatologie en Venerologie (NVDV). Richtlijn Lymfoedeem. Utrecht: FMS; 2014. Geraadpleegd op 11 mei 2021. Beschikbaar via https://richtlijnendatabase.nl/
- Nederlandse Vereniging voor Psychosociale Oncologie (NVPO). Richtlijn detecteren behoefte psychosociale zorg. Utrecht: FMS; 2014. Geraadpleegd op 11 mei 2021. Beschikbaar via https://richtlijnendatabase.nl/
- Nederlandse Vereniging voor Revalidatieartsen (VRA). Richtlijn medisch specialistische revalidatie bij oncologie (2.0). Utrecht: VRA; 2018. Geraadpleegd op 11 mei 2021. Beschikbaar via https://richtlijnendatabase.nl/
- Neefjes ECW, van den Hurk RM, Blauwhoff-Buskermolen S, van der Vorst MJDL, Becker-Commissaris A, van der Schueren MAE, Buffart LM, Verheul HMW. Muscle mass as a target to reduce fatigue in patients with advanced cancer. J Cachexia Sarcopenia Muscle. 2017;8(4):623- 9.
- Nelson NL. Breast cancer-related lymphedema and resistance exercise: a systematic review. J Strength Cond Res. 2016;30(9); 2656-65.
- Schwartz AL, Bea JW, Winters-Stone K. Long-term and late effects of cancer treatments on prescribing physical activity. In Schmitz KH, editor. Exercise oncology. Prescribing physical activity before and after a cancer. Springer Nature; Hershey, PA, Verenigde Staten; 2020. pag 267-82.
- Stelten S, Hoedjes M, Kenter GG, Kampman E, Huijsmans RJ, van Lonkhuijzen LRCW, Buffart LM. Rationale and study protocol of the Physical Activity and Dietary intervention in women with OVArian cancer (PADOVA) study: a randomised controlled trial to evaluate effectiveness of a tailored exercise and dietary intervention on body composition, physical function and fatigue in women with ovarian cancer undergoing chemotherapy. BMJ Open. 2020;10(11):e036854.
- van der Leeden M, Huijsmans RJ, Geleijn E, de Rooij M, Konings IR, Buffart LM, Dekker J, Stuiver MM. Tailoring exercise interventions to comorbidities and treatment-induced adverse effects in patients with early stage breast cancer undergoing chemotherapy: a framework to support clinical decisions. Disabil Rehabil. 2018;40(4):486-96.
- Vogel J, Beijer S, Delsink P, Doornink N, ten Have H, van Lieshout R, redactie. Handboek voeding bij kanker. Tweede druk. Utrecht: De Tijdstroom; 2016.
B.5 De veiligheid van beweeginterventies
Aandacht voor klachten ten gevolge van bijwerkingen en (mogelijke) langetermijneffecten van de behandeling is van belang met het oog op het opstellen van (haalbare) doelen, het bewaken van de veiligheid in de trainingssituatie en het voorkomen en vroegtijdig signaleren van overbelasting.
Op basis van de aanwezige klachten of beperkingen en ondergane medische behandelingen moet op individuele basis worden afgewogen of het bewegen verantwoord is en of er sprake is van trainbaarheid.
Onderbouwing
Uit wetenschappelijk onderzoek blijkt het risico op ernstige bijwerkingen door fysieke activiteit bij mensen die leven met of na kanker laag (< 5%) en er hebben zich geen levensbedreigende situaties of sterfgevallen voorgedaan (Speck 2010; Stout 2017). Bovendien is het aandeel patiënten dat na aanvankelijke deelname afziet van een beweeginterventie, laag (< 10%) en is de therapietrouw over het algemeen hoog (> 80%) (Singh 2018, 2020). Het is echter verstandig om onderzoeksbevindingen te bezien in het licht van de beperkingen van het doen van onderzoek. Patiënten die betrokken zijn bij onderzoek naar de effectiviteit van beweeginterventies zijn in vergelijking met de algemene populatie, veelal gemotiveerder, jonger en lichamelijk actiever, en de ziekte bevindt zich bij hen doorgaans ook in een vroeger stadium. Verder kunnen uitsluitingscriteria voor deelname aan onderzoek gehanteerd zijn, zoals de aanwezigheid van specifieke aan de behandeling gerelateerde bijwerkingen, andere chronische ziekten of comorbiditeit. Dit maakt dat onderzoeksbevindingen over veiligheid en haalbaarheid van beweeginterventies niet generaliseerbaar zijn naar de gehele populatie van mensen die leven met of na kanker.
Zowel de ziekte als behandeling van kanker kan invloed hebben op de veiligheid van beweeginterventies. Om een veilige en effectieve beweeginterventie op te kunnen stellen, is het belangrijk eventuele klachten of symptomen in kaart te brengen. De ‘American College of Sports Medicine’ (ACSM) heeft op basis van de ‘National Comprehensive Cancer Network (NCCN) Survivorship Guideline’ aanbevelingen geformuleerd voor wanneer medische goedkeuring noodzakelijk is (waarmee wordt bedoeld: toestemming van een medisch professional voor een beweeginterventie) en/of verdere evaluatie door een medisch professional (Campbell 2019; NCCN 2018). Deze risicobeoordeling is opgenomen in de volgende tabel.
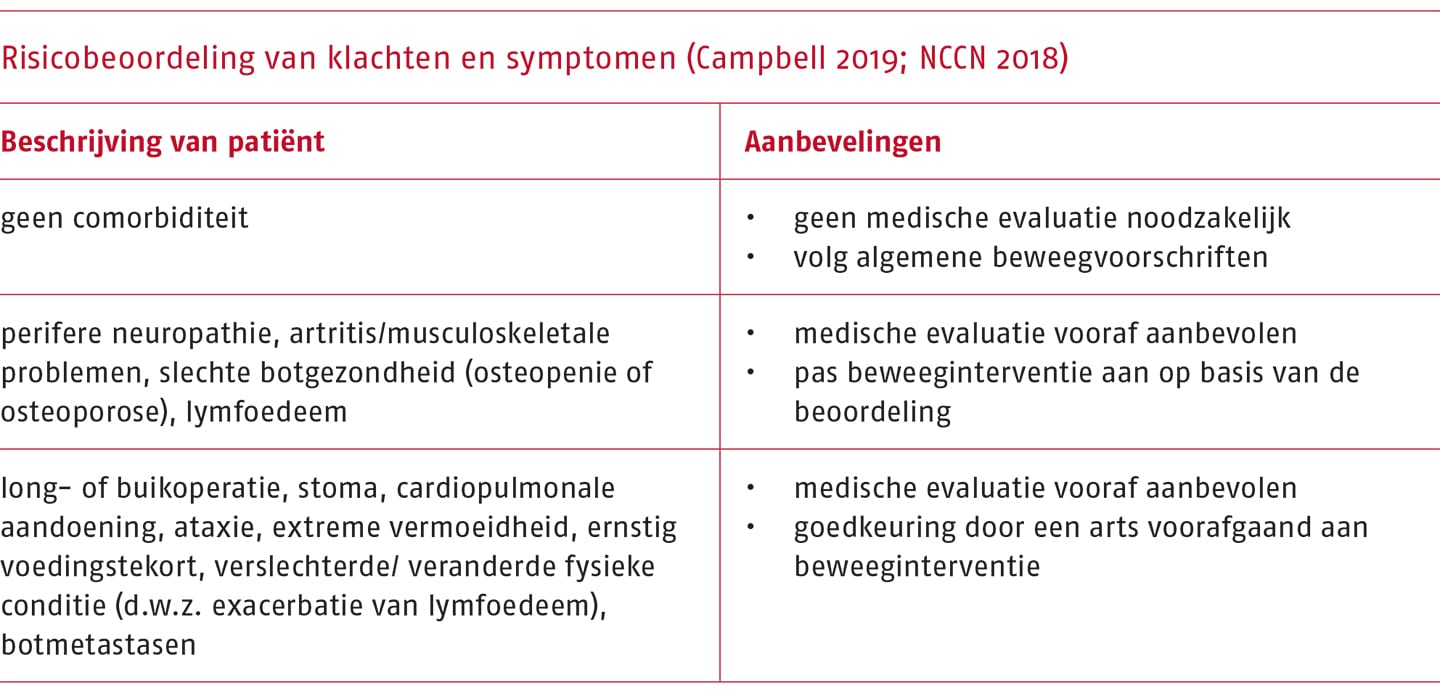
Voor de therapeut is het in het kader van een beweeginterventie belangrijk om zich te oriënteren op de mogelijk effecten op het (bewegend) functioneren van de bij zijn patiënt gebruikte combinatie van medicijnen, en op het veilig omgaan met deze effecten tijdens het uitvoeren van het behandelplan gedurende een cytostaticakuur. Voor professionals die betrokken zijn bij de zorg voor patiënten die behandeld zijn of worden met cytostatica, is de ‘Handreiking veilig omgaan met cytostatica’ beschikbaar (IKNL 2015).
In overleg met de werkgroep en de klankbordgroep is besloten deze richtlijn te voorzien van een actuele beschrijving van de veiligheid van beweeginterventies ter bevordering van een actieve leefstijl en verbetering van de kwaliteit van leven van patiënten die leven met en na kanker, en de hieraan gerelateerde nieuwe inzichten voor het opstellen van een behandelplan voor deze patiëntengroep. Deze beschrijving berust op de hier genoemde bronnen.
- American College of Sports Medicine. ACSM’s Guidelines for exercise testing and prescription. 10e druk. Philadelphia, PA: Wolters Kluwer; 2018.
- Campbell KL, Winters-Stone KM, Wiskemann J, May AM, Schwartz AL, Courneya KS, Zucker DS, Matthews CE, Ligibel JA, Gerber LH, Morris GS, Patel AV, Hue TF, Perna FM, Schmitz KH. Exercise guidelines for cancer survivors: consensus statement from international multidisciplinary roundtable. Med Sci Sports Exerc. 2019;51(11):2375-90.
- Integraal Kankercentrum Nederland (IKNL). Handreiking veilig omgaan met cytostatica, versie 2.0. Utrecht: IKNL; 2015.
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF). KNGF-standaard Beweeginterventie oncologie. Amersfoort: KNGF; 2011.
- National Comprehensive Cancer Network (NCCN). Survivorship, Version 2.2018, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2018 Oct;16(10):1216-1247.
- Nederlandse Vereniging voor Revalidatieartsen (VRA). Richtlijn medisch specialistische revalidatie bij oncologie (2.0). Utrecht: VRA; 2018. Geraadpleegd op 11 mei 2021. Beschikbaar via https://richtlijnendatabase.nl/
- Singh B, Hayes SC, Spence RR, Steele ML, Millet GY, Gergele L. Exercise and colorectal cancer: a systematic review and meta-analysis of exercise safety, feasibility and effectiveness. Int J Behav Nutr Phys Act. 2020;17(1):122.
- Singh B, Spence RR, Steele ML, Sandler CX, Peake JM, Hayes SC. A systematic review and meta- analysis of the safety, feasibility, and effect of exercise in women with stage ii+ breast cancer. Arch Phys Med Rehabil. 2018;99(12):2621-36.
- Speck RM, Courneya KS, Masse LC, Duval S, Schmitz KH. An update of controlled physical activity trials in cancer survivors: a systematic review and meta-analysis. J Cancer Surviv. 2010;4(2):87-100.
- Stout NL, Baima J, Swisher AK, Winters-Stone KM, Welsh J. A systematic review of exercise systematic reviews in the cancer literature (2005-2017). PM R. 2017;9:S347-84.

