Complicerende factoren
C.1 Botmetastasen
Aanbevelingen
Ga na bij de verwijzer of er sprake is van stabiele botmetastasen. Verzamel in aanvulling daarop zoveel mogelijk informatie die van belang is voor de fysio- of oefentherapeutische behandeling; in het bijzonder in verband met het risico op het optreden van een (pathologische) fractuur of compressie van het ruggenmerg.
Deze informatie behelst minimaal:
- de locatie en aard van de botmetastasen (zo gedetailleerd mogelijk);
- de aanwezigheid van neurologische symptomen;
- de aanwezigheid van osteoporose;
- de aanwezigheid van pijn die is gerelateerd aan de locatie van metastasen;
- eerdere fracturen;
- de behandeling die is ingezet vanwege de botmetastasen;
- de inschatting van het valrisico.
Beoordeel deze informatie periodiek opnieuw.
Kom in samenspraak met de behandelend arts of verpleegkundig specialist tot een geschikt oefen- of fysiotherapeutisch behandelplan.
Weeg voor de start van een beweeginterventie in samenspraak met de patiënt de voor- en nadelen tegen elkaar af. Betrek daar het volgende bij:
- de risico’s van de beweeginterventie die door de arts zijn benoemd (zoals het risico op fracturen of compressie van het ruggenmerg);
- de mate waarin de beweeginterventie kan worden aangepast om de risico’s te minimaliseren;
- potentiële voordelen van de beweeginterventie en de gezondheidsrisico’s van niet bewegen, zoals het valrisico dat voortkomt uit inactiviteit en het daarmee gepaard gaande verhoogde risico op fracturen.
Bied de beweeginterventie gepersonaliseerd aan en houd rekening met de locatie en aard van de botmetastasen. Stem de manier waarop bewegingen worden uitgevoerd af op de locatie van de botmetastasen indien dit nodig is.
Bied de beweeginterventie bij voorkeur gesuperviseerd aan bij patiënten met botmetastasen. Instrueer patiënten die de voorkeur geven aan zelfstandig trainen, ten minste over de manier waarop de oefeningen veilig en effectief kunnen worden uitgevoerd.
Vermijd dwarse krachten en/of compressiekrachten op een locatie met aangetoonde metastasen om het risico op een fractuur te verminderen. Dit geldt ook voor de uitvoering van inspanningsdiagnostiek.
Pas bij voorkeur een beweeginterventie toe waarbij zoveel mogelijk functioneel wordt getraind. Overweeg bij deze training het eigen lichaamsgewicht (zwaartekracht) te gebruiken in plaats van apparatuur en halters. Formuleer samen met de patiënt heldere doelen en communiceer verwachtingen.
Ga niet over tot begeleiding van patiënten met instabiele botmetastasen zonder dat er een uitgebreide risicobeoordeling heeft plaatsgevonden in overleg met de betrokken arts en eventueel andere betrokken behandelaars.
Bied bij patiënten met instabiele botmetastasen een oefenprogramma of beweeginstructies aan met een focus op functioneel oefenen binnen de grenzen zoals afgesproken in een multidisciplinair team.
Onderbouwing
Aanleiding
Botmetastasen kunnen leiden tot pijn, een afname van fysieke functies en verminderd functioneren op het gebied van activiteiten en participatie. Als gevolg hiervan kunnen patiënten met botmetastasen een afname in kwaliteit van leven ervaren. Voldoende fysieke activiteit en lichaamsbeweging kunnen zorgen voor een verbetering van het lichamelijk functioneren en worden aanbevolen voor mensen die leven met of na kanker. Voor patiënten met botmetastasen blijft een beweeginterventie vaak onbenut door onzekerheid over de veiligheid en het risico op bijwerkingen, zoals pathologische fracturen. Om therapeuten te ondersteunen, is het daarom belangrijk om aanbevelingen te formuleren voor het veilig toepassen van effectieve beweeginterventies in aanwezigheid van botmetastasen.
Uitgangsvraag
Wat is een veilige toepassing van beweeginterventies bij patiënten met botmetastasen?
Literatuur
In de literatuur is beschreven dat beweeginterventies voor patiënten met stabiele botmetastasen geen verhoogd risico geven op ernstige bijwerkingen als gevolg van een beweeginterventie in vergelijking met geen beweeginterventie. Zelfs deelname aan sport en spelvormen wordt in verband gebracht met een zeer laag risico op bijwerkingen die zijn gerelateerd aan het bewegen in aanwezigheid van stabiele botmetastasen.
In een groot deel van de wetenschappelijke studies zijn patiënten met pijn of instabiele botmetastasen echter niet geïncludeerd en was voor deelname aan een beweeginterventie toestemming van de behandelend arts, een uitgebreide overdracht met de functionele status van de patiënt of een minimumniveau van functioneren nodig.
In aanwezigheid van botmetastasen werden krachtoefeningen voorgeschreven waarbij de belasting van het gebied met botmetastasen geminimaliseerd werd en/of werden weerstandsbanden gebruikt in plaats van apparaten. Met deze aanpassingen zijn bij patiënten met botmetastasen alsnog positieve effecten gevonden op verschillende uitkomsten, zoals fysiek functioneren en spierkracht.
Overwegingen
Wanneer wordt overwogen een beweeginterventie aan te bieden aan patiënten met botmetastasen is het belangrijk om de juiste achtergrondinformatie te verzamelen. Patiënten die met botmetastasen bij een therapeut komen, zullen in de meeste gevallen te maken hebben met stabiele metastasen. Bij twijfel is het belangrijk dit te verifiëren bij de behandelend arts. In het volgende kader is een overzicht opgenomen van mogelijke risicofactoren. Deze lijst is opgesteld door een internationale werkgroep die bestaat uit experts op het gebied van bewegen bij botmetastasen, op grond van systematisch literatuuronderzoek en raadpleging van stakeholders (Campbell 2022, Weller 2021). Op basis van deze risicofactoren kan de therapeut beoordelen of de focus van een beweeginterventie voornamelijk op beweegvoorbereiding komt te liggen (gericht op juiste, veilige uitvoering van beweging), op oefening of op training. Zie de volgende figuur.
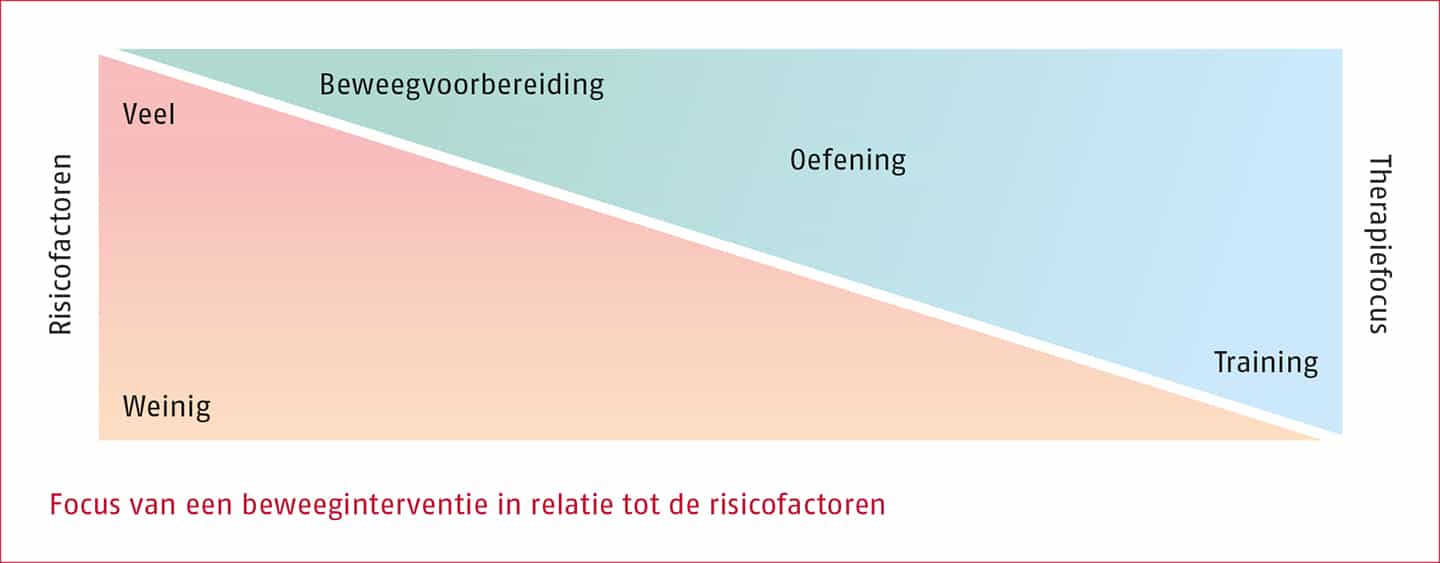
Risicofactoren voor bewegen bij patiënten met botmetastasen
Osteolytische metastasen
- Metastasen in gewichtdragende botten (femur, wervelkolom, bekkenring, heupkom)
- Pijn gerelateerd aan de locatie van metastasen
- Neurologische symptomen
- Gebruik van pijnmedicatie gerelateerd aan de locatie van metastasen
Aan de behandeling van metastasen gerelateerde factoren
- Bestraling van de metastasen in de afgelopen twee maanden
- Geplande of eerdere chirurgische of medische behandeling voor skeletgerelateerde voorvallen of symptomatische aandoeningen die zijn gerelateerd aan het skelet
Aan (de behandeling van) kanker gerelateerde factoren
- Progressie van de ziekte
- Metastasen in andere orgaansystemen (bijvoorbeeld hersenen, long)
- Type kanker dat zich vaak uit in osteolytische metastasen (zoals long-, schildklier- en niercelcarcinoom)
- Huidig gebruik van medicatie die de afbraak van botten remt of botten steviger maakt (denosumab, zoledroninezuur), of gebruik gedurende een periode > 6 maanden
Aan de patiënt gerelateerde factoren
- Algemene symptomen zoals comorbiditeit, vermoeidheid, extreem gewichtsverlies
- Geen of weinig ervaring met lichaamsbeweging
- Slechte ECOG-prestatiestatus
- Twee of meer valpartijen in de afgelopen 12 maanden
- Osteoporose
- Beperkingen in ADL
- Cognitieve stoornissen die het naleven van voorzorgsmaatregelen
ECOG = ‘Eastern Cooperative Oncology Group’
Daarnaast kan in het geval van metastasen in lange pijpbeenderen een risicoanalyse gemaakt worden met behulp van de ‘Mirels Classification’ (Howard 2018; Sheill 2018) en bij metastasen in de wervelkolom met de ‘Spinal Instability Neoplastic Score’ (SINS; Fox 2017). Deze scores worden echter niet in alle Nederlandse ziekenhuizen routinematig gebruikt, en zijn dus niet altijd voorhanden. Neurologische symptomen zijn verdacht en de therapeut verwijst de patiënt met neurologische symptomen altijd direct terug naar de arts voor aanvullend onderzoek.
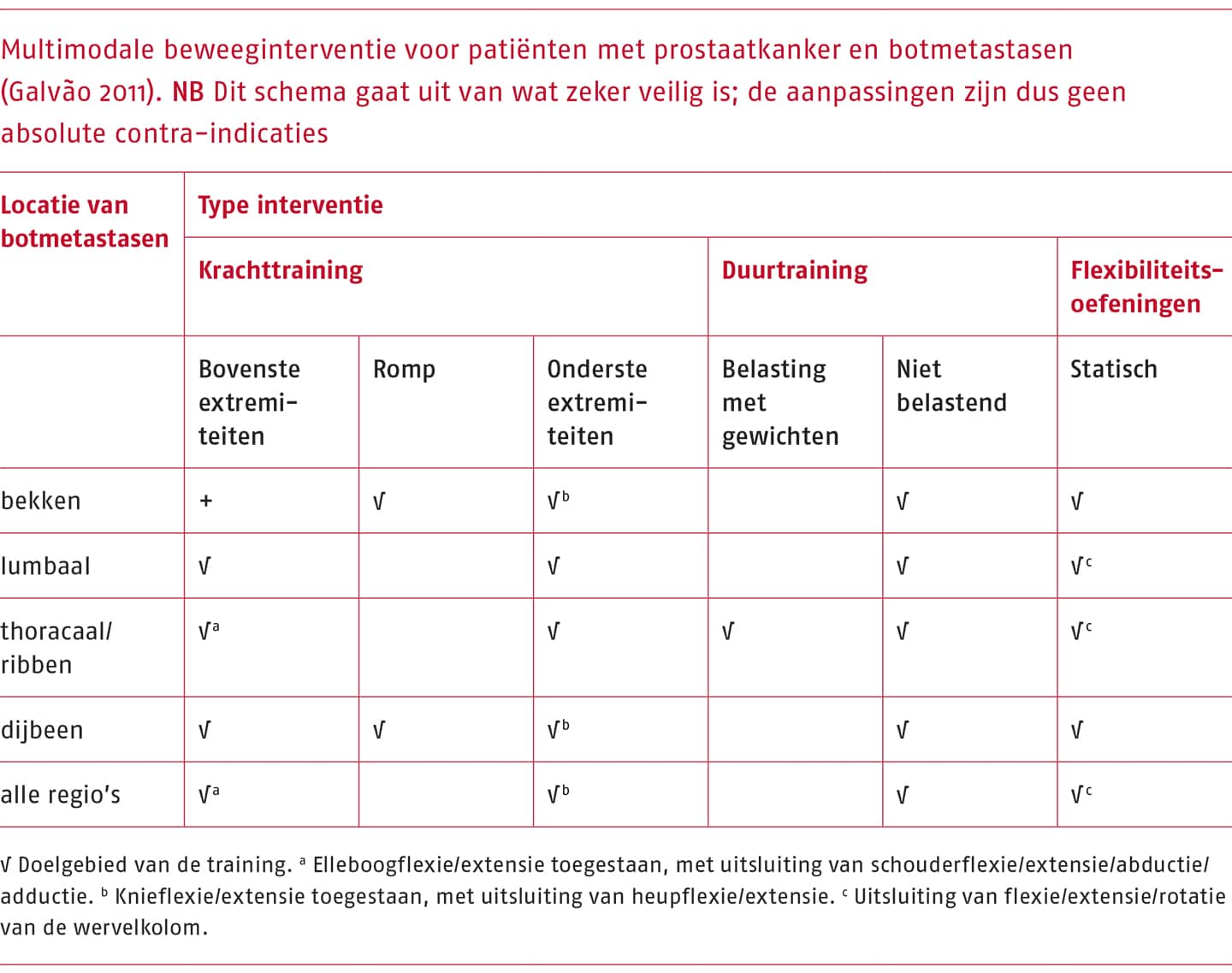
Bij het inrichten van de beweeginterventie houdt de therapeut rekening met de locatie en aard van de botmetastase(n), om het risico te verlagen. Als er aanpassingen nodig zijn, kan gedacht worden aan het weglaten van bepaalde oefeningen of tests, het minder belasten van een bepaald gebied of het aanpassen van een beweging, oefening of test. Door Galvão (2011) is een multimodale beweeginterventie opgesteld voor patiënten met prostaatkanker en botmetastasen om compressiebelasting op de gebieden met botmetastasen te minimaliseren en rekening te houden met verminderde belastbaarheid van het bot. Zie de volgende tabel.
De therapeut hoort zich zo min mogelijk te laten leiden door beperkingen, maar moet zich realiseren dat bepaalde oefeningen een verhoogd risico met zich meebrengen, bijvoorbeeld bij dwarse krachten op een locatie met aangetoonde metastasen. Directe 1RM-tests worden afgeraden. Bij stabiele botmetastasen worden 12 RM-tests over het algemeen veilig geacht. Er kan ook overwogen worden geen tests uit te voeren en de belasting pragmatisch te bepalen op grond van ervaren belasting en kwaliteit van uitvoering van de beweging. Daarom is het belangrijk dat de therapeut bij elke oefening een analyse maakt van de keten van krachtoverbrenging, en hoe als gevolg hiervan de aangedane regio wordt belast (Guo 2020). Hierbij wordt rekening gehouden met afwijkende beweegpatronen ten gevolge van bewegingsangst. Deze kunnen potentieel klachten in andere gebieden opleveren. De patiënt een beweeginterventie onthouden kan indirect ook tot schade leiden, doordat inactiviteit kan leiden tot vallen en een verhoogd risico op fracturen.
Functioneel trainen is bij patiënten met botmetastasen belangrijk. Mogelijk verlaagt functioneel trainen het risico van een beweeginterventie, omdat daarbij alleen het eigen gewicht, de zwaartekracht en functionele gewichten worden gebruikt, die de patiënt in het dagelijks leven ook zou gebruiken. De therapeut moedigt de patiënt aan om te bewegen, en geeft een goede uitleg over eventuele risico’s en hoe deze zoveel mogelijk kunnen worden beperkt. Hierbij kan gedacht worden aan het aanpassen van de manier waarop de diverse bewegingen kunnen worden uitgevoerd, daar waar dat nodig is. Kennisoverdracht tussen therapeut en patiënt over hoe en in welke vorm bewegingsopdrachten worden uitgevoerd is belangrijk, alsmede communicatie tussen betrokken zorgverleners onderling zodat de patiënten een eenduidig advies krijgt, om er zeker van te zijn dat alle relevante informatie over de (belastbaarheid van) botmetastasen bekend is bij alle betrokken zorgverleners, en om ervoor te zorgen dat symptomen en verschijnselen die mogelijk gerelateerd zijn aan (verergering van) botmetastasen tijdig worden opgemerkt.
Over het algemeen zijn de risico’s van een beweeginterventie bij patiënten met stabiele botmetastasen laag, maar deze eventuele risico’s op fracturen of compressie van het ruggenmerg, zoals aangegeven door de arts, worden wel met de patiënt besproken, toegelicht en vastgelegd in het dossier. De therapeut weegt deze risico’s in samenspraak met de patiënt af tegen de voordelen van bewegen en de risico’s van niet bewegen.
De wetenschappelijke evidentie over veiligheid en haalbaarheid van beweeginterventies bij patiënten met instabiele botmetastasen is beperkt. De begeleiding bij patiënten met instabiele botmetastasen verschilt van patiënt tot patiënt en vraagt een uitgebreide risicobeoordeling en overleg met de betrokken zorgverleners.
Wanneer een patiënt met botmetastasen zelfstandig wil trainen, is het noodzakelijk dat de therapeut de patiënt instrueert in het veilig uitvoeren van oefeningen. Op enig moment en op enig niveau zal (periodieke) supervisie belangrijk zijn. Afhankelijk van de situatie van de patiënt maakt de therapeut een inschatting van de frequentie waarop de patiënt wordt gezien.
Zoekactie
De informatie die nodig is voor het formuleren van aanbevelingen ten aanzien van de veiligheid van beweeginterventies bij patiënten met botmetastasen is vergaard met behulp van het recentelijk uitgevoerd systematisch literatuuronderzoek van Weller (2021). In dit onderzoek worden onder andere de veiligheid, haalbaarheid en effectiviteit beschreven van beweeginterventies bij patiënten met botmetastasen op basis van de evidentie van gecontroleerde studies. Het literatuuronderzoek is uitgevoerd op 16 juli 2020 in de elektronische databases MEDLINE, Embase, PubMed CINAHL, PEDro en CENTRAL.
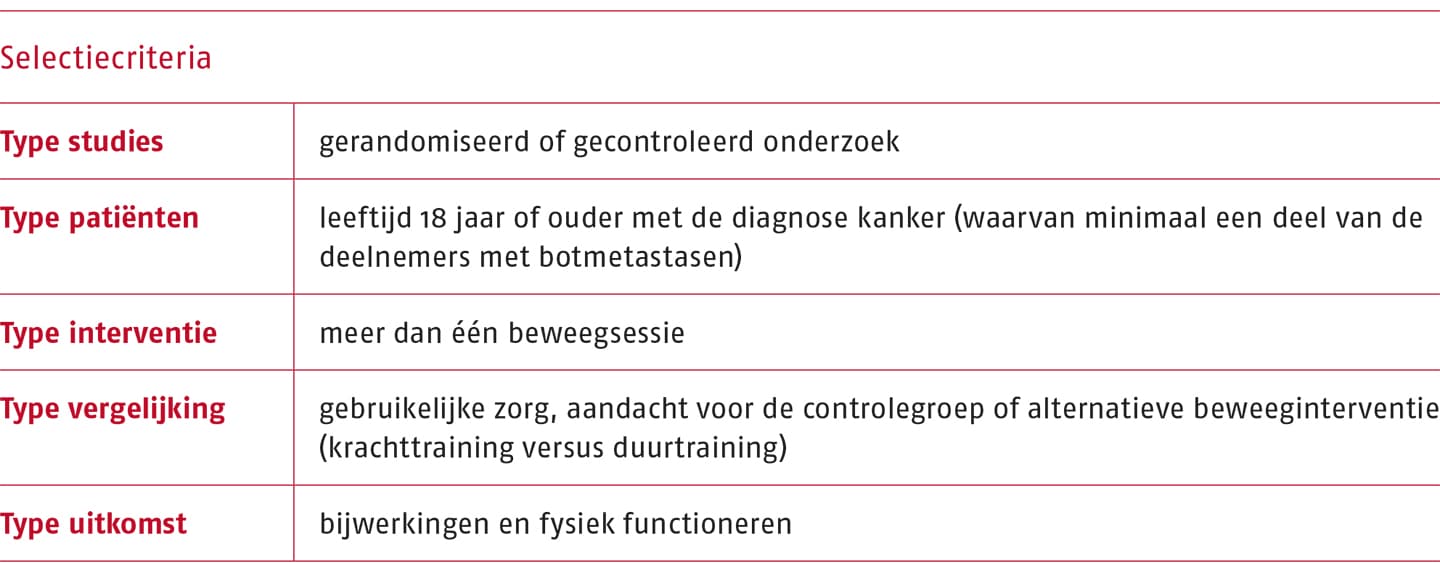
De selectiecriteria die Weller (2021) hanteerde, zijn opgenomen in de volgende tabel.
Karakteristieken van geïncludeerde studies
In totaal zijn 16 studies geïncludeerd waarin de haalbaarheid en effectiviteit van krachttraining (5 studies), duurtraining (1 studie), een combinatie van kracht- en duurtraining (7 studies) of een beweeginterventie in spelverband (3 studies) zijn onderzocht in zowel een gesuperviseerde als een niet-gesuperviseerde setting. Daarnaast is één studie geïncludeerd waarin de effectiviteit van kracht- en duurtraining met elkaar is vergeleken. 13 studies includeerden zowel patiënten met als zonder botmetastasen en vier studies includeerden alleen patiënten met botmetastasen. Van de 1489 deelnemers die zijn geïncludeerd in de review, hadden er 645 (43%) botmetastasen; de gemiddelde leeftijd van de deelnemers was 65 jaar. Op basis van de gegevens van drie studies varieerde de leeftijd van 32 tot 87 jaar. Negen studies onderzochten de effectiviteit van een gesuperviseerde beweeginterventie; in zes studies werd een combinatie van gesuperviseerde en niet-gesuperviseerde sessies aangeboden en in twee studies bestond de interventie uit niet-gesuperviseerde sessies. De supervisie werd verzorgd door gekwalificeerde fysiotherapeuten, inspanningsfysiologen of sportprofessionals.
Negen studies rapporteerden bijwerkingen in zowel de interventie- als de controlegroep, zeven studies alleen in de interventiegroep en één studie rapporteerde helemaal geen bijwerkingen, maar alleen vermoeidheidsklachten. Zeven studies gebruikten een classificatietool om de ernst van de bijwerkingen te beoordelen. In drie studies werden ernstige bijwerkingen gerapporteerd van zowel patiënten met als zonder botmetastasen. Van de 57 ernstige bijwerkingen traden er 27 op in de interventie- en 30 in de controlegroep. Vier ernstige bijwerkingen (in 0,5% van het totaal aantal deelnemers aan de beweeginterventie) konden worden toegeschreven aan de beweeginterventie. Alle bijwerkingen konden worden toegeschreven aan een voetbaltraining en traden niet op in het gebied met de botmetastasen. De ernstige bijwerkingen bestonden uit: twee fracturen, één achillespeesruptuur en één infectie als gevolg van een schram die werd veroorzaakt door een scheenbeschermer. In de vier studies waarin alleen patiënten met botmetastasen werden geïncludeerd, zijn geen ernstige bijwerkingen gerapporteerd.
In negen studies werden geen patiënten geïncludeerd met pijn of instabiele botmetastasen. Ook was voor deelname aan vier studies toestemming van de arts noodzakelijk en in acht studies was een minimale prestatiestatus vereist (‘Eastern Cooperative Oncology Group’ (ECOG) prestatiestatus 0-1/2; Karnofsky-prestatiestatus (KPS) > 70). Daarnaast werden in zeven van de geïncludeerde studies de trainingsvoorschriften aangepast in verband met de botmetastasen. Zo werden krachtoefeningen voorgeschreven waarbij de belasting van het gebied met botmetastasen geminimaliseerd werd, en/of werden weerstandsbanden gebruikt in plaats van apparaten.
In geen van de 17 studies werden significant negatieve effecten gerapporteerd. Ten opzichte van de controlegroep werd in zeven studies een significante verbetering in fysiek functioneren gerapporteerd, in drie studies een significante vermindering in vermoeidheid en vier studies rapporteerden een significante verbetering in kwaliteit van leven als gevolg van de beweeginterventie. Zes studies rapporteerden een significante verbetering in lichaamssamenstelling en objectief gemeten spierkracht. In twee studies werd een significante vermindering van pijn gerapporteerd als gevolg van de beweeginterventie. In de vier studies waarin alleen patiënten met botmetastasen waren geïncludeerd, werd geen significant effect op vermoeidheid of kwaliteit van leven gevonden. Wel werd een significante verbetering in fysiek functioneren (3 studies) en spierkracht (2 studies) gerapporteerd. Eén studie rapporteerde daarnaast een significante vermindering in pijn als gevolg van de beweeginterventie, terwijl in drie studies geen verschil in pijn tussen de interventie- en de controlegroep werd gevonden.
Individuele studiekwaliteit
De opzet en uitvoering van de individuele studies (‘risk of bias’; RoB) zijn in de meta-analyse van Weller (2021) beoordeeld met behulp van de ‘Cochrane Risk of Bias 2.0’. Voor de beoordeling van de studie van Rosenberger (2017) is gebruikgemaakt van ‘Risk of Bias In Non-Randomized Studies of Interventions’ (ROBINS). Zie voor de beoordeling van de RoB van alle individuele studies die Weller includeerde bijlage C.1-1 (opent in nieuw tabblad).
Kwaliteit van de gevonden literatuur
Een van de items van de RoB-tool beschrijft waarin is afgeweken van de voorgeschreven interventie. Omdat de beschrijving van dit item als onduidelijk is beoordeeld in acht van de 17 studies (47%) en die onduidelijkheid mogelijk invloed heeft gehad op de gevonden resultaten, is de bewijskracht van de meta-analyse met één niveau verlaagd. Dit had tot gevolg dat de kwaliteit van het bewijs als redelijk is beoordeeld. Zie voor het GRADE-evidenceprofiel de volgende tabel.
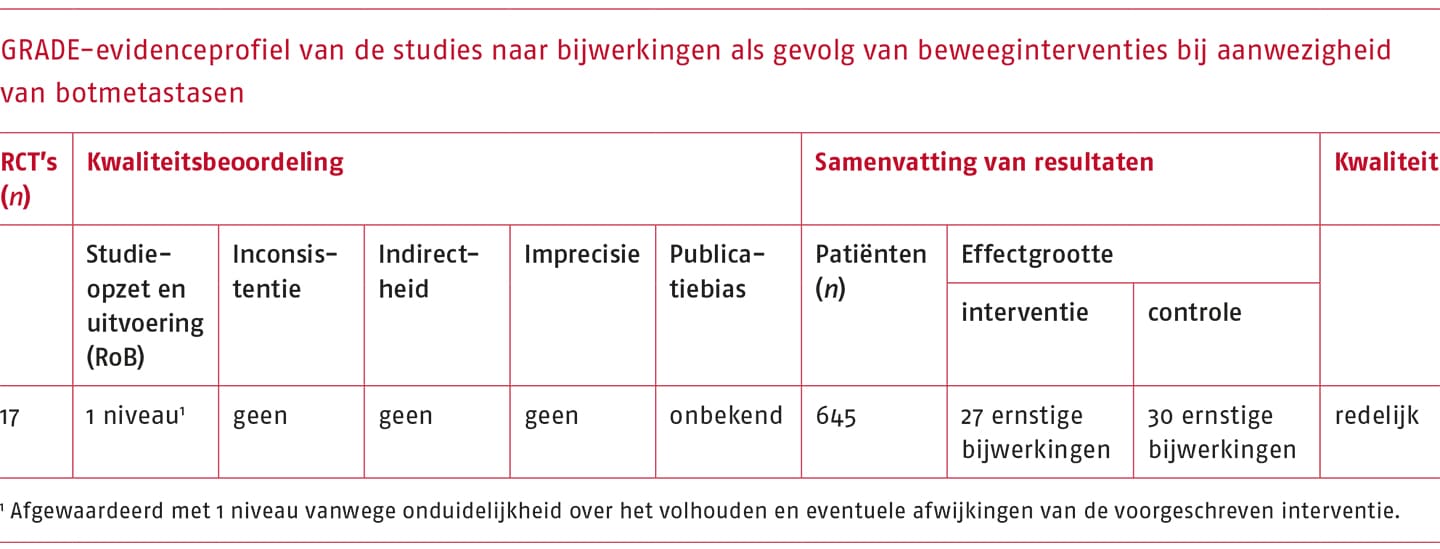
Conclusie op basis van de literatuur
Er is bewijs van redelijke kwaliteit dat beweeginterventies bij patiënten met stabiele botmetastasen niet leiden tot een verhoogd risico op ernstige bijwerkingen in vergelijking met geen beweeginterventie, maar alleen als de beweeginterventie aangepast wordt aan de locatie van botmetastasen.
Overwegingen
De aanbevelingen worden niet alleen bepaald door bevindingen in de literatuur. Ook andere overwegingen spelen daarbij een rol. De overwegingen betroffen:
Gewenste effecten: Bij patiënten met botmetastasen kan een beweeginterventie belangrijke voordelen opleveren op de uitkomstmaten, zoals op fysiek functioneren en op spierkracht.
Ongewenste effecten: Het risico op ernstige bijwerkingen als gevolg van een beweeginterventie bij patiënten met botmetastasen is zeer klein, maar alleen als de beweeginterventie wordt aangepast aan de locatie van de botmetastasen. De evidentie beperkt zich tot stabiele metastasen. Bij instabiele metastasen is een uitgebreide risicobeoordeling nodig, evenals overleg met de betrokken zorgverleners.
Kwaliteit gewenste effecten: De bewijskracht is redelijk.
Balans tussen gewenste en ongewenste effecten: Aangezien er geen aanwijzingen zijn dat een beweeginterventie bij patiënten met stabiele botmetastasen ook maar enige mate leidt tot een verhoogd risico, maar mogelijk wel effectief is ter verbetering van fysiek functioneren en spierkracht, overstijgen de gewenste de ongewenste effecten. De risico’s van de beweeginterventie moeten in gezamenlijkheid met de patiënt afgewogen worden tegen de voordelen van bewegen en de gezondheidsrisico’s van niet bewegen.
Waarde aan gewenste effecten: Het onthouden van een effectieve beweeginterventie kan tot schade leiden. Een voorbeeld daarvan is dat het valrisico zal toenemen door inactiviteit. Het onthouden van een effectieve interventie kan daardoor leiden tot een toename van vallen en daarmee het risico op fracturen. Het belang van een voor de patiënt toereikende conditie en een goede uitvoer van beweging is duidelijk in verband met het optimaliseren van activiteiten van het dagelijks leven, het algemeen welbevinden van de patiënt, het verkleinen van het valrisico en het durven bewegen ondanks de botmetastasen.
Variatie in waarde aan gewenste effecten: De effectiviteit en veiligheid van beweeginterventies bij patiënten met instabiele botmetastasen zijn onbekend. Begeleiding bij patiënten met botmetastasen verschilt van patiënt tot patiënt. Bij instabiele botmetastasen verdient de begeleiding extra aandacht in verband met het verhoogde risico op incidenten.
Benodigde middelen (kosten): Er zijn geen extra kosten verbonden aan de interventie (ten opzichte van reguliere behandeling door de fysio- of oefentherapeut).
Variatie in benodigde middelen (kosten): Niet van toepassing.
Kosteneffectiviteit: Er is geen evidentie beschikbaar over de kosteneffectiviteit van een beweeginterventie bij patiënten met botmetastasen.
Aanvaardbaarheid: Bij aanwezigheid van stabiele botmetastasen moet bewegen zoveel mogelijk worden aangemoedigd. Begeleiding van patiënten met instabiele botmetastasen vereist een uitgebreide risicobeoordeling in overleg met de betrokken arts en eventueel andere betrokken behandelaars. Om te komen tot risicoreductie, in geval er sprake is van risico’s, kan zoveel mogelijk functioneel worden getraind, waarbij alleen gebruik wordt gemaakt van het eigen gewicht, de zwaartekracht en functionele gewichten die de patiënt in het dagelijks leven ook zou gebruiken. Artsen, verpleegkundigen of verpleegkundig specialisten zouden bedenkingen kunnen uiten over de veiligheid van de belasting bij patiënten. Het is essentieel dat tussen alle betrokken behandelaars op grond van expliciete klinische overwegingen overeenstemming is over wat veilig kan en wat niet, zodat aan de patiënt een eenduidig advies kan worden gegeven en de patiënt niet aan onnodige risico’s wordt blootgesteld, maar ook geen effectieve zorg wordt onthouden.
Haalbaarheid: De implementatie van beweeginterventies bij patiënten met stabiele botmetastasen is in de dagelijkse praktijk haalbaar in een eerstelijnspraktijk, waarbij goede informatie van de behandelend arts over de aard en de locatie van de botmetastasen essentieel is. De therapeut hoort zich zo min mogelijk te laten leiden door beperkingen, maar moet zich wel realiseren dat bepaalde oefeningen risicoverhogend kunnen werken (bijvoorbeeld: dwarse krachten of compressiekrachten op een locatie met aangetoonde metastasen). Om een juiste risico-inschatting te maken, is het noodzakelijk om van de behandelend arts informatie te krijgen over de locatie van de metastasen en deze informatie te gebruiken bij het beoordelen van de veiligheid van oefentherapie en training. De therapeut gaat bij de verwijzer na of er sprake is van stabiele of instabiele metastasen en of er sprake is van neurologische symptomen, osteoporose, pijn die is gerelateerd aan de locatie van de metastasen, eerdere fracturen, welke behandeling is ingezet vanwege de botmetastasen en hoe het valrisico wordt ingeschat. Op basis van deze risicofactoren kan, in samenspraak met de behandelend arts of verpleegkundig specialist, tot een geschikt fysio- of oefentherapeutisch behandelplan gekomen worden. De informatie die de therapeut verzamelt is in overleg met de werkgroep en de klankbordgroep geselecteerd en sluit aan bij op dit moment in ontwikkeling zijnde internationale richtlijnen. De aard van de botmetastasen is in deze overweging opgenomen in verband met een mogelijk groter risico op fracturen bij osteolytische metastasen dan bij osteoblastische metastasen of gemengd osteolytische/osteoblastische metastasen.
Conclusie
De werkgroep adviseert zoveel mogelijk relevante informatie te verzamelen, en in samenspraak met de behandelend arts of verpleegkundig specialist tot een geschikt fysio- of oefentherapeutisch behandelplan te komen.
Meetinstrumenten
Botmetastasen zijn vooral aanwezig in sterk doorbloede gedeeltes van het bot, zoals de wervelkolom, het bekken en de lange pijpbeenderen. Bij 70% van de patiënten zijn de botmetastasen afkomstig van een mamma-, long-, prostaat-, schildklier- of niercelcarcinoom. Bij ongeveer 70% van de patiënten met botmetastasen bestaan de symptomen uit botpijn en verminderde mobiliteit. Botmetastasen kunnen zichtbaar worden gemaakt met behulp van een röntgenfoto, MRI, botscintigrafie of CT-scan. Eventueel kan behalve radiologisch onderzoek een biopsie worden uitgevoerd wanneer er nog geen eerder bewezen botmetastasen zijn geïdentificeerd. De diagnostiek van botmetastasen zal daarom altijd door een arts worden uitgevoerd. Bij de intake voor een beweeginterventie zal een eventuele beperking of bedreiging van het inspanningsvermogen in kaart moeten worden gebracht. Bij het selecteren van meetinstrumenten voor het meten van de inspanningscapaciteit en andere functies van het bewegingsapparaat houdt de fysio- of oefentherapeut rekening met de locatie en aard van de botmetastasen, op vergelijkbare wijze als bij het aanbieden van training. Het toepassen van directe 1RM-tests wordt afgeraden. De therapeut consulteert bij twijfel over de uitvoering van een beweeginterventie bij patiënten met botmetastasen de primaire behandelaar.
Het evidence-to-decisionformulier voor de veilige toepassing van beweeginterventies bij patiënten met botmetastasen is opgenomen als bijlage C.1-2 (opent in nieuw tabblad).
- Bjerre ED, Brasso K, Jørgensen AB, Petersen, TH, Eriksen AR, Tolver A, Christensen JF, Poulsen MH, Madsen SS, Østergren PB, Borre M, Krustrup P, Johansen C, Rørth M, Midtgaard J. Football compared with usual care in men with prostate cancer (FC Prostate Community Trial): a pragmatic multicentre randomized controlled trial. Sports Med. 2019;49(1):145-58.
- Bourke L, Doll H, Crank H, Daley A, Rosario D, Saxton JM. Lifestyle intervention in men with advanced prostate cancer receiving androgen suppression therapy: a feasibility study. Cancer Epidemiol Biomarkers Prev. 2011;20(4):647-57.
- Bourke L, Gilbert S, Hooper R, Steed LA, Joshi M, Catto JWF, Saxton JM, Rosario DJ. Lifestyle changes for improving disease-specific quality of life in sedentary men on long-term androgen-deprivation therapy for advanced prostate cancer: a randomised controlled trial. Eur Urol. 2014;65(5):865-72.
- Campbell KL, Cormie P, Weller S, Alibhai SMH, Bolam KA, Campbell A, Cheville AL, Dalzell MA, Hart NH, Higano CS, Lane K, Mansfield S, McNeely ML, Newton RU, Quist M, Rauw J, Rosenberger F, Santa Mina D, Schmitz KH, Winters-Stone KM, Wiskemann J, Goulart J. Exercise Recommendation for People with Bone Metastases: Expert Consensus for Health Care Providers and Exercise Professionals. JCO. 2022; online ahead of print.
- Cheville AL, Moynihan T, Herrin J, Loprinzi C, Kroenke K. Effect of collaborative telerehabilitation on functional impairment and pain among patients with advanced-stage cancer: a randomized clinical trial. JAMA Oncol. 2019;5(5):644-52.
- Cormie P, Newton RU, Spry N, Joseph D, Taaffe DR, Galvao DA. Safety and efficacy of resistance exercise in prostate cancer patients with bone metastases. Prostate Cancer Prostatic Dis. 2013;16(4):328-35.
- Dawson JK, Dorff TB, Todd Schroeder E, Lane CJ, Gross ME, Dieli-Conwright CM. Impact of resistance training on body composition and metabolic syndrome variables during androgen deprivation therapy for prostate cancer: a pilot randomized controlled trial. BMC Cancer. 2018;18(1):368.
- Fox S, Spiess M, Hnenny L, Fourney DR. Spinal Instability Neoplastic Score (SINS): reliability among spine fellows and resident physicians in orthopedic surgery and neurosurgery. Global Spine J. 2017;7(8):744-48.
- Galvão DA, Taaffe DR, Spry N, Cormie P, Joseph D, Chambers SK, Chee R, Peddle-McIntyre CJ, Hart NH, Baumann FT, Denham J, Baker M, Newton RU. Exercise preserves physical function in prostate cancer patients with bone metastases. Med Sci Sports Exerc. 2018;50(3):393-9.
- Guo Y, Ngo-Huang AT, Fu JB. Perspectives on spinal precautions in patients who have cancer and spinal metastasis. Phys Ther. 2020. 100(3):554-63.
- Howard EL, Shepherd KL, Cribb G, Cool P. The validity of the Mirels score for predicting impending pathological fractures of the lower limb. Bone Joint J. 2018;8(8):1100-05.
- Integraal Kankercentrum Nederland (IKNL). Richtlijn botmetastasen. Utrecht: IKNL; 2010. Geraadpleegd op 11 mei 2021. Beschikbaar via https://richtlijnendatabase.nl/
- Litterini AJ, Fieler VK, Cavanaugh JT, Lee JQ. Differential effects of cardiovascular and resistance exercise on functional mobility in individuals with advanced cancer: a randomized trial. Arch Phys Med Rehabil. 2013;94(12):2329-35.
- Rief H, Petersen LC, Omlor G, Akbar M, Bruckner T, Rieken S, Haefner MF, Schlampp I, Förster R, Debus J, Welzel T, German Bone Research Group. The effect of resistance training during radiotherapy on spinal bone metastases in cancer patients – a randomized trial. Radiother Oncol. 2014;112(1):133-9.
- Rosenberger F, Wiskemann J, Vallet S, Haag GM, Schembri E, Jäger D, Grüllich C. Resistance training as supportive measure in advanced cancer patients undergoing TKI therapy-a controlled feasibility trial. Support Care Cancer. 2017;25(12):3655-64.
- Scott JM, Zabor EC, Schwitzer E, Koelwyn GJ, Adams SC, Nilsen TS, Moskowitz CS, Matsoukas K, Iyengar NM, Dang CT, & Jones LW. Efficacy of Exercise Therapy on Cardiorespiratory Fitness in Patients With Cancer: A Systematic Review and Meta-Analysis. J Clin Oncol. 2018;36(22):2297-305.
- Sheill G, Guinan EM, Peat N, Hussey J. Considerations for exercise prescription in patients with bone metastases: a comprehensive narrative review. PM R. 2018;10(8):843-6.
- Solheim TS, Laird BJA, Balstad TR, Stene GB, Bye A, Johns N, Pettersen CH, Fallon M, Fayers P, Fearon K, Kaasa S. A randomized phase II feasibility trial of a multimodal intervention for the management of cachexia in lung and pancreatic cancer. J Cachexia Sarcopenia Muscle. 2017;8(5):778-88.
- Sprave T, Rosenberger F, Verma V, Förster R, Bruckner T, Schlampp I, Bostel T, Welzel T, Akbaba S, Rackwitz T, Nicolay NH, Grosu AL, Wiskemann J, Debus J, Rief H. Paravertebral muscle training in patients with unstable spinal metastases receiving palliative radiotherapy: an exploratory randomized feasibility trial. Cancer (Basel). 2019;11(11):1771.
- Uster A, Ruehlin M, Mey S, Gisi D, Knols R, Imoberdorf R, Pless M, Ballmer PE. Effects of nutrition and physical exercise intervention in palliative cancer patients: A randomized controlled trial. Clin Nutr. 2018;37(4):1202-9.
- Uth J, Hornstrup T, Schmidt JF, Christensen JF, Frandsen C, Christensen KB, Helge EW, Brasso K, Rørth, Midtgaard J, Krustrup P. Football training improves lean body mass in men with prostate cancer undergoing androgen deprivation therapy. Scand J Med Sci Sports. 2014;24 Suppl 1:105-12.
- Villumsen BR, Jorgensen MG, Frystyk J, Hørdam B, Borre M. Home-based ‘exergaming’ was safe and significantly improved 6-min walking distance in patients with prostate cancer: a single-blinded randomised controlled trial. BJU Int. 2019 Apr 22. Published ahead of print. Doi: 10.1111/bju.14782
- Weller S, Hart NH, Bolam KA, Mansfield S, Santa Mina D, Winters-Stone KM, Campbell A, Rosenberger F, Wiskemann J, Quist M, Cormie P, Goulart J, Campbell KL. Exercise for individuals with bone metastases: A systematic review. Crit Rev Oncol Hematol. 2021 Oct;166:103433.
- Yee J, Davis GM, Hackett D, Beith JM, Wilcken N, Currow D, Emery J, Philips J, Martin A, Hui R, Harrison M, Segelov E, Kilbreath SL. Physical activity for symptom management in women with metastatic breast cancer: a randomized feasibility trial on physical activity and breast metastases. J Pain Symptom Manage. 2019;58(6):929-39.
C.2 Cardiotoxiciteit
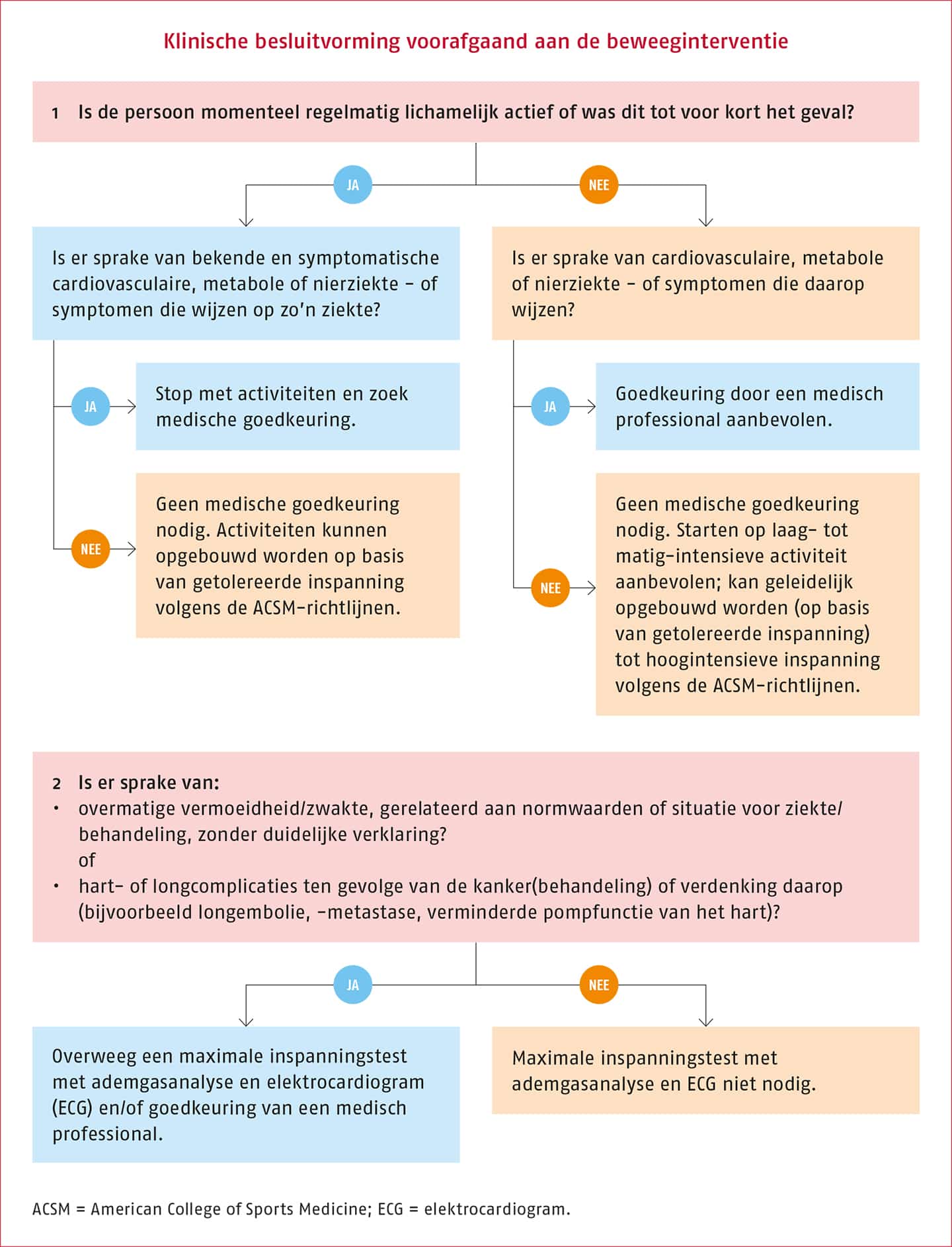
Overleg met de behandelend arts over de aanvraag van een maximale inspanningstest met ECG en ademgasanalyse op basis van risicofactoren voor een verminderde cardiale belastbaarheid en klinische besluitvorming. Zie de volgende tabel.
Het diagram ter ondersteuning van de klinische besluitvorming is weergegeven in de volgende figuur.
Gebruik de resultaten van de maximale inspanningstest om:
- te bepalen of fysieke training veilig toegepast kan worden;
- limiterende factoren te identificeren;
- een weloverwogen keuze te maken voor therapievormen en de intensiteit van de fysieke training.
Bespreek eventuele risico’s op cardiovasculaire incidenten met de patiënt. Maak voorafgaand aan de start van een beweeginterventie een risico-batenafweging met de patiënt. Weeg hierin mee:
- de risico’s van de beweeginterventie (zoals risico’s op cardiovasculaire incidenten);
- de mate waarin de beweeginterventie kan worden aangepast om de risico’s zoveel mogelijk te minimaliseren;
- potentiële voordelen van de beweeginterventie en de gezondheidsrisico’s van niet bewegen.
Vermijd valsalvamanoeuvres (krachtig ‘vastzetten’ van de adem ter verhoging van intra-abdominale en intrathoracale druk) bij patiënten met cardiovasculaire klachten als gevolg van de kankerbehandeling, in verband met de bijkomende acute verhoging van de bloeddruk.
Onderbouwing
Aanleiding
De huidige therapieën voor kanker maken overleving van de ziekte op de lange termijn mogelijk. Hoewel een groot deel van de patiënten geneest, hebben veel therapieën cardiotoxische effecten op zowel de korte als de lange termijn. Therapiegerelateerde cardiotoxiciteit kan worden gedefinieerd als symptomen en tekenen van hartfalen na aanvang van het medisch-therapeutisch traject. Deze symptomen hebben invloed op de veiligheid van beweeginterventies. Om therapeuten te ondersteunen in het maken van weloverwogen keuzes is het belangrijk om aanbevelingen te formuleren voor een veilige toepassing van een beweeginterventie voor de patiënt met therapiegerelateerde cardiotoxiciteit.
Uitgangsvraag
Wat is een veilige toepassing van beweeginterventies bij patiënten met therapiegerelateerde cardiotoxiciteit?
Literatuur
Er is weinig wetenschappelijke evidentie over de veiligheid van beweeginterventies voor patiënten met therapiegerelateerde cardiotoxiciteit. Twee gerandomiseerde studies concluderen dat een aerobe beweeginterventie mogelijk veilig is voor patiënten met behandelingsgerelateerd hartfalen. De resultaten van één studie suggereren dat een beweeginterventie met name veilig is voor patiënten die in staat zijn om een beweeginterventie vol te houden. Het is echter niet te beoordelen of bijwerkingen resulteerden in het niet volhouden van de interventie.
Overwegingen
Er is voorzichtigheid geboden bij het aanbieden van een beweeginterventie aan patiënten met therapiegerelateerde cardiotoxiciteit. Aerobe training bij patiënten met verminderde cardiale belastbaarheid kan mogelijk veilig worden uitgevoerd, met name door patiënten die in staat zijn om een beweeginterventie vol te houden. Echter, in de gevonden onderzoeksresultaten zijn meer bijwerkingen gevonden in de interventiegroep met aerobe beweeginterventie dan in de controlegroep (Jones 2014). Hierbij is niet duidelijk of deze bijwerkingen zijn ontstaan als gevolg van de interventie. De therapeut overweegt de inzet van een beweeginterventie in samenspraak met de patiënt, waarbij met de patiënt wordt besproken wat de risico’s zijn en welke winst de beweeginterventie kan opleveren. In een artikel van de Europese Vereniging voor Cardiologie (ESC) is een overzicht te vinden van de meest voorkomende hartproblematiek na medisch-oncologische behandeling (Zamorano 2016).
Een goede inventarisatie van risicofactoren helpt de therapeut om in te schatten of de interventie leidt tot grote risico’s op bijwerkingen en cardiovasculaire voorvallen en om te beoordelen of deze risico’s opwegen tegen eventuele verbetering van de conditie van de patiënt.
In de literatuur zijn hartritmestoornissen, een toename in het aantal klachten of in de ernst van de klachten beschreven als bijwerking. Een overzicht van de risicofactoren is te vinden in het volgende kader.
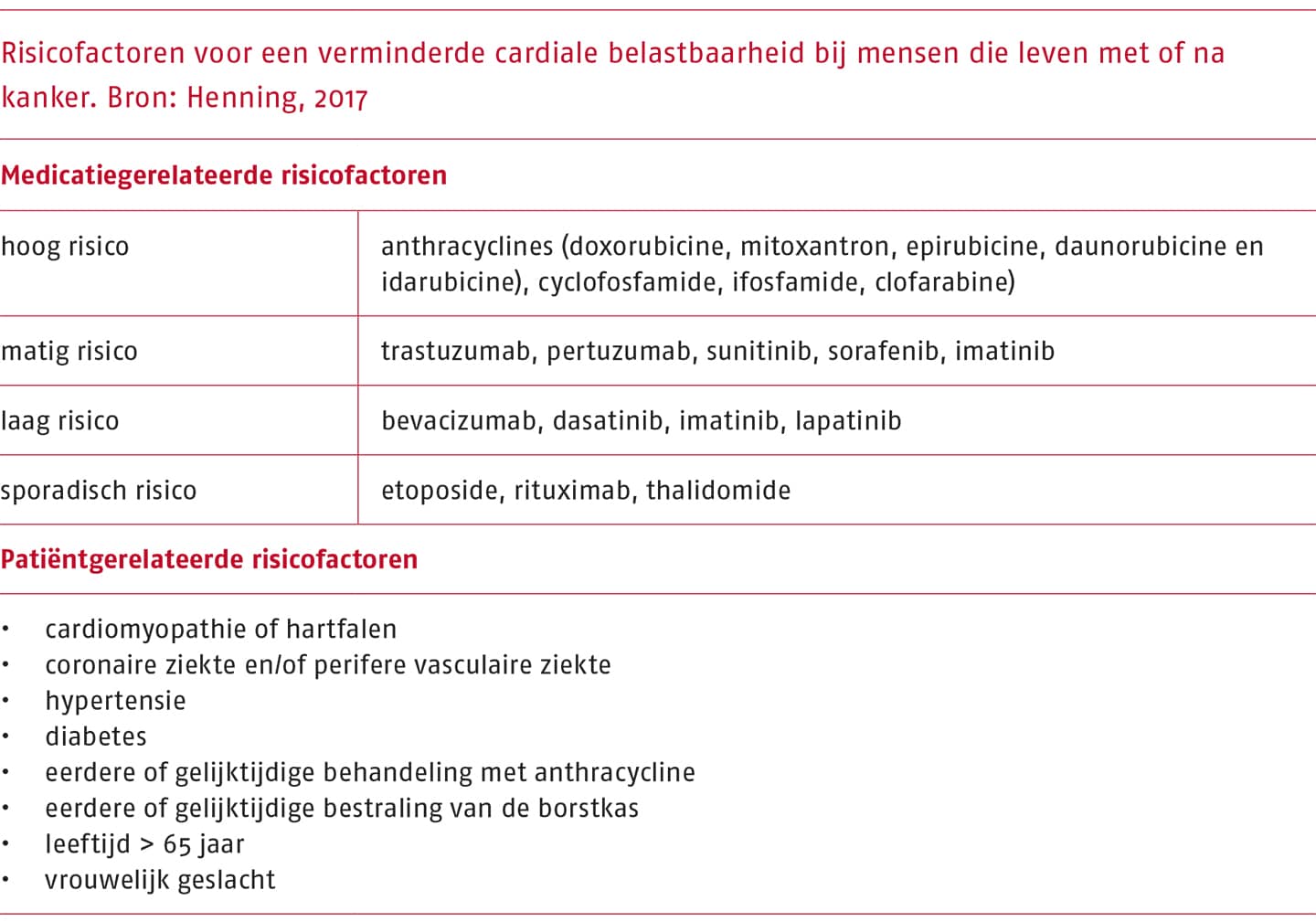
Risicofactoren voor een verminderde cardiale belastbaarheid (Henning 2017)
Medicatiegerelateerde risicofactoren
- Hoog risico: anthracyclines (doxorubicine, mitoxantron, epirubicine, daunorubicine en idarubicine), cyclofosfamide, ifosfamide, clofarabine
- Matig risico: trastuzumab, pertuzumab, sunitinib, sorafenib, imatinib
- Laag risico: bevacizumab, dasatinib, imatinib, lapatinib
- Sporadisch risico: etoposide, rituximab, thalidomide
Patiëntgerelateerde risicofactoren
- Cardiomyopathie of hartfalen
- Coronaire ziekte en/of perifere vasculaire ziekte
- Hypertensie
- Diabetes
- Eerdere of gelijktijdige behandeling met anthracycline
- Eerdere of gelijktijdige bestraling van de borstkas
- Leeftijd > 65 jaar
- Vrouwelijk geslacht
Zowel de ‘American Heart Association’ (Gilchrist 2019) als de Europese Vereniging voor Cardiologie (ESC; Pelliccia 2021) beschrijft dat door het meten van de maximale inspanningscapaciteit een persoonlijke beweeginterventie op maat opgesteld kan worden die veilig is. Het uitvoeren van een inspanningstest geeft de mogelijkheid om abnormale cardiovasculaire reacties te identificeren die anders niet optreden tijdens normale dagelijkse activiteiten.
‘Cardio Pulmonary Exercise Testing’ (CPET) kan van toegevoegde waarde zijn bij patiënten met beperkte fysieke capaciteit, als er geen vooruitgang wordt geboekt of als er zorgen zijn over de belastbaarheid van de patiënt. De aanvraag van CPET gaat in samenspraak met de (huis)arts. De resultaten van de maximale inspanningstest kunnen gebruikt worden om te bepalen of fysieke training veilig gegeven kan worden, voor het identificeren van limiterende factoren en voor het maken van een weloverwogen keuze tussen therapievormen en de intensiteit van de fysieke training (Campbell 2019).
In wetenschappelijk onderzoek heeft een maximale inspanningstest bij patiënten die leven met of na kanker en die zijn gediagnosticeerd met hartfalen, het risico op eventuele bijwerkingen niet volledig kunnen afdekken. Er is onvoldoende bewijs dat trainen op basis van de resultaten van een inspanningstest effectief is ter vermindering van het risico op cardiovasculaire gebeurtenissen als gevolg van inspanning (Riebe 2015). Daarnaast kan het uitvoeren van een maximale inspanningstest een onnodige belemmering zijn voor het starten van een beweeginterventie. Het risico op cardiovasculaire voorvallen is het hoogst wanneer inactieve patiënten met een cardiovasculaire aandoening hoogintensief fysiek actief zijn. Het is daarom van toegevoegde waarden om:
- het huidige niveau van fysieke activiteit van de patiënt;
- de aanwezigheid van symptomen en/of bekende cardiovasculaire problemen, en
- de gewenste trainingsintensiteit in kaart te brengen.
Een maximale inspanningstest kan overwogen worden op basis van risicofactoren voor een verminderde cardiale belastbaarheid (zie het kader ‘Risicofactoren voor een verminderde cardiale belastbaarheid’). Op basis van de gezondheidsscreening van de ‘American College of Sports Medicine’ en de criteria uit de beslisboom van de richtlijn ‘Medisch Specialistische Revalidatie bij oncologie’ is een diagram opgesteld ter ondersteuning van de klinische besluitvorming voorafgaand aan een beweeginterventie (zie de Praktijkrichtlijn (opent in nieuw tabblad))
De maximale inspanningstest hoeft niet te worden afgenomen indien er een duidelijke klinische aanleiding is dat het testresultaat geen toegevoegde waarde heeft voor het behandelproces. Bij mensen met hartfalen als gevolg van de oncologische behandeling geeft de ejectiefractie mogelijk belangrijke informatie over de belastbaarheid van de patiënt. Als de patiënt slechter presteert dan verwacht, gaat de therapeut op zoek naar de oorzaak daarvan. Op basis van klinische expertise wordt geadviseerd bij verdenking op cardiale risico’s grote krachtinspanning en valsalvamanoeuvres (krachtig ‘vastzetten’ van de adem ter verhoging van intra-abdominale en intrathoracale druk) te vermijden.
Voor duurtraining op lage intensiteit of flexibiliteitsoefeningen is geen uitgebreide beoordeling van de capaciteit vereist (Riebe 2018). Wanneer therapiegerelateerde cardiotoxiciteit de uitvoering van een beweeginterventie bemoeilijkt, is het verstandig de KNGF-richtlijn ‘Hartrevalidatie’ te raadplegen. De therapeut beoordeelt op grond van de richtlijn of doorverwijzing naar een therapeut met voldoende kennis en vaardigheden op het gebied van hartfalen noodzakelijk is.
Er is een systematisch literatuuronderzoek uitgevoerd naar de volgende vraag: Wat is bij mensen die leven met of na kanker en therapiegerelateerde cardiotoxiciteit (P) die een beweeginterventie krijgen (I), in vergelijking met mensen die geen beweeginterventie krijgen (C), het verschil in het aantal bijwerkingen (O)?
Op 19 maart 2021 is met relevante zoektermen een systematische zoekactie uitgevoerd naar gerandomiseerde gecontroleerde studies (RCT’s), systematische reviews en meta-analyses in onder meer de databases MEDLINE, Embase, Cochrane en PEDro. De verantwoording van de zoekactie is opgenomen in bijlage C.2-1 (opent in nieuw tabblad).

In de volgende tabel staan de selectiecriteria van de zoekactie.
Karakteristieken van de geïncludeerde studies
Op basis van titel en abstract zijn 60 artikelen geselecteerd waarvan de volledige tekst is beoordeeld. Uiteindelijk zijn twee gerandomiseerde studies geïncludeerd waarin de veiligheid van beweeginterventies bij patiënten met een verminderde cardiale belastbaarheid is onderzocht.
Jones (2014) beschrijft de veiligheid van een aerobe beweeginterventie bij patiënten met kanker en hartfalen. 90 patiënten met een gemiddelde leeftijd van 66 jaar werden gerandomiseerd naar een interventiegroep die een aerobe beweeginterventie kreeg of een controlegroep die standaardzorg kreeg. De beweeginterventie bestond uit drie gesuperviseerde groepssessies van 20 tot 45 minuten per sessie met een intensiteit van 60 tot 70% van de hartslagreserve (HRR) gedurende 12 weken. Daarnaast kregen de deelnemers het advies om vijf dagen per week 40 minuten fysiek actief te zijn met een hartslag van 60 tot 70% van de HRR. Tsai (2019) onderzocht de haalbaarheid van een beweeginterventie bij 25 patiënten tussen de 28 en 76 jaar oud. Deelnemers die gerandomiseerd waren in de interventiegroep konden kiezen tussen een gesuperviseerde beweeginterventie van 16 weken of een niet-gesuperviseerde beweeginterventie van 12 weken. De beweeginterventie bestond in beide gevallen uit drie keer per week duurtraining van 30 minuten per sessie, met een Borgscore van 12.
Door Jones (2014) werd een hogere incidentie van bijwerkingen gerapporteerd in de groep die deelnam aan de beweeginterventie in vergelijking met de groep die standaardzorg kreeg (45% vs. 23%; p = 0,046) in de twee jaar volgend op de interventie. Dit verschil werd veroorzaakt door een hogere incidentie van verergering van hartfalen en ernstige aritmie. Post-hocanalyses suggereren dat patiënten die niet in staat waren om de beweeginterventie vol te houden, een verhoogd risico hebben op ziekenhuisopnames of overlijden in de twee jaar na de interventie. In de studie van Tsai (2019) werden twee bijwerkingen gedocumenteerd die gerelateerd werden aan de beweeginterventie. Bij één deelnemer werden premature ventriculaire contracties geobserveerd tijdens inspanning. Na herevaluatie kreeg de deelnemer toestemming om door te gaan met de beweeginterventie. Een tweede deelnemer ervaarde ernstige vermoeidheid tijdens minimale inspanning. Na onderzoek door de cardioloog kreeg ook deze deelnemer toestemming om de beweeginterventie te hervatten en de deelnemer rapporteerde daarna geen ernstige vermoeidheid meer. In beide studies werd geconcludeerd dat een aerobe beweeginterventie veilig is voor patiënten met behandelingsgerelateerd hartfalen. Jones (2014) rapporteerde hierbij dat een beweeginterventie met name veilig is voor patiënten die in staat zijn om de interventie vol te houden.
Individuele studiekwaliteit
De opzet en uitvoering van de gerandomiseerde studies is beoordeeld met behulp van de risk-of-bias (RoB) tool van de Cochrane Collaboration. De beoordeling van de RoB van de individuele studies is opgenomen als bijlage C.2-2 (opent in nieuw tabblad).
Kwaliteit van de gevonden literatuur
De kwaliteit van de studieopzet en de uitvoering van de studie is met twee niveaus verlaagd in verband met de beperkte kwaliteit van de verzamelde data. In een van de studies mochten patiënten die gerandomiseerd waren in de interventiegroep zelf kiezen tussen een gesuperviseerde of niet-gesuperviseerde interventie. Daarnaast werden de bijwerkingen gemonitord op basis van zelfrapportage van de deelnemers en waren de deelnemers zelf op de hoogte van de groep waarnaartoe ze gerandomiseerd waren. In dit geval kan het niet blinderen tot een over- of onderschatting van bijwerkingen hebben geleid. Tussen de twee studies die zijn besproken, bestaat heterogeniteit in de aard van de bijwerkingen die zijn gerapporteerd en in beide gevallen betreft het kleine studies. Er is daarom afgewaardeerd voor inconsistentie en imprecisie. De kwaliteit van het bewijs wordt als zeer laag beoordeeld. Zie voor het GRADE-evidenceprofiel de volgende tabel.
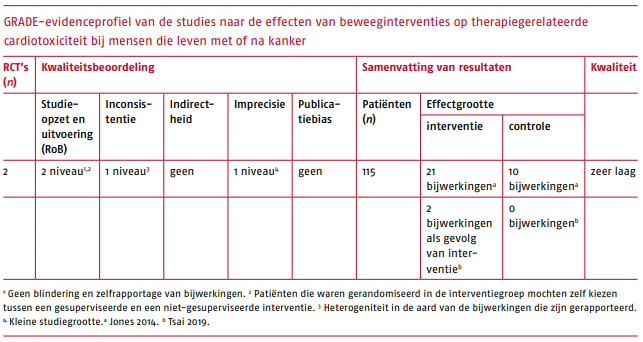
Conclusies op basis van de literatuur
Een aerobe beweeginterventie bij patiënten met therapiegerelateerde cardiotoxiciteit brengt mogelijk een verhoogd risico op bijwerkingen met zich mee. Op basis van de zeer lage kwaliteit van de gevonden literatuur kan er geen uitspraak worden gedaan over de veiligheid van beweeginterventies bij patiënten met cardiotoxiciteit.
Overwegingen
De aanbevelingen worden niet alleen bepaald door bevindingen in de literatuur. Ook andere overwegingen spelen daarbij een rol. De overwegingen betroffen:
Gewenste effecten: Aerobe training bij mensen die leven met of na kanker en die een verminderde cardiale belastbaarheid hebben, kan mogelijk veilig worden uitgevoerd, met name door patiënten die in staat zijn om een beweeginterventie vol te houden.
Ongewenste effecten: Een aerobe beweeginterventie bij mensen die leven met of na kanker en therapiegerelateerde cardiotoxiciteit brengt mogelijk verhoogde risico’s op cardiovasculaire voorvallen met zich mee. Het is niet duidelijk of bijwerkingen ontstaan als gevolg van de beweeginterventie.
Kwaliteit gewenste effecten: De bewijskracht is zeer laag.
Balans tussen gewenste en ongewenste effecten: De balans tussen de gewenste en ongewenste effecten is op basis van de wetenschappelijke evidentie niet goed te beoordelen. Voorzichtigheid is geboden bij het aanbieden van een beweeginterventie.
Waarde aan gewenste effecten: De therapeut bespreekt de inzet van een interventie met de patiënt, waarbij in gezamenlijkheid met de patiënt aan de orde komt wat de risico’s van de beweeginterventie zijn en welke winst die deze interventie kan opleveren.
Variatie in waarde aan gewenste effecten: De verwachte gewenste effecten zijn afhankelijk van de inspanningstolerantie en verwachtingen van de patiënt, de risico-inventarisatie en de haalbaarheid van de interventie.
Benodigde middelen (kosten): Een CPET kan van toegevoegde waarde zijn bij de risico-inventarisatie of indien geen vooruitgang wordt geboekt en er zorgen zijn over de belastbaarheid van de patiënt. De aanvraag voor een CPET vindt plaats in samenspraak met de (huis)arts. In wetenschappelijk onderzoek heeft een CPET bij patiënten met kanker die zijn gediagnosticeerd met hartfalen, het risico op eventuele bijwerkingen niet volledig kunnen afdekken.
Variatie in benodigde middelen (kosten): Een CPET brengt extra kosten met zich mee. Afhankelijk van de risico-inventarisatie bij de individuele patiënt zal overwogen moeten worden of een CPET van toegevoegde waarde is.
Kosteneffectiviteit: Studies naar kosteneffectiviteit zijn niet gevonden.
Aanvaardbaarheid De therapeut bespreekt het risico op eventuele bijwerkingen met de patiënt en bespreekt ook dat het achterwege laten van training het cardiovasculair risicoprofiel niet verbetert.
Haalbaarheid: De haalbaarheid van de gewenste effecten voor de patiënt hangt af van de belastbaarheid van de patiënt en de risicobeoordeling op bijwerkingen.
Conclusie
De werkgroep besluit therapie aan te bevelen mits valsalvamanoeuvres worden vermeden. Daarnaast dient op basis van risicofactoren en overleg met de behandelend arts, beoordeeld te worden of een maximale inspanningstest met ECG aangevraagd moet worden om te bepalen of fysieke training veilig gegeven kan worden.
Meetinstrumenten
Door de Europese Vereniging voor Cardiologie (ESC) wordt echocardiografie geadviseerd voorafgaand aan hoogintensieve fysieke activiteit bij patiënten die behandeld zijn met cardiotoxische medicatie. Het diagnosticeren van cardiale toxiciteit en linkerventrikeldisfunctie is een taak van de cardioloog of oncoloog. Metingen van de linkerventrikel-ejectiefractie worden meestal gebruikt om de hartfunctie te beoordelen bij patiënten die chemo- of radiotherapie hebben gekregen. Echocardiografische bepalingen zijn echter gevoeliger voor de detectie van ventriculaire disfunctie.
De fysio- of oefentherapeut kan overleggen met de behandelend arts over de aanvraag van een maximale inspanningstest bij patiënten met beperkte fysieke capaciteit. De fysieke capaciteit kan bepaald worden met behulp van een Zes Minuten Wandel Test (6MWT) zoals toegelicht in de KNGF-richtlijn COPD (KNGF 2020). De resultaten van de maximale inspanningstest kunnen gebruikt worden om te bepalen of fysieke training veilig gegeven kan worden, voor het identificeren van limiterende factoren en voor het maken van een weloverwogen keuze tussen therapievormen en de intensiteit van de fysieke training (Campbell 2019).
Het evidence-to-decisionformulier voor het toepassen van meetinstrumenten bij cardiotoxiciteit is opgenomen als bijlage C.2-3 (opent in nieuw tabblad).
- Campbell KL, Winters-Stone KM, Wiskemann J, May AM, Schwartz AL, Courneya KS, Zucker DS, Matthews CE, Ligibel JA, Gerber LY, Morris GS, Patel AV, Hue TF, Perna FM, Schmitz KH. Exercise guidelines for cancer survivors: consensus statement from international multidisciplinary roundtable. Med Sci Sports Exerc. 2019;51(11):2375-90.
- Gilchrist SC, Barac A, Ades PA, Alfano CM, Franklin BA, Jones LW, La Gerche A, Ligibel JA, Lopez G, Madan K, Oeffinger KC, Salamone J, Scott JM, Squires RW, Thomas RJ, Treat-Jacobson DJ, Wright JS. Cardio-oncology rehabilitation to manage cardiovascular outcomes in cancer patients and survivors: a scientific statement from the American Heart Association. Circulation. 2019;139:997-1012.
- Henning RJ, Harbison RD. Cardio-oncology: cardiovascular complications of cancer therapy. Future Cardiol. 2017;13(4):379-96.
- Jones LW, Pamela SD, Michel GK, Mackey JR, Wojdyla D, Kraus WE, Whellan DJ, O’Connor CM. Safety and efficacy of aerobic training in patients with cancer who have heart failure: An Analysis of the HF-ACTION Randomized Trial. J Clin Oncol. 2014;32(23):2496-502.
- Pelliccia A, Sharma S, Gati S, Bäck M, Börjesson M, Caselli S, Collet JP, Corrado D, Drezner JA, Halle M, Hansen D, Heidbuchel H, Myers J, Niebauer J, Papadakis M, Piepoli MF, Prescott E, Roos- Hesselink JW, Stuart AG, Taylor RS, Thompson PD, Tiberi M, Vanhees L, Wilhelm M. 2020 ESC Guidelines on sports cardiology and exercise in patients with cardiovascular disease. Europ Heart J. 2021;42:17-96.
- Riebe D, Ehrman JK, Liguori G, Magal M. ACSM’s Guidelines for exercise testing and prescription. 10e druk . Philadelphia, PA: Wolters Kluwer; 2018.
- Riebe D, Franklin BA, Thompson PD, Garber CE, Whitfield GP, Magal M, Pescatello LS. Updating ACSM’s recommendations for exercise preparticipation health screening. Med Sci Sports Exerc. 2015;47(11):2473-9.
- Sase K, Kida K, Furukawa Y. Cardio-Oncology rehabilitation – challenges and opportunities to improve cardiovascular outcomes in cancer patients and survivors. J Cardiol. 2020. 76(6):559-67.
- Tsai E, Mouhayar E, Lenihan D, Song J, Durand JB, Fadol A, Massey M, Harrison C, Basen-Engquist K. Feasibility and outcomes of an exercise intervention for chemotherapy-induced heart failure. J Cardiopulm Rehabil. 2019;39(3):199-203.
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF). KNGF-richtlijn COPD. Amersfoort: KNGF; 2020.
- Zamorano JL, Lancellotti P, Rodriguez Muñoz D, Aboyans V, Asteggiano R, Galderisi M, Habib G, Lenihan DJ, Lip GY, Lyon AR, Lopez Fernandez T, Mohty D, Piepoli MF, Tamargo J, Torbicki A, Suter TM, Zamorano JL, Aboyans V, Achenbach S, Agewall S, Badimon L, Barón-Esquivias G, Baumgartner H, Bax JJ, Bueno H, Carerj S, Dean V, Erol Ç, Fitzsimons D, Gaemperli O, Kirchhof P, Kolh P, Lancellotti P, Lip GY, Nihoyannopoulos P, Piepoli MF, Ponikowski P, Roffi M, Torbicki A, Vaz Carneiro A, Windecker S; Authors/Task Force Members; ESC Committee for Practice Guidelines (CPG); Document Reviewers. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur J Heart Fail. 2017;19(1):9-42.
C.3 Chemotherapie-geïnduceerde perifere neuropathie (CIPN)
Aanbevelingen
Wees bij patiënten met risico op het ontwikkelen van CIPN alert op signalen van neuropathie indien deze nog niet eerder opgemerkt zijn. Deze signalen zijn opgenomen in het volgende kader.
Symptomen van chemotherapie-geïnduceerde perifere neuropathie (CIPN) (Bron: Scheel, 2014)
- Tintelingen en prikkelingen
- Vreemd gevoel aan de handen en voeten
- Verstoorde tastzin
- Verminderd pijngevoel of pijnscheuten
- Verminderde temperatuurgevoeligheid
- Gevoelloosheid
- Zwakte of verminderde spierkracht of -functie
- Problemen in de coördinatie
Adviseer patiënten met (verandering in) neuropathieklachten deze klachten te bespreken met de medisch-oncoloog of huisarts.
Overweeg een beweeginterventie aan te bieden bij patiënten met CIPN, bij voorkeur zo vroeg mogelijk na het ontstaan van de klachten.
Overweeg aanpassingen in de beweeginterventie op grond van klachten van de individuele patiënt met CIPN, voor zover deze aanpassingen nodig zijn voor het veilig en effectief kunnen uitvoeren van het beoogde oefenprogramma.
Gebruik de ‘Timed Up & Go’ (TUG) test of de ‘Fullerton Advanced Balance (FAB) scale’ voor het in kaart brengen van de functionele mobiliteit en het valrisico bij patiënten met CIPN die aangeven balansproblemen te ervaren of bij wie je balansproblemen vermoedt.
Stimuleer en motiveer de patiënt met CIPN om het lichaamsdeel waarin de neuropathie zich manifesteert te bewegen.
Overweeg een interventie die is gericht op gedragsverandering of pijneducatie (eventueel door een daarin gespecialiseerde therapeut) bij patiënten met CIPN die beperkt worden door pijn of ongemak.
Bied de patiënt met CIPN begeleiding aan die is gericht op het verminderen of voorkomen van bewegingsangst.
Onderbouwing
Aanleiding
De behandeling met chemotherapie kan resulteren in centraal (hersenen, hersenstam en ruggenmerg) of perifeer (zenuwen die vanaf het ruggenmerg naar de ledematen lopen) zenuwletsel. Chemotherapie-geïnduceerde perifere neuropathie (CIPN) is een bijwerking van behandeling met geneesmiddelen, zoals platinaderivaten, taxanen, vinca-alkaloïden, thalidomide en bortezomib. CIPN is het gevolg van schade aan perifere zenuwen en veroorzaakt symptomen van gevoelloosheid, tintelingen en/of pijn in handen en/of voeten. Het veroorzaakt daarnaast afname van spierfunctie en problemen in de coördinatie, die een negatief effect hebben op de proprioceptie en controle van de lichaamshouding. Deze leiden op hun beurt tot een vermindering van de kwaliteit van leven, een verhoogd valrisico en vermindering van het fysiek functioneren. CIPN doet zich voor bij 20 tot 95% van de patiënten met kanker, afhankelijk van het type chemotherapie, demografische kenmerken van de patiënt en comorbide aandoeningen, en kan na afloop van de behandeling nog jarenlang aanhouden.
Een beweeginterventie vermindert mogelijk de klachten van CIPN. Bij het toepassen van een beweeginterventie is het belangrijk dat therapeuten rekening houden met sensorische en motorische beperkingen en passende veiligheidsmaatregelen nemen. Het formuleren van aanbevelingen kan therapeuten ondersteunen bij het veilig toepassen van effectieve beweeginterventies in aanwezigheid van CIPN.
Uitgangsvraag
Hoe dient een beweeginterventie aangepast te worden bij patiënten met CIPN?
Literatuur
Beweeginterventies voor CIPN blijken effectief en veilig te zijn voor patiënten die reeds klachten ervaren. In meerdere studies is beschreven dat een beweeginterventie de kwaliteit van leven, kracht, balans, en de door CIPN veroorzaakte symptomen verbetert. De meest toegepaste interventies bestaan uit een combinatie van duur-, kracht- en balanstraining. De onderzochte beweeginterventies duurden 3 tot 36 weken, met 10 tot 60 minuten per sessie, verspreid over twee, drie, vijf of zeven dagen per week op lage tot hoge intensiteit. De oefeningen werden gesuperviseerd of niet-gesuperviseerd uitgevoerd. Op basis van de wetenschappelijke evidentie is het moeilijk om concrete aanbevelingen te formuleren over FITT-factoren vanwege variabiliteit in de interventieduur en -structuur en het type oefeningen dat werd toegepast.
Omdat de verschillende type interventies niet rechtstreeks met elkaar vergeleken zijn binnen een enkele studie is het niet mogelijk om op basis van de wetenschappelijke literatuur een definitieve conclusie te trekken over de meest effectieve beweeginterventie bij patiënten met CIPN. Op grond van de beschikbare wetenschappelijke evidentie lijkt het in algemene zin niet noodzakelijk om aanpassingen te doen aan een beweeginterventie bij patiënten met CIPN.
Overwegingen
In de praktijk komen patiënten vaak niet met een hulpvraag die primair gericht is op het terugdringen van de neuropathie. Overwegingen ten aanzien van CIPN doen zich dus vooral voor waar deze klachten de fysio- of oefentherapeutische behandeling en/of diagnostiek (mogelijk) beïnvloeden. Omdat in de literatuur geen systematische aanpassingen zijn gerapporteerd in interventiestudies naar bewegen bij CIPN, lijkt er geen algemeen geldige noodzaak te zijn voor dergelijke aanpassingen. De therapeut past de beweeginterventie dan ook aan op geleide van de symptomen en klachten van de individuele patiënt en voor zover aanpassingen nodig zijn om het beoogde oefenprogramma veilig en effectief te kunnen uitvoeren. De begeleiding van patiënten met CIPN verschilt dus van patiënt tot patiënt. Goede begeleiding en uitleg over de uitvoering van de diverse oefeningen zijn belangrijk. De therapeut geeft altijd individuele begeleiding alvorens de patiënt eventueel op groepstraining te laten overstappen.
Het is van belang dat de patiënt uitgelegd krijgt dat het primaire doel van de beweeginterventie niet het verminderen van de klachten is. Dit voorkomt verkeerde verwachtingen. In de communicatie met de patiënt is het ook belangrijk om duidelijk te zijn over mogelijke effecten van de beweeginterventie op symptomen of functionele status. Een beweeginterventie wordt in de praktijk namelijk niet ingezet om symptomen van neuropathie te verminderen. Wel laat de wetenschappelijke literatuur overwegend positieve effecten zien op kwaliteit van leven, kracht, balans, en de functionele status. Daarom is het belangrijk om steeds te overwegen of het wenselijk is een beweeginterventie in te zetten voor het optimaliseren van het beweegpatroon en de balans.
Beweeginterventies bij patiënten met CIPN geven geen verhoogd risico op bijwerkingen in vergelijking met geen beweeginterventie, mits de beweeginterventie is aangepast aan de verminderde sensibiliteit en/of kracht van de patiënt. De therapeut laat zich zo min mogelijk leiden door beperkingen van de patiënt, maar moet zich er wel van bewust zijn dat bepaalde oefeningen leiden tot een verhoogd risico op bijvoorbeeld balansverstoringen. Zoveel mogelijk ADL-gericht aanbieden van de oefeningen optimaliseert de overdracht van effecten naar het dagelijks leven.
Een beweeginterventie onthouden aan een patiënt met CIPN kan indirect tot schade leiden. Zo kan bewegingsangst ten gevolge van CIPN het valrisico vergroten en de mobiliteit verlagen.
Communicatie tussen betrokken zorgverleners is belangrijk in verband met vroegsignalering van CIPN; de therapeut kan hiermee bijdragen aan het monitoren van toxiciteit.
Het is belangrijk dat de therapeut alert is op signalen van neuropathieklachten (Scheel 2014):
- tintelingen en prikkelingen;
- vreemd gevoel aan de handen en voeten;
- verstoorde tastzin;
- verminderd pijngevoel of pijnscheuten;
- verminderde temperatuurgevoeligheid;
- gevoelloosheid;
- zwakte of verminderde spierkracht of -functie;
- problemen in de coördinatie.
Daarnaast kan met een vroege start van een beweeginterventie bewegingsangst worden voorkomen. Waar nodig kan de therapeut samenwerking zoeken met de ergotherapeut indien er zich problemen voordoen in het dagelijks functioneren. Als de patiënt pijn heeft tijdens het lopen kan de therapeut samenwerking zoeken met een podotherapeut voor aanpassing van het schoeisel.
Zoekactie
Om de uitgangsvraag te beantwoorden is een systematisch literatuuronderzoek uitgevoerd naar de volgende vraag: Wat is bij mensen die leven met of na kanker en chemotherapie-geïnduceerde perifere neuropathie (P) die een beweeginterventie krijgen (I), in vergelijking met mensen die geen beweeginterventie krijgen (C), het verschil in incidenten (O)?
Op 19 maart 2021 is met relevante zoektermen een systematische zoekactie uitgevoerd in de databases MEDLINE, Embase, Cochrane en PEDro. De verantwoording van de zoekactie is opgenomen in bijlage C.3-1 (opent in nieuw tabblad).

In de volgende tabel staan de selectiecriteria van de zoekactie.
Karakteristieken van de geïncludeerde studies
Op basis van titel en abstract zijn 41 artikelen geselecteerd waarvan de volledige tekst is beoordeeld. Er zijn geen studies gevonden die specifieke aanpassingen bij CIPN hebben onderzocht op noodzakelijkheid of effectiviteit. Uiteindelijk is één systematische review geïncludeerd (Tanay 2021). Daarin is de meest recente literatuur opgenomen over de haalbaarheid van beweeginterventies en interventies die zijn gericht op gedragsverandering bij patiënten met CIPN. De doelstellingen van de review waren onder andere: het bewijs te beoordelen van gedrags- en beweeginterventies gericht op het beperken van CIPN-symptomen, de componenten te bepalen van een interventie en samen te vatten wat de effectiviteit is van interventies op het verminderen van CIPN-symptomen en het verbeteren van de kwaliteit van leven, de balans en de spierkracht. Door middel van een systematische zoekstrategie werden artikelen geïdentificeerd die gepubliceerd waren tussen januari 2000 en mei 2020. Er werden acht gerandomiseerde, vier pre-/posttestdesign-studies en één quasi-experimentele studie geïncludeerd, met in totaal 743 deelnemers (64% was gediagnosticeerd met borstkanker). Op basis van de gegevens van vier studies varieerde de leeftijd van de deelnemers tussen 19 en 82 jaar. Alle studies onderzochten het effect van een beweeginterventie: vier na afloop van de behandeling van kanker, zes studies tijdens de behandeling ervan en drie studies zowel tijdens als na de behandeling.
1. Beweeginterventies
De beweeginterventies in het onderzoek van Tanay (2021) waren allemaal ontwikkeld op basis van wetenschappelijk bewijs en richtlijnen van de ‘American College of Sports Medicine’, en waren afgestemd op patiënten met neuropathie en kanker of op ouderen met balansproblemen. Ze duurden drie tot 36 weken, en werden twee, drie of vijf keer per week gegeven. De duur van een sessie was 10 tot 60 minuten en de intensiteit varieerde van laag- tot matig-intensief. Sommige beweeginterventies bestonden uit één type training, andere uit een combinatie van duurtraining, krachttraining, balans- en flexibiliteitsoefeningen. Ook werd gebruikgemaakt van loopbanden, fietsergometers en crosstrainers, balanskussens, losse gewichten en oefenmatten. Vijf studies onderzochten een volledig niet-gesuperviseerde interventie, zeven studies een volledig gesuperviseerde interventie en één studie een combinatie van niet-gesuperviseerde en gesuperviseerde beweegsessies.
Geen van de geïncludeerde studies beschreef specifieke aanpassingen bij CIPN. Er werden geen ongunstige bijwerkingen van de beweeginterventie gerapporteerd. Redenen voor het niet naleven of voltooien van de beweeginterventie waren: gebrek aan motivatie, te druk om trainingsdoelen te halen, niet aan neuropathie gerelateerde evenwichtsproblemen, geen baat hebben bij de interventie, vervoersproblemen, een medisch voorval (niet gerelateerd aan de beweeginterventie) of mentaal-emotionele problemen. Tanay (2021) beschrijft dat het moeilijk is om de haalbaarheid van beweeginterventies te beoordelen vanwege variabiliteit in de interventieduur, de structuur van de interventie en het type oefeningen. Bovendien zijn de verschillende typen interventies niet rechtstreeks met elkaar vergeleken binnen een enkele studie. Dit maakt het problematisch om een interventie te selecteren die therapeuten aan patiënten met CIPN kunnen aanbevelen.
2. Gedragsinterventies
Interventies die de kennis van de patiënt over CIPN vergroten, zelfmanagementvaardigheden verbeteren en de toegang tot symptoommanagement mogelijk maken, leiden tot minder klachten van CIPN (Tanay 2021). Dergelijke gedragsgeoriënteerde strategieën moeten onderdelen bevatten die de kennis van patiënten vergroot en hen aanmoedigt om hun gedrag en de manier waarop ze denken of emotioneel reageren op hun symptomen te veranderen. ‘Motivational interviewing’, ‘goal setting’, ‘action statements’, trainingsdagboeken en/of het inzetten van beweegmonitors zijn bewezen effectieve manieren om een hogere therapietrouw te bereiken bij beweeginterventies.
3. Effectiviteit van beweeginterventies bij CIPN
Bij een systematische zoekactie ten behoeve van deze richtlijn zijn op 19 maart 2021 15 systematische reviews geïdentificeerd waarin de effectiviteit van beweeginterventies op CIPN-klachten was beschreven. Omdat er veel overlap bestaat tussen de wetenschappelijke evidentie in deze reviews onderling is ervoor gekozen om de evidentie te beschrijven van de drie meest recent gepubliceerde systematische reviews (Kanzawe-Lee 2020; Lin 2021; Tanay 2021).
Met de zoekstrategie van Kanzawe-Lee (2020) in april 2019 zijn 13 studies geïncludeerd waarvan zeven gerandomiseerde en zes quasi-experimentele studies. Zeven van deze studies zijn ook beschreven in de studie van Tanay (2021). Het aantal deelnemers in deze 13 studies varieerde van 21 tot 355 met een gemiddelde leeftijd van 56 jaar (variërend van 18 tot 81 jaar). De oncologische behandeling bestond uit platinaderivaten, taxanen of een combinatie van verschillende typen chemotherapie. In negen studies waren de deelnemers nog onder behandeling; in vier studies was de behandeling inmiddels afgerond. De interventies bestonden uit yoga, duurtraining, krachttraining, balanstraining of een combinatie van verschillende interventietypen. De beweeginterventies varieerden van 23 tot 210 min/week, op één tot zeven dagen per week gedurende 3 tot 36 weken op een matig-tot-hoge intensiteit (50-80% van de hartslagreserve, 40-75% van de VO2piek of Borgscore 13-15). Balanstraining bestond voornamelijk uit vier oefeningen gedurende 15 tot 30 seconden die twee tot drie keer werden herhaald. De studies die ook door Tanay (2021) werden geïncludeerd, zijn hiervoor al beschreven.
In drie observationele studies werd een significante verbetering in CIPN-symptomen beschreven als deze symptomen werden gemeten met ‘Total Neuropathy Score’ (TNS) en de ‘Total Neuropathy Score-clinical version’ (TNSc). Het betrof een geïndividualiseerde beweeginterventie van acht weken op drie dagen per week, met balans-, kracht- en duurtraining van 1 uur per sessie, een beweeginterventie van drie weken bestaande uit 15 sessies met de focus op balansoefeningen, en een tweewekelijkse beweeginterventie met kracht- en balansoefeningen van 60 minuten per sessie gedurende 12 weken.
In de gerandomiseerde studies werden uiteenlopende effecten gevonden: twee studies rapporteerden een significante vermindering in CIPN-klachten in de interventiegroep, maar niet in de controlegroep na een niet-gesuperviseerde beweeginterventie van gecombineerde duur- en krachttraining op matige intensiteit van zes weken (355 deelnemers, allen gediagnosticeerd met borstkanker) of een gesuperviseerde beweeginterventie van kracht-, duur- en sensomotorische training op twee dagen per week gedurende 36 weken (61 deelnemers, allen gediagnosticeerd met lymfeklierkanker). In twee andere studies werd geen significant verschil tussen de interventie- en de controlegroep gerapporteerd. Deze interventies bestonden uit tweewekelijkse balansoefeningen van 45 minuten per sessie gedurende vier weken (22 deelnemers, allen gediagnosticeerd met verschillende typen kanker) of een geïndividualiseerde balans- en duurtraining op twee dagen per week gedurende 12 weken (37 deelnemers, allen gediagnosticeerd met darmkanker). Eén studie rapporteerde stabiele klachten van CIPN als gevolg van een tweewekelijkse beweeginterventie van balans- en krachttraining van acht weken, maar een significante achteruitgang in klachten in de controlegroep (30 deelnemers, allen gediagnosticeerd met darmkanker). Door Kanzawe-Lee (2020) werden in totaal negen studies beschreven met een significant positief effect op CIPN-klachten; zes van deze studies werden ook geïncludeerd in de review die Tanay (2021) uitvoerde.
Tanay (2021) rapporteerde dat in negen studies met een beweeginterventie met componenten die waren gericht op het verbeteren van de balans, een statistisch-significante verbetering in de balansscores is gemeten met de Berg Balance Schaal (BBS), de ‘Fullerton Advanced Balance (FAB) scale’ of een andere balanstest. Deze bevindingen worden bevestigd in de review van Kanzawe-Lee (2020), waarin beschreven wordt dat in alle studies waarin balans is gemeten een positief effect is gerapporteerd in de interventiegroep ten opzichte van de controlegroep (6 studies). Tanay (2021) beschrijft dat vijf van de acht studies een significante verbetering rapporteerden in kwaliteit van leven na een beweeginterventie. In de review van Kanzawe-Lee (2020) zijn dit vier van de acht studies. Zowel Tanay (2021) als Kanzawe-Lee (2020) beschrijft dat beweeginterventies kunnen leiden tot verbeteringen in balans, fysiek functioneren en symptomen van CIPN bij volwassenen met CIPN; het bewijs is echter beperkt in aantal en kwaliteit. Verder lopen de huidige onderzoeken te ver uiteen om te kunnen achterhalen wat de meest effectieve trainingsvoorschriften zijn ter verbetering van CIPN-klachten en de kwaliteit van leven.
Door Lin (2021) is een systematische review gepubliceerd waarin de effecten van vijf studies zijn gecombineerd in een meta-analyse. Deze meta-analyse bleek echter onjuist uitgevoerd en de resultaten zijn dan ook niet in deze richtlijn meegenomen.
Samenvoeging van de resultaten
Om een indruk te krijgen van de grootte van de effecten van beweeginterventies op CIPN-symptomen en functionele balans is een poging gedaan de effecten van gerandomiseerde studies samen te voegen. In totaal zijn 11 gerandomiseerde studies geïdentificeerd waarin het effect van een beweeginterventie is vergeleken met een controlebehandeling zonder beweeginterventie. In deze studies zijn verschillende typen interventies onderzocht (duurtraining, krachttraining, balansoefeningen, sensorimotortraining en zenuwglijden) en zijn de uitkomsten met verschillende maten gemeten. Door deze heterogeniteit en het ontbreken van geschikte data in veel gepubliceerde artikelen heeft de projectgroep besloten de effecten niet samen te voegen. Een overzicht van de studies en de gevonden uitkomsten zijn te vinden in bijlage C.3-2 (opent in nieuw tabblad).
Individuele studiekwaliteit (RoB)
De opzet en uitvoering van de individuele studies zijn in het systematisch literatuuronderzoek van Tanay (2021) beoordeeld aan de hand van de criteria van de ‘Effective Public Health Practice Project’ (EPHPP) kwaliteitsbeoordelingstool. Voor de beoordeling van de studies die zijn geïncludeerd in de review van Kanzawe-Lee (2020) is de ‘Consolidated Standards of Reporting Trials (CONSORT) extension checklist’ gebruikt. De RoB-tabel voor de beoordeling van de individuele studies is opgenomen als bijlage C.3-3 (opent in nieuw tabblad) en bijlage C.3-4 (opent in nieuw tabblad).
De geïncludeerde reviews geven beperkte informatie over de grootte van het effect op verschillende uitkomstmaten en beperken zich grotendeels tot rapportage van de statistische significantie van de uitkomsten. De klinische relevantie van de bevindingen laat zich daarom moeilijk beoordelen.
Kwaliteit van de gevonden literatuur
Het bewijs is gebaseerd op zowel gerandomiseerde studies als observationele studies, waardoor een lage kwaliteit van bewijs als uitgangspunt wordt genomen. De kwaliteit van de studieopzet en uitvoering is met twee niveaus verlaagd vanwege de lage tot matige kwaliteit van de individuele studies. Er bestaat heterogeniteit in de onderzochte interventie ,tussen de verschillende studies en de gerapporteerde uitkomstmaten. Op grond daarvan is de kwaliteit ten aanzien van inconsistentie met één niveau verlaagd. De kwaliteit van het bewijs wordt als zeer laag beoordeeld.
Het GRADE-evidenceprofiel van de studies naar de effecten van beweeginterventies bij mensen die leven met en na kanker met CIPN, is opgenomen in de volgende tabel.

Conclusies op basis van de literatuur
Door de zeer lage kwaliteit van de gevonden literatuur kan er geen conclusie getrokken worden over aanpassingen die nodig zijn bij het aanbieden van een beweeginterventie aan mensen die leven met of na kanker en met CIPN. De resultaten lijken erop te wijzen dat beweeginterventies zonder specifieke aanpassingen haalbaar zijn. Door heterogeniteit in de verschillende typen interventie en uitkomstmaten is het niet mogelijk om op basis van de wetenschappelijke literatuur een definitieve conclusie te trekken over wat de meest effectieve beweeginterventie is voor patiënten met CIPN.
Overwegingen
De aanbevelingen worden niet alleen bepaald door bevindingen in de literatuur. Ook andere overwegingen spelen daarbij een rol. De overwegingen betroffen:
Gewenste effecten: Vanuit de literatuur zijn significant positieve effecten gerapporteerd van een beweeginterventie op CIPN-symptomen, hoewel klinische duiding moeilijk is door het ontbreken van een effectschatting.
Ongewenste effecten: Er zijn geen ongewenste bijwerkingen van beweeginterventies gerapporteerd bij patiënten met CIPN.
Kwaliteit gewenste effecten: Het bewijs is van zeer lage kwaliteit.
Balans tussen gewenste en ongewenste effecten: Aangezien er geen ongewenste effecten gerapporteerd zijn, overtreffen de gewenste effecten van de interventie de ongewenste effecten.
Waarde aan gewenste effecten: In verband met het welbevinden van de patiënt is het belangrijk de conditie en manier van bewegen van patiënten te verbeteren. Uit klinische ervaring van de werkgroepleden en hun achterban komt een beeld naar voren dat patiënten met CIPN bewegingsangst kunnen ontwikkelen en een hoger valrisico hebben. Vermijdingsgedrag kan leiden tot afname van activiteit of tot inactiviteit. Dit heeft negatieve consequenties voor de gezondheid in het algemeen en de functies van het bewegingsapparaat in het bijzonder. De literatuur ondersteunt de meerwaarde van interventies gericht op zelfmanagement. De benoemde interventies (zoals ‘goal setting’, activiteitenmonitoring, omgaan met symptomen) maken doorgaans onderdeel uit van een beweeginterventie, en de fysio- of oefentherapeut kan daarmee een rol spelen in het verbeteren van het zelfmanagement bij CIPN.
Variatie in waarde aan gewenste effecten: In de praktijk komen patiënten vaak niet bij de fysio- of oefentherapeut met een primaire hulpvraag die gaat over de neuropathie. In de meeste gevallen zal de patiënt ook andere klachten ervaren, welke tot variatie in de gewenste effecten kunnen leiden.
Benodigde middelen (kosten): Omdat er geen specifieke aanpassingen aan de orde zijn, zijn er geen extra kosten verbonden aan de interventie.
Variatie in benodigde middelen (kosten): Niet van toepassing.
Kosteneffectiviteit: Er is geen evidentie beschikbaar over de kosteneffectiviteit van een beweeginterventie bij patiënten met CIPN. Beweeginterventies tijdens chemotherapie onder begeleiding van een fysiotherapeut zijn mogelijk kosteneffectief, afhankelijk van de ‘willingness to pay’ en het oordeel over de ziektelast vanuit maatschappelijk perspectief (Van Waart 2017). De kosten vanuit het perspectief van de gezondheidszorg zijn beperkt en zeer laag in vergelijking met de totale kosten van de gezondheidszorg voor mensen met kanker.
Aanvaardbaarheid: Beweeginterventies zijn aanvaardbaar voor therapeuten en patiënten met CIPN. Er zijn geen aanwijzingen van ongewenste bijwerkingen van beweeginterventies bij patiënten met CIPN.
Haalbaarheid: Beweeginterventies tijdens of na de behandeling van kanker worden al veelvuldig toegepast. Beweeginterventies bij patiënten met CIPN worden als haalbaar beschouwd.
Conclusie
De werkgroep besluit oefentherapie aan te bevelen indien er aanpassingen gemaakt worden in de beweeginterventie op grond van klachten van de individuele patiënt met CIPN, voor zover nodig om het beoogde oefenprogramma veilig en effectief te kunnen uitvoeren.
Meetinstrumenten
CIPN-klachten kunnen in kaart worden gebracht aan de hand van verschillende fysieke tests en vragenlijsten. Zo kunnen klachten aan de handen worden vastgesteld met behulp van de knijpkracht, of polsextensie/dorsaalflexiekracht door het manueel meten van spierkracht (Knoerl 2020). Omdat klachten zich als eerste uiten in de ledematen, is het onvermogen om weerstand te bieden bij matige tegendruk een aanwijzing voor significant krachtverlies, wat mogelijk kan duiden op CIPN. Objectieve functionele tests, zoals de ‘Timed Up and Go’ (TUG), kunnen gebuikt worden als meetinstrument voor het in kaart brengen van de functionele mobiliteit en het valrisico van patiënten met CIPN. Deze test heeft een hoge betrouwbaarheid, maar heeft als nadeel dat veel patiënten de maximale score behalen. Als er sprake is van een maximale score, of wanneer er behoefte bestaat om de problemen die de patiënt ervaart beter in kaart te brengen, kan de FAB-scale gebruikt worden. Dit meetinstrument heeft meerwaarde boven de BBS, omdat veel patiënten relatief goed functioneren. De FAB-scale heeft een hogere onderscheidende waarde. Bij een patiënt met een slechtere balans kan wél overwogen worden de BBS af te nemen.
De effecten van CIPN zijn ook terug te zien in het looppatroon. Patiënten lopen voorzichtiger, met langzamere en kleinere stappen. Aandacht voor de loopcapaciteit op langere afstanden en voor complicaties, zoals uitglijden, struikelen of vallen, is belangrijk, omdat problemen zich minder snel uiten bij het lopen van korte afstanden en in een gecontroleerde omgeving. De normwaarden van de Zes Minuten Wandeltest (6MWT) kunnen niet worden toegepast om een indruk te krijgen van het aeroob uithoudingsvermogen wanneer er sprake is van neuropathie in de voeten.
Verder kunnen sensorische en functionele klachten gemeten worden met behulp van vragenlijsten zoals de ‘Functional Assessment of Cancer Therapy/Gynecologic Oncology Group Neurotoxicity’ (FACT/GOG-Ntx) of de ‘European Organisation for Research and Treatment of Cancer Quality of Life Questionnaire-Chemotherapy’ (EORTC QLQ-CIPN20). De vragenlijsten bevatten vragen waarmee functionele problemen kunnen worden beoordeeld, zoals aankleden, lopen, oppakken en vasthouden van objecten. Uit onderzoek blijken de interne consistentie, betrouwbaarheid, responsiviteit en validiteit van deze vragenlijsten hoog.
Bij de selectie van meetinstrumenten is gewerkt volgens het stappenplan van het ‘Raamwerk Klinimetrie’ (KNGF 2016). Met het doorlopen van de acht stappen in het raamwerk wordt de keuze voor de meetinstrumenten verantwoord en wordt vervolgens onderscheid gemaakt tussen de aanbevolen en optionele meetinstrumenten.
Stap 1: Wat wil je meten?
In deze module worden parameters genoemd die tijdens het diagnostisch en therapeutisch proces bij patiënten met CIPN in kaart gebracht kunnen worden. Deze parameters kunnen worden geobjectiveerd tijdens de anamnese, ten behoeve van het stellen van doelen, het monitoren tijdens de interventie of ten behoeve van de (eind)evaluatie. Deze parameters vallen onder het ICF-domein ‘Activiteiten en participatie’/ ‘Functionele mobiliteit’ / ‘Valrisico’.
Stap 2: Waarom wil je meten?
De genoemde parameters in stap 1 kunnen met zowel een prognostisch, diagnostisch als evaluatief doel gemeten worden.
Stap 3: Met welk soort meetinstrument wil je meten?
Er is gezocht naar meetinstrumenten die geschikt zijn voor het objectiveren van beide parameters. Als vertrekpunt is gebruikgemaakt van het systematisch literatuuronderzoek dat is uitgevoerd door de ‘EDGE Task Force’, die in het leven is geroepen door de ‘American Physical Therapy Association’ voor advisering over klinimetrie bij mensen met kanker (Huang 2019).
Van de twee meetinstrumenten die sterk worden aanbevolen in deze review, is in het kader van deze richtlijn de ‘Fullerton Advanced Balance (FAB) scale’ geanalyseerd, omdat de FAB-scale in de Nederlandse fysio- en oefentherapiepraktijk al wordt gebruikt.
Van de drie meetinstrumenten die aanvullend door de ‘EGDE Task Force’ worden aanbevolen, is in het kader van deze richtlijn specifiek naar de ‘Timed Up & Go (TUG) test’ gekeken, omdat de TUG goed aansluit bij het diagnostisch doel en ook dit instrument al veel gebruikt wordt in de Nederlandse fysio- en oefentherapeutische praktijk.
Stap 4: Hoe vind je een meetinstrument?
De meetinstrumenten zijn beschikbaar via www.meetinstrumentenzorg.nl.
Stap 5: Wat is de hanteerbaarheid?
Fullerton Advanced Balance (FAB) scale: De FAB-scale bestaat uit 10 statische en dynamische activiteiten in verschillende situaties met als doel evenwichtsproblemen te identificeren. Wanneer beperkt tijd beschikbaar is of wanneer minder uitgebreide diagnostiek nodig is, is ook een korte versie beschikbaar bestaande uit de items 4 t/m 7.
De Airex®-matten: zullen aangeschaft moeten worden wanneer deze niet aanwezig zijn in de fysio- of oefentherapeutische praktijk, maar dit brengt geringe kosten met zich mee. Het afnemen van deze test duurt 10 tot 12 minuten.
Timed Up & Go (TUG) test: De TUG-test meet de tijd die de patiënt nodig heeft om op te staan uit een stoel, 3 meter comfortabel (energetisch meest efficiënt) te lopen, om te keren, weer terug te lopen en te gaan zitten. De patiënt mag zijn eigen loophulpmiddel en/of orthese gebruiken, maar er mag geen fysieke hulp of aanmoediging worden gegeven. De test is praktisch en simpel uit te voeren.
Stap 6: Wat is de klinimetrische kwaliteit?
Fullerton Advanced Balance (FAB) scale: De FAB-scale is betrouwbaar en valide en wordt sterk aanbevolen door de ‘EDGE Task Force’ (Huang 2019). De test heeft een hoge sensitiviteit (74,6%) en specificiteit (52,6%) (Hernandez 2008). De test-hertestbetrouwbaarheid is zeer hoog: 0,98 (Wampler 2007).
Timed Up & Go (TUG) test: De NICE-richtlijnen en de ‘EDGE Task Force’ raden een TUG-test aan voor het beoordelen van het lopen en de balans (Huang 2019; NICE 2013). Bij een normwaarde van 20 seconden is door Marschollek (2011) een sensitiviteit van 90% en een specificiteit van 22% gevonden. De TUG-test is vooral informatief voor een kwalitatieve beoordeling (NVKG, 2017).
Stap 7 en 8: Zijn er normwaarden beschikbaar en hoe bereken en interpreteer je de gegevens?
Fullerton Advanced Balance (FAB) scale:
Normgegevens (Hernandez 2008):
- Score ≤ 25: In 7 van de 10 gevallen loopt de patiënt risico op vallen.
Los van de scoring kan bij de uitvoer van elk onderdeel beoordeeld worden wat de kwaliteit van de uitvoering is van de gevraagde activiteit, om zicht te krijgen op welke componenten (functie, vaardigheid en zelfvertrouwen etc.) van functionele balans het meest problematisch zijn.
Timed Up & Go (TUG) test:
Normgegevens (Podsiadlo 1991):
- Score < 20 sec: De revalidant loopt zelfstandig en veilig.
- Score > 30 sec: Er is hulp bij het lopen noodzakelijk.
Het evidence-to-decisionformulier voor het toepassen van beweeginterventies bij CIPN is opgenomen als bijlage C.3-5 (opent in nieuw tabblad).
- Dhawan S, Andrews R, Kumar L, Wadhwa S, Shukla G. A randomized controlled trial to assess the effectiveness of muscle strengthening and balancing exercises on chemotherapy-induced peripheral neuropathic pain and quality of life among cancer patients. Cancer Nurs. 2020;43(4):269-80.
- Hernandez D, Rose DJ. Predicting which older adults will or will not fall using the Fullerton Advanced Balance scale. Arch Phys Med Rehabil. 2008;89(12):2309-15.
- Huang MH, Hile E, Croarkin E, Wampler-Kuhn M, Blackwood J, Colon G, Pfalzer LA. Academy of Oncologic Physical Therapy EDGE Task Force. Rehabil Oncol. 2019;37(3):92-103.
- Jordan B, Margulies A, Cardoso F, Cavaletti G, Haugnes HS, Jahn P, le Rhun E, Preusser M, Scotté F, Taphoorn MJB, Jordan K. Systematic anticancer therapy-induced peripheral and central neurotoxicity: ESMO-EONS-EANO clinical practice guidelines for diagnosis, prevention, treatment and follow-up. Ann Oncol. 2020. 31(10):1306-19.
- Jordan K, Feyer P, Höller U, Link H, Wörmann B, Jahn F. Supportive treatments for patients with cancer. Dtsch Arztebl Int. 2017;114(27-28):481-7.
- Kanzawa-Lee GA, Larson JL, Resnicow K, Lavoie-Smith EM. Exercise effects on chemotherapy-induced peripheral neuropathy: a comprehensive integrative review. Cancer Nurs. 2020. 43(3):172-85.
- Kleckner IR, Kamen C, Gewandter JS, Mohile NA, Heckler CE, Culakova E, Fung C, Janelsins MC, Asare M, Lin PJ, Reddy PS, Giguere J, Berenberg J, Kesler SR, Mustian KM. Effects of exercise during chemotherapy on chemotherapy-induced peripheral neuropathy: a multicenter, randomized controlled trial. Support Care Cancer. 2018;26(4):1019-28.
- Kneis S, Wehrle A, Müller J, Maurer C, Ihorst G, Gollhofer A, Bertz H. It’s never too late – balance and endurance training improves functional performance, quality of life, and alleviates neuropathic symptoms in cancer survivors suffering from chemotherapy-induced peripheral neuropathy: results of a randomized controlled trial. BMC Cancer. 2019;19(1):414.
- Knoerl R, Gilchrist L, Kanzawa-Lee GA, Donohoe C, Bridges C, Lavoie-Smith EM. Proactive rehabilitation for chemotherapy-induced peripheral neuropathy. Semin Oncol Nurs. 2020;36(1).
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF) / Zuyd Onderzoek Hogeschool. Toepassing van het ‘Raamwerk klinimetrie voor evidence based products’ om meetinstrumenten te ordenen in de KNGF-richtlijnen. Amersfoort/Heerlen: KNGF/Zuyd; 2016.
- Lin WL, Wang RH, Chou FH, Feng IJ, Fang CJ, Wang HH. The effects of exercise on chemotherapy- induced peripheral neuropathy symptoms in cancer patients: a systematic review and meta- analysis. Support Care Cancer. 2021;29(9):5303-11.
- Loprinzi CL, Lacchetti C, Bleeker J, Cavaletti G, Chauhan C, Hertz DL, Kelley MR, Lavino A, Lustberg MB, Paice JA, Schneider BP, Lavoie-Smith EM, Smith ML, Smith TJ, Wagner-Johnston N, Hershman DL. Prevention and management of chemotherapy-induced peripheral neuropathy in survivors of adult cancers: ASCO guideline update. J Clin Oncol. 2020. 38(28):3325-48.
- Marschollek M, Rehwald A, Wolf KH, Gietzelt M, zu Schwabedissen HM, Schulze M. Sensors vs. experts: A performance comparison of sensor-based fall risk assessment vs. conventional assessment in a sample of geriatric patients. BMC Med Inform Decis Mak. 2011;11:48-54.
- Nederlandse Vereniging voor Klinische Geriatrie. Richtlijn Preventie van valincidenten bij ouderen. NVKG; 2017. Geraadpleegd op 11 mei 2021. Beschikbaar via https://richtlijnendatabase.nl/
- NICE: The assessment and prevention of falls in older people. Geraadpleegd op 11 mei 2021. Beschikbaar via http://www.nice.org.uk/CG161.
- Podsiadlo D, Richardson S. The timed ‘Up & Go’: a test of basic functional mobility for frail elderly persons. J Am Geriatr Soc. 1991. 29(2):142-8.
- Scheel A, Beijers AJM, Mols F, Faber CG, Vreugdenhil G. Chemotherapie-geïnduceerde perifere neuropathie; invloed op kwaliteit van leven. Ned Tijdschr Geneeskd. 2014;158:A7455.
- Tanay MAL, Armes J Moss-Morris R, Rafferty AM, Robert G. A systematic review of behavioural and exercise interventions for the prevention and management of chemotherapy-induced peripheral neuropathy symptoms. J Cancer Surviv. 2021 Mar 12. Published ahead of print. Doi: 10.1007/s11764-021-00997-w
- Wampler MA, Topp KS, Miaskowski C, Byl NN, Rugo HS, Hamel K. Quantitative and clinical description of postural instability in women with breast cancer treated with taxane chemotherapy. Arch Phys Med Rehabil. 2007;88(8):1002-8.
C.4 Vermoeidheid
Aanbevelingen
Bied de beweeginterventie gesuperviseerd aan bij patiënten met kankergerelateerde vermoeidheid.
Breng in de anamnese factoren in kaart die invloed hebben op vermoeidheid (waaronder verwerkingsproblemen, angst voor een recidief, disfunctionele cognities, onregelmatig slaap-waakritme, over- of onderactiviteit, en irreële verwachtingen van de omgeving).
Overweeg een multidisciplinaire behandeling of cognitief-gedragsmatige aanpak in de volgende situaties:
- De patiënt ervaart op het moment van de kankerdiagnose al ernstige vermoeidheid.
- De patiënt ervaart angst/spanning, depressie of slaapproblemen.
- Na een beweeginterventie van 12 weken treedt geen vooruitgang op, ondanks een adequate fysiologische prikkel.
Overleg, als dit op basis van de genoemde situaties geïndiceerd lijkt, met de behandelend arts over verwijzing voor cognitieve gedragstherapie en over voortzetting van de beweeginterventie.
Gebruik de Multidimensionele Vermoeidheids Index (MVI -20) om kankergerelateerde vermoeidheid in kaart te brengen en te evalueren wanneer hier vanuit de anamnese aanleiding toe is.
Bepaal op basis van het ingangsniveau en de gestelde doelen de duur van een beweeginterventie, maar overweeg een beweeginterventie ten minste 12 weken aan te bieden met een frequentie van drie dagen per week, waarbij ten minste matig-intensief getraind wordt.
Bied de beweeginterventie gepersonaliseerd aan. Houd hierbij rekening met symptomen en beperkingen die de patiënt ervaart. Besteed behalve aan de FITT-factoren (frequentie, intensiteit, type en tijd) en trainingsprogressie tijdens de beweeginterventie, ook aandacht aan de algehele activiteitenregulatie.
Overweeg ‘High Intensity Interval Training’ (HIIT) bij patiënten die hieraan de voorkeur geven en die over voldoende bewegingsvaardigheden beschikken. Start bij patiënten bij wie HIIT niet uitgevoerd kan worden in verband met belemmerende comorbiditeit, te lage uitgangsfitheid of andere symptomen en beperkingen, met een beweeginterventie van continue intensiteit.
Onderbouwing
Aanleiding
Vermoeidheid is een van de meest voorkomende klachten bij mensen die leven met of na kanker. Vermoeidheidsklachten komen voor bij 75 tot 100% van de patiënten en kunnen langdurig aanhouden na afloop van een (succesvolle) behandeling (Abrahams 2016; Bower 2014; Hofman 2007). Door de negatieve impact van vermoeidheid op werkhervatting, dagelijkse activiteiten en sociale contacten heeft vermoeidheid een belangrijke invloed op de kwaliteit van leven van mensen die leven met of na kanker. Het is daarom belangrijk om deze vermoeidheidsklachten te verminderen.
Vermoeidheid kan niet alleen een rol spelen bij hulpvragen op het gebied van het bewegend functioneren, maar het verminderen van vermoeidheid kan ook een hulpvraag op zichzelf zijn. Voor de therapeut is het in beide gevallen van belang om te weten welke vormen van beweeginterventies het meest aannemelijk effectief zijn voor het reduceren (of beperken) van vermoeidheidsklachten.
Uitgangsvraag
Wat is de best passende beweeginterventie om aan kanker gerelateerde vermoeidheidsklachten te verminderen?
Literatuur
Er is sterk bewijs dat beweeginterventies effectief zijn om vermoeidheidsklachten te verminderen bij mensen die leven met of na kanker. Deze effecten zijn niet afhankelijk van demografische of klinische karakteristieken van de patiënt. De ernst van vermoeidheidsklachten voorafgaand aan een beweeginterventie vormt hierop een uitzondering; deze lijkt wel van invloed te zijn. Zowel tijdens als na de behandeling zijn de effecten groter bij patiënten met ernstige vermoeidheidsklachten voorafgaand aan een beweeginterventie in vergelijking met patiënten die weinig vermoeidheidsklachten ervaren.
Er is geen verschil gevonden in effectiviteit tussen interventies die tijdens of na de behandeling van kanker zijn aangeboden, tussen interventies met een verschillende frequentie (range: 2-5 sessies per week) en sessieduur (range: 15-120 minuten per sessie) of tussen aerobe training en krachttraining. Een dosis-effectrelatie wat betreft de intensiteit van de interventie is niet aangetoond. Een gesuperviseerde beweeginterventie onder begeleiding van een therapeut is effectiever dan een niet-gesuperviseerde beweeginterventie. Bij een gesuperviseerde beweeginterventie van 12 weken kan een positief effect op vermoeidheid verwacht worden. Er is geen verschil in effectiviteit aangetoond op vermoeidheidsklachten tussen een matig-intensieve aerobe beweeginterventie en ‘High Intensity Interval Training’ (HIIT). Bij vermoeidheidsklachten die worden veroorzaakt door angst en depressie, pijn, anemie, slaapproblemen, medicatie en ondervoeding heeft een beweeginterventie mogelijk geen positieve effecten op de vermoeidheid.
Overwegingen
In de ACSM-beweegrichtlijn voor mensen met kanker wordt beschreven dat een beweeginterventie van minimaal 12 weken, op 3 dagen per week van matige intensiteit, significant gunstige effecten heeft op vermoeidheid zowel tijdens als na de behandeling van kanker. Er is suggestief bewijs dat beweegvoorschriften van langer dan 30 minuten per sessie gedurende langer dan 12 weken resulteren in een grotere afname van vermoeidheid dan beweeginterventies van kortere duur (Campbell 2019). Dit betekent voor de dagelijkse klinische praktijk dat het niet aan te raden is om een beweeginterventie in te zetten op een lage intensiteit voor de vermindering van de vermoeidheid. Daarnaast hebben verschillende studies aangetoond dat de uitvoering van HIIT veilig is voor patiënten met kankergerelateerde vermoeidheid (Piraux 2020). De effectiviteit van HIIT in relatie tot andere vormen van training is onvoldoende beschreven. Regelmatige evaluatie van de interventie is gewenst in het kader van het evenwicht tussen de belasting en de belastbaarheid van de patiënt.
Bij vermoeidheidsklachten die worden veroorzaakt door angst en depressie, pijn, anemie, slaapproblemen, medicatie en ondervoeding heeft een beweeginterventie mogelijk geen positieve effecten op de vermoeidheid. Het is daarom belangrijk om in de anamnese de factoren die vermoeidheid in stand houden (waaronder verwerkingsproblemen, angst voor een recidief, disfunctionele cognities, onregelmatig slaap-waakritme, over- of onderactiviteit en irreële verwachtingen van de omgeving) in kaart te brengen (Blijenberg 2007). Wanneer een van deze factoren aanwezig is, is een gedragsmatige aanpak (bijvoorbeeld cognitieve gedragstherapie, psychologische en/of psychosomatische begeleiding), slaaptherapie, medicatie of een consult bij een diëtist mogelijk beter geschikt ter vermindering van de vermoeidheidsklachten (NCCN 2018; Portenoy 1999). Een gecombineerde begeleiding van een beweeginterventie en een gedragsmatige aanpak en/of de inzet van diëtetiek is te overwegen. Wanneer patiënten bij de diagnose al kampen met ernstige vermoeidheid is vooral een cognitief-gedragsmatige aanpak effectief (VRA 2018). De richtlijn ‘Medisch Specialistische Revalidatie’ kan geraadpleegd worden wanneer er sprake is van samenhangende problematiek waarbij meerdere zorgverleners een rol spelen.
De therapeut kan met behulp van psycho-educatie uitleggen dat vermoeidheid een logisch gevolg kan zijn van de ziekte en de behandeling ervan. Daarnaast kan de therapeut ondersteuning bieden bij de invulling van de dagelijkse activiteiten. Hierbij kan ook overwogen worden de patiënt te verwijzen naar een ergotherapeut. Het inzichtelijk maken van beweging die al aanwezig is in de dagindeling kan helpend zijn. Hierbij kan aan de patiënt duidelijk gemaakt worden dat fysieke activiteit niet alleen in de therapeutische omgeving plaatsvindt, maar ook in het dagelijks leven. Adviezen omtrent het invoeren van beweegactiviteiten in de ADL zijn gewenst. Sommige activiteiten of taken kunnen mogelijk op een andere manier ingevuld worden om fysieke activiteit te stimuleren. In deze adviezen is maatwerk essentieel voor het opstellen van realistische behandeldoelen en het geven van de optimale begeleiding. Sociale ondersteuning kan van toegevoegde waarde zijn. De therapeut kan de thuissituatie en sociale ondersteuning inventariseren. De sociale omgeving kan helpen in het creëren van routine, door bijvoorbeeld kinderen wandelend naar school te brengen of door een terugkerende wandel- of fietsafspraak te maken met een vriend of familielid. Bij de sturing of advisering is het belangrijk om aan te sluiten bij de voorkeuren en interesses van de patiënt.
Daarnaast is het essentieel om de problematiek te bekijken in het brede perspectief. Vermoeidheid is vrijwel nooit een op zichzelf staand probleem. Patiënten melden zich vaak met gecombineerde problematiek. Het is om die reden wenselijk een multidimensionale benadering en gecombineerde begeleiding toe te passen.
Ten aanzien van vermoeidheid in de palliatieve fase, zie de richtlijn ‘Vermoeidheid bij kanker in de palliatieve fase’ van de IKNL.
Zoekactie
Door de projectgroep is besloten deze vraag te beantwoorden aan de hand van bestaande richtlijnen en bevindingen die zijn gerapporteerd in recent gepubliceerd systematisch literatuuronderzoek. Dit literatuuronderzoek is uitgevoerd met de volgende vraagstelling: Wat is bij mensen die leven met of na kanker (P) die een beweeginterventie krijgen (I), in vergelijking met mensen die geen beweeginterventie krijgen (C), het verschil in vermoeidheid (O)? Hierbij is gekeken naar:
- De effecten van gesuperviseerde beweeginterventies op vermoeidheid zowel tijdens als na de behandeling van kanker in vergelijking met geen beweeginterventie.
- De effecten van niet-gesuperviseerde beweeginterventies op vermoeidheid zowel tijdens als na de behandeling van kanker in vergelijking met geen beweeginterventie.
- Verschil in effect tussen beweeginterventies bij verschillende patiëntkarakteristieken en trainingsvoorschriften (frequentie, intensiteit, type en tijdsduur; FITT).
- Het effect van ‘High Intensity Interval Training’ (HIIT) in vergelijking met een beweeginterventie van continue intensiteit op vermoeidheid bij mensen die leven met of na kanker.
Voor de eerste drie aspecten zijn reeds gepubliceerde systematische meta-analyses geïncludeerd (Buffart 2017, 2018; Van Vulpen 2020). Deze onderzoeken hadden als doel de individuele deelnemersgegevens van gerandomiseerde interventiestudies te gebruiken om moderatoren van de interventie-effecten op vermoeidheid, kwaliteit van leven en fysiek functioneren te onderzoeken.
Voor het vierde aspect is in het kader van deze richtlijn een systematisch literatuuronderzoek uitgevoerd naar de effectiviteit van HIIT op vermoeidheid in vergelijking met een beweeginterventie van continue intensiteit bij mensen die leven met of na kanker. Op 12 februari 2021 is met relevante zoektermen een systematische zoekactie uitgevoerd naar gerandomiseerde gecontroleerde studies (RCT’s), systematische reviews en meta-analyses in onder meer de databases MEDLINE, Embase, Cochrane en PEDro. De verantwoording van de zoekactie is opgenomen in bijlage C.4-1 (opent in nieuw tabblad).
In de volgende tabel staan de selectiecriteria van deze zoekactie.

Karakteristieken van de geïncludeerde studies
Op basis van een systematisch literatuuronderzoek van Buffart (2017) in PubMed, Embase, PsycINFO en CINAHL bleken 69 gerandomiseerde studies naar beweeginterventie geschikt voor inclusie. Ten behoeve van deze richtlijn zijn de originele data van 36 van deze studies opgenomen in een database. Van de overige studies was het niet mogelijk om de originele data te verzamelen. Er is geen verschil in effect gevonden tussen de studies die wel en niet geïncludeerd zijn.
In de meta-analyse van Van Vulpen (2020) werden 36 individuele studies geïncludeerd. In vijf studies werd geen vermoeidheid gerapporteerd. De gegevens uit de overige 31 studies zijn gebruikt om de effecten van een beweeginterventie op vermoeidheid te onderzoeken. In die 31 studies werden in totaal 2437 patiënten met verschillende typen kanker gerandomiseerd naar een beweeginterventie en 1929 deelnemers naar de controlegroep. Van deze patiënten was een groot deel vrouw (78%). 70% was gediagnosticeerd met borstkanker; de gemiddelde leeftijd was 54 jaar. Onderzocht werd of demografische en klinische eigenschappen en veel of weinig vermoeidheid voorafgaand aan de beweeginterventie invloed hadden op het effect van de beweeginterventie, en ook werd het effect van de verschillende trainingsvoorschriften onderzocht.
In de meta-analyse van Buffart (2018) zijn dezelfde studies geïncludeerd als in de meta-analyse van Van Vulpen (2020).
1. Effectiviteit van gesuperviseerde beweeginterventies op vermoeidheid
De resultaten van de studie van Van Vulpen (2020) laten zien dat een gesuperviseerde beweeginterventie tijdens en na de behandeling van kanker kan leiden tot minder vermoeidheid (z-score β= -0,23 (95%-BI -0,29 tot -0,17). De effecten zijn onderzocht met een mixed effect model en er is gecorrigeerd voor de beginwaarden. Een random intercept op studieniveau is toegepast en de verschillen tussen de groepen zijn gerapporteerd in z-scores (interpretatie: 0,2-0,5 = klein effect; 0,5-0,8 = matig effect; ≥ 0,8 = groot effect).
2. Effectiviteit van niet-gesuperviseerde beweeginterventies op vermoeidheid
Uit de meta-analyse van Van Vulpen (2020) blijkt dat niet-gesuperviseerde beweeginterventies resulteren in een zeer klein en niet-significant effect (z-score β= -0,04; 95%-BI -0,13 tot 0,04).
3. Verschil in effect tussen beweeginterventies bij verschillende patiëntkarakteristieken en trainingsvoorschriften
Patiëntkarakteristieken
In een studie waarin dezelfde gegevens zijn gebruikt als in de studie van Van Vulpen is onderzocht of er verschillen bestaan in de effectiviteit van beweeginterventies op vermoeidheid tussen patiënten die voorafgaand aan de interventie meer of minder vermoeidheid ervaren (Buffart 2018). Dit is onderzocht door de patiënten in subgroepen te verdelen op basis van de ervaren vermoeidheid voorafgaand aan de interventie. De resultaten van deze analyses laten een significant effect zien van de vermoeidheid voorafgaand aan de interventie (z-score β= -0,05; 95%-BI -0,10-0,00) met grotere effecten voor patiënten die voorafgaand aan de interventie meer dan gemiddelde vermoeidheid ervaren (z-score β= -0,22; 95%-BI -0,37 tot -0,07) in vergelijking met weinig vermoeide patiënten (z-score β= -0,03; 95%-BI -0,13 tot 0,08). Zie de volgende figuur.
Een gemiddelde vermoeidheidsscore correspondeerde in deze studie met een waarde van 12,1 voor algemene vermoeidheid gemeten met de Multidimensionele Vermoeidheids Index en een waarde van 37,1 gemeten met de ‘Functional Assessment of Chronic Illness Therapy’ (FACIT) vermoeidheidsschaal.
Voor zowel gesuperviseerde als niet-gesuperviseerde interventies werd door Van Vulpen (2020) geen verschil in effect gevonden tussen groepen op basis van leeftijd, geslacht, opleidingsniveau, burgerlijke staat, body mass index (BMI), type kanker of soort behandeling.
Trainingsvoorschriften
In de meta-analyse van Van Vulpen (2020) werd op basis van individuele patiëntgegevens geen aanwijzing gevonden voor verschillen in effecten op vermoeidheid tussen gesuperviseerde interventies die verschilden in frequentie, sessieduur, intensiteit of type. In dit onderzoek werden wel aanwijzingen gevonden dat interventies van 12 weken of korter grotere effecten lieten zien in vergelijking met interventies langer dan 12 weken, met name als de interventie langer dan 24 weken duurde (≤ 12 weken: z-score β = -0,29, 95%-BI -0,39 tot -0,20; > 12-24 weken: z-score β = -0,25, 95%-BI -0,41 tot -0,10; > 24 weken: z-score β = -0,11, 95%-BI -0,22 tot 0,00). De auteurs van de review schrijven dit toe aan afnemende therapietrouw en/of toenemende contaminatie vanaf 12 weken, hoewel ook een mogelijk plafondeffect niet wordt uitgesloten. Deze bevinding staat in contrast met de bevindingen die in de ACSM-richtlijnen worden beschreven, waarin een groter effect werd gevonden bij programma’s die langer dan 12 weken duurden en die een langere sessieduur hadden.
4. Effectiviteit van HIIT in vergelijking met beweeginterventies van continue intensiteit
De zoekactie in het kader van deze richtlijn leverde 185 hits op. Op basis van titel en abstract zijn 124 studies geëxcludeerd. Er bleven 61 studies over, waarvan 23 systematische literatuuronderzoeken die alle op volledige tekst zijn beoordeeld, waarop uiteindelijk één systematisch literatuuronderzoek werd geïncludeerd omdat daarin de effectiviteit van HIIT was vergeleken met training van continue intensiteit en geen training (Mugele 2019). In dit systematisch literatuuronderzoek is slechts één studie geïncludeerd waarin het effect op vermoeidheid van HIIT is vergeleken met een beweeginterventie van continue intensiteit (Schmitt 2016). Deze kleine studie werd uitgevoerd bij 28 vrouwen met een gemiddelde leeftijd van 53 jaar die voor verschillende vormen van kanker waren behandeld. De interventie bestond uit zes sessies van 75 minuten op een laag-tot-matig intensieve continue intensiteit of acht HIIT-sessies in een periode van drie weken. Vermoeidheid werd gemeten voorafgaand aan en na afloop van de interventie met behulp van de Multidimensionele Vermoeidheids Index (MVI) (hoe hoger de score hoe groter de vermoeidheid). Zowel HIIT (-1,31 ± 2,02 punten) als laag-tot-matig-intensieve training (-3,23 ± 2,52 punten) resulteerde gemiddeld in een vermindering van de algemene vermoeidheid. Laag-tot-matig-intensieve training resulteerde in een grotere vermindering van de algemene vermoeidheid in vergelijking met HIIT (p = 0,04), maar dit verschil werd niet gevonden voor de andere subschalen van vermoeidheid, gemeten met de MVI (fysieke vermoeidheid, mentale vermoeidheid, verminderde motivatie en verminderde activiteit).
30 studies betroffen gerandomiseerde studies. Eén betrof een studie die werd gepubliceerd na het systematisch literatuuronderzoek van Mugele (2019) en relevant bleek voor de beantwoording van de uitgangsvraag (Piraux 2020). In deze studie werden de effecten van HIIT vergeleken met respectievelijk krachttraining en geen training bij patiënten met prostaatkanker tijdens de behandeling met radiotherapie. In totaal werden 78 patiënten geïncludeerd, van wie er 27 werden gerandomiseerd naar de HIIT-trainingsgroep, 25 naar de groep die krachttraining kreeg en 26 naar de controlegroep. Vermoeidheid werd gemeten met de ‘Functional Assessment of Chronic Illness Therapie – Fatigue’ (FACIT-F) (hoe lager de score hoe groter de vermoeidheid). De resultaten laten zien dat zowel HIIT (p = 0,012) als krachttraining (p = 0,039) een toename in vermoeidheid kan beperken in vergelijking met de controlegroep. Er werden geen verschillen gevonden tussen de effecten van krachttraining en HIIT (effectgrootte niet gerapporteerd).
De overige acht studies waren geen systematische reviews of RCT’s. Daarmee voldeden deze studies niet aan de inclusiecriteria en ze zijn daarom niet meegenomen in de verdere analyse.
Individuele studiekwaliteit (RoB)
De opzet en uitvoering van de individuele studies (‘risk of bias’; RoB) zijn beoordeeld met behulp van de risk-of-bias (RoB) tool van de Cochrane Collaboration in het systematisch literatuuronderzoek van Van Vulpen (2020) (gerapporteerd in Buffart, 2017). Ook voor de beoordeling van de studies van Schmitt (2016) en Piraux (2020) is gebruikgemaakt van de Cochrane RoB-tool. Zie voor de beoordeling van de RoB van de individuele studies bijlage C.4-2 (opent in nieuw tabblad).
Kwaliteit van de gevonden literatuur
Ten aanzien van de eerste drie aspecten is ondanks de afwezigheid van blindering bij vrijwel alle studies, ervoor gekozen niet af te waarderen voor studieopzet en -kwaliteit, aangezien blindering in dergelijke studies onmogelijk is en overige aspecten binnen de RoB-tool zeer goed gescoord werden.
Op basis van de ‘trim-and-fill’-procedure die is uitgevoerd door Van Vulpen (2020) en Buffart (2018) is er reden om aan te nemen dat er sprake is van publicatiebias. De kwaliteit van bewijs voor de effecten van een gesuperviseerde beweeginterventie op vermoeidheid is op grond dáárvan wel afgewaardeerd en als redelijk beoordeeld. De variatie in de effecten en het betrouwbaarheidsinterval van studies die een niet-gesuperviseerde beweeginterventie vergeleken met geen beweeginterventie is groot. De kwaliteit van het bewijs is daarom afgewaardeerd op basis van inconsistentie en publicatiebias, waarmee de kwaliteit van het bewijs voor de effecten van niet-gesuperviseerde interventies op vermoeidheid laag is.
Het bewijs voor verschillen in effecten tussen beweeginterventies die variëren in FITT-factoren is afkomstig uit de studie van Van Vulpen (2020). De kwaliteit van het bewijs is redelijk, omdat ook voor deze vergelijking afgewaardeerd is voor publicatiebias.
Ten aanzien van het vierde aspect is voor individuele studiekwaliteit afgewaardeerd doordat de randomisatieprocedures onduidelijk waren beschreven. Daarnaast is afgewaardeerd voor inconsistentie omdat de effectgrootte onduidelijk was gerapporteerd. Voor de vergelijking tussen studies waarin HIIT werd vergeleken met een beweeginterventie van continue intensiteit kon de publicatiebias niet beoordeeld worden. De kwaliteit van het bewijs komt uit op laag.
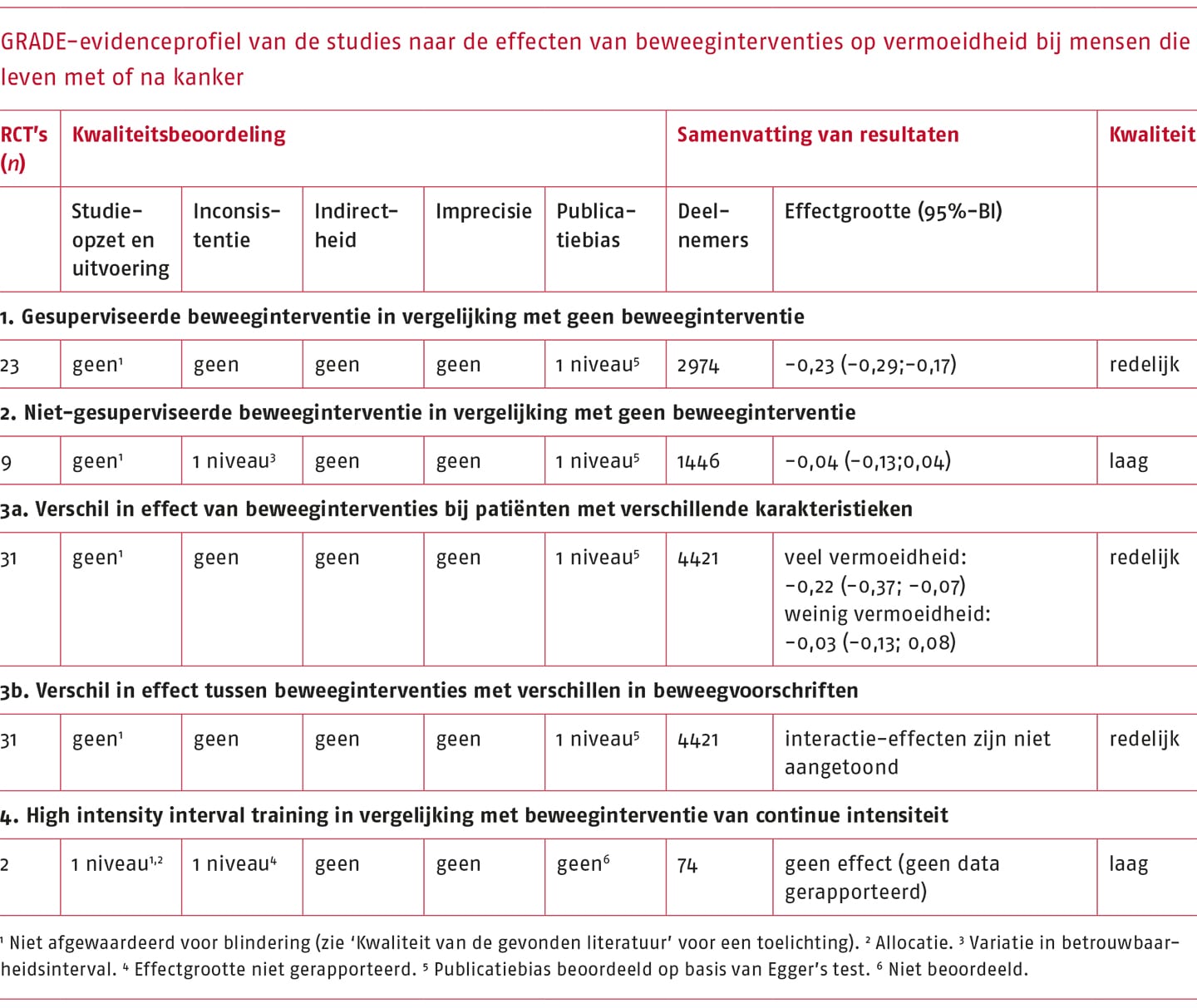
Het GRADE-evidenceprofiel van de gevonden studies is opgenomen in de volgende tabel.
Conclusies op basis van de literatuur
Er is een klein effect van gesuperviseerde beweeginterventies in vergelijking met geen beweeginterventies op de uitkomstmaat vermoeidheid. De kwaliteit van bewijs is redelijk.
Er is geen effect van een niet-gesuperviseerde beweeginterventie in vergelijking met geen beweeginterventie op de uitkomstmaat vermoeidheid. De kwaliteit van bewijs is laag.
Er is een groter effect van beweeginterventies bij patiënten met meer dan gemiddelde vermoeidheid in vergelijking met patiënten met minder dan gemiddelde vermoeidheid. Er is geen verschil in effect aangetoond tussen interventies van laag-tot-matige intensiteit en matig-tot-hoge intensiteit, tussen een interventie van < 3 sessies per week en ≥ 3 sessies per week, en tussen krachttraining of aerobe training. De kwaliteit van bewijs is redelijk.
Er is geen verschil in effect op vermoeidheid tussen beweeginterventies waarbij HIIT wordt toegepast, in vergelijking met beweeginterventies waarbij training van continue intensiteit wordt toegepast. De kwaliteit van bewijs is laag.
Overwegingen
De aanbevelingen worden niet alleen bepaald door bevindingen in de literatuur. Ook andere overwegingen spelen daarbij een rol.
De overwegingen betroffen:
Gewenste effecten: Vanuit de literatuur zijn kleine positieve effecten gerapporteerd van een beweeginterventie op vermoeidheid. De effectiviteit van gesuperviseerde beweeginterventies is groter dan die van niet-gesuperviseerde beweeginterventies. Er zijn geen aantoonbare verschillen tussen de effecten op vermoeidheid van beweeginterventies van continue intensiteit en HIIT. De werkgroep merkt op dat behalve effecten op ervaren vermoeidheid, beweeginterventies ook bijdragen aan een betere algehele fitheid, een beter cardiovasculair risicoprofiel en een hogere kwaliteit van leven. Daarbij is het tevens van belang dat fitheid een positieve rol speelt tijdens de behandeling en gunstige effecten heeft op de uitkomsten van de behandeling. Er zijn bij de overweging voor een beweeginterventie daarom mogelijk meer gezondheidsuitkomsten betrokken dan alleen vermoeidheid.
Ongewenste effecten: Er zijn geen ongewenste effecten van beweeginterventies gerapporteerd in de geïdentificeerde studies.
Kwaliteit gewenste effecten: De bewijskracht voor de effecten op vermoeidheid van een gesuperviseerde beweeginterventie is redelijk. De kwaliteit van bewijs heeft betrekking op het bewijs van sterk gestandaardiseerde beweeginterventies. In de oefen- en fysiotherapeutische praktijk zal een hogere mate van aanpassing op het individu aan de orde zijn, waarbij behalve fysiologische effecten van beweeginterventies ook cognitief-gedragsmatige componenten worden toegepast (zoals ‘goal setting’, psycho-educatie, coaching op activiteitenregulatie) en mogelijk substitutie naar of toevoeging van functionele trainingsvormen die zijn gericht op voor de patiënt waardevolle dagelijkse activiteiten.
Balans tussen gewenste en ongewenste effecten: Aangezien er geen ongewenste effecten gerapporteerd zijn, overtreffen de gewenste effecten van de interventie de ongewenste effecten.
Waarde aan gewenste effecten: De effecten van beweeginterventies op vermoeidheid zijn klein en het is onwaarschijnlijk dat met die effecten de grens voor klinische relevantie overschreden wordt. In wetenschappelijk onderzoek wordt echter vaak een selectie van actieve deelnemers geïncludeerd en wordt gerapporteerd dat de controlegroep vaak ook erg actief is. Het effect van een beweeginterventie op vermoeidheidsklachten is in de praktijk mogelijk groter dan wordt gerapporteerd in wetenschappelijk onderzoek.
Variatie in waarde aan gewenste effecten: Er is een significant moderatie-effect gerapporteerd van de vermoeidheid voorafgaand aan de interventie (z-score β= -0,05; 95%-BI -0,10 tot 0,00) met grotere effecten voor deelnemers die voorafgaand aan de interventie meer dan gemiddelde vermoeidheid ervaren (z-score β= -0,22; 95%-BI -0,37 tot -0,07) in vergelijking met deelnemers met weinig vermoeidheid (z-score β= -0,03; 95%-BI -0,13 tot 0,08).
Benodigde middelen (kosten): Er zijn geen extra kosten verbonden aan de interventie.
Variatie in benodigde middelen (kosten): Omdat in de oefen- en fysiotherapiepraktijk geen standaardprogramma’s worden aangeboden, maar zorg op maat, kan er sprake zijn van variatie in kosten. Een ‘graded-activity’-programma bij patiënten met bewegingsangst heeft waarschijnlijk meer tijd nodig om tot de gewenste resultaten te komen dan een trainingsprogramma dat meteen op voldoende intensiteit kan worden aangeboden. Ook de aanwezigheid van risico’s op grond van (zeer) lage belastbaarheid, comorbiditeit of lage bewegingsvaardigheid, kan leiden tot een langer dan gemiddelde behandelduur.
Kosteneffectiviteit: Informatie over de kosteneffectiviteit is beperkt. Ongesuperviseerde beweeginterventies tijdens de behandeling met chemotherapie zijn waarschijnlijk niet kosteneffectief vanuit maatschappelijk perspectief. Beweeginterventies tijdens chemotherapie onder begeleiding van een fysio- of oefentherapeut zijn dat mogelijk wel, afhankelijk van de ‘willingness to pay’ en de gangbare inschatting van de ziektelast (Van Waart 2017). De kosten vanuit het perspectief van de gezondheidszorg zijn beperkt en zeer laag in vergelijking met de totale kosten van de gezondheidszorg voor mensen met kanker (VRA 2018).
Aanvaardbaarheid: Beweeginterventies zijn aanvaardbaar voor therapeuten en mensen tijdens of na de behandeling van kanker. De voor deze richtlijn geraadpleegde ervaringsdeskundigen gaven hierbij wel aan dat zij prijs stellen op een bredere advisering dan alleen trainingsbegeleiding op locatie bij de fysio- of oefentherapeut. Met name het verkrijgen van inzicht in (het vinden van de juiste balans tussen) belasting en belastbaarheid in activiteiten van het dagelijks leven werd hierbij expliciet benoemd.
Haalbaarheid: Beweeginterventies tijdens of na de behandeling van kanker worden al veelvuldig toegepast en worden als haalbaar beschouwd.
Conclusie
De werkgroep besluit therapie aan te bevelen bij mensen die leven met of na kanker en vermoeidheid. Indien de patiënt op het moment van de kankerdiagnose al ernstige vermoeidheid, angst/spanning, depressie of slaapproblemen ervaart of wanneer na een beweeginterventie van 12 weken geen vooruitgang is geboekt, ondanks een adequate fysiologische prikkel, dient een multidisciplinaire behandeling of cognitief-gedragsmatige aanpak overwogen te worden.
Meetinstrumenten
Alle meetinstrumenten die opgenomen zijn in de ‘KNGF-standaard Beweeginterventie Oncologie’ en in de richtlijn ‘Medisch specialistische revalidatie bij oncologie’ van de Nederlandse Vereniging van Revalidatieartsen (VRA 2018) zijn in de overwegingen betrokken.
De Lastmeter kan gebruikt worden als signaleringsinstrument van last in het algemeen en onderliggende oorzaken van die last, zoals vermoeidheid. Het is belangrijk om bij de diagnostiek een multidimensionele benadering toe te passen en te kijken naar de fysieke, emotionele en cognitieve dimensies van vermoeidheid.
Voor het diagnosticeren van vermoeidheid wordt de Multidimensionele Vermoeidheids Index (MVI) aanbevolen. Voor de beoordeling van onderliggende oorzaken van vermoeidheid is mogelijk aanvullend onderzoek nodig. Denk hierbij aan bloedonderzoek of een vragenlijst over angst en depressie (‘Hospital Anxiety and Depression Scale’ (HADS)). Hiervoor is onderlinge afstemming met betrokken primaire oncologische behandelaars of de huisarts belangrijk.
Het diagnosticeren van angst of depressiestoornissen valt buiten het expertisegebied van de fysio- en oefentherapeut. Het is wel aan te bevelen om op deze stemmingsproblemen te screenen. Bij een score boven de daarvoor geldende afkappunten kan met de patiënt besproken worden of verdere diagnostiek en/of behandeling door een daarvoor gekwalificeerde zorgverlener wenselijk is.
Bij de selectie van meetinstrumenten is gewerkt volgens het stappenplan van het ‘Raamwerk Klinimetrie’ (KNGF 2016). Het stappenplan bestaat uit acht stappen. Per stap wordt de keuze voor de meetinstrumenten verantwoord en vervolgens wordt onderscheid gemaakt tussen de aanbevolen en optionele meetinstrumenten.
Stap 1: Wat wil je meten?
Vermoeidheid is een parameter binnen het ICF-domein ‘functies en anatomische eigenschappen’ die tijdens de anamnese kan worden geobjectiveerd ten behoeve van het stellen van doelen, het monitoren van de interventie en ten behoeve van de (eind)evaluatie tijdens het diagnostisch en therapeutisch proces.
Voor de differentiaaldiagnostiek kan een aanvullend meetinstrument worden gebruikt.
Stap 2: Waarom wil je meten?
De genoemde parameter kan met zowel een diagnostisch doel als een evaluatief doel gemeten worden.
Stap 3: Met welk soort meetinstrument wil je meten?
Er is gezocht naar een meetinstrument dat geschikt is voor het objectiveren van de parameter vermoeidheid. Voor vermoeidheid is de Multidimensionele Vermoeidheids Index (MVI) geanalyseerd, omdat deze aanbevolen wordt in de richtlijn ‘Medisch specialistische revalidatie bij oncologie (2.0)’ (VRA 2018).
Stap 4: Hoe vind je een meetinstrument?
Het meetinstrument is beschikbaar via www.meetinstrumentenzorg.nl.
Stap 5: Wat is de hanteerbaarheid?
De MVI is een zelfrapportage-instrument en bestaat uit 20 stellingen en uitspraken die betrekking hebben op vijf dimensies van vermoeidheid en de consequenties hiervan. De MVI is goed hanteerbaar en wordt het meest gebruikt in de klinische zorg in Nederland voor het meten van kankergerelateerde vermoeidheid (VRA 2018). Het invullen van de stellingen kost ongeveer 5 minuten.
Stap 6: Wat is de klinimetrische kwaliteit?
De MVI is betrouwbaar, valide en gevoelig voor verandering (Meek 2000; Minton 2009). De interne consistentie van de subschalen is onderzocht bij Nederlandse patiënten met kanker die radiotherapie ondergingen en beoordeeld als goed tot zeer goed (Cronbachs α = 0,79 tot 0,93; Smets 1996). In dezelfde studie is ondersteunend bewijs gevonden voor voldoende constructvaliditeit en structurele validiteit. In een grote studie in de algemene bevolking bleef de structurele validiteit niet overeind en bleek de subschaal ‘Algemene vermoeidheid’ de betrouwbaarste maat voor vermoeidheid (Kieffer 2021). Een ander recent onderzoek waarin een grote studie was opgenomen met 1818 patiënten met kanker, vond ook geen bewijs voor de onderliggende factor ‘structuur’, maar adviseert niettemin de subschalen wel zoals bedoeld te scoren (Hinz 2020).
Stap 7 en 8: Zijn er normwaarden beschikbaar en hoe bereken en interpreteer je de gegevens?
Hoe hoger de score op de MVI, des te groter het niveau van vermoeidheid en hoe meer de vermoeidheid een beperkende factor is. De scoringstool van het Integraal Kankercentrum Nederland (IKNL) kan gebruikt worden om de score te berekenen.
Voor het evalueren van de vermoeidheid van een individuele patiënt in de loop van de tijd kunnen de schaalscores gebruikt worden. Voor het vergelijken met een referentiegroep van (Duitse) mensen na kanker kunnen de z-scores gebruikt worden. Met behulp van deze tool kan per dimensie de afwijking van de score van de patiënt ten opzichte van de referentiegroep berekend worden. Omdat getwijfeld wordt aan de validiteit van de indeling in subschalen, beveelt de werkgroep aan om deze scores te gebruiken als gesprekshulp en niet als definitief diagnosticum. De z-scores zijn opgenomen als bijlage C.4-3 (opent in nieuw tabblad).
Het evidence-to-decisionformulier voor beweeginterventies bij vermoeidheid is opgenomen als bijlage C.4-4 (opent in nieuw tabblad).
- Abrahams HJ, Gielissen MF, Schmits IC, Verhagen CAHHVM, Rovers MM, Knoop H. Risk factors, prevalence, and course of severe fatigue after breast cancer treatment: a meta-analysis involving 12 327 breast cancer survivors. Ann Oncol. 2016;27(6):965-74.
- Adams SC, DeLorey DS, Davenport MH, Fairey AS, North S, Courneya KS. Effects of high-intensity interval training on fatigue and quality of life in testicular cancer survivors. Br J Cancer. 2018; 118(10):1313-21.
- Berger AM, Abernethy AP, Atkinson A, Barsevick AM, Breitbart WS, Cella D, Cimprich B, Cleeland C, Eisenberger MA, Escalante CP, Jacobsen PB, Kaldor P, Ligibel JA, Murphy BA, O’Connor T, Pirl WF, Rodler E, Rugo HS, Thomas J, Wagner LI. Cancer-related fatigue. Clinical practice guidelines in oncology. J Natl Compr Canc Netw. 2010. 8(8):904-31.
- Bleijenberg G, Gielissen MFM, Voskamp H. Cognitieve gedragstherapie bij vermoeidheid na kanker. Ned Tijdschr Oncol. 2007. 4(5):200-5.
- Bower JE. Cancer-related fatigue-mechanisms, risk factors, and treatments. Nat Rev Clin Oncol, 2014;11(10):597-609.
- Buffart LM, Kalter J, Sweegers MG, Courneya KS, Newton RU, Aaronson NK, Jacobsen PB, May AM, Galvão DA, Chinapaw MJ, Steindorf K, Irwin ML, Stuiver MM, Hayes S, Griffith KA, Lucia A, Mesters I, van Weert E, Knoop H, Goedendorp MM, Mutrie N, Daley AJ, McConnachie A, Bohus M, Thorsen L, Schulz KH, Short CE, James EL, Plotnikoff RC, Arbane G, Schmidt ME, Potthoff K, van Beurden M, Oldenburg HS, Sonke GS, van Harten WH, Garrod R, Schmitz KH, Winters-Stone KM, Velthuis MJ, Taaffe DR, van Mechelen W, Kersten MJ, Nollet F, Wenzel J, Wiskemann J, Verdonck-de Leeuw IM, Brug J. Effects and moderators of exercise on quality of life and physical function in patients with cancer: An individual patient data meta-analysis of 34 RCTs. Cancer Treat Rev. 2017 Jan;52:91-104.
- Buffart LM, Sweegers MG, May AM, Chinapaw MJ, van Vulpen JK, Newton RU, Galvao DA, Aaronson NK, Stuiver MM, Jacobsen PB, Verdonck-de Leeuw IM, Steindorf K, Irwin ML, Hayes S, Griffith KA, Lucia A, Herrero-Roman F, Mesters I, van Weert E, Knoop H, Goedendorp MM, Mutrie N, Daley AJ, McConnachie A, Bohus M, Thorsen L, Schulz KH, Short CE, James EL, Plotnikoff RC, Arbane G, Schmidt ME, Potthoff K, van Beurden M, Oldenburg HS, Sonke GS, van Harten WH, Garrod R, Schmitz KH, Winters-Stone KM, Velthuis MJ, Taaffe DR, van Mechelen W, Jose Kersten M, Nollet F, Wenzel J, Wiskemann J, Brug J, Courneya KS. Targeting exercise interventions to patients with cancer in need: an individual patient data meta-analysis. J Natl Cancer Inst. 2018;110(11):1190-200.
- Campbell KL, Winters-Stone KM, Wiskemann J, May AM, Schwartz AL, Courneya KS, Zucker DS, Matthews CE, Ligibel JA, Gerber LH, Morris GS, Patel AV, Hue TF, Perna FM, Schmitz KH. Exercise guidelines for cancer survivors: consensus statement from international multidisciplinary roundtable. Med Sci Sports Exerc. 2019;51(11):2375-90.
- Hinz A, Benzing C, Brähler E, Zenger M, Herzberg PY, Finck C, Schmalbach B, Petrowski K. Psychometric properties of the Multidimensional Fatigue Inventory (MFI-20), derived from seven samples. J Pain Sympt Man. 2020;59(3):717-23.
- Hofman M, Ryan JL, Figueroa-Moseley CD, Jean-Pierre P, Morrow GR. Cancer-related fatigue: the scale of the problem. Oncologist. 2007;12:4-10.
- Integraal Kankercentrum Nederland (IKNL). Richtlijn vermoeidheid bij kanker in de palliatieve fase. Utrecht: IKNL; 2019. Geraadpleegd op 1 mei 2021. Beschikbaar via https://richtlijnendatabase.nl/
- Kieffer JM, Starreveld DEJ, Boekhout A, Bleiker EMA. A questionable factor structure of the multidimensional fatigue inventory in the general Dutch population. J Clin Epidemiol. 2021;14;137:266-76.
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF)/Zuyd Onderzoek. Toepassing van het ‘Raamwerk klinimetrie voor evidence based products’ om meetinstrumenten te ordenen in de KNGF-richtlijnen. Amersfoort/Heerlen: KNGF/Zuyd; 2016.
- Meek PM, Nail LM, Barsevick A, Schwartz AL, Stephen S, Whitmer K, Beck SL, Jones LS, Walker BL. Psychometric testing of fatigue instruments for use with cancer patients. Nurs Res. 2000;49(4):181-90.
- Minton O, Stone P. A systematic review of the scales used for the measurement of cancer-related fatigue (CRF). Ann Oncol. 2009. 20(1):17-25.
- Mugele H, Freitag N, Wilhelmi J, Yang Y, Cheng S, Bloch W, Schumann M. High-intensity interval training in the therapy and aftercare of cancer patients: a systematic review with meta- analysis. J Cancer Surviv. 2019;13(2):205-23.
- National Comprehensive Cancer Network (NCCN). Survivorship, Version 2.2018, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2018 Oct;16(10):1216-47.
- Nederlandse Vereniging voor Revalidatieartsen (VRA). Richtlijn medisch specialistische revalidatie bij oncologie (2.0). Utrecht: VRA; 2018. Geraadpleegd op 11 mei 2021. Beschikbaar via https://richtlijnendatabase.nl/
- Piraux E, Caty G, Renard L, Vancraeynest D, Tombal B, Geets X, Reychler G. Effects of high-intensity interval training compared with resistance training in prostate cancer patients undergoing radiotherapy: a randomized controlled trial. Prostate Cancer Prostatic Dis. 2020. 2021 Mar;24(1):156-65.
- Integraal Kankercentrum Nederland (IKNL). Richtlijn Vermoeidheid bij kanker in de palliatieve fase. Utrecht: IKNL; 2019. Geraadpleegd op 11 mei 2021. Beschikbaar via https://richtlijnendatabase.nl/
- Portenoy RK, Itri LM. Cancer-related fatigue: guidelines for evaluation and management. Oncologist, 1999. 4(1):1-10.
- Schmitt J, Lindner N, Reuss-Borst M, Holmberg HC, Sperlich B. A 3-week multimodal intervention involving high-intensity interval training in female cancer survivors: a randomized controlled trial. Physiol Rep. 2016;4(3):e12693.
- Schulz SVW, Laszlo R, Otto S, Prokopchuk D, Schumann U, Ebner F, Huober J, Steinacker JM. Feasibility and effects of a combined adjuvant high-intensity interval/strength training in breast cancer patietns: a single-center pilot study. Disabil Rehabil. 2018;40(13):1501-8.
- Smets EMA, Garssen B, Cull A, de Haes JCJM. Application of the multidimensional fatigue inventory (MFI-20) in cancer patients receiving radiotherapy. Br J Cancer. 1996;73(2):241-5.
- Stuiver MM, Wittink HM, Velthuis MJ, Kool N, Jongert WAM. KNGF-standaard beweeginterventie Oncologie. Amersfoort: Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF); 2011.
- van Vulpen JK, Sweegers MG, Peeters PHM, Courneya KS, Newton RU, Aaronson NK, Jacobsen PB, Galvao DA, Chinapaw MJ, Steindorf K, Irwin ML, Stuiver MM, Hayes S, Griffith KA, Mesters I, Knoop H, Goedendorp MM, Mutrie N, Daley AJ, McConnachie A, Bohus M, Thorsen L, Schulz KH, Short CE, James EL, Plotnikoff RC, Schmidt ME, Ulrich CM, van Beurden M, Oldenburg HS, Sonke GS, van Harten WH, Schmitz KH, Winters-Stone KM, Velthuis MJ, Taaffe DR, van Mechelen W, Kersten MJ, Nollet F, Wenzel J, Wiskemann J, Verdonck-de Leeuw IM, Brug J, May AM, Buffart LM. Moderators of exercise effects on cancer-related ratigue: a meta-analysis of individual patient data. Med Sci Sports Exerc. 2020;52(2):303-4.
- van Waart H, Van Dongen JM, Van Harten WH, Stuiver MM, Huijsmans R, Hellendoorn-van Vreeswijk JAJH, Sonke GS, Aaronson NK. Cost-utility and cost-effectiveness of physical exercise during adjuvant chemotherapy. Eur J Health Econ. 2018;19(6):893-904.

